Text
ФАУНА
СССР
РЫБЫ
II
выпуск
1
ЗООЛОГИЧЕСКИЙ ИНСТИТУТ АКАДЕМИИ НАУК СССР
НОВАЯ СЕРИЯ № 48
РЫБЫ
Том П, вып, 1
А. Н. СВЕТ О ВИДОВ
СЕЛЬДЕВЫЕ (CLUPEIDAE)
ИЗДАТЕЛЬСТВО АКАДЕМИИ НАУК СССР
МОСКВА - 1952 > ЛЕНИНГРАД
Главный редактор акад. Е. Н. Павловский
Редактор тома А. А. Штакелъберг
ПРЕДИСЛОВИЕ
В последние годы трудами ряда авторов изучение наших сельдей
значительно подвинулось вперед. Перед Великой Отечественной войной
Полярным научно-исследовательским институтом рыбного хозяйства и
океанографии (ПИНРО) было очень много сделано в отношении изучения
систематического положения и биологии мурманской сельди. Исследо-
вания Всекаспийской научной рыбохозяйственной экспедиции, а затем
каспийских станций Всесоюзного Научно-исследовательского института
рыбного хозяйства и океанографии (ВНИРО), в частности Волго-кас-
ццйской, Азербайджанской и Туркменской, пролили свет на некоторые
до того неизвестные стороны биологии и распространения каспийских
сельдей. В особенности важные результаты были достигнуты Всекас-
пийской экспедицией в изучении систематики каспийских сельдей, при-
чем был описан ряд до того неизвестных форм сельдей, свойственных
южной части Каспийского моря. Рядом авторов были изучены сельди
Черного и Азовского морей, причем и здесь были достигнуты важные ре-
зультаты. Много было сделано также в отношении познания сельдевых
Балтийского, Белого и дальневосточных морей.
Таким образом, накопился обширный материал, требующий, однако,
общей систематической переработки, так как работ, охватывающих
не только все семейство, но даже и отдельные роды сельдевых, встре-
чающиеся в водах СССР, до сих пор или во всяком случае на протяжении
нескольких десятилетий у нас не было. Изучались, например, каспий-
ские сельди, но совершенно не принимались при этом во внимание близ-
кие к ним черноморско-азовские сельди того же рода, и наоборот. При
таком изолированном изучении форм отдельных видов или видов, свой-
ственных другому бассейну, несомненно, по совершенно справедливым
словам В. К. Солдатова,1 нельзя получить не только правильного пони-
мания происхождения и эволюции отдельных родов семейства, но
и вообще правильных систематических выводов. Следовательно, составле-
ние сводки по всем представителям сельдевых морей СССР являлось
насущно необходимым. Учитывая все это, Зоологический институт Ака-
демии Наук СССР и поручил эту работу автору.
1 «Крайне интересный вопрос о том, один ли вид рода Caspialosa, путем расхо-
ждения некоторых признаков, дал начало многочисленным формам сельдей Каспий-
ского бассейна, или же процесс видообразования среди этих рыб уже завершился
еще до обособления Каспийского моря в отдельный бассейн и в последующее время
стал происходить обратный процесс конвергенции — сглаживания видовых призна-
ков благодаря сходным сравнительно условиям существования в замкнутом бас-
сейне — этот вопрос, думается мне, может быть решен окончательно только после
сравнительной монографической обработки всего этого рода и в Азовско-Черноморском
бассейне, а, может быть, даже и после обработки и близкого родаЛ/о«а» (В. К. С о л-
д а т о в. Рыбы и рыбный промысел. 1928 : 85).
4
ПРЕДИСЛОВИЕ
В монографии по трескообразным, опубликованной в издании «Фауна
СССР» несколько лет назад, внимание автора было обращено главным
образом на изучение высших систематических единиц отряда —
семейств и родов, так как этот вопрос являлся в той группе наименее
ясным. Для сельдевых наших вод, наоборот, наиболее актуальным
является вопрос о низших единицах. Поэтому основное внимание
автора в этой работе было обращено на виды и формы видов, причем
вследствие специфической особенности изучаемой группы, в част-
ности каспийско-черноморских сельдей, автор предпринял изучение
их • не только по коллекционным материалам, но просмотрел массо-
вые материалы и в полевой обстановке. Исключение среди каспийских
сельдей составляют лишь проходные сельди, ознакомиться с которыми
на массовых материалах в полевой обстановке автор, по не зависящим
от него причинам, возможности не имел. Большое внимание уделялось,
наряду с признаками морфологическими, биологическим особенностям
форм видов, так как в некоторых случаях, при наличии совершенно
очевидных биологических особенностей, морфологических отличий не обна-
руживалось. В таких случаях автор, отмечая эти формы, старался избе-
гать каких-либо латинских наименований их, так как считал, что излиш-
нее наводнение систематики, без особых на то оснований, описанием новых
форм и новыми латинскими названиями вряд ли принесет пользу делу.1
Что касается форм уже описанных, то при отсутствии существенных
признаков, дающих возможность распознавать эти формы, они рассма-
триваются не в качестве самостоятельных систематических категорий,
а совместно с типичными формами, и указываются их биологические
особенности. Описания и латинского наименования заслуживают только
те формы, которые мы можем в какой-то мере различить. В конце кон-
цов внутри не только почти каждого вида, но почти каждого подвида
сельдей можно выделить не одну форму, а зачастую ряд форм, у которых
Могут быть биологические различия, а морфологические отличия отсут-
ствуют или же незначительны. Такие формы безусловно нужно отме-
чать, тщательно изучая их биологические особенности,1 так как это
имеет помимо научного и хозяйственное значение; однако стремление
описывать эти формы, давая им новые латинские наименования, в прак-
тическом отношении пользы не дает, а в научном приносит только вред
и создает ненужную путаницу.
Автор не всегда стремился переисследовать и переопределить экзем-
пляры сельдей, изученные предыдущими исследователями и хранящиеся
где-либо, кроме Зоологического института Академии Наук СССР и,
в отношении некоторых видов, Кафедры ихтиологии Ленинградского
Государственного университета; точно так же не во всех случаях автор
приводит синонимы начального периода изучения наших сельдей. Эта
работа в основном уже проделана предыдущими исследователями.
В частности для каспийских сельдей это сделано Л. С. Бергом и К. А.
Киселевичем. Автор, однако, считал необходимым разыскать и переис-
следовать типы всех видов и форм в тех случаях, когда это оказывалось
возможным. К сожалению, разыскать удалось типы далеко не всех видов
1 В связи с этим не лишне напомнить слова В. К. Бражникова: «Дело не в том.
конечно, чтобы наводнять систематику описанием новых видов и разновидностей,
но биологически отличные формы должны быть так или иначе отмечены; систематика
может только выиграть, если в ней будет более простора также и для биологической
характеристики видов и разновидностей» (В. К. Бражников. К систематике
каспийских сельдей. Вести, рыбопр., III, 1898 : 235).
ПРЕДИСЛОВИЕ
5
и форм, а для многих из них, особенно из числа описанных в последнее
время, типы не указывались вообще. В настоящее время, когда систе-
матика наших сельдей в основном направлена на изучение форм внутри
вида, установление типов всех известных видов и форм сельдевых наших
вод насущно необходимо. Поэтому в тех случаях, когда тип указан не был,
ио сохранились экземпляры, по которым сделано описание данного вида
или формы, автор на основании кодексов международных правил номен-
клатуры, выбирал один из них за тип (лектотип). В тех же случаях, когда
тип указан не был, и экземпляры, по которым было сделано описание,
не сохранились, в качестве типа избирался один из наиболее типичных
экземпляров из числа исследованных автором настоящей работы. Автор
считает также важным опубликование рисунков всех установленных
таким образом типов видов и форм, точно так же как и тех из сохранив-
шихся. рисунки которых опубликованы ранее не были.
П ри изучении форм сельдевых часто много внимания уделяется методу
комбинированных признаков, разработанному Гейнке для форм океаниче-
ской сельди, а в последнее время нашедшему применение и в отношении
каспийских сельдей, причем некоторыми авторами (А. В. Морозов, В. И.
Мойс,пор и А. А. Михайловская) вычислены таблицы, облегчающие пользо-
папие этим методом. Однако, несмотря на это, вряд ли кто прибегает к поль-;
лопанию этим методом при определении сельдей даже при помощи таких
облегчающих вычисления таблиц. Если же принять во внимание разли-
чии, имевшие место в измерениях сельдей различными авторами, то таким
путем можно притти даже к ошибочным результатам. Во всяком случае
И пиленой обстановке этим методом пользоваться нельзя, а в лаборатор-
ной им практически по пользуются. Автор отказался, за немногими необ-
ходимыми исключениями, даже от пользования вариационно-статисти-
ческим методом, пора чрезмерного увлечения которым у нас миновала,
стараясь обращать больше внимания на внешние отличительные особен-
ности форм.
Как и в работе по трескообразным, автор не мог ограничить свое
внимание сельдевыми, встречающимися только в водах СССР, а зачастую
обращался к родам и видам их, встречающимся и за пределами наших
вод, правда не в такой степени, как в отношении трескообразных.
В частности, семейство взято в полном объеме при рассмотрении его гео-
графического распространения и истории происхождения, без .чего, как
очевидно каждому, нельзя получить правильных выводов. Точно так же
при разработке системы семейства и в особенности при характеристике
подсемейств приняты во внимание все известные и доступные ли-
тературные данные. Автору казалось не бесполезным ознакомить
более широко с семейством сельдевых и ихтиологов, занятых деталь-
ным изучением сельдей СССР, но не всегда имеющих общее представле-
ние об этом обширном семействе в целом, так как сводки по нему нет.
Вследствие особо важного хозяйственного значения сельдевых о них
и в СССР и за границей накопилась большая литература. Из этой обшир-
ной литературы, с которой автор имел возможность ознакомиться в до-
статочной степени, здесь цитируется далеко не все, а лишь наиболее
существенное, даже из написанного о сельдях СССР. Из значительной
литературы по ископаемым сельдевым упомянуты лишь наиболее суще-
ственные и крупные работы, так как описания и определения ископаемых
видов и в особенности родов семейства большей частью не точны
и не надежны. На основании ознакомления с этой литературой можно
сделать лишь один вывод, что до критической переработки всего извест-
6
ПРЕДИСЛОВИЕ
його материала по ископаемым сельдевым на основе более надежных
морфологических признаков ко всем этим описаниям нужно относиться
е большой осторожностью. Поэтому автор не пытался, за исключением
Одного случая, устанавливать филогенетические отношения между иско-
паемыми и современными сельдевыми. В очень общей форме данные
об ископаемых привлечены и при рассмотрении вопроса о происхожде-
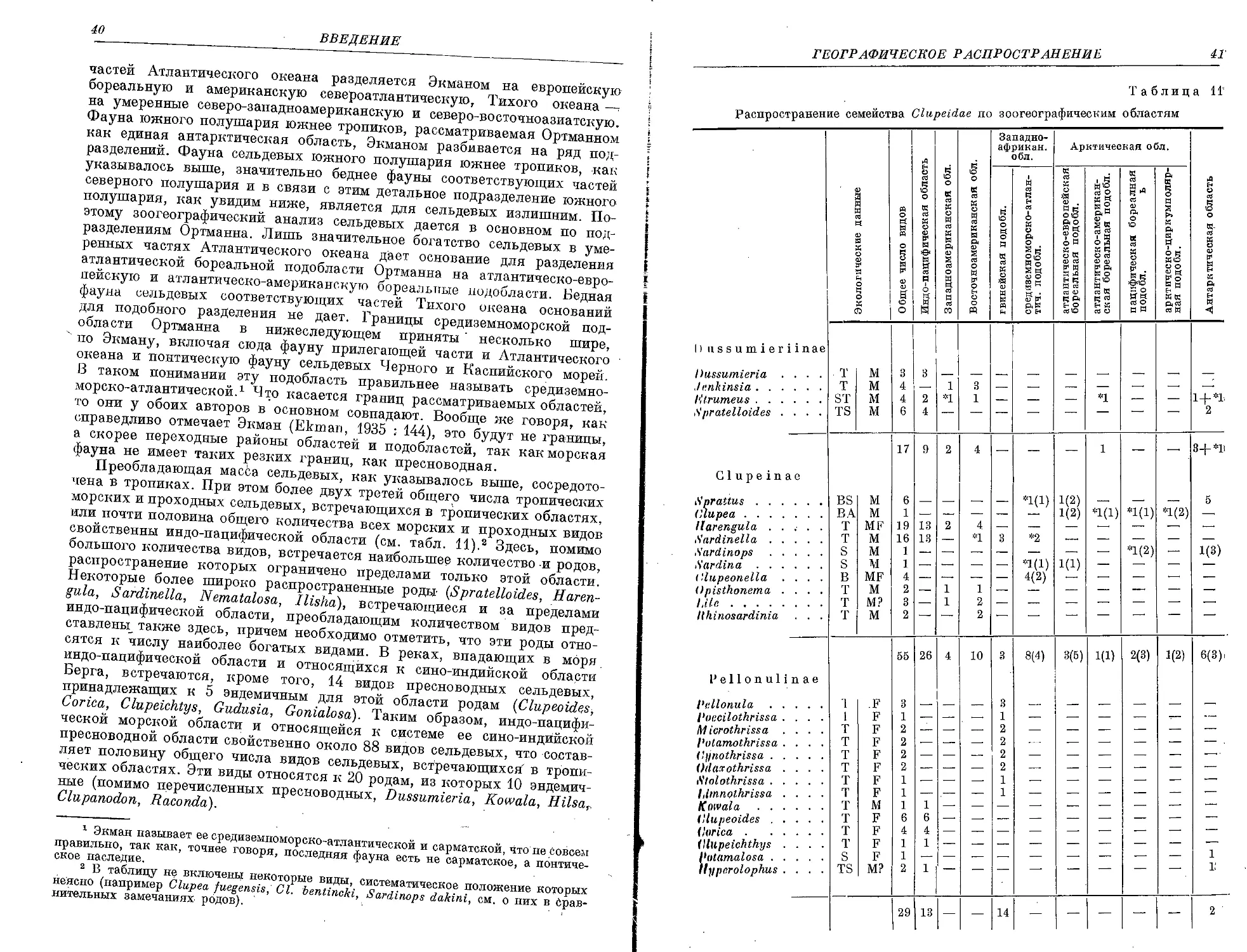
нии фауны сельдевых отдельных зоогеографических подразделений.
Работа эта вряд ли могла быть выполнена без внимания и содействия
как ряда учреждений, в частности ВНИРО и подведомственных ему
институтов и станций, так и отдельных лиц, оказавших большую помощь
при сборе материалов. В подсчетах количеств жаберных тычинок большую
помощь оказала А. А. Коровкина, которой автор обязан и за изготовле-
ние рентгеносыимков. Рисунки рыб при любезном содействии дирекции
ВНИРО в лице Л. С. ' Бердичевского выполнены Н. Н. Кондаковым;
Л. С. Бергом просмотрены некоторые части рукописи и сделаны ценные
замечания. Всем этим учреждениям и лицам автор считает своим приятным
долгом высказать глубокую признательность.
Насколько удовлетворительно справился автор с. поставленной перед
ним задачей, покажет будущее. Во всяком случае автор надеется, что
коренным образом переработанная систематика некоторых родов и ви-
дов, разработка основ системы семейства и высказанные им взгляды
на происхождение и эволюцию группы окажут известное влияние
на плодотворность дальнейших исследований. Некоторые вопросы, ка-
сающиеся биологии сельдевых и отдельных представителей семейства
и выполненные, автором параллельно с этой работой по специальным
заданиям, имеют существенное и хозяйственное значение. •
В течение двух лет, прошедших со времени окончания этой работы,
опубликовано значительное количество работ, преобладающее число'
которых цитируется в. соответствующих местах. Наиболее существенные
данные из этих работ по мере возможности использованы в тексте.
СИСТЕМАТИЧЕСКИЙ УКАЗАТЕЛЬ ВИДОВ И ПОДВИДОВ
Сем. Clupfcidafe
Стр.
1. Род Etrumeus Bleeker
С К, ininropiiB (Schlegel)......... . . . ........................•........... 101
i 2. Род Sprattus Girgensohn : . .
I,. 8, sprattus (Linn4)...................................................... 101
111. Я. sprattus phalericus (Risso)......................................... 107
lb, 8, sprattus balticus (G. Schneider)...................................... 112
3. Род Clupea Linne
1. Cl. harengus L............................................................ 117
la. Gl. harangue harengus L....................................................123
lb. Cl. harengus harengus n. membras L. . . . . . . ... . ................ . 140
1c. Cl. harengus pallasi Valenciennes......................................... 145
id. Cl. harengus pallasi n. maris-albi Berg .................................. 158
le. Cl. harengus pallasi n. suworowi Rabinerson .. ... . . .... . . . .. . . . 163
4. Род Harengula Valenciennes
1. H. zunasi Bleeker . ...................................................... 169
5. Род Sardinella Valenciennes
1. S. aurita Valenciennes . . .. ............................................ 172
6. Род Sardinops Hubbs
1. S. sagax (Jenyns)......................................................... 177
la. S. sagax melanosticta (Schlehel)......................................... 178
7. Род Sardina Antipa
1. S. pilchardus (Walbaum) . . ............................................ 188
la. S. pilchardus sardina (Risso) ........................................... 189
8. Род Clupeonella Kessler
1. Cl. delicatula (Nordmann)................................................ 193
la. Cl. delicatula delicatula (Nordmann)...................................... 194
lb. Cl. delicatula caspia Svetovidov.......................................... 199
Jbi. Cl. delicatula caspia m. tscharchalensis (Borodin)....................... 204
2. Cl. engrauliformis (Borodin) ............................................. 205
3. Cl. abrau (Maljatskij) .. . .............................................. 208
4. Gl. grimmi Kessler . ..................................................... 209
9. , Род Alosa Cuvier
1. A. saposhnikovi (Grimm) ............................................... 223
2. A. sphaerocephala (Berg) . ............................................. 227
3. A. caspia (Eichwald) .................................................. 229
3a. A. caspia palaeostomi (Sadowsky) . . .-................................ 231
OK А - - A-L-
8
СИСТЕМАТИЧЕСКИЙ УКАЗАТЕЛЬ
Стр.
Зс. A. caspia tanaica (Grimm)................................................• • 235
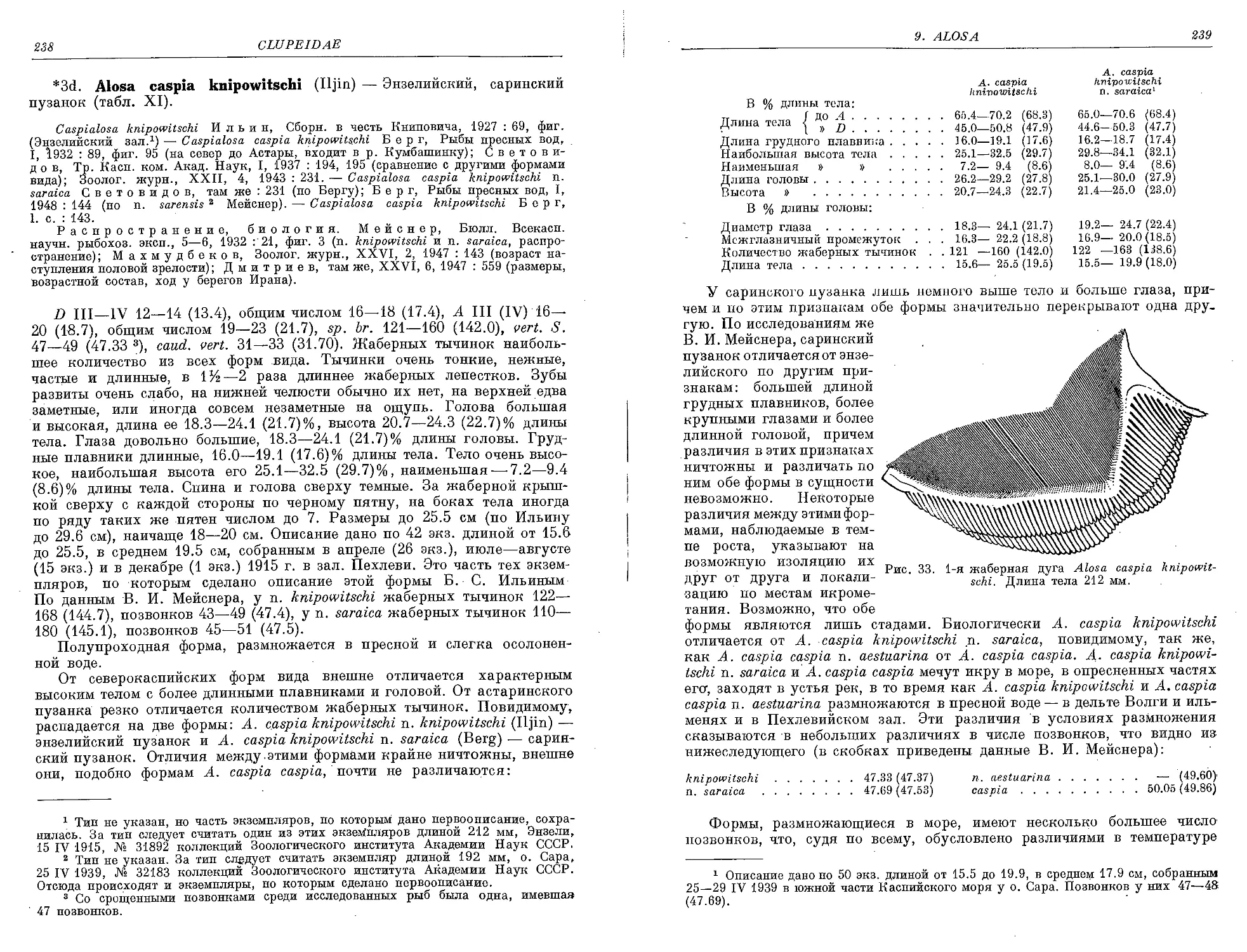
3d. A. caspia knipowitschi (Iljin)......................................... 238
Зе. A. caspia persica (Iljin)................................................ 240»
3f. A. caspia caspia (Eichwald) .............................................. 242
3g. A. caspia salina (Svetovidov)............................................. 249
4. A. brashnikovi (Borodin).................................................... 251
4a. A. brashnikovi maeotica (Grimm)........................................... 254
4b. A. brashnikovi brashnikovi (Borodin)....................................... 258
4c. A. brashnikovi agrachanica (Mikhaylovsky).................................. 263
4d. A. brashnikovi sarensis (Mikhaylovsky).................................... 266
4e. A. brashnikovi orientalis (Mikhaylovsky).................................. 268
4f. A. brashnikovi autumnalis (Berg)......................................... 270»
4g. A. brashnikovi kisselevitshi (Bulgakov).................................... 272
4n. A. brashnikovi nirchi (Morosow)............................................ 274
4i. A. brashnikovi grimmi (Borodin)........................................... 277
5. A. curensis (Suworow).................................................. 279-
6. A. kessleri (Grimm).................................................. 280
6a. A. kessleri pontica (Eichwald)........................................... 282
6b. A. kessleri volgensis (Berg) . ........................................... 292
6c. A. kessleri kessleri (Grimm).............................................. 299
7. A. fallax (Lacepede)...........'............................................ 308
7a. A. fallax nilotica (Geoffroy)................................................ 309
7b. A. fallax fallax (Lacepede)................................................ 310»
8. A. alosa (L.)................................................................ 312
8a. A. alosa bulgarica Drensky ........................................... . 313
9. A. sapidissima (Wilson)...........’......................................... 314
10. Род Clupanodon Lacepede
1. Cl. punctatus (Schlegel)................................................... 31ft
11. Род Ilisha Gray
1. I. elongate (Bennett)........................................................ 321
ВВЕДЕНИЕ
КРАТКИЙ ИСТОРИЧЕСКИЙ ОЧЕРК СИСТЕМЫ СЕМЕЙСТВА
Отношение семейства сельдевых к близкиц семействам и положение
ого в системах, предложенных рядом авторов, в зависимости от призна-
ков, принятых за основу в этих системах, и положения в системах
отряда, к которому относились сельдевые, различно. Не останавливаясь
на этом детально, укажем, что обзор систем рыб с конца XVII в.
по XX в. дан Леннбергом (Lonnberg, 1924 : 43—62), позднейших работ —
Л. С. Бергом (1940 : 88—95), где интересующиеся могут найти необхо-
димые сведения. Здесь отметим только, что в новейшей системе рыб,
предложенной Бергом (1940 : 221—227), сем. Clupeidae относится к самому
обширному из 18 подотрядов отряда Clupeiformes — подотр. Clupeoidei,.
который разделяется следующим образом:
Подотр. CLUPEOIDEI
Надсемейства .
Elopoidae —сем. Elopidae, Magalopidae
Albuloidae —сем. Albulidae, Pterothrissidae
Clupeoidae —сем. Pseudobericidae, f Syllaemi-
dae, Clupeidae, Engraulidae
Alepocephaloidae — сем. Alepocephalidae, Dolichopterygi-
dae, Macristiidae
Объем сем. Clupeidae как у авторов раннего периода ихтиологии, так
и у позднейших точно так же различен. Объем семейства первыми авто-
рами принимался крайне широко, со включением ряда близких и далеко
стоящих от него семейств как отряда Clupeiformes современных авто-
ров, так и других отрядов.
Не вдаваясь в детали, укажем, что Кювье (Cuvier, 1829 : 316) относил
к сельдевым представителей семейств Elopidae, Megalopidae, Engraulidae,,
Chirocentridae, Hyodontidae, Notopteridae и Osteoglossidae отряда Clupei-
formes современных авторов и ряда семейств {Polypteridae, Amiidae,.
Lepidosteidae, Sudidae и др.), относимых в настоящее время к другим
отрядам.
В значительно меньшем объеме рассматривал сельдевых (fam. Clu-
peoidei) Мюллер (Muller, 1843 : 324), включивший в него помимо родов,
относимых современными авторами к сем. Clupeidae, некоторые роды,
рассматриваемые в настоящее время как отводящиеся в основном к дру-
гим семействам Clupeiformes {Engraulidae, Hyodontidae, Elopidae, Alepo-
cephalidae). Семейства Polypteridae и Lepidosteidae Мюллер (Muller, 1846 :
202) в замечательной для своего времени системе рыб относит не к сель-
девым, а к другому подклассу (Ganoidei).
Приблизительно в таком же объеме рассматривалось сем. Clupeidae-
Гюнтером (Gunther, 1868 : 381), который делит его на следующие группы;
io
ВВЕДЕНИЕ
I Engraulina, II Chatoessina, III Clupeina, IV Dussumieriina, V Albulina,
VI Elopina, VII Chanina. Из этих групп в настоящее время к сем. С1и-
.peidae относятся лишь группы Chato'essina, Clupeina и Dussumieriina.
Группа Engraulina является самостоятельным, близким к Clupeidae
семейством, Albulina и Elopina — более резко отграниченными семей-
ствами подотряда Glupeoidei, Chanina — семейством, относящимся
к отряду Clupeiformes, но к особому подотряду Chanoidei.
Преобладающее большинство последующих авторов сем. Clupeidae
принимало в значительно меньшем объеме, в объеме группы Clupeina
Гюнтера, или включало в него и группы Chato'essina и Dussumieriina.
Остальные группы Гюнтера рассматривались в качестве семейств
отр. Clupeiformes (Isospondili, Malacopterygii s. str. auct.).
В большем объеме сем. Clupeidae рассматривалось лишь немногими
авторами; из числа их отметим Буланже (Bulenger, 1904: 562—565)
и Гудрича (Goodrich, 1909 : 391—393), включивших в сем. Clupeidae
из ныне живущих сельдевых группы Engraulina и Chanina Гюнтера,
причем группа Dussumieriina включена ими в подсем. Engraulinae,
a Chato'essina — в подсем. Clupeinae. Всех ныне живущих сельдевых оба
автора делят на подсемейства Engraulinae, Clupeinae и Chaninae.
У большинства других авторов’ разногласия существовали лишь
в отношении групп Chato'essina и Dussumieriina.
Джордэн и Эверманн (Jordan a. Evermann, 1896 : 417) включают
группу Dussumieriina в сем. Clupeidae, которое они разделяют на подсе-
мейства Dussumieriinae, Clupeinae и Pristigasterinae. Группа Chatoessina
рассматривается ими в качестве самостоятельного семейства (JDorosomidae;
цит. раб. : 415). Эта группа как самостоятельное семейство (Dorosomatidae)
принималась также Джорданом и Херре (Jordan а. Негге, 1906 : 623).
Ригэн (Regan, 1917b : 297), наоборот, считает, что выделение сем. Dorosomi-
dae в самостоятельное или даже в группу внутри семейства искусственно.
Позднее Джордэн (Jordan, 1923 : 120—122) принимает сем. Clupeidae
в более узком смысле, выделяя из него сем. Dussumieriidae и Dorosomidae.
Последние два семейства в качестве самостоятельных рассматриваются
и рядом других авторов (McCulloch, 1929 : 36, 41; Fowler, 1941 : 561).
Берг (1940 : 223, 224), наоборот, включает эти семейства в Clu-
peidae, которое он разделяет на подсем. Dussumieriini, Clupeini
.и Dorosomatini. Не останавливаясь здесь на этом вопросе подробнее,
укажем, что оба упомянутых семейства имеют основания для выделения
их самое большее в ранг подсемейства (см. стр. 92—94).
Классификация сельдевых внутри семейства разработана слабо, как
это отчасти видно из сказанного. Подсемейства, как указывалось выше,
различали Джордэн и Эверманн и Л. С. Берг. Из других авторов, разде-
лявших сем. Clupeidae, следует отметить Расса (1936 : 299), который
.по типам строения икринок выделил среди сельдевых северной части
Атлантического океана три группы: 1) Clupea, Sprattus, Pomolobus (сюда
•он относит также Spratelloides=Stolephorus), 2) Alosa, Caspialosa, 3) Sar-
dina, Sardinella, Clupeonella, Brevoortia. Отмечая, что это деление
не стоит в согласовании с группировками, установленными для рассма-
триваемых родов Ригэном (Regan, 1917с : 377) на основании наличия
или отсутствия в верхней челюсти медиальной вырезки, Т. С. Расс считает
свое деление более обоснованным. В подтверждение большей обосно-
ванности своих группировок им приведены лишь особенности строе-
ния икринок, однако признак, положенный в основу группировок
Ригэна, довольно существен; Действительно, род Brevoortia весьма свое-
СИСТЕМА СЕМЕЙСТВА
11
оОрн'.юп, но медиальная вырезка у него все же есть, так же как она
имеется и у Pomolobus. Вообще оба эти рода по ряду признаков гораздо
Лдиже ко второй группе Т. С. Расса и менее к тем, в которые они им поме-
щены. Что же касается Spratelloid.es, относимого в первую группу, то
этот род принадлежит к подсем. Dussumieriinae, принимаемому мно-
I ими, как указывалось выше, даже за особое семейство.
СИСТЕМА СЕМЕЙСТВА И ПРИНЦИПЫ КЛАССИФИКАЦИИ
Морфология представителей сем. Clupeidae изучена еще слабо; доста-
точно резких и существенных признаков для выделения подсемейств
известно мало, причем большинство их —• признаки внешнеморфологи->
чоские. На основании ряда морфологических особенностей семейство
нровизорно может быть разделено на следующие 6 подсемейств: I Dussu-
mieriinae, II Clupeinae, III Pellonulinae, IV Alosinae, V Dorosomatinae,
VI Pristigasterinae (характеристики их см. ниже, стр. 92—94).
Принципы классификации сельдевых, как, впрочем, и преобладаю-
щего большинства семейств рыб, за исключением немногих, точно так же
не разработаны. Некоторые соображения о примитивности или высоте
организации высказывались, как будет указано ниже, в отношении лишь
отдельных форм видов или самое большее немногих видов сельдевых
и притом на основании лишь единичных морфологических особенностей.
Классификация же, как неоднократно подчеркивал автор (1946 : 183;
1948 : 19), должна основываться на комплексе морфологических особен-
ностей, функционально связанных с наиболее характерной биологической
особенностью рассматриваемой систематической группы и выработан-
ных в результате взаимодействия организма со средой. Наичаще ком-
плекс морфологических особеыыостей, положенных в основу системы,
бывает связан с движением и обитанием в различных частях водной
среды, реже с питанием, иногда с размножением изучаемой системати-
ческой группы. Изменение комплекса морфологических особенностей
обычно сопровождается изменением их в процессе онтогенеза рассматри-
ваемой группы. Поэтому особенно важно учитывать и данные онтоге-
неза, которые обычно являются исходной точкой при построении си-
стемы.
Одной из особенностей развития личинок и строения взрослых сельде-
вых следует считать различие в положении спинного плавника. Как
известно, личинки сельдевых по сравнению со взрослыми, подобно личин-
кам и малькам многих костистых рыб, характеризуются сильно удлинен-
ной передней частью тела, вследствие чего брюшные, анальный и спин-
ной плавники у них отнесены далеко назад и, что самое существенное
и свойственно только сельдевым и некоторым близким к ним семействам
отр. Clupeiformes, спинной плавник у них расположен не над брюшными
плавниками, как у взрослых, а значительно далее назади, между брюш-
ными и анальным или почти над анальным (у Engraulidae). В процессе
метаморфоза личинок передняя часть тела у них укорачивается вслед-
ствие сложного перемещения плавников. Спинной плавник при этом
перемещается над миотомами вперед, а брюшные плавники назад, по-
этому взаимное расположение обоих плавников становится таким, как
у взрослых. Одновременно с этим анальный плавник перемещается впе-
ред (Lebour, 1921; Ford, 1930). У взрослых сельдевых спинндй плавник
расположен над или несколько позади от брюшных в непосредственной
к ним близости. При этом у разных видов семейства и видов одного
12
ВВЕДЕНИЕ
и того же рода и даже форм вида положение спинного, брюшных и аналь-
ного плавников неодинаково: у одних они расположены ближе к перед-
нему концу тела, у других — дальше. Обусловлено это тем, что у раз-
ных родов и видов плавники закладываются в различном удалении
от переднего конца тела, не над одними и теми же миотомами, а в даль-
нейшем степень перемещения плавников у разных родов и видов неоди-
накова (Lebour, 1921; Ford, 1930). Перемещение спинного плавника
заканчивается к концу метаморфоза личинок и неоформившихся мальков,
и у вполне сформировавшихся мальков и у молоди он расположен уже,
как у взрослых. В дальнейшем, по мере роста молоди и взрослых рыб,
как это видно на примере каспийской тюльки (Clupeonella delicatula
caspia), положение анального и брюшного плавников несколько изме-
няется.1
Длина тела (в мм).......... 40—50 — 60—70 — 80— 90—100—110—120—130*
В % длины тела:
антедорсальное расстояние . . . 45.8 45.8 45.1 45.7 45.6 45.5 45.5 45.8 45.5
антеанальное » ... 66.6 66.8 66.5 67.6 68.8 68.9 69.3 69.0 69.3
антевентральное » ... 49.9 49.7 49.8 49.8 51.7 51.5 51.7 50.9 50.4
Спинной плавник, как видно из приведенных примеров, занимает
постоянное положение как у взрослых, половозрелых рыб, так и у рыб,
еще не достигших половой зрелости. Что касается анального и брюшного
плавников, то положение их на протяжении жизни рыбы претерпевает
перемещение, судя по всему, в связи с половым созреванием вследствие
растяжения брюшной стенки развивающимися половыми продуктами.
Увеличение антеанального и антевёнтрального расстояний происходит
по достижении рыбами размеров 70—80 мм, что приблизительно соот-
ветствует половому созреванию. В дальнейшем антеанальное расстояние
остается примерно постоянным, увеличиваясь в незначительной степени,,
на доли процента. Антевентральное расстояние изменяется несколько
в большей степени, повидимому, в связи с различным растяжением брюш-
ной стенки вследствие разной степени наполнения полости тела поло-
выми продуктами, у исследованных крупных рыб отчасти уже выметан-
ными. К такому же выводу о постоянстве антедорсального расстояния,
характеризующего положение спинного плавника у взрослых черно-
морско-азовских проходных сельдей (Alosa kessleri pontica), пришла
Майорова (1939 : 7), а для черноморского анчоуса (JEngraulis encrasicholus
ponticus), относящегося к близкому сельдевым семейству того же под-
отряда, С. М. Малятский и отчасти Александров (1927 : 45, 46). Точно-
так же и относительно атлантической сельди (Clupea harengus harengus)
установлено, что у взрослых рыб длиной свыше 10 см положение спин-
ного, брюшных и анального плавников остается с возрастом неизменным
(Heincke, 1898 : ИЗ). Таким образом, у взрослых сельдевых положение
спинного, а в известной мере также анального и брюшного плавников
следует считать практически неизменным.
Положение спинного плавника у сельдевых несомненно имеет важное
филогенетическое значение, и ряд авторов, устанавливая филогенетиче-
ские отношения некоторых Clupeidae (Малятский, 1930 : 69) и близких
1 На каждый класс размеров приходится по 10 рыб. Как молодь, так и взрослые
рыбы происходят из одного места (от западных берегов средней части Каспийского
моря) и пойманы приблизительно в одно время. Такие же цифры рассматриваемых
признаков получены автором и для тюльки из северной части моря перед дельтой Волги.
СИСТЕМА СЕМЕЙСТВА
13
к ним Engraulidae (Fage, 1911 : 25; 1920 : 31; Александров, 1927 : 83)
и кладя в основу своих построений антедорсальное расстояние (у Engrau-
lidae) или постдорсальное (у Clupeidae), имеют в сущности дело с поло-
жением спинного плавника. Помимо значительного перемещения при
развитии личинок и различного положения у взрослых сельдевых
спинной плавник имеет неодинаковое положение и у других, в осо-
бенности более примитивных семейств отряда. У наиболее примитивных
из Clupeiformes, подотрядов Lycopteroidei (сем. Lycopteridae, нижний
мел Забайкалья, Монголии и сев. Китая; Берг, 1940 : 218) и Leptole-
pidoidei (сем. Leptolepidae, от верхнего триаса до среднего мела; Берг,
там же : 219; Woodward, 1895 : 500—530; 1919 : 121—139; Rayner, 1937 :
46—74), спинной плавник отнесен далеко назад,- причем у Lycopteridae
начало его расположено над анальным или слегка впереди его, а у более
высокоорганизованных Leptolepidae спинной плавник расположен по се-
редине между анальным и брюшным.'У более примитивных, чем сельде-
вые, современных семейств Elopidae, М egalopidae (оба семейства известны
с нижнего мела) и Albulidae (известны с палеоцена), относимых вместе
с сельдевыми к одному и тому же подотряду Clupeoidei, спинной плавник
расположен так же, как у Clupeidae. Следовательно, некоторые особен-
ности в положении спинного плавника, которые у ископаемых семейств
отряда являются конечной стадией, у современных семейств, в частности
у сельдевых, свойственны только личинкам и являются лишь онтостадией.
Однако есть основание считать, что личиночная стадия у более примитив-
ных семейств Clupeoidei, сем. Elopidae и Albulidae, заканчивается при
более крупных размерах и длится значительно дольше, чем у сем. Clu-
peidae. В частности, личиночная стадия Albulidae, невидимому, в некото-
рой степени даже аналогична личиночной стадии угрей. Личинка Albula
была описана в качестве особого рода Esunculus (Капр, 1856 : 143,
табл. XVI, фиг. 3) и имеет значительно более крупные размеры, чем
личинки сем. Clupeidae (Fitch, 1950).
Одной из наиболее характерных биологических особенностей сельде-
вых является их пелагический образ жизни, причем по образу жизни
их следует считать скорее неритическими, чем океаническими (подроб-
нее об этом см. стр. 39). Большинство из сельдевых, ведя пелагический
образ жизни, живет в море; значительная часть является проходными
или пресноводными — речными или озерными. Сельдевые, живущие
в море, имеют разную степень подвижности — одни из них совершают
значительные по протяженности миграции, другие менее подвижны
и совершают лишь ограниченные миграции. Одни из сельдевых живут
на некотором отдалении от берегов, другие держатся у берегов, в зали-
вах, бухтах и пр.
Сопоставление положения плавников на теле с образом жизни дает
возможность установить известную функциональную .связь между рас-
сматриваемыми признаками и биологическими особенностями сельдевых.
По положению спинного плавника роды и виды подсем. Clupeinae
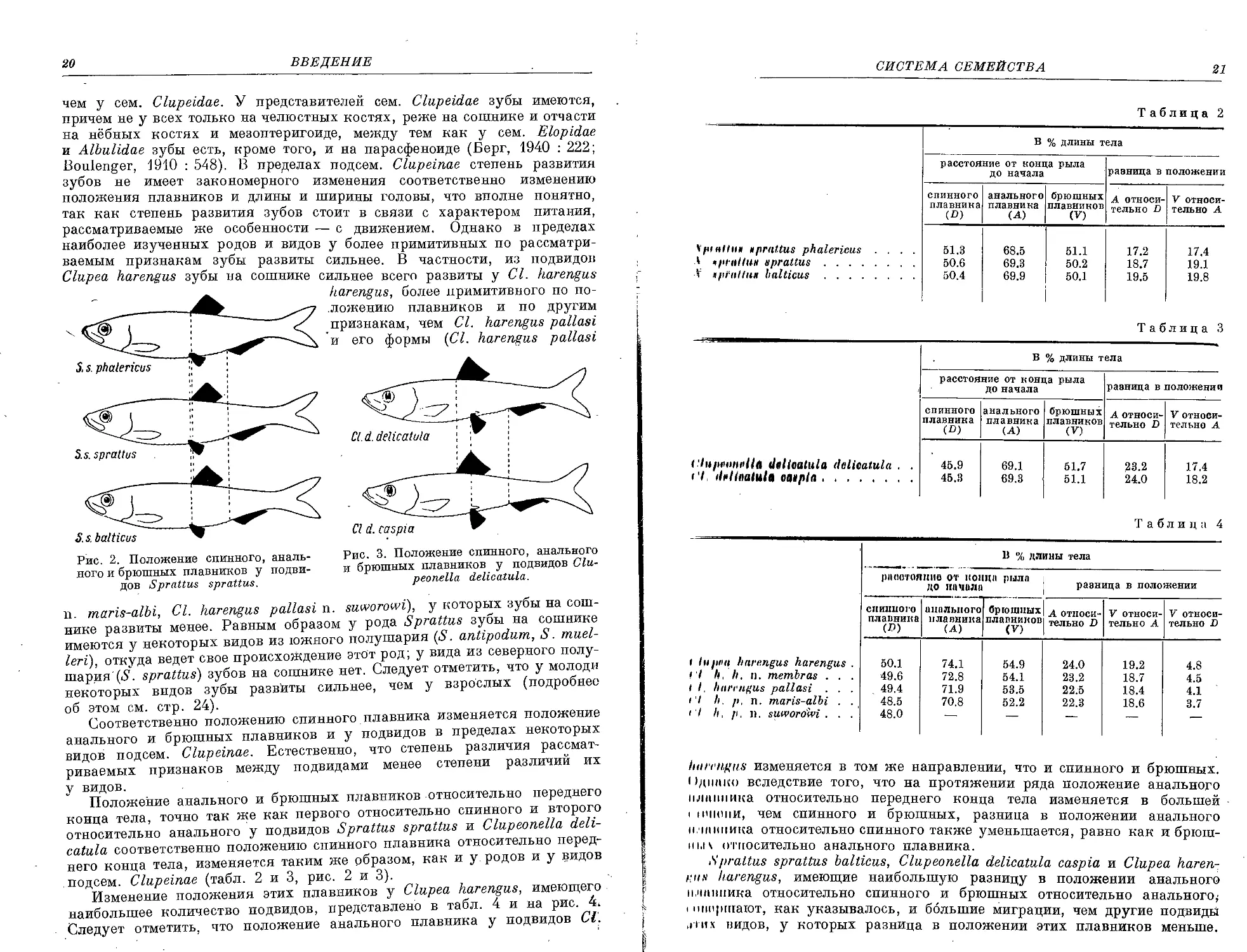
располагаются в следующий ряд (табл. 1, рис. 1).
Соответственно изменению положения спинного плавника относи-
тельно переднего конца тела закономерно изменяется положение брюш-
ного и анального плавников, причем положение спинного и брюшного
плавников на протяжении ряда претерпевает изменение в одном направ-
лении, изменение же положения анального плавника — в обратном.
Каковы же причины различного положения спинного, анального
и брюшного плавников? Об этом отчасти уже сказано выше. Прежде
14
ВВЕДЕНИЕ
Таблица 1
В % длины тела В % длины головы
расстояние от конца рыла до начала разница в положении межглаз- ничный
спинного анального брюшных А отно- промежу-
плавника плавника плавников сительно тельно А
(О) (А) (V) D
Sprattus sprattus s. 1. 50.8 69.2 50.5 18.4 18.7 17.3
Clupea harengus s. 1. . . . 49.1 72.6 53.7 23.5 18.9 16.8
Harengula zunasi 39.9 71.1 48.6 31.2 22.5 23.5
Sardinella aurita Sardinops sagax mela.no- 39.6 71.5 46.5 31.9 25.0 20.0.
sticta 41.0 72.5 48.1 31.5 24.4 17.2'
Sardina pilchardus sardina 41.0 70.0 45.9 29.0 24.1 18.7
Clupeonella delicatula s. 1. 45.6 69.2 51.4 23.6 17.8 18.5
Cl. engrauliformis .... 46.8 68.9 52.0 22.1 16.9 17.5 '
Cl. abrau 47.4 67.6 52.3 20.2 15.3 16.7
Cl. grimmi 50.2 66.7 53.7 16.5 13.0 14.1
Примечание. За длину тела в табл. 1—8 принято расстояние от конца
рыла до конца средних лучей хвостового плавника. Это сделано как для едино-
образия всех рассматриваемых величин, так и вследствие большей точности изме-
рения длины тела’ до конца средних лучей хвостового плавника, чем до конца
лопастей его.
всего различие это обусловлено неодинаковым положением плавников;
у личинок. В дальнейшем, в процессе метаморфоза личинок, спинной,
анальный и брюшной плавники у разных представителей семейства пере-
мещаются на неодинаковое расстояние. В подсем. Clupeinae, по исследо-
ваниям Форда (Ford, 1930) и Лебаур (Lebour, 1921), у Sprattus и Clupea,
имеющих почти одинаковую удаленность спинного плавника от перед-
него конца тела, этот плавник перемещается вперед на равное число
миотомов (4—5). У Sardina, стоящего в середине подсемейства, по иссле-
дованиям тех же авторов, спинной плавник, расположенный к переднему
концу тела значительно ближе, перемещается вперед уже на 10 миото-
мов. Следовательно, более близкое положение к переднему концу тела
спинного плавника у родов, расположенных в середине подсемейства,
обусловлено большим перемещением его вперед, чем у родов, располо-
женных в начале и, вероятно, в конце подсемейства. Анальный плавник
наиболее далеко отнесен назад у Clupea. Соответственно этому у личинок
этого рода он перемещается вперед всего лишь на 2 миотома. У личинок
Sprattus и Sardina анальный плавник перемещается вперед на большее
число миотомов (ца 4—5 у первого и на 5—6 у второго), вследствие чего
и во взрослом состоянии этот плавник у них расположен ближе к перед-
нему концу тела, чем у Clupea. Таким образом, различие в положении
рассматриваемых плавников обусловлено неодинаковым перемещением
его в процессе метаморфоза личинок, а большее различие родов подсе-
мейства по положению спинного плавника по сравнению с различием
в положении брюшных плавников — большим перемещением первого,
чем последних.
Соответственно изменению положения относительно переднего конца
тела спинного плавника положение анального и брюшных плавников
изменяется не во всех случаях закономерно. Так, анальный плавник
у Г/к/и'Н относил несколько более
ННШД ио сриипоиию со стоящими
от пего родами, брюшные
ilHiililltoui несколько более удалены
НТ неродного конца тела у Clupea и
SiiftiiiKipN. ('.трогая закономерность,
Пй |Н1Л лол ьшш изменению положения
1’НИНИого плавника относительно не-
родного конца тела, наблюдается в
ИИМИ1ЮНИИ положения анального
нлннникн относительно спинного и
fiptollliioro относительно анального.
При атом разница в положении
«пильного плавника относительно
(Шинного,1 по мере уменьшения рас-
стоянии от переднего конца тела до
ппнпного плавника и увеличения
до анального, на протяжении ряда
илтоствоино увеличивается (табл. 1).
По этой же причине разница в по-
ложении брюшных плавников отно-
с.итольно анального увеличивается.
Изменение положения брюшных
плавников относительно спинного за-
кономерного характера не имеет.
Параллельно с изменением поло-
жения спинного плавника, с умень-
шением расстояния от него до пе-
реднего конца тела, ширина головы
(межглазничный промежуток) увели-
чивается. В> дальнейшем с увеличе-
нием расстояния от начала спинного
плавника до переднего конца тела
ширина головы уменьшается. Сле-
дует отметить, что и здесь Clupea и
Sardinops несколько уклоняются от
общего закономерного характера из-
менения этого признака на протя-
жении подсемейства. Что касается
длины головы и числа лучей в аналь-
ном и спинном плавниках, харак-
теризующих размеры (длину основа-
ния) этих плавников и изменяющихся
1 Разница в положении анального
плавника относительно спинного здесь и
в дальнейшем изложении выражается раз-
ностью между расстоянием обоих плавни-
ков от переднего конца тела. Равным об-
разом разница в положении брюшных
плавников относительно анального выра-
жается разностью между расстояниями
этих плавников от переднего конца тела.
Точнее говоря, разница во взаимном по-
ложении этих плавников представлена (,в
виде проекции расстояний между ними на
продольную ось тела, выраженную в про-
центах длины тела.
У sagax melanosticta
Рис. 1. Положение спинного, аналь-
ного и брюшных плавников у подсем.
Clupeinae.
1'6
ВВЕДЕНИЕ
строго закономерно в других рассматриваемых ниже группах сельдевых,
то в подсем. Clupeinae. эти особенности такого строгого параллельного
характера не имеют и поэтому в таблице не приведены. Однако и здесь
с изменением положения спинного плавника ближе к переднему концу
тела число лучей в анальном плавнике в общем уменьшается, а число
лучей в спинном плавнике, наоборот, увеличивается. Размеры головы
точно так же, как и в рассматриваемых ниже группах сельдевых, с уве-
личением ее ширины уменьшаются.
Кроме того, параллельно с изменением положения спинного плавника
относительно переднего конца тела и разницы в положении плавников
относительно друг друга изменяется и степень развития каналов системы
боковой линии на голове. Наиболее развиты каналы системы боковой
линии на голове у родов со спинным плавником, расположенным ближе
к переднему концу тела и с наибольшей разницей в положении плавни-
ков относительно друг друга, в частности у Sardina (Третьяков, 1950,
рис. 5; Wolfahrt, 1937, рис. 1, 10), Sardinops и Sardinella. Значительно
менее развиты эти каналы у родов со спинным плавником, отнесенным
далее назад, и с меньшей разницей в положении плавников относительно
друг друга, например у Clupea (Bamford, 1941, рис. 9), и еще менее
у Sprattus и Clupeonella (Третьяков, 1938, рис. 3; 1950, рис. 2). Посред-
ством каналов системы боковой линии, как установлено, рыба ориенти-
руется в течениях, воспринимает неподвижные (например берега и пр.),
а также движущиеся предметы, в том числе, что крайне важно для стай-
ных сельдевых, рыб и даже мелкие пищевые объекты (Пучков, 1941 :
262—266; Wunder, 1936 : 53—67).
Ископаемые виды рода Clupeonella по основным из рассматриваемых
особенностей более примитивны, чем современные, причем Богачев (1938 :
47) отмечает, что один из известных понтических видов (CZ. vexata) имеет
значительное сходство с современным Cl. engrauliformis. Однако голова
у Cl. vexata значительно крупнее, чем даже у наиболее большеголового
из современных видов (CZ. grimmi). У другого ископаемого вида (Z7Z.
binagadensis), провизорно относимого тоже к роду Clupeonella, длина
головы еще больше. По расстоянию спинного плавника от конца рыла,
составляющему около 49—50% длины тела, Cl. vexata близок к наибо-
лее примитивному из современных видов.
Помимо изменения ширины в межглазничной области, ширина головы
изменяется и в других ее частях, почему выше, ссылаясь на изменение
межглазничного промежутка, говорилось об изменении ширины головы
вообще. Изменение ширины головы в других ее частях у видов рода
Clupeonella видно из данных измерений ширины черепа:
С1. дггттпг Cl. abrau Cl. engrauli- Ci formis . delivatula caspia
Ширина черепа (в % длины черепа): между отростками sphenoticum . 35.8 36.6 39.1 39.6
между задними краями foramen temporale 20.4 21.0 20.8 23.9
впереди sphenoticum Количество черепов 19.6 20.2 22.7 24.2
7 2 20 20
Изменение всех рассматриваемых признаков, за исключением, как
указывалось, числа лучей в плавниках и длины головы, происходит
строго закономерно, причем численные значения одних из них (положе-
ние спинного плавника и брюшных относительно переднего конца тела,
СИСТЕМА СЕМЕЙСТВА
17
число лучей к (шильном плавнике) по направлению от начала ряда к се-
редине yfhiiuni'ir, возрастая вновь к концу ряда, других (положение аналь-
ного илпнцннц относительно переднего конца тела и относительно спин-
ного, брюшных относительно анального, межглазничный промежуток,
число лучой и спинном плавнике), наоборот, возрастают к середине ряда
и убыншот itiioiii. к концу его. Иными словами, спинной и брюшные плав-
ники от ннчилв ряда к середине его перемещаются к переднему концу
тела, проторшшая перемещение в обратном направлении от середины
к концу рндщ Анальный плавник, наоборот, в направлении от начала
ряда к 1'ор<’ДИ11О от переднего конца тела и от спинного плавника уда-
ляется, норомощаясь вновь к переднему концу тела и к спинному плав-
нику от «ч'рндпны к концу ряда, равно как и брюшные плавники по отно-
шению |? ,ч пильному. Ширина головы в направлении от начала ряда
к середине увеличивается, длина уменьшается; в направлении от середины
ряда к концу ширина головы, наоборот, уменьшается, а длина увели-
чивается.
Роды, стоящие в первой и второй половинах ряда, существенно раз-
личаются тем, что у родов первой половины (роды Sprattus, Clupea)
анальный плавник имеет нормальное строение, а у родов второй (роды
Sardinella, Sardinops, Sardina, Clupeonella) два последних луча аналь-
ного плавника удлинены и выдаются в виде лопасти (рис. 17, 21, 24, 26).
Род Harengula занимает промежуточное положение между этими двумя
группами, так как два последних луча анального плавника у него удли-
нены слабо, не образуя лопасти (рис. 15).
Роды, расположенные в середине ряда {Harengula, Sardinella, Sardi-
nops, Sardina), характерны развитием у большинства их пигментных
темных пятен па боках тола, совершенно отсутствующих у родов, распо-
ложенных в начале и конце ряда. У большинства видов рода Harengula,
как и у изображенного на табл. V Н. zunasi, пятен на теле нет;
лишь у некоторых видов (Н. humeralis, Н. thrissina, Н. clupeola, Н. majo-
rina и др.) с каждой стороны тела есть по темному пятну за жаберной
крышкой и у немногих из них — сзади него иногда по ряду неясно выра-
женных пятен на боках тела. Рет пятен на теле и у большинства видов
рода Sardinella, и лишь некоторые из них имеют, как иУ aurita, по тем-
ному пятну за жаберной крышкой. У Sardinops с каждой стороны
на боках тела всегда имеется от нескольких до 15 расположенных в ряд
темных пятен; ниже этого ряда у S. sagax melanosticta изредка есть вто-
рой и иногда третий ряд из меньшего числа более светлых и неясных
пятен. Ряд таких же темных пятен, как и у Sardinops, есть и у Sardina,
но эти пятна на теле сверху бывают не всегда заметны, но обнаружи-
ваются по удалении чешуи.
Следовательно, в развитии темных пигментных пятен на боках тела
наблюдаются все переходы от наибольшей степени развития их у рода
Sardinops, расположенного в середине ряда, к родам, стоящим в начале
и конце ряда и не имеющим пятен совершенно. Отсутствие или наличие
удлиненных лучей в анальном плавнике имеет переходный характер
у рода Harengula, расположенного также по середине ряда.
Кроме того, роды, стоящие в середине ряда, связаны между собой
некоторыми и другими морфологическими особенностями. У Sardinella,
Sardinops и Sardina на хвостовом плавнике у основания лопастей есть
удлиненные чешуи (ala), отсутствующие у Sprattus, Clupea и Harengula,
стоящих в начале ряда, и у Clupeonella, стоящего в конце. Расположен-
ные рядом роды Harengula и Sardinella имеют двулопастные кожистые
2 Фауна СССР —314
18
ВВЕДЕНИЕ.
выросты на вертикальной части ключицы, a Sardinops и Sardina —
радиальные бороздки на крышечной кости.
Таким образом, изменение рассматриваемых морфологических особен-
ностей на протяжении ряда происходит не прямолинейно (в сторону
возрастания одних и убывания других), а циклически, представляя восхо-
дящую спираль. На протяжении этой спирали рассматриваемые морфоло-
гические особенности претерпевают закономерное изменение, причем
удлинение -двух последних лучей анального плавника имеет нарастающий
характер; все остальные особенности (положение плавников относительно
переднего конца тела и друг друга, пигментация и пр.) возрастают
к середине ряда, убывая вновь к концу его и давая в начале и в конце .
• сходные особенности.
Это закономерное изменение рассматриваемых признаков стоит в тес-
ной связи с изменением биологических особенностей родов, видов и форм
подсем. Clupeinae, большинство представителей которого, за исключе-
нием нескольких пресноводных видов, является морскими рыбами. Роды
' (Sardinops, Sardina, Sardinella и в меньшей степени Harengula), у кото-
рых спинной и брюшные плавники расположены наиболее близко к пе-
реднему концу тела, а анальный плавник наиболее отнесен назад, ведут
и наиболее подвижный образ жизни. Многие из них, в частности Sardi-.
nops и Sardina, совершают миграции большой протяженности. Роды,
стоящие в начале и в конце ряда, с отнесенными назад спинными и брюш-
ными плавниками, с расположенным ближе к переднему концу тела
анальным плавником и наименее отстоящими анальным плавником
от спинного и брюшными от анального менее подвижны. Из видов рода
Clupeonella наиболее подвижный образ жизни ведет Cl. delicatula, кас-
пийская форма которого (С7. delicatula caspia) совершает миграции
из южной части моря в северную и частично заходит даже в реки;
в море эта форма держится ближе к берегам. Азовская фор ма этого
вида (Cl. delicatula delicatula) совершает меньшие передвижения. Ch
engrauliformis держится в некотором отдалении от берегов в южной и
средней частях Каспийского моря, иногда подходит и в прибрежную
зону. Cl. alrau, населяющий небольшое пресноводное озеро, совершает
более ограниченные миграции. Наконец, Cl. grimmi живет главным
образом в южной части Каспийского моря и отчасти в средней, держится
в открытом море в галистатической области, никогда не подходя к бере-
гам, и на значительно больших глубинах, чем другие виды рода. Clupea
совершает в общем меньшие по протяженности миграции, чем Sardinops,
Sardina и другие роды, расположенные в середине ряда. Cl. harengus
pallasi, Cl. harengus pallasi n. suworowi, Cl. harengus pallasi n. maris-albi
и Cl. harengus membras живут и размножаются ближе к берегам, чем С1.
harengus harengus. Последний размножается на больших глубинах, часто
в отдалении от берегов, на банках среди моря. Среди локальных форм
Cl. harengus harengus есть такие, которые совершают значительные мигра-
ции (например мурманская сельдь), но у многих форм, в частности у не-
которых в Северном море, миграпии ограниченные. Формы Sprattus
sprattus живут и размножаются в море, но не у самых берегов, а в неко-
тором отдалении от них. S. sprattus balticus вецет более прибрежный образ
жизни, так как живет и размножается в заливах и фиордах;^, sprattuspha-
lericus держится и размножается в море, в большем отдалении от берегов,
Таким образом, изменение комплекса рассматриваемых морфологи-
ческих особенностей, как видно из сказанного, стоит в тесной связи
' с образом жизни, в частности с движением, причем наиболее про-
СИСТЕМА СЕМЕЙСТВА
19
। россивные формы совершают большие по протяженности мигра-
ции.
Термины «прогрессивность» и «примитивность» понимаются здесь
и далее в смысле большей или меньшей близости по рассматриваемым
морфологическим особенностям к личинке и к стоящим ниже в системе
семействам отряда. Вообще же по комплексу рассматриваемых морфоло-
гических особенностей каждый вид и форма наилучшим образом приспо-
соблены к условиям, в которых они обитают, и к тому образу жизни,
который они ведут. Вместе с тем наиболее прогрессивные по рассматри-
ваемым морфологическим особенностям роды и виды подсемейства С1и-
pelnae и, как будет видно в дальнейшем, виды родов других подсемейств,
а также и формы ряда видов являются более прогрессивными и по био-
логическим особенностям. Критериями биологической прогрессивности
н данном случае следует считать помимо протяженности миграций раз-
меры ареала и большую численность вида в случае монотипических рр^ов
пли большое число видов у' политипическиХ родов.
Наиболее широкий ареал из подсем. Clupeinae занимают более про-
грессивные по рассматриваемым морфологическим особенностям — Clufrea
harengus (2 подвида со многими формами в умеренных частях Атланти-
ческого и Тихого океанов и в прилегающих морях, см. рис. 14), Нагеп-
gula (около 19 видов в тропических частях Тихого, Индийского и западной
части Атлантического .океанов), Sardinella (около 16 видов в тропи-
ческих и отчасти в субтропических частях Индийского, Атлантического
и западной части Тихого океанов), Sardinops sagax (5 субтропических
подвидов по обе стороны северной части Тихого океана и в южном полу-
шарии у берегов Южн. Америки, Австралии, Новой Зеландии и южной
Африки, см. рис. 23) и Sardina pilchardus (2 субтропических подвида
в северной части Атлантического океана, в Средиземном и Черном морях
(рис. 23). Все они отличаются или большой численностью, составляя основу
мирового промысла (CZ. harengus, S. pilchardus и особенно 5. sagax),
или, не имея большой численности и хозяйственного значения, боль-
шим количеством видов (роды Harengula и Sardinella). Следует отметить,
что большим количеством видов отличаются тропические роды, субтро-
пические и умеренные являются монотипическими, но отличаются, как
указывалось, большой численностью.1 Более примитивные по комплексу
рассматриваемых признаков роды и виды занимают менее обширный
ареал, совершают меньшие миграции и не имеют такой большой числен-
ности. Наименьший ареал в рассматриваемом подсемействе имеет род
Clupeonella, а из видов его Cl. grimmi, несколько больший — Cl. engrau-
lijormis и самый большой — Cl. delicatula, отличающийся и наибольшей
численностью из всех видов рода и представленный двумя подвидами.
Значительно больший, приблизительно такой же, как Sardina pilchardus,
ареал занимает Sprattus sprattus. Численность этого вида меньше чис-
ленности S. pilchardus.
Помимо рассматриваемых особенностей для суждения о высоте или
примитивности организации сельдевых существенное значение иногда
имеет степень развития зубов. У наиболее примитивных .из современных
Clupeoidei, сем. Elopidae и Albulidae, зубы развиты значительно сильнее,
1 Большая или меньшая численность обусловливает в общем большее или мень-
шее хозяйственное значение, если данный вид или форма его достаточно освоены
промыслом. Поэтому характеристику численности во всех случаях см. «Хозяйствен-
ное значение» (стр. 81—83). ' :
2*
20
ВВЕДЕНИЕ
чем у сем. Clupeidae. У представителей сем. Clupeidae зубы имеются,
причем не у всех только на челюстных костях, реже на сошнике и отчасти
на нёбных костях и мезоптеригоиде, между тем как у сем. Elopidae
и Albulidae зубы есть, кроме того, и на парасфеноиде (Берг, 1940 : 222;
Boulenger, 1910 : 548). В пределах подсем. Clupeinae степень развития
зубов не имеет закономерного изменения соответственно изменению
положения плавников и длины и ширины головы, что вполне понятно,
так как степень развития зубов стоит в связи с характером питания,
рассматриваемые же особенности — с движением. Однако в пределах
наиболее изученных родов и видов у более примитивных по рассматри-
ваемым признакам зубы развиты сильнее. В частности, из подвидов
Clupea harengus зубы на сошнике сильнее всего развиты у Cl. harengus
Рис. 2. Положение спинного, аналь-
ного и брюшных плавников у подви-
дов Sprattus sprattus.
harengus, более примитивного по по-
ложению плавников и по другим
признакам, чем Cl. harengus pallasi
и его формы (Cl. harengus pallasi
Рис. 3. Положение спинного, анального
и брюшных плавников у подвидов Clu-
peonella delicatula.
n. maris-albi, Cl. harengus pallasi n. suworowi), у которых зубы на сош-
нике развиты менее. Равным образом у рода Sprattus зубы на сошнике
имеются у некоторых видов из южного полушария (S. antipodum, S. muel-
leri), откуда ведет свое происхождение этот род; у вида из северного полу-
шария (5. sprattus) зубов на сошнике нет. Следует отметить, что у молоди
некоторых видов зубы развиты сильнее, чем у взрослых (подробнее
об этом см. стр. 24).
Соответственно положению спинного плавника изменяется положение
анального и брюшных плавников и у подвидов в пределах некоторых
видов подсем. Clupeinae. Естественно, что степень различия рассмат-
риваемых признаков между подвидами менее степени различий их
у видов.
Положение анального и брюшных плавников относительно переднего
конца тела, точно так же как первого относительно спинного и второго
относительно анального у подвидов Sprattus sprattus и Clupeonella deli-
catula соответственно положению спинного плавника относительно перед-
него конца тела, изменяется таким же образом, как и у. родов и у видов
подсем. Clupeinae (табл. 2 и 3, рис. 2 и 3).
Изменение положения этих плавников у Clupea harengus, имеющего
наибольшее количество подвидов, представлено в табл. 4 и на рис. 4,
Следует отметить, что положение анального плавника у подвидов Cl.
СИСТЕМА СЕМЕЙСТВА
21
Таблица 2
В % длины тела
расстояние от конца рыла до начала разница в положении
спинного плавника (D) анального плавника (А) брюшных плавников (V) А относи- тельно О V относи- тельно А
v^ihHii* sprattus phalericus .... 51.3 68.5 51.1 17.2 17.4
* чргиНин sprattus 50.6 69.3 50.2 18.7 19.1
V sprnllus balticus 50.4 69.9 50.1 19.5 19.8
Таблица 3
В % длины тела
расстояние от конца рыла до начала разница в положении
спинного плавника (D) анального плавника (А) брюшных плавников (V) А относи- тельно D V относи- тельно А
ClH/ifiuiuilla dilioatula delicatula . . 45.9 69.1 51.7 23.2 17.4
t'l drliaatula caspia ........ 45.3 69.3 51.1 24.0 18.2
Таблица 4
U % длины тела
рпсотояпио от конца рыла до начала разница в положении
спинного анального брюшных А относи- V относи- V относи-
плавника (Р) п ла вника | (А) плавников (V) тельно D тельно А тельно D
( lupua harengus harengus . 50.1 74.1 54.9 24.0 19.2 4.8
f l h, II. n. membras . . . 49.6 72.8 54.1 23.2 18.7 4.5
1 1, harengus pallasi . . . 49.4 71.9 53.5 22.5 18.4 4.1
f l h. p. n. maris-albi . . 48.5 70.8 52.2 22.3 18.6 3.7
i ‘l h, p. n. suworoivi . . . 48.0 — — — — —
hfiirngiis изменяется в том же направлении, что и спинного и брюшных.
|)дц||ко вследствие того, что на протяжении ряда положение анального
IUIIIIIIIина относительно переднего конца тела изменяется в большей
< питии, чем спинного и брюшных, разница в положении анального
нппшика относительно спинного также уменьшается, равно как и брюш-
ных относительно анального плавника.
Sprattus sprattus balticus, Clupeonella delicatula caspia и Clupea haren-
rus harengus, имеющие наибольшую разницу в положении анального
п.наппика относительно спинного и брюшных относительно анального;
। опоршают, как указывалось, и большие миграции, чем другие подвиды
,ггих видов, у которых разница в положении этих плавников меньше.
22
ВВЕДЕНИЕ
У подвидов Sprattus sprattus и Clupeonella delicatula положение анального
плавника изменяется в обратном направлении, чем спинного и брюшных,
у подвидов и форм , Clupea harengus положение всех плавников изме-
няется в одном направлении.
Изучение изменения признаков, положенных в основу системы у под-
сем. Clupeinae, проведено на достаточно большом количестве рыб 1
каждого вида и более низких систематических форм, что устраняет влия-
ние индивидуальной изменчивости. Отсутствие подобных ма/гериалов
Рис. 4. Положение спинного, анального
и брюшных плавников у подвидов и
форм Clupea harengus.
по другим подсемействам, встречаю-
щимся в преобладающей своей массе
вне пределов наших вод, не даёт
возможности остановиться' на рас-
смотрении и их таким же образом.
Поэтому в дальнейшем мы остано-
вимся на рассмотрении лишь неко-
торых родов и полиморфных видов,
встречающихся, в наших водах, а из
подсемейств — лишь Dorosomatinae
и Pristigasterinae, для которых имею-
щиеся литературные данные позво-
ляют установить закономерное изме-
нение числа лучей в анальном и
спинном плавниках у родов в пре-
делах обоих подсемейств.
По положению спинного и прочих
плавников, по окраске и некоторым
другим особенностям виды рода
Alosa располагаются следующим
образом (табл. 5, рис. 5). Как видно
из этой таблицы и рисунка, по поло-
жению спинного и других плавни-
ков, по ширине и длине головы, а
также по. степени развития темных
пигментных пятен на боках тела
виды рода Alosa располагаются в
ряд, который, невидимому, является
частью общего ряда подсем. Alosinae.
Изменение всех рассматриваемых
признаков происходит в общем зако-
номерно, за исключением некоторых
из них у А. alosa и А. sapidissima, что обусловлено в основном малым коли-
чеством исследованных рыб (4 экз. первого и 2 экз. второго). При этом
следует отметить, что изменение положения всех плавников относи-
тельно переднего конца тела происходит в одном направлении, как
у форм Clupea harengus, в отличие от подсем. Clupeinae и других видов
1 Средние значения признаков каждого вида и форм отдельных видов, приве-
денные в табл. 1—7, основываются в среднем на 50 экз., по которым произведено опи-
сание этих видов и форм в систематической части, где указано количество исследо-
ванных рыб. Выключение составляют лишь немногие виды и формы, по которым ис-
следовано меньшее количество экземпляров. Средние значения признаков Sprattus
sprattus s. 1., Clupea harengus s. 1. и Clupeonella delicatula s. 1. в табл. 1, Alosa caspia
s. 1. и др. в табл. 5 представляют среднее из средних значений их для всех форм
данных видов.
СИСТЕМА СЕМЕЙСТВА
23:
Т а б л и ц а, 5
В % длины тела в % длины головы 1 Число лучей в анальном плавнике
расстояние от конца рыла до начала разница в положении длина головы межглазничный промежуток
СПИННОГО плавника I т анального 1 плавника брюшных | плавников I (V) | А относи- тельно D V относи- тельно А
Пузанки
Alosa saposhnikovi .... 47.9 68.9 49.7 21.0 19.2 27.1 14.4 20.9
A.^sphaerocephala .... 47.3 68.9 48.5 21.6 20.4 25.7 17.8 21.0
A. caspia s. 1. ..... . 46.0 67.9 47.8 21.9 20.1 26.0 17.8 ' 21.1
Сельди
Alosa brashnikovi s. 1. . . 46.6 69.3 49.3 22.4 20.0 25.1 17.6 20.7 "
A. kessleri s. 1 45.2 67.9 47.8 22.7 20.1 24.0 17.7 20.8
A. fallax s. 1 . 44.3 67.2 46.3 22.9 20.9 23.0 20.6 21.8
A. alosa's. 1 . . 44.3 67.6 44.3 23.3 23.3 22.8 22.2 23.7
A. sapidissima 43.7 68.0 — 24.3 — 22.9 21.6 20.5
этого подсемейства, у которых анальный плавник претерпевает переме-
щение в обратном направлении, чем спинной и брюшные. Однако
в отличие от форм Clupea harengus расстояния между анальным и спин-
ным и брюшными и анальным плавниками, наоборот, увеличиваются.
С увеличением размеров головы, как у подсем. Clupeinae, ширина ее
увеличивается.
Виды рода Alosa делятся на две группы: на пузанков и сельдей (см.
об этом стр. 214). Виды из группы пузанков (A. saposhnikovi, A. sphaero-
cephala и A. caspia) по всем рассматриваемым особенностям являются
более примитивными, чем виды из группы сельдей, из последних среди-
земноморско-атлантические виды (A. fallax, A. alosa, A. sapidissima) —
наиболее высокоорганизованными. В связи с различием в форме тела
пузанков и сельдей в положении спинного и анального плавников относи-
тельно переднего конца тела между обеими группами наблюдается неко-
торое захождение и параллельный характер изменения положения плав-
ников в каждой группе, проявляющийся, как будет указано ниже,
и у каспийских и у черноморско-азовских форм Alosa caspia. Однако раз-
ность в положении плавников относительно друг друга имеет непрерыв-
ный возрастающий характер за исключением разности в положении брюш-
ного плавника относительно анального у A. caspia, что, повидимому,
обусловлено наличием у него немигрирующих форм, локализованных
в южной части моря.
У всех видов рода Alosa за жаберной крышкой сверху с каждой сто-
роны тела имеется по темному пятну. Позади этого пятна у некоторых
видов на боках тела есть еще по нескольку таких же пятен, расположен-
ных в ряд. Из группы пузанков у A. saposhnikovi имеется только одно
пятно за жаберной крышкой; у A. sphaerocephala, кроме того, бывает
изредка несколько пятен и на боках тела, которые у A. caspia.встре-
чаются значительно чаще и в большем количестве. Далее, из сельдей
24
ВВЕДЕНИЕ
у большинства форм A. brashnikovi есть только пятно за жаберной крыш-
кой, но у некоторых наиболее специализированных форм этого вида
иногда (Л. brashnikovi nirchi) или обычно (A. brashnikovi grimmi) имеется,
кроме того, по ряду расплывчатых темных пятен на боках тела. Из форм
A. kessleri у одних (A. kessleri volgensis, мелкая форма A. kessleri pontica)
имеется только по пятну за жаберной крышкой, у других (A. kessleri
kessleri, крупная форма A. kessleri pontica) изредка есть по ряду из не-
скольких пятен и на боках тела. Наконец, у 4. jallax, A. alosa и A. sapi-
dissima на боках тела есть постоянно по ряду пятен, причем под этим
рядом иногда имеется еще 1—2 ряда из меньшего числа пятен. Наличие
пятен на боках тела у каспийско-черноморских сельдей ставилось в связь
с сезоном, полом, зрелостью половых продуктов. Однако позднее (Дех-
тярева, 1940 : 61) установлено, что пятна на боках тела есть и у молоди
тех видов, у которых они имеются во взрослом состоянии, и, следова-
тельно, наличие их зависит не от указанных причин.
Как и у некоторых видов и подвидов подсем. Clupeinae, существен-
ное значение, наряду с рассматриваемыми особенностями, имеет степень
развития зубов. Берг (1913 : 12) на основании того, что у молоди
видов Alosa зубы развиты сильнее, чем у взрослых, считает виды с хо-
рошо развитыми зубами примитивными, виды с менее развитыми зу-
бами — более высокоорганизованными. Мнение это стоит в полном согла-
сии с предлагаемой системой рода за немногими лишь исключениями
(4. kessleri kessleri, черноморско-азовские формы 4. caspia). Из группы
пузанков зубы наиболее сильно развиты у 4. saposhnikovi, наименее —
у всех форм 4. caspia-, A. sphaerocephdla занимает промежуточное поло-
жение между этими видами. Далее, из группы сельдей зубы наиболее
развиты у всех форм 4. brashnikovi. У 4. kessleri зубы развиты менее,
особенно у 4. kessleri volgensis, иногда почти незаметные; наи-
более развиты они у 4. kessleri kessleri. Наконец, у средиземноморско-
атлантических видов 4. /allax, A. alosa и 4. sapidissima зубы наименее
развитые из всех видов рода.1 Следует отметить, что у молоди зубы
наиболее развиты у тех видов (4. saposhnikovi, A. brashnikovi и др.),
у которых они сильнее всего выражены во взрослом состоянии,
у молоди же видов со слабыми зубами они менее заметны (Дехтярева,
1940 : 58).
Изменение признаков, положенных в основу системы видов рода
Alosa, в обоих группах, пузанков и сельдей, находятся в такой же связи
с особенностями их образа жизни, как и у подсем. Clupeinae. A. saposh-
nikovi и 4. sphaerocephala, у которых спинной и другие плавники наибо-
лее отнесены назад и наименьшая разность в положении плавников отно-
сительно друг друга, всю жизнь проводят в море, не заходя в реки. Оба
эти вида, судя по всему, совершают миграции в основном из средней
части Каспийского моря в северную. 4. caspia совершает более отдален-
ные миграции, в особенности его северокаспийские формы, идущие
на нерест из южной части моря в северную, причем все черноморско-
азовские формы и отчасти 4. caspia caspia заходят в реки. Из сельдей
наименее протяженные миграции совершают формы 4. brashnikovi, боль-
шинство которых всю жизнь проводит в южной части Каспийского моря,
и лишь две формы (4. brashnikovi brashnikovi, A. brashnikovi agrachanica)
идут для размножения в северную часть его, не заходя в реки. Черно-
1 У молоди этих видов, как и у упомянутых выше, зубы более развитые (ясно
заметные на ощупь), чем у взрослых.
СИСТЕМА СЕМЕЙСТВА
25
морско-азовская форма (A. brashnikovi maeotica), подобно двум послед-
ним, совершает миграции значительной протяженности из Черного моря
и северо-западную часть его и в Азовское море. Проходные виды, у кото-
рых спинной и другие плавники расположены ближе к переднему концу
тела и разность в положении плавников относительно друг друга наи-
оолыпая, совершают наиболее отдаленные миграции. Каспийские формы
.1. kessleri (A. kessleri volgensis, A. kessleri kessleri) из южной части моря
идут для икрометания в реки северной части, черноморско-азовская
(.1. kessleri pontica) — из Черного моря в реки северо-западной части
его и Азовского моря. Средиземноморско-атлантические виды (А. /allax,
.1. alosa, A. sapidissimd) являются также проходными. Протяженность
миграций их в море не известна, но в отношении A. sapidissima можно
считать установленным, что эти миграции превосходят по протяженности
ц|ковые у A. kessleri (см. стр. 316).
Наиболее прогрессивные виды как из пузанков, так и из сельдей
имеют и более широкий ареал, отличаясь вместе с тем и большей чис-
ленностью.
Изменение признаков, положенных в основу классификации, рассма-
тривалось у видов рода Alosa. У подсем. Clupeinae, как указывалось
выше, оно наблюдается и у подвидов в пределах видов. То же самое можно,
уста повить у некоторых видов рода Alosa. Так, например, у A. caspia
гакан же зависимость, как и у видов рода, наблюдается в отношении
почти всех рассматриваемых признаков, причем, как и у видов из группы
пузанков и сельдей Alosa, изменение их, в частности изменение положе-
нии плавников, у каспийских и черноморско-азовских форм имеет неко-
торое захождение и параллельный характер. Однако в каждой из групп
изменение положения плавников имеет характер закономерного переме-
щения их к передней части тела (табл. 6, рис. 6). При этом все признаки
Таблица &
К и с и и й с к и е формы
|/|ии caspia knipowitschi .
I caspia persica............
I caspia caspia ...........
I caspia salina ...........
•I i> p и о м о p с к о - а а о в -
с, к и е формы
Uokii caspia palaeostomi .
I caspia nordmanni . . .
I caspia tanaica.......
В % длины тела В % длины головы
расстояние от конца рыла до начала разница в положении длина головы межглазничный промежуток
спинного плавника (£) анального плавника (А) 1 брюшных плавников (V) А относи- тельно D 1 i V относи- ! тельно А 1 высота тела 1
47.9 68.3 49.0 20.4 19.3 27.8 29.7 17.5
46.9 68.2 48.4 21.3 19.8 26.8 29.1 18.2
45.8 67.6 47.4 21.8 20.2 26.4 26.4 18.5
45.5 67.4 46.9 21.9 20.5 25.4 26.2 18.8
46.0 68.5 48.4 22.5 20.1 25.9 27.7 15.6
45.2 68.0 47.6 22.8 20.4 25.3 24.4 16.7
44.5 67.3 46.8 22.8 20.5 24.7 24.2 17.4
21.7
21.5
21.3
20.7
S
о
л
в
СО
№
|>»aj
R £
s
2 и
R ffl
2 w
в ч
tr и
20.9
20.9
20.7
Рис. 5. Положение спинного, анального
я брюшных плавников у видов рода
Alosa.
СИСТЕМА СЕМЕЙСТВА
и imi'iihiotch сходным образом, как и у видов рода. В сходной взаимо-
। ниш находятся рассматриваемые признаки и с образом жизни форм
I caspia. Среди каспийских форм спинной и анальный плавники
и ннконы далеко назад, разность в положении их относительно друг
ipyiii меньше и лучей в анальном плавнике больше у форм, живущих
н рппмпожающихся в южной части моря (A. caspia knipowitschi,
I caspia persica). У форм, зимующих в южной части моря, а для
рн 1М1ЮЖ0ИИЯ идущих в северную часть моря (A. caspia caspia,
I caspia salina), спинной и анальный плавники расположены ближе
н пиродному концу тела, разность в положении их относительно друг
ipyrn больше и лучей в анальном плавнике:меньше. Черноморсй'о-азов-
I нно формы A. caspia соответственно в общем более близкому располо-
жению плавников к переднему концу тела и пр., чем у каспийских форм,
ш-дут и общем и более подвижный образ жизни, причем в,се они для раз-
множения заходят в низовья рек, в озера и лиманы, и ни одна из них
ни монет икру в море, между тем как большинство каспийских форм
размножается в море, в заливах и ильменях или в устьях рек. Наимень-
шие но протяженности миграции из всех черноморско-азовских форм
I. caspia совершает A. caspia palaeostomi, локализованный в южной
чисти моря, наибольшие — A. caspia nordmanni и A. caspia tanaica', нер-
пы ii с мест зимовок от южных берегов Крыма и западных Черного моря
идет в реки северо-западной части его, второй от южного кавказского
побережья — в р. Дон и лиманы дельты Кубани. Помимо указанных
признаков каку каспийских, так и у черноморско-азовских форм A. caspia
с ходпым образом изменяется. высота тела, находящаяся также в за-
висимости от миграционных особенностей. Как видно из рис. 6 и табл. 6,
у форм, совершающих миграции большей протяженности в северные
части моря, тело значительно ниже, в особенности у каспийских, чем
у форм, локализованных в южных частях моря. Что касается темных пя-
тен на боках тела, то у черноморско-азовских форм они встречаются реже
п в менее выраженной форме, чем у каспийских. Следует отметить, что
у черноморско-азовских форм и других видов рода Alosa (A. kessleri
pontica) пятна на боках тела развиты менее.
У A. kessleri рассматриваемые признаки изменяются непрерывно
па протяжении всех форм вида (табл. 7, рис. 7), за исключением длины
головы, изменение которой, как и у форм A. caspia, имеет параллельный
характер соответственно делению форм вида на черноморско-азовских
и каспийских (табл. 7, рис. 7). Что касается степени развития зубов,
то они менее всего развиты у A. kessleri volgensis, более — у A. kessleri
pontica и A. kessleri kessleri. Таким образом, степень развития зубов
и данном случае не стоит в связи с изменением других признаков, что
вполне понятно, так как эта особенность связана не с движением,
а с питанием.
Судя по всем рассматриваемым признакам, за исключением степени
развития зубов, наиболее высокоорганизованной формой вида следует
считать A. kessleri kessleri. Это стоит в полном согласии и с тем, что пятна
па боках тела из обеих каспийских форм имеет только эта. По более
отнесенным назад плавникам, большим размерам и большей ширине
головы и пр. наиболее примитивной формой A. kessleri следует считать
,1. kessleri pontica. При этом крупная форма A. kessleri pontica, имеющая
изредка на боках тела темные пятна, соответствует биологически и от-
части морфологически A. kessleri kessleri, у которой пятна на теле бывают
чаще, а мелкая форма — A. kessleri volgensis (подробнее об этом см.
28
ВВЕДЕНИЕ
Таблица 7'
В % длины тела
В %
длины
головы
расстояние от конца рыла до начала разница в положении я
о СО t- £ £со о К И Q S Я д s Вй 2 §=> О § и 2 и е s £
Я Й д и J3 № R m я и 2 о 8 и СО И S D mJ
© О И'-' И я ЙС- о с О Й КС ф Я я с
Черноморско-азов-
ские формы
Alosa kessleri J мелкая . . . 46.0 68.4 48.3 22.4 20.1 25.3 15.8
pontica ( крупная . . 45.2 67.9 47.8 22.7 20.1 23.0 17.4
v Каспийские формы Alosa kessleri volgensis . . . 45.0 67.7 47.6 22.7 20.1 24.5 17.5
A. kessleri kessleri 44.8 67.6 47.5 22.8 20.1 23.1 20.3
стр. 65). Более высокой степени
у A. kessleri kessleri по сравнению
Рис. 7. Положение спинного, анального
и брюшных плавников у форм Alosa
kessleri.
развития рассматриваемых признаков:
с A. kessleri volgensis и крупной формы;
A. kessleri pontica по сравнению с
мелкой соответствуют особенности!
в распространении и биологии, по-
добные отмеченным у более высоко-
организованных видов рода Alosa
и форм A. caspia. A. kessleri kessleri
и крупная форма A. kessleri pontica.
заходят для нереста высоко вверх
по течению рек, в то время как мел-
кая форма A. kessleripontica и A. kes-
sleri volgensis высоко в реки не под-
нимаются и нерестуют в нижнем те-
чении, последняя иногда частично'
даже в предустьевом пространстве
Волги.
Из всех форм А. /allax и A. alosa
представилась возможность иссле-
довать лишь некоторые и притом на
немногочисленном материале. Иссле-
дуемые признаки и этих форм обоих
видов имеют в общем такие же зако-
номерные изменения, как и у дру-
гих видов рода (табл. 8, рис. 8).
A. brashnikovi, наиболее богатый
формами из всех видов рода, обла-
дающий, кроме того, некоторыми
своеобразными биологическими адап-
тациями, крайне изменчив в основных, связанных с этими адаптациями
морфологических особенностях. Формы этого вида, расположенные соот-
СИСТЕМА СЕМЕЙСТВА
29
Таблица 8
В % длины тела
В %
длины
головы
расстояние от конца
рыла до начала
3
и к
S’ к
s °
Я
S £
в и
Ь s
Я о
v &
S И
jnisu fallax nilotica...........
t /к/Zu c fallax................
HPli'TiJOHHO положению спинного плавника, почти не обнаруживают
шшой-либо закономерности в изменении других рассматриваемых при-
нципов, почему фактический материал здесь не приводится. Однако сле-
дует отметить, что и здесь у форм, идущих для нереста в северную часть
Кионийского моря (Л. brashnikovi brashnikovi и A. brashnikovi agracha-
nlaa), спинной и анальный плавники расположены ближе к переднему
копну тела, межглазничный промежуток шире, чем у других форм.
Вместе с тем, у A. brashnikovi kisselevitshi, ведущей наиболее пелагиче-
ский образ жизни, но живущей и
рвзмиожающейся в южной части
Каспийского моря, спинной плавник
расположен'еще ближе к переднему
концу тела, а межглазничный про-
межуток так же широк, как у обе-
их упомянутых форм. Наиболее от-
несены плавники назад и уже го-
лова у южнокаспийских форм
(Л. brashnikovi orientalis, A. brash-
nikovi grimmi, A. brashnikovi nirchi),
ведущих придонный образ жизни.
Морфологические особенности
форм A. brashnikovi обусловлены
приспособлениями их к различным
условиям существования. Основным
фактором образования форм этого
Рис. 8. Положение спинного, анального
и брюшного плавников у форм Alosa
fallax.
вида является, повидимому, приспо-
собление их главным образом к различному характеру питания, крайне
разнообразному у форм этого вида, вследствие чего у них и наблюдаются
большое разнообразие и различия в строении жаберных тычинок, рта
о частей черепа, связанных с питанием. Наиболее резко обособленная
форма вида, A. brashnikovi grimmi, является вместе с тем по образу жизни
и характеру питания наиболее придонной из всех форм вида. Питается
эта форма преимущественно бычками, иногда даже моллюсками {Car-
ilium), реже тюлькой, в связи с чем жаберных тычинок у ней наименьшее
количество, а на конце нижней челюсти у взрослых рыб имеется мозо-
листое утолщение, развивающееся, повидимому, вследствие соприкосно-
30.
ВВЕДЕНИЕ
Пения нижней челюсти с грунтом при захватывании пищи. Весьма харак-
терно, что у молодых рыб, длиной до 20 см, мозолистого утолщения
на нижней челюсти нет. Повидимому, по этой же причине отсутствует
у A. brashnikooi grimmi и бугорок на конце нижней челюсти, имеющийся
почти постоянно у всех других форм вида. Вследствие механического
воздействия грубой пищи жаберные тычинки искривляются, на конце
утолщаются, расплющиваются, разветвляются и обламываются, а ты-
чинки на нижнем конце жаберной дуги редуцируются и отсутствуют
даже у молодых, благодаря чему первая тычинка у этой формы отстоит
далеко от основания языка (см. рис. 46). Окраска у A. brashnikooi grimmi
белесая, а на боках тела с каждой стороны, кроме пятна за жаберной
крышкой, обычно имеется по ряду расплывчатых серых пятен, почти
сливающихся в продольную полосу. Близкая к Л. brashnikooi grimmi
и ведущая подобно ей придонный образ жизни A. brashnikooi nirchi имеет
иногда на нижней челюсти точно такое же, но небольшое мозолистое
утолщение; окраска у этой формы бледная; на боках тела, помимо пятна
х,за жаберной крышкой, иногда имеется по ряду расплывчатых серых
пятен. Наиболее резко уклоняющаяся от этих форм, а в особенности
от A. brashnikooi grimmi, A. brashnikooi kisseleoitshi имеет самое большое
количество жаберных тычинок из всех форм вида, причем тычинки у этой
формы обычно заостренные, не утолщенные и не разветвленные на кон-
цах, первая тычинка расположена близко от основания языка. Держится
эта форма в поверхностных слоях воды, питается тюлькой, креветками,
бычками. Вследствие различий в характере питания наблюдаются изме-
нения и в строении частей скелета головы A. brashnikooi grimmi. Часть
черепа у этой формы в области прикрепления hyomandibulare, а посред-
ством него и нижней челюсти (именно передний конец каждого spheno-
ticum) укорочена и сзади закруглена и не изогнута крючкообразно
(табл. XLVIII, В), как у других форм вида (например у A. brashnikooi
brashnikooi, A. brashnikooi orientalis, A. brashnikooi kisseleoitshi, см.
табл. XLIV—XLVI, В). Сходное строение имеет передний конец каждого
sphenoticum и у Л. brashnikooi nirchi. У этих форм наблюдаются Суще-
ственные различия и в строении жаберных тычинок, подробно описан-
ные в диагнозах.
Таким образом, из этих примеров видно, что наиболее специализи-
рованными формами A. brashnikooi следует считать A. brashnikooi grimmi
и затем A. brashnikooi nirchi, приспособившихся к совершенно несвой-
ственному сельдевым придонному образу жизни и преимущественно
бентоядному питанию. Эта биологическая специализация сопровождается
рядом глубоких морфологических изменений й появлением пятен
на боках тела, свойственных, как указывалось выше, наиболее высоко-
организованным видам и формам. Спинные же и другие плавники распо-
ложены ближе к переднему концу тела, и разница в положении их
относительно друг друга больше у форм, идущих для размножения в север-
ную часть Каспийского моря (A. brashnikooi brashnikooi и A. brashnikooi
agrachanica), чем у форм, постоянно живущих и размножающихся в юж-
ной части моря (Л. brashnikooi sarensis, A. brashnikooi autumnalis), а среди
последних менее всего у ведущих придонный образ жизни (Л. brashnikooi
grimmi, A. brashnikooi nirchi). Среди южнокаспийских форм Л. brashni-
kooi спинной и анальный плавники расположены ближе всего к перед-
нему концу тела и разность в положении этих плавников относительно,
друг друга больше у наиболее пелагической формы (Л. brashnikooi kisse-
leoitshi).
СИСТЕМА СЕМЕЙСТВА
3:1
Ki тественно,. что наиболее прогрессивные по рассматриваемым мор-
.|ю.!ц>гическим особенностям формы A. caspia и A. brashnikooi, идущие1
। и, икрометания в северную часть Каспийского моря, занимают и более
in и pi и, ий ареал, чем формы, локализованные в южной части моря. Вместо
। к'м эти формы характерны и большей численностью.
У подсем. Dorosomatinae основание анального плавника несколько
iin.ui‘1' удлиненное и плавник имеет большее количество лучей, чем у рас-
, Min репных выше подсем. Clupeinae и отчасти Alosinae, спинной плавник,
iinniinpoT, в общем немного короче и с меньшим количеством лучей.
\ родов подсемейства по мере увеличения числа лучей в анальном плав-
iiiii.i- число лучей в спинном плавнике уменьшается (табл. 9).1 У родов
lioiiisoina, Gonialosa и Signalosa, имеющих наибольшее число лучей
к iiiiii.ii.пом плавнике и наименьшее в спинном, за жаберной крышкой
i.i'pxy с каждой стороны тела есть по большому темному пятну. У родов
' in/«iiKKlon, Nematalosa и Anodontostoma с наименьшим числом лучей
и nun,in.пом плавнире и наибольшим в спинном, кроме пятна за жабер-
... крышкой, имеются ряды темных более мелких пятен вдоль рядов
Ч1.|нуп па верхней половине тела.
11>к лодпие роды имеют более ко- Таблица 9
puihoo расстояние от конца рыла
и, начала спинного плавника (co-
ni но I I'l iioiino перечисленным выше
рилам G2.2, 44.8 й 45.3%) и бо-
НН1 длинное до начала анального
(I hoiпотственно 66.7, 68.8 и
i I I "и) и брюшных (44.0, 45.0,
o' I i"ii), чем у Dorosoma (до начала
«iiiiiiiiot'o 47.2, анального 57.0,
.....иного 37.9%). Отсутствие ма-
iiipiin.iioii по некоторым родам
iiiiiiriBvioiicTna не дает возможности
Число лучей в плавнике
анальном СПИННОМ"
Anodontostoma 18—21 17—19
Nematalosa 18—24 13—18
Clupanodon 20—28 15—18
Signalosa 21—27 13—16
Gonialosa 22—28 14—17
Dorosoma 26—38 12—15
pin положить их соответственно
нодожопию плавников, но, судя по всему, роды Clupanodon, Nematalosa и
I nmlontosloma, имеющие наиболее развитую пигментацию па теле, должны,
loiii и с.ходпыо роды в подсем. Clupeinae, запять среднюю часть ряда. Пред-
। inпнтоли подсем. Dorosomatinae — проходные, пресноводные и . отчасти
kinpi Kiio рыбы, держащиеся в заливах и эстуариях. Образ жизни их изу-
чен мило, и поэтому в настоящее время затруднительно установить связь-
мнжду рассматриваемыми морфологическими и биологическими особен-
nori ими.
Подсем. Pristigasterinae характерно еще более удлиненным основа-
нном ппалыюго плавника с большим числом лучей в нем и слабым разви-
том брюшных и спинного плавников, причем оба последних плавника
у никоторых родов отсутствуют. По мере увеличения числа лучей в аналь-
ном плавнике число их в спинном, как это отмечено и у подсем. Clupeinae
И IhiniNoniatinae, уменьшается (табл. 10), и, наконец, у рода Raconda,
HMtHoiiioro наибольшее число лучей в анальном плавнике, спинной плав-
нНИ вообще отсутствует. Параллельно с этим брюшные плавники, имею-
IIIHiii'll лишь у родов Ilisha, Pellona и Chirocentrodon, редуцируются
н у hivitijiьпых родов отсутствуют. Роды подсем. Pristigasterinae в таблице
• Количество лучей в анальном и спинном плавниках в табл. 9 и 10 приведено-
НН |H|f1iiTiiM, цитированным npif описании обоих подсемейств в систематической части..
32
ВВЕДЕНИЕ
Таблица 10
Число лучей в плавнике Плавники
анальном СПИННОМ спинной брюшные
Ilisha 33—52 14—21 Есть Есть
Pellona 33—53 16—20 » »
Chirocentrodon 40—42 13—15 » »
Pristigaster 46—55 15 » Нет
Pliosteostoma 53 13 » »
Opisthopterus 56—65 13—17 » »
Odontognathus 67—78 11—12 » »
Raconda 82—92 — Нет »
расположены соответственно увеличению числа лучей в анальном плав-
нике и уменьшению числа их в спинном. Возможно, что в зависимости
от величины антедорсального расстояния расположение их будет иное
и даст, как в подсем. Clupeinae, возрастание одних и убывание других
к середине ряда и соответственно убывание и возрастание к концу. Био-
логия представителей подсем. Pristigasterinae не изучена, н поэтому уста-
новить взаимосвязь между рассматриваемыми морфологическими особен-
ностями и образом жизни не представляется возможным.
В заключение естественно задать вопрос, каково значение различий
в положении плавников, числа лучей в них, ширины головы и других
признаков, которые, как указывалось, теснейшим образом связаны
•с биологическими особенностями — с протяженностью миграций
л жизнью на разных глубинах и на разной отдаленности от берегов?
Функция плавников, в частности непарных, выяснена еще недоста-
точно. По наблюдениям Васнецова (1941 : 503), спинной плавник,
расположенный, как у преобладающего большинства сельдевых, на уровне
или немного сзади центра тяжести, служит для сохранения прямолиней-
ности движения и для фиксации положения середины тела при поворо-
тах. Анальный плавник, расположенный у всех костистых рыб в задней
части тела сзади уровня центра тяжести тела, служит для подъема и опу-
скания передней части тела, так как при помощи его соответственно
изменяется положение задней части тела в обратном направлении. Уда-
ление его влечет за собой затруднение или неспособность к опусканию
головы вниз. Такую же роль выполняет и спинной плавник, располо-
женный сзади уровня центра тяжести тела рыбы.
Более детально этот вопрос не изучен. В частности, не выяснено
значение различия во взаимном положении спинного и анального плав-
ников, разница в положении которых по отношению друг к другу
изменяется, как указывалось, более закономерно и. имеет большую абсо-
лютную разность между крайними значениями ее, чем между крайними
положениями этих плавников относительно передней части тела. На осно-
вании того, что изложено выше, об этом можно только догадываться и
высказывать предположения. У представителей подсем. Clupeinae, совер-
шающих миграции наибольшей протяженности и живущих в основном
в более поверхностных слоях воды (Sardinops, Sardina, Sardinella'}-,- аналь-
ный плавник отнесен назад, спинной еще в большей степени вперед
я поэтому разница во взаимном расположении этих плавников наиболее
СИСТЕМА СЕМЕЙСТВА
33
значительна (см. табл. 1). У представителей того же подсемейства, не со-
вершающих таких миграций и живущих в основном на больших глубинах
(Sprattus, Clupea, Clupeonelld), наоборот, анальный плавник расположен
ближе к переднему концу тела, спинной более удален от него, чем у упо-
мянутых выше родов, и поэтому разница во взаимном расположении
их значительно меньше.
Равным образом и у форм Sprattus sprattus и Clupeonella delicatula
разница в положении спинного и анального плавников относительно
друг друга увеличивается параллельно уменьшению расстояния спин-
ного плавника от конца рыла, О биологических отличиях этих форм
сказано выше.
Большее значение положения спинного и анального плавников отно-
сительно друг друга, чем относительно переднего конца тела, нагляднее
видно у видов рода Alosa. Несмотря па то что положение анального пла-
вника у видов этого рода в отличие от подсем. Clupeinae изменяется
в том же направлении, что и спинного, тем не менее разница во вза-
имном положении этих плавников, по мере уменьшения расстояния спин-
ного плавника от конца рыла, как указывалось, увеличивается (табл. 5).
Виды, имеющие менее отнесенные назад спинной и анальный плавники
и, что самое существенное, большую разницу во взаимном положении
их, совершают более отдаленные миграции. Наибольшую разницу в поло-
жении этих плавников относительно друг друга имеют виды из группы
сельдей, наименьшую — виды из группы пузанков, среди последних
наибольшую A. caspia, некоторые формы которого заходят для икромета-
ния в реки, среди первых — проходные виды. Об этом свидетельствуют
также и формы некоторых видов Alosa, в частности A. caspia (см. табл. 6):
у черноморско-азовских форм, заходящих для размножения в реки,
расстояние между началом спинного и анального плавников больше,
чем у каспийских, а среди последних расстояние это больше у форм,
идущих для икрометания в северную часть моря, чем у форм, живущих
в южной части моря, не выходящих за пределы его.
Наконец, еще более убедительный пример большего значения поло-
жения спинного и анального плавников относительно друг друга, чем
относительно переднего конца тела, представляют формы Clupea harengus
(табл. 4). Изменение положения анального плавника по отношению к пе-
реднему концу тела у форм этого вида в отличие от видов подсем. Clu-
peinae и форм других видов его имеет такой же характер, как и изменение
положения спинного. Однако разница во взаимном положении этих
плавников по мере уменьшения расстояния от конца рыла до начала
<шинного плавника не увеличивается, как у всех рассматриваемых выше
сельдевых, а уменьшается, что стоит в полном соответствии с размерами
миграций форм Cl. harengus. Cl. harengus harengus, имеющий наибольшую
разницу в положении этих плавников, совершает, как указывалось выше,
п большие по размерам миграции, чем другие формы, у которых разница
во взаимном положении этих плавников меньше. К сходному выводу
автор пришел и относительно тресковых, у которых виды, имеющие боль-
шие промежутки между спинными и анальными плавниками, являются
более подвижными.
Таким образом, из приведенных примеров видно, что большее зна-
чение и большую связь с другими рассматриваемыми морфологическими
особенностями, а также и с биологическими имеет положение спинного
и анального плавников на теле не столько по отношению к переднему
концу тела, сколько относительно друг друга. Виды и формы, имеющие
3 Фауна СССР —314
34
ВВЕДЕНИЕ
большую разницу во взаимном положении спинного и анального плавни-
ков, совершают более отдаленные миграции и являются более подвижными.
Еще менее изучено значение изменения числа лучей в спинном
и анальном плавниках, характеризующее длину основания их. Из всех
рассматриваемых примеров можно сделать заключение, что увеличение
числа лучей в анальном плавнике идет параллельно уменьшению числа
их в спинном. Особенно наглядно видно это у тех из рассматриваемых
групп, где число лучей в плавниках велико — в подсем. D ого sonatinas
и особенно Pristigasterinae. Судя по характеру изменения числа их
у представителей подсем. Clupeinae, можно полагать, что оно также
теснейшим образом связано с движением, так как число лучей в аналь-
ном плавнике менее всего у видов, совершающих большие по протяжен-
ности миграции, однако у видов Alosa — наоборот. В частности, такую же
зависимость между размерами анальных плавников, в особенности первого
анального плавника, и подвижностью обнаружена автором у тресковых
(Световидов, 1948:27). Наиболее подвижный образ жизни ведут виды,
- имеющие более короткий первый анальный плавник и располагающиеся
в середине ряда подсем. Gadinae. Виды, живущие на больших глубинах
и ведущие менее подвижный образ жизни, имеют длинный первый
анальный плавник.
Функция брюшных плавников менее ясна, чем спинного и анального.
По указанию Васнецова (1941 : 50), эти плавники являются рулями
глубины. Вместе с тем, по исследованиям того же автора, при удалении
брюшного плавника тело рыбы несколько смещается в сторону, что ука-
зывает на роль этих плавников в фиксации середины тела на месте при
поворотах. Значение же положения брюшных плавников на теле рыбы
относительно переднего конца тела и тем более относительно непарных
плавников совершенно не изучено. Судя по более близкому положению
брюшных плавников к переднему концу тела и большему удалению
от анального у рыб, совершающих отдаленные миграции, можно пола-
гать, что эти плавники имеют отношение и к движению.
В теснейшей связи с рассматриваемыми морфологическими и биоло-
гическими особенностями сельдевых находятся и размеры головы, зна-
чительно более широкой у видов и форм отдельных видов с более отне-
сенным вперед спинным плавником, большей разницей в положении
относительно него анального и совершающих большие миграции. Это
вполне понятно, так как среди пелагических рыб многие из совершающих
отдаленные миграции, например кефали, имеют торпедообразную форму
тела с расширенной головой. Что касается длины головы, не имеющей,
невидимому, функциональной связи с движением, то увеличение ее
в связи с уменьшением ширины, можно полагать, обусловлено коррелятив-
ной изменчивостью.
Степень развития сети каналов системы боковой линии на голове
у видов подсем. Clupeinae находится также в связи с движением, так как
они более развиты у видов, совершающих отдаленные миграции, чем.
у видов с меньшими размерами миграций.
Таким образом, параллельный характер изменения рассматриваемых
морфологических особенностей находится в теснейшей связи с биологи-
ческими особенностями, с размерами совершаемых ими миграций.
Эта взаимная связь выражается, с одной стороны, в положении спин-
ного, анального и брюшных плавников на теле как относительно перед-
него конца его, так в основном относительно друг друга, в различном
числе лучей в спинном и анальном плавниках, характеризующем их
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
35
длину, в большей или меньшей ширине головы и у некоторых сельдевых
в высоте тела, характеризующими в совокупности различную степень
приспособления к движению. С другой стороны, как это видно на при-
мере подсем. Clupeinae, эта связь выражается в различной степени раз-
вития каналов системы боковой линии на голове, характеризующей
приспособление к ощущению движения. Следовательно, комплекс рас-
сматриваемых морфологических особенностей заключает приспособление
к движению — к различной протяженности миграций и к ощущению
движения.
Несколько особняком стоит изменение пигментации, не имеющей
приспособительного характера к движению. Однако параллельное изме-
нение интенсивности ее в связи с изменением комплекса рассматривае-
мых признаков резко бросается в глаза, имеет не случайный характер
и обусловлено не прямым отношением к движению, а косвенными причи-
нами. Как известно, наиболее сильно изменяется окраска большинства
рыб, в частности лососевых, в период наиболее интенсивной их жизне-
деятельности, во время икрометания и, невидимому, стимулируется
не только созреванием половых продуктов, но и усиленным обменом ве-
ществ в связи с совершаемыми ими в этот период отдаленными мигра-
циями. Пигментация более развита, как указывалось, у тех сельдевых,
которые совершают отдаленные миграции, и развитие пигментных клеток,
вероятно, стимулировано усиленным обменом веществ этих сельдевых.
Таким образом, судя по всему, и различие в развитии пигментации сель-
девых стоит в связи с движением, с размерами совершаемых ими миграций.
ГЕОГРАФИЧЕСКОЕ .РАСПРОСТРАНЕНИЕ
Современное распространение семейства сельдевых, как и распростра-
нение основной массы водной и наземной фауны, помимо причин
исторических, обусловлено главным образом их экологическими особен-
ностями, в частности отношением к температуре.
Преобладающее большинство представителей семейства по своему
распространению является тропическим. Из 50 родов и около 190 видов
сельдевых распространение почти 150 видов, относящихся к 37 родам,
ограничено тропиками, причем некоторые виды ряда родов (Harengula
zunazi, Sardinella aurita, Ilisha elongata и др.) заходят в южные части
субтропических морей.
Умеренным широтам свойственна сравнительно небольшая часть
сельдевых, в которую входят роды, распространенные в бореальной
и в большей части субарктической областях Дерюгина (1915 : 717; 1924 :
96; 1928 : 352). Здесь встречается около 20 видов, относящихся к 7 родам,
причем виды некоторых родов или формы некоторых видов свойственны
более южным широтам, субтропикам (Sprattus sprattus phalericus, Alosa
jallax nilotica и ряд пресноводных форм этого вида из бассейна Среди-
земного моря, A. alosa africana и некоторые пресноводные и проходные
формы этого вида из бассейна Эгейского моря и юго-западной части Чер-
ного) и даже отчасти тропикам' (Pomolobus chrysochloris, Brevoortia tyran-
nus patronus).
Незначительная часть сельдевых по своему распространению зани-
мает промежуточное положение между тропическими и бореальными,
являясь в основном субтропическими. Не считая некоторых упомянутых
выше форм бореальных видов и некоторых заходящих сюда видов
тропических родов, в субтропических морях северного полушария
3*
36
ВВЕДЕНИЕ
встречаются лишь 4 вида, относящиеся к 3 родам семейства (Etrumeus,
Sardina, Sardinops), причем 2 из этих видов относятся к двум родам (Sar-
dina и Sardinops). Формы Sardinops свойственны субтропическим морям и
южного полушария, одна из форм Sardina (S. pilchardus pilchardus) встре-
чается в умеренных морях. Из 4 видов рода Etrumeus один (Е. sadina)
свойствен субтропическим и прилегающим тропическим частям морей
северного полушария (от Мексиканского зал. до м. Код), второй (Е. jack-
soniensis) — южного; третий вид этого рода (Е. micropus) является
отчасти тропическим (Гавайские о-ва), но в основном встречается также
в субтропических морях северного (у берегов Японии, в зал. Петра Вели-
кого, у Калифорнии) и южного (у южных берегов Африки) полушарий.
Скорее субтропическим следует считать также один из видов рода Doro-
soma (D. cepedianum cepedianum — от м. Код до Техаса, D. cepedianum
exile — Техас).
Арктических среди сельдевых нет ни одного рода и вида. В аркти-
ческих морях встречаются лишь некоторые подвиды Clupea harengus
(Cl. harengus pallasi n. maris-albi, Cl. harengus pallasi n. suworowi и от-
части Cl. harengus pallasi), являющиеся умеренноарктическими (Nie-
derarktische по терминологии Hofsten, 1915 : 202). Высоко арктических
(Hocharktische, no Hofsten, 1915) среди сельдевых нет.
В южном полушарии южнее тропиков встречается значительно мень-
шее количество сельдевых, чем в соответствующих частях северного.
Умеренным и отчасти субтропическим морям южного полушария свой-
ствен встречающийся и в северном полушарии род Sprattus, некоторые
из 5 известных здесь видов которого, судя по всему, являются лишь
подвидами. 2 вида этого рода (S. arcuatus, S. melanostoma) встречаются
у берегов Южн. Америки, 3 — у южных берегов Австралии (S. bassensis)
и Новой Зеландии (S. muelleri, S. antipodum). В основном субтропиче-
ским в южном полушарии является единственный вид рода Potamalosa
(Р. richmondia, пресные воды Австралии), точно так же как и оба вида
рода Hyperolophus, причем распространение одного из них (Н. translu-
cidus, берега Нового Южн. Уэльса) ограничено самыми южными частями
прилегающих тропических морей. Упомянутые выше для субтропических
морей северного полушария роды Etrumeus и Sardinops в субтропических
морях южного полушария встречаются у берегов южной Африки (Е. micro-
pus, S. sagax ocellata), Южн. Америки (5. sagax sagax), Австралии
(Е. facksoniensis, S. sagax neopilchardus) и Новой Зеландии (S. sagax
neopilchardus). Субтропическим морям южного полушария свойственно
также несколько видов в основном тропического рода Spratelloides, встре-
чающихся здесь у берегов южной Африки (S. aestuarius) и Австралии
(5. robustus). В субтропиках южного полушария встречаются некоторые
и тропические виды как упомянутых родов (например Spratelloides delicatu-
lus), так и ряда других (например Ilisha natalensis, Hilsa durbanensis —
у берегов Гожной Африки, Nematalosa richardsoni — южная - Австра-
лия, некоторые виды широкораспространенных родов Harengula, Sardi-
nella). В антарктических частях южного полушария сельдевых нет.
Таким образом, основная масса сельдевых — тропические рыбы;
бореальных и субтропических среди сельдевых значительно меньше,
арктических почти нет; в высокоарктической подобласти сельдевые
отсутствуют.
Второй экологической особенностью, обусловившей распространение
сельдевых, следует считать их отношение к солености. По этой эколо-
гической особенности сельдевые представляют довольно смешанную
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
37
группу. Смешанный характер по отношению к солености имеет не только
семейство сельдевых в целом, но, как будет указано ниже, и отдельные
роды и даже виды.
Основная масса сельдевых, около 25 родов, заключающих в общей
«ложности свыше 100 видов, является морскими рыбами тропических,
умеренных и отчасти арктических морей. Сюда относятся роды с наи-
большим количеством видов, как, например, Harengula, Sardinella. Неко-
торые виды в основном морских родов заходят в пресную воду, в устья
рок и даже в реки и озера (например некоторые формы Clupea harengus,
в особенности Cl. harengus pallasi, Ilisha indica и другие виды этого рода),
некоторые роды (Clupeonella) или виды и подвиды морских родов живут
в солоноватой воде (например некоторые подвиды Sprattus sprattus) или
проводят всю жизнь в пресной воде (см. ниже, стр. 71).
Значительная часть сельдевых (около 15 родов, примерно с 30 видами)
является пресноводными рыбами, причем распространение преобладаю-
щего большинства их ограничено тропиками. Большая часть их, 8 родов
(Pellonula и близкие роды из подсем. Pellonulinae) с 14 видами, населяют
пресные воды западной Африки. Ряд родов того же подсемейства с 6 ви-
дами встречается в пресных водах Индо-малайского архипелага (Clu-
peoides, Сorica, Clupeichthys) и Австралии (Potamalosa). Несколько родов
(Gudusia, Gonialosa, подсем. Alosinae) с 4 видами свойственны пресным
подам Индии. Все виды рода Signalosa (подсем. Dorosomatinae) живут
в пресных водах атлантического побережья центральной и тропической
части Сев. Америки. Из 4 видов рода Dorosoma 3 связаны в основном
с. пресными водами; один вид этого рода (D. cepedianum), имеющий более
северное распространение, живет в пресной и солоноватой воде, реже
встречается в морской, будучи отчасти, повидимому, проходным. Пресно-
водными являются также некоторые виды ряда морских родов (например
Hhinosardinia amazonica — р. Амазонка и реки Гвианы, Ilisha macrogaster —
роки Борнео, Harengula tawilis — пресноводное озеро на Филиппинских
о-вах и некоторые другие). Из пресноводных сельдевых более северных
широт следует отметить Clupeonella abrau из пресноводного озера Абрау.
Из остальных морских, точнее солоноватоводных, видов этого рода одйн
(Cl. delicatula), будучи в равной мере морским и проходным и отчасти
пресноводным, образует пресноводную морфу (Cl. delicatula caspia m.
tscharchalensis). Ряд пресноводных форм образует виды проходных сель-
дей из родов Alosa и Pomolobus. Таковы из рода Alosa A. alabamae ohien-
sis, A. alosa macedonica, A. fallax lacustris, A. fallax gracilis и A. fallax
killarnensis,—все, за исключением последней,, умеренной формы, субтро-
пические. Из рода Pomolobus местами в пресной воде живут постоянно
проходные Р. chrysochloris и Р. pseudoharengus.
Проходных среди сельдевых, несколько меньшее количество, чем
морских, и по количеству видов столько же, сколько и пресноводных.
К числу их относится около 7 родов не более чем с 30 видами. Значи-
тельное количество проходных сельдей, в отличие от пресноводных,
встречается в умеренных широтах. Таковыми являются роды Alosa
(4 или 5 проходных и 4 или 5 морских, солоноватоводных) и Pomolobus
(4 вида), причем некоторые проходные формы Alosa живут и размно-
жаются в субтропиках (например A. fallax nilotica, A. alosa africana,).
Из каспийско-черноморских видов Alosa, помимо типично проходного
вида A. kessleri, имеется A. caspia, одни формы которого размножаются
в море, другие — в реках или устьях рек. Из сельдевых умеренных широт
следует отметить упомянутый выше вид — Clupeonella delicatula, кото-
38
ВВЕДЕНИЕ
рый размножается как в море, так и в реках. К сельдевым более южных
широт относится род Brevoortia, относящийся, судя по всему, к солоно-
ватоводным рыбам. Один вид этого рода (В. pectinata) встречается в уме-
ренных водах южного полушария (от северной Патагонии до южной
Бразилии), второй — в умеренных водах северного полушария
(В. smithi — в эстуариях Сев. Каролины), третий — как в умеренных
водах Сев. Америки (В. tyrannus tyrannus и В. tyrannus brevicauda), так
почти и в тропических (В. tyrannus patronus в Мексиканском зал.).
Из тропических сельдевых проходными являются некоторые виды рода
Hilsa (Н. reevesii, Н. тасгига) и, возможно, остальные 5 видов этого рода.
Проходными также, вероятно, являются роды Nematalosa и Anodonto-
stoma. Образ жизни ряда других тропических сельдевых не известен
(например Ethmidium, Ethmalosa), но возможно, что некоторые из них
тоже проходные. Имеющиеся для ряда сельдевых указания на их отно-
шение к солености носят крайне неопределенный характер. В частности,
это особенно относится ко многим видам рода Ilisha.
Таким образом, большинство сельдевых — морские рыбы, значи-
тельно меньшая часть их, будучи тесно связана с морем, •—проходные;
йриблизительно такое же количество сельдевых по числу видов, как
и проходных, но большее по числу родов — пресноводные. Во всех широ-
тах, где встречаются сельдевые, преобладающая' масса их является мор-
скими. Таковы все из немногих сельдевых, встречающихся в арктических
широтах. Сельдевые умеренных широт — морские или проходные; лишь
некоторые из них, упомянутые выше, пресноводные, причем гораздо боль-
шее количество пресноводных форм образуют проходные умеренные
сельдевые в субтропиках, чем в умеренных широтах. Пресноводными
из умеренных и субтропических сельдевых в основном являются под-
виды и лишь единичные виды. Ни одного рода, обитающего в пресных
водах, здесь нет. Основная масса пресноводных сельдевых свойственна
тропикам, где встречаются как ряд родов, все виды которых пресновод-
ные, так и значительное количество пресноводных видов морских родов.
В тропиках встречается значительное количество и проходных сельдей.
Следовательно, при относительном все же преобладании морских коли-
чество пресноводных сельдевых в тропических областях наибольшее,
что стоит в полном согласии с фактами, известными и для других групп
животных.
Следует отметить, что морской или пресноводный образ жизни свой-
ствен целым крупным подразделениям семейства — подсемействам. Мор-
скими в основном, за редкими исключениями, являются подсемейства
Dussumieriinae, Clupeinae и Pristigasterinae, в основном пресноводными —
Pellonulinae. Представители подсемейства Alosinae и Dorosomatinae —
проходные или пресноводные и отчасти солоноватоводные и морские.
Рассмотрение распределения сельдевых по зоогеографическим обла-
стям представляет некоторые трудности вследствие указанного выше
неоднородного экологического характера их по отношению к солености.
Однако основная масса сельдевых, как указывалось выше, является
морскими. Если же принять во внимание и проходных, значительную
часть своей жизни проводящих в море, то следует считать, что распро-
странение преобладающего большинства представителей семейства тес-
нейшим образом связано с морем. Поэтому в основу зоогеографического
анализа сельдевых взяты морские и проходные. Пресноводные рассма-
триваются попутно соответственно зоогеографическим подразделениям,
разработанным для пресноводных рыб Бергом (1909 : 242 и сл.).
1 HUI J.
Зоогеографические подразделения для морской фауны пелагической
и для прибрежной (литоральной и неритической) существенно разли-
чаются. Сельдевые, как известно, являются рыбами пелагическими,
однако по распространению и образу жизни относятся скорее к нерити-
ческой фауне, чем к океанической. Действительно, в открытых частях
океанов, на большом отдалении от берегов сельдевые обычно не встре-
чаются. Распространение большинства представителей семейства свя-
зано с берегами. Многие из сельдевых вообще держатся в прибрежной
зоне, в заливах и эстуариях. Даже наиболее пелагические и подвижные
из них во время размножения подходят к берегам, в заливы и т. п. {Clu-
pea harengus, Sardina pilchardus, Sardinella aurita, Sprattus sprattus и др.).
1I оэтому анализ распределения сельдевых по зоогеографическим областям
произведен по зоогеографическим подразделениям для прибрежной
фауны.
Из всех зоогеографических подразделений моря (Ortmann, 1895;
Dahl, 1921 и др. и на основе их Гептнер, 1936) наиболее полно разрабо-
танное предложил Экман (Ekman, 1935). Границы основных подразде-
лений Экмана, называемых им фаунами, наиболее близко совпадают
<• границами областей и подобластей Ортманна (Ortmann, 1895) для лито-
ральной фауны. Однако подразделения Экмана, основанные на новейших
исследованиях, значительно более детальны, в частности в отношении
южного полушария южнее тропиков, как это видно из нижеследующего
сопоставления:
По Экману
Индо-вестпацифическая фауна
Фауна тропической Америки
Атлантическая фауна
Пацифическая фауна
Фауна тропической западной Африки
Средиземноморско-атлантическая и
сарматская фауна
Атлантическая бореальная фауна
Европейская бореальная фауна
Американская североатлантическая
фауна
Северопацифическая умеренная фауна
Северо-западноамериканская уме-
ренная фауна
Северо-восточноазиатская умерен-
ная фауна
Арктическая фауна
Южное полушарие
Южно- и юго-западноафриканская
фауна
Южноавстралийская и новозеланд-
ская фауна
Перуанско-северочилийская фауна
Южное полушарие. Фауна холодных
морей
Кергуэленская обл.
Фауна антибореальной Южн. Аме-
рики
Антарктическая обл.
По Орт манну
Индо-пацифическая обл.
Восточноамериканская обл.
Западноамериканская обл.
Западноафриканская обл.
Гвинейская подобл.
Средиземноморская подобл.
Арктическая обл.
Атлантическая бореальная подобл.
Пацифическая бореальная подобл.
Арктическо-циркумполярная под-
обл.
Антарктическая обл.
Зоогеографические подразделения, относящиеся к тропическом
и арктическому поясам, у обоих авторов одинаковы. Фауна умеренны
40
ВВЕДЕНИЕ
частей Атлантического океана разделяется Экманом на европейскую
бореальную и американскую североатлантическую, Тихого океана —.
на умеренные северо-западноамериканскую и северо-восточноазиатскую.
Фауна южного полушария южнее тропиков, рассматриваемая Ортманном
как единая антарктическая область, Экманом разбивается на ряд под-
разделений. Фауна сельдевых южного полушария южнее тропиков, как
указывалось выше, значительно беднее фауны соответствующих частей
северного полушария и в связи с этим детальное подразделение южного
полушария, как увидим ниже, является для сельдевых излишним. По-
этому зоогеографический анализ сельдевых дается в основном по под-
разделениям Ортманна. Лишь значительное богатство сельдевых в уме-
ренных частях Атлантического океана дает основание для разделения
атлантической бореальной подобласти Ортманна на атлантическо-евро-
пейскую и атлантическо-американскую бореальные подобласти. Бедная
фауна сельдевых соответствующих частей Тихого океана оснований
для подобного разделения не дает. Границы средиземноморской под-
области Ортманна в нижеследующем приняты ' несколько шире,
" по Экману, включая сюда фауну прилегающей части и Атлантического
океана и понтическую фауну сельдевых Черного и Каспийского морей.
В таком понимании эту подобласть правильнее называть средиземно-
морско-атлантической.1 Что касается границ рассматриваемых областей,
то они у обоих авторов в основном совпадают. Вообще же говоря, как
справедливо отмечает Экман (Ekman, 1935 : 144), это будут не границы,
а скорее переходные районы областей и подобластей, так как морская
фауна не имеет таких резких границ, как пресноводная.
Преобладакицая масса сельдевых, как указывалось выше, сосредото-
чена в тропиках. При этом более двух третей общего числа тропических
морских и проходных сельдевых, встречающихся в тропических областях,
или почти половина общего количества всех морских и проходных видов
свойственны индо-пацифической области (см. табл. 11).1 2 3 Здесь, помимо
большого количества видов, встречается наибольшее количество и родов,
распространение которых ограничено пределами только этой области.
Некоторые более широко распространенные роды- (Spratelloides, Нагеп-
gula, Sardinella, Nematalosa, Ilisha), встречающиеся и за пределами
индо-пацифической области, преобладающим количеством видов пред-
ставлены, также здесь, причем необходимо отметить, что эти роды отно-
сятся к числу наиболее богатых видами. В реках, впадающих в моря
индо-пацифической области и относящихся к сино-индийской области
Берга, встречаются, кроме того, 14 видов пресноводных сельдевых,
принадлежащих к 5 эндемичным для этой области родам (Clupeoides,
Corica, Clupeichtys, Gudusia, Gonialosa). Таким образом, индо-пацифи-
ческой морской области и относящейся к системе ее сино-индййскоя
пресноводной области свойственно около 88 видов сельдевых, что состав-
ляет половину общего числа видов сельдевых, встречающихся' в тропи-
ческих областях. Эти виды относятся к 20 родам, из которых 10 эндемич-
ные (помимо перечисленных пресноводных, Dussumieria, Kowala, Hilsa,
Clupanodon, Raconda).
1 Экман называет ее средиземноморско-атлантической и сарматской, что не совсем
правильно, так как, точнее говоря, последняя фауна есть не сарматское, а понтиче-
ское наследие.
2 В таблицу не включены некоторые виды, систематическое положение которых
неясно (например Clupea fuegensis, Cl. bentincki, Sardinops dakini, см. о них в Срав-
нительных замечаниях родов).
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
4Г
Таблица 1Т
Распространение семейства Clupeidae по зоогеографическим областям
Экологические данные 1 Общее число видов Индо-пацифическая область i Западноамериканская обл. Восточноамериканская обл. Западао- африкан. обл. Арктическая обл. Антарктическая область
, гвинейская подобл. I I ср ед иве мио морско- а тлан- тич. подобл. атлантическо-европейская; бореальная подобл. j атлантическо-американ- ская бореальная подобл. ; пацпфическая бореалная подобл. ь ар кт ическо-цир к умполяр- ная подобл.
О ussumieriinae
Oussumieria .... T M 3 3 — — — — — — — — —
JenJtinsia T M 4 —— 1 3 — —, — — —• —— ——-
Elrumeus ST M 4 2 *1 1 — — — *1 <— — 1-1- *1.
Spratelloides .... TS M 6 4 —. — — — — — —— — 2
17 9 2 4 —— — — 1 — — 8-f-*li
Clupeinae
Sprattus BS M 6 —. — — *1(1) 1(2) — — — 5
Clupea BA M 1 — — — — 1(2) *1(1) *1(1) *1(2) —
llarengula ..... T MF 19 13 2 4 ——• — — —— —
Sardinella T M 16 13 — *1 3 *2 — —, —— —
Sardinops s M 1 — — — — — — — *1(2) — 1(3)
Sardina s M 1 —. — —• —- *1(1) 1(1) — —. — ——
Clupeonella .... в MF 4 —. — — —— 4(2) — — —
Opisthonema . . . . T M 2 —• 1 1 — — — — — ——
Cite. T M? 3 —. 1 2 — — — — — —-
Hkinosardinia . . . T M 2 —. — 2 — — — — — — —
Pellonulinae Pellonula I F 55 3 26 4 10 3 3 8(4) 3(5) 1(1) 2(3) 1(2) 6(3),
Poecilothrissa .... 1 F 1 .— — — 1 — — — — -— ——
Microthrissa . . . . T F 2 — — 2 — — — — — —
Potamothrissa .... T F 2 — — — 2 — — — — — .
Cynothrissa T F 2 — — — 2 — — — — —— ——• ‘
Odanothrissa .... T F 2 — — — 2 —. — — — —
Stolothrissa T F 1 — — — 1 — — — — — —
IJmnothrissa .... T F 1 — — — 1 —- — — — —
Kowal a T M 1 1 — — — — —— — — — —
fllupeoid.es T F 6 6 —-* — — —- — — — — —
(lorica T F 4 4 '— —— — — — — — — —
(llupeichthys . . . . T F 1 1 — — — — — — — — •—
Potamalosa s F 1 — — — — — — — — — 1
(lypcrolophus .... TS M? 2 1 — — — — — — — — 1;
29 13 — — 14 — — — — — 2
ВВЕДЕНИЕ
Таблица 11 (продолжение)
Экологические данные Общее число видов Ипдо-пацифическая область Западноамериканская обл. | Восточноамериканская обл. Западно- африкан. обл. Арктическая обл. Антарктическая область
гвинейская подобл. '1 средиаемноморско-атлан- । тич. подобл. 1 1 атлантическо-европейская ! бореальная подобл. атлантическо-американ- ская бореальная подобл. пацифическая бореальная 1 подобл. арктическо-циркумполяр- । ная подобл.
Alosinae -
Alosa BS MAF 10 . 1* .— 8(27) 2(3) 2(3) — — —
.Pomolobus В AF 4 — — — — 4 — — —
Btevoortia BS М 3 — — *1(1) — — — 2(2) — — 1
Ethmidium ST ? 2 .— 2 — —— — • — *1
Ethmalosa т i> 1 — — — 1 — — — — —
Hilsa т А 7 7 — — — — — —. — —
Gudusia т F 2 2 — — — — — — — —- —
29 9 2 1(1) 1 8(27) 2(3) 8(5) — — 2
Dorosomat inae
Anodontostoma . . . т А? 2 2 — — —
Nematalosa .... т А? 8 7 —. — — — .— — — — 1
Clupanodon .... т М 2 2 — — — — — — — — —
Signalosa т F 3 — — 3(2) — — — — — •— —
Gonialosa т F 2 2 — — — .— — — — —
Dorosoma TS FA? 4 — 1 3(1) — — — *1(1) — — —
21 13 1 6(3) — — — 1(1) — — 1
J*ristigaster inae
Ilisha ....... т МА? 16 14 1 —. 1 — — — —
JPellona т М 7 1 1 5 —— — — * — -— — —
Chirocentrodon . . . т М 1 •— — 1 — — — -— —. — —
Pristigaster т М 1 1
Pliosteostoma . . . т М 1 1 — — — — — — — —
Opisthopterus .... т М 6 2 4 — —- — — •—. — — —
•Odontognathus ... т М? 3 — 2 1 — — — — — — —
Raconda т М 1 1
36 18 9 8 1 — — — — — —
Общее число видов .... 187 88 18 29 19 16(31) 5(8) 11(7) 2(3) 1(2) 14+*1
Условные обозначения. В первой графе: Т — тропические, S — субтро-
пические, В — бореальные, А — арктические; во второй графе: М — морские, А —
(проходные, F—пресноводные. Звездочкой обозначены виды, основной ареал кото-
рых лежит в другой области. В скобках указано количество подвидов.
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
43
В остальных тропических областях сельдевых значительно меньше.
11 з этих областей в наибольшем количестве они представлены в восточно-
американской области, которой свойственно около 23 морских и про-
бодных видов. Несколько родов (Rhino Sardinia, Pristigaster, Chirocentro-
don) эндемичны для этой области. Большая часть видов некоторых родов
(Jenkinsia, Lile, Pellona), распространенных и в других тропических
областях, встречается в восточноамериканской области, причем по коли-
честву видов эти роды сравнительно малочисленны. Пресные воды бас-
сейна восточноамериканской морской области относятся в основном к бра-
зильской подобласти Л. С. Берга. Здесь встречаются 6 видов сельдевых,
принадлежащих к 2 родам (Dorosoma, Signalosa), отдельные виды кото-
рых встречаются и далее к северу за пределы подобласти, Некоторые
виды, упомянутые среди морских, заходят и, возможно, даже проводят
пело жизнь в пресной воде (например Lile platana, Rhino Sardinia amazo-
nica). Общее число сельдевых, свойственных восточноамериканской мор-
ской области и бразильской пресноводной подобласти, достигает
до 30 видов, относящихся к 15 родам, из которых 4 эндемичные (помимо
перечисленных морских, Signalosa).
В еще меньшем количестве встречаются сельдевые в западноамери-
каиской области, имеющей лишь 17 видов, относящихся к 11 родам.
Единственным эндемичным для этой области, не встречающимся за пре-
делами ее, является монотипический род Pliosteostoma. Из родов, общих
ипнадноамериканской и другим тропическим областям, нет ни одного,
который был бы представлен в этой области преобладающим количеством
лидов. В пресных водах, относящихся к бассейну западноамериканской
области, из пресноводных сельдевых известен лишь один, описанный
подавно вид (Dorosoma smithi). До этого род Dorosoma являлся эндемич-
ным для восточноамериканской области.
В западноафриканской области насчитывается до 18 видов морских
и проходных сельдевых, но тропическими из них будут лишь 5 видов,
встречающиеся в гвинейской подобласти. Эндемичный в этой подобласти
лишь один монотипический род Ethmalosa, образ жизни и условия раз-
множения которого точно не известны. Остальные 4 встречающихся
и этой подобласти морских вида относятся к 2 родам (Sardinella Txllisha)
с наибольшим среди сельдевых количеством видов, преобладающее коли-
чество которых свойственно индо-пацифической области. Значительно
больше сельдевых в пресных водах гвинейской подобласти, которые
относятся к среднеафриканской подобласти принятых нами зоогеографи-
чоских подразделений для пресноводных рыб. Этой подобласти свой-
итнонно 14 видов, принадлежащих 8 эндемичным родам (Pellonula, Poeci-
Hlhrissa, Microthrissa, Potamothrissa, Cynothrissa, Odaxothrissa, Stolothrissa,
Idinnothrissa), обитающих главным образом в р. Конго и ее бас-
сейне и оз. Танганайке. Упомянутый эндемичный для гвинейской под-
области род Ethmalosa, известный из устья р. Конго, возможно, есть
также пресноводный или проходной. Следовательно, общее количество
ШМП>девых гвинейской подобласти и относящейся к ее бассейну средне-
|фриканской подобласти распространения пресноводных рыб исчис-
ДИОТся 19 видами, из которых 15 относятся к 9 эндемичным родам.
В средиземноморско-атлантической подобласти встречаются 16 видов
мерских, солоноватоводных и проходных сельдевых западноафриканской
|бласти, причем тропических из них лишь 2 (Sardinella eba и S. aurita);
Последний широко распространен почти во всех тропических областях,
||ХОДит и в субтропики. Остальные сельдевые этой подобласти относятся
44
ВВЕДЕНИЕ
к субтропическим родам (Sardina) или являются субтропическими фор-
мами (^prattus sprattus phalericus, средиземноморские формы Alosa) видов
в основном бореальных родов, большая же часть видов (все виды рода
Clupeonella и каспийско-черноморские виды рода Alosa) являются боре-
альными. Эндемичны для средиземноморско-атлантической подобласти
лишь два последних рода. Морских или солоноватоводных среди сельде-
вых этой подобласти 11 видов, проходных или полупроходных 4.
Из числа последних видов Alosa caspia является в равной мере и морским,
солоноватоводным. Фауна пресноводных рыб бассейна средиземноморско-
атлантической подобласти относится к средиземноморской, западно-
балканской и понто-каспийской провинциям средиземноморской под-
области Берга (Berg, 1933 : 182—208). Чисто пресноводных сельдевых
здесь имеется всего лишь один вид (Clupeonella abrau) и 3 подвида рода
Alosa (A. fallax lacustris, A. fallax gracilis, A. alosa macedonica) в озерах
средиземноморского бассейна. Таким образом, всего в рассматриваемой
подобласти вместе с пресноводными встречается 16 видов с 31 подвидом'
сельдевых, относящихся к 6 родам, в преобладающей массе морских или
солоноватоводных.
Обширной арктической области Ортманна, включающей бореальные,
арктические и отчасти субтропические элементы морской фауны, свой-
ственно всего лишь около 15 видов морских (4) или проходных (10) сель-
девых. Эндемичными для этой области являются роды Clupea и отчасти
Pomolobus, причем первый встречается во всех ее подобластях. Чисто
пресноводных родов и даже видов в пресных водах бассейна арктической
области нет. Пресноводные здесь лишь некоторые подвиды проходных
видов.
В атлантическо-европейской бореальной подобласти встречаются
5 видов сельдевых, принадлежащих 4 родам; из этих видов 3 морские,
2 проходные. Эндемичных родов, встречающихся в пределах только этой
подобласти, нет, но из 4 встречающихся здесь родов 2 (Sprattus и Sardina)
в западной половине северной части Атлантического океана, у берегов
Сев. Америки, отсутствуют. В пресных водах (в основном балтийская
провинция средиземноморской подобласти и отчасти ледовитоморская
циркумполярной подобласти Л. С. Берга), относящихся к бассейну атлан-
тическо-европейской бореальной подобласти, имеется всего лишь один
подвид (Alosa fallax killarnensis, оз. Килларней в Ирландии).
Наибольшее количество видов (11) сельдевых, относящихся к 6 родам,
имеется в атлантическо-американской бореальной подобласти, причем
большая часть их, 4 вида, относятся к эндемичному для этой подобласти
роду Pomolobus, лишь один из видов которого (Р. chrysochloris) встре-
чается в прилегающих частях восточноамериканской области. Из числа
встречающихся здесь видов чисто морской лишь один (Clupea harengus),
все остальные проходные или полупроходные, или солоноватоводные.
Соответственно несколько больше здесь по сравнению с пресными водами,
относящимися к бассейну предыдущей подобласти, и пресноводных рыб,
обитающих в миссисипской подобласти Л. С. Берга (Alosa alabamae ohiensis
и формы, которые образует в пресных водах Dorosoma cepedianum). Кроме
того, жилые формы в пресных водах имеют некоторые виды Pomolobus.
В пацифической бореальной подобласти сельдевые представлены
лишь 2 подвидами, основные формы которых встречаются в других под-
областях и областях. Основная форма одного из этих видов (Clupea
harengus) свойственна . атлантическо-европейской и атлантическо-амери-
канской бореальным подобластям, второго (Sardinops sagax) — антаркти-
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
45
ческой области. Для пацифической бореальной подобласти характерно
полное отсутствие проходных сельдевых как у американских, так и у ази-
ате,них берегов. В пресных водах, относящихся к бассейну этой подобласти
(амурская переходная область, колорадская и отчасти циркумполярная
подобласти JI. С. Берга), нет также и чисто пресноводных сельдевых.
11 аиболее бедна сельдевыми арктическо-циркумполярная подобласть
рассматриваемой области, где имеются всего лишь 2 подвида одного
и того же вида (Clupea harengus), основная форма которого широко рас-
пространена в атлантическо-европейской и атлантическо-американской,
а близкий подвид — в тихоокеанской бореальных подобластях. Проход-
ных сельдевых в этой подобласти нет; нет и пресноводных в относящейся
к бассейну ее циркумполярной подобласти Л. С. Берга.
Фауна сельдевых обширной антарктической области имеет в основ-
ном субтропический характер, в меньше!! степени — тропический или
бореальный. Антарктических среди сельдевых нет. Всего в этой области
насчитывается около 14 видов, в основном морских, отчасти проход-
ных (2 вида), относящихся к 9 родам, причем большая часть видов (5)
относится к роду Sprattus и некоторые из них, судя по всему, являются
лишь подвидами. Преобладающее число встречающихся в этой области
видов (около 12) эндемичные. Эндемичных из числа морских и проход-
ных родов здесь нет. В наибольшем количестве в антарктической области
сельдевые имеются у южных берегов Австралии и Новой Зеландии (8 ви-
дов), южной оконечности Южн. Америки (5 видов), немногие (2 вида)
у южных берегов Африки. Один из этих видов (Sardinops sagax) в качестве
подвидов представлен во всех перечисленных местах. Пресноводных видов
здесь лишь один, относящийся к эндемичному роду Potamalosa (реки
Нового Южн. Уэльса и Виктории).
Тропические морские и проходные сельдевые наиболее многочисленны
и эндемичны, как мы видели, в индо-пацифической области, которая
наиболее богата представителями и других групп прибрежных водных
животных (Ekman, 1934 : 321).
Из других тропических областей по числу видов, родов и эндемизму
наиболее богата восточноамериканская область. Эта область, по Экману
(Ekman, 1935 : 8), наиболее близка к индо-пацифической благодаря
связям, которые имеются между обеими областями в ряде групп живот-
ных. Из 12 встречающихся в восточноамериканской области морских
и проходных родов семейства общими с индо-пацифическими являются
4 рода: Sardinella (13 видов индо-пацифических, один из них встречается
и в восточноамериканской области), который есть в гвинейской подоб-
ласти, но отсутствует в западноамериканской области, Harengula
(13 видов индо-цацифических, 4 восточноамериканских), Etrumeus (2 вида
индо-пацифических, один восточноамериканский), Pellona (один вид
индо-пацифический, 5 восточноамериканских); последние 3 рода,
наоборот, отсутствуют в гвинейской подобласти и есть в западно-
американской.
Такую же связь с индо-пацифической областью имеет и менее богатая
сельдевыми западноамериканская область. Из 12 встречаемых здесь родов
общими с индо-пацифической областью являются: Etrumeus (один вид,
встречаемый и в индо-пацифической области), Harengula (2 вида),
Opisthopterus (4 вида западноамериканских, 2 инДо-пацифических),
Pellona (один вид) и Ilisha (один вид западноамериканский, 14 индо-
пацифических), который есть в гвинейской подобласти, но отсутствует
в восточноамериканской области.
46
ВВЕДЕНИЕ
Наиболее бедная как сельдевыми, так и другими водными прибреж-
ными животными гвинейская подобласть имеет много общего с сельде-
выми индо-пацифической области. Из 3 встречающихся здесь морских
родов сельдевых лишь один, эндемичный для этой области род Ethmalosa,
не встречается в индо-пацифической области. Остальные роды (Sardinel-
la — 3 вида ъ Ilisha— один вид) в большей мере представлены в индо-
пацифической области. Первый род связывает гвинейских сельдевых
также и с восточноамериканскими, последний (Ilisha) — с западноамери-
канскими.
Таким образом, пелагическая и абиссальная свободная от островов:
восточная часть Тихого океана между Полинезией и Америкой пред-
ставляет преграду (ostpazifische Sperre; Ekman, 1935 : 106) к распростра-
нению из индо-пацифической области в западноамериканскую не только
тропической литоральной фауны, но и сельдевых, которые хотя и
являются пелагическими, но, как указывалось выше, теснейшим образом
связаны с берегами. Однако благодаря пелагическому и более подвиж-
ному образу жизни сельдевых, для некоторых из них эта преграда
оказалась менее непреодолимой, чем для ряда типично литоральных
животных, так как и в индо-пацифической области, и в западноамерикан-
ской имеются не только виды, относящиеся к одним и тем же родам, но
и виды идентичные (Etrumeus micropus).
Почти такую же преграду для распространения тропической лито-
ральной фауны представляет и центральная часть Атлантического океана
(zentralatlantische Sperre; Ekman, 1935 : 107), причем некоторые сельде-
вые расселяются и через эту преграду, так как по обе стороны тропиче-
ской части Атлантического океана, помимо видов одних и тех же родов,
встречается и общий вид {Sardinella aurita).
Значительно большую близость имеют сельдевые восточно- и западно-
американской областей. Общими для обеих областей являются следую-
щие роды: с одной стороны, упомянутые выше, встречающиеся и в индо-
пацифической области Pellona (5 видов в восточноамериканской области,
один в западноамериканской), Harengula (4 вида в восточноамериканской
области, 2 в западноамериканской), Etrumeus (по одному виду в восточно-
и западноамериканской областях), с другой, — роды, свойственные только
восточно- и западноамериканской областям — Odontognathus (один вид
в первой, 2 во второй), Lile (2 вида в восточноамериканской области,
один в западноамериканской), Opisthonema (по одному виду в каждой
области) и Jenkinsia (3 вида в восточноамериканской области и один
в западноамериканской) и в основном пресноводный род Dorosoma (3 вида
в восточноамериканской области, один в западноамериканской). Следо-
вательно, связь между сельдевыми восточно- и западноамериканской
областями несколько большая, чем между этими областями и индо-паци-
фической областью. Помимо 3 эндемичных родов в восточноамериканской
области и одного в западноамериканской здесь имеются 5 упомянутых
родов, встречающихся только в этих областях. Характерно отсутствие
общих видов, встречающихся и в восточно- и в западноамериканской
областях, обусловленное отсутствием возможностей обмена фаун обеих
областей с миоцена или по крайней мере с плиоцена (Берг, 1918 : 1838)
вследствие поднятия Панамского перешейка. Наличие эндемичных родов
в каждой из рассматриваемых областей и значительного числа родов,
встречающихся только в этих областях, свидетельствует о том, что
восточно- и западноамериканскую области следует рассматривать как
географический центр сельдевых, правда, значительно меньший, чем
I
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
47
индо-пацифическая область. Значительно большее в восточноамерикан-
ской области, чем в западноамериканской, общее количество видов,.
эндемичных родов и видов, принадлежащих общим только для обеих
областей родам, следует рассматривать как свидетельство того, что геогра-
| фический центр этих сельдевых лежит в восточноамериканской области..
I Бедность прибрежной тропической фауны западного побережья
Африки (гвинейской подобласти), помимо влияния причин исторических,
объясняют (Ekman, 1935 : 88) более низкими температурами воды, строе-
нием дна и пр. Для сельдевых, в частности, наибольшее значение помимо
узости тропической области у западных берегов Африки, имеет, как нам
кажется, слабое развитие береговой линии вследствие малой изрезан-
1гости берегов и отсутствия островов, что для сельдевых, хотя пелаги-
[ ческих, но в основном прибрежных рыб, имеет существенное значение.
’ Совершенно очевидно, что, помимо общеизвестных исторических причин
' (Ekman, 1935 : 97), богатство индо-пацифической области как сельде-
! выми, так и вообще литоральными животными в значительной степени.
обусловлено наиболее сильным развитием здесь береговой линии и боль-
шим количеством островов. Подобным же образом следует объяснять
и меньшее богатство заиадноамериканских морских сельдевых по сравне-
нию с восточноамериканскими, так как помимо большей узости западно-
американской области по сравнению с востбчноамериканской береговая
линия западных берегов Америки изрезана слабо и почти не имеется
островов.
Пресноводные сельдевые наиболее многочисленны и эндемичны, как
указывалось выше, в тропических областях, где известны пресноводные
виды даже таких типично морских рыб, как акулы и скаты. В тропических
областях условия для перехода от морского к пресноводному образу
жизни наиболее благоприятны; в объяснение причин этого высказан ряд .
мнений [сводку этого вопроса см. у Пирса (Pearse, 1936)]. В частности,
Пель зенер (Pelseneer, 1906 : 699) более активный переход морских живот-
ных в пресные воды в Индо-малайском архипелаге объясняет понижен-
ными соленостью и плотностью воды окружающих морей. Однако наиболее
многочисленны и эндемичны пресноводные сельдевые, как указыва-
лось выше, в пресных, водах западной Африки, у берегов которой таких
опреснений нет. Большое количество пресноводных сельдевых в средне-
африканской подобласти, нам кажется, обусловлено теми же причинами,.
что и бедность их в морских водах гвинейской подобласти — слабой
и.зрезанностыо береговой линии и почти полным отсутствием здесь островов
и, кроме того, наличием обширных пресноводных бассейнов (р. Конго,
оз. Танганайка). Не найдя здесь достаточно благоприятных условий-
в море, сельдевые перешли в пресные воды, где дали пышный расцвет,
образовав большое количество эндемичных родов. Что касается пресно-
водных сельдевых сино-индийской области, то значительное количество -
их, как и исключительное богатство морских индо-пацифической области,
обусловлено в первую очередь причинами историческими. Известное
значение, конечно, имело и поверхностное опреснение морей Индо-малай-
ского архипелага (Pelseneer, 1906), но несомненно большее — обширные
речные системы, в которые даже при наличии исключительно благоприят-
ных условий для прибрежных животных в море (развитие береговой
линии, архипелаг островов с массой проливов и заливов) и перешел ряд.
сельдевых. Последнее обстоятельство, нам кажется, наиболее удовлетво-
рительно объясняет и наличие сельдевых в пресных водах бассейна,
восточноамериканской области, в которую впадает, ряд крупных речных.
48
ВВЕДЕНИЕ
систем, и отсутствие их в пресных водах бассейна западноамериканской
области, не имеющей больших рек.
Во внетропических областях северного полушария количество видов
семейства и их эндемизм последовательно уменьшаются в средиземно-
морско-атлантической, атлантическо-американской бореальной, атлан-
тическо-европейской бореальной, пацифической бореальной и арктическо-
циркумполярной подобластях.
Средиземноморско-атлантическая и атлантическо-европейская боре-
альные подобласти характерны некоторыми общими, эндемичными для
обеих них родом (Sardina) и видами (Sprattus sprattus, Alosa alosa, A. j al-
lax) \ первая подобласть отличается от последней отсутствием рода Clupea
и наличием рода Clupeonella и одного из видов Sardinella (S. aurita).
Общими для атлантическо-европейской и атлантическо-американской
бореальных подобластей являются роды Alosa и Clupea, встречающиеся
по обе стороны северной части Атлантического океана; последний есть
в северной части Тихого океана и отчасти в арктических морях, являясь
общим для всех подобластей арктической области (см. табл. 11). Неко-
торые роды встречаются лишь по одну сторону северной части Атланти-
ческого океана: роды Sprattus и Sardina — у берегов Европы в атлан-
тическо-европейской бореальной и средиземноморско-атлантической
подобластях, роды Pomolobus и Brevoortia — у берегов Сев. Америки, при-
чем роды Sprattus и Brevoortia имеются и в южном полушарии (Brevoortia
у берегов Южн. Америки, Sprattus, кроме того, у берегов Австралии
и Новой Зеландии).
Для атлантическо-европейской бореальной подобласти характерно
преобладание морских сельдевых (3 вида) над проходными (2 вида), для
атлантическо-американской бореальной подобласти наоборот — преобла-
дание проходных (8 видов) над морскими и солоноватоводными (3 вида).
Наряду с преобладанием проходных сельдевых в последней подобласти
естественно значительно больше и пресноводных форм (4), образуемых
проходными, чем в первой подобласти (1).
Сельдевые пацифической бореальной подобласти, как указывалось
выше, связаны, с одной стороны, с сельдевыми обеих атлантических
бореальных подобластей и арктическо-циркумполярной (Clupea haren-
gus), с другой — с антарктической областью (Sardinops sagax). Сельде-
вые арктическо-циркумполярной подобласти теснейшим образом связаны
•с обеими атлантическими бореальными подобластями и в еще большей
степени с пацифической. О причинах отсутствия в пацифической бореаль-
ной и арктическо-циркумполярной подобластях проходных и пресновод-
ных сельдевых сказано ниже (стр. 51, 55).
Сельдевые антарктической области имеют связи с сельдевыми почти
всех областей и подобластей, за исключением гвинейской и арктическо-
циркумполярной подобластей; наиболее теплолюбивые из них, имеющие
в основном субтропический характер, связаны с индо-пацифической
•областью (Spratelloides — 4 вида индо-пацифические, 2 антарктические;
Hyperolophus— один вид пацифический, один антарктический; Nema-
ialosa — 7 видов индо-пацифических, один антарктический) и отчасти
с другими тропическими областями (Etrumeus — 2 вида индо-пацифи-
ческих, встречающихся, кроме того, в западноамериканской и антаркти-
ческой областях, один восточноамериканский, один антарктический).
Ряд родов является общим с умеренными и субтропическими подобла-
стями северного полушария (Sprattus — один вид в средиземноморско-
атлантической и атлантическо-европейской бореальной подобластях,
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ 49
5 в антарктической области у берегов Южн. Америки, Австралии и Новой
Зеландии; Sardinops — один вид в пацифической бореальной подобласти
у берегов Сев. Америки и юго-западной Азии и в антарктической области
у берегов Австралии, Южн. Америки и южной Африки; Brevoortia —
2 вида в атлантическо-американской бореальной подобласти, один из ко-
торых представлен подвидом в восточноамериканской области и один
в антарктической области). Наибольшие связи, следовательно, наблю-
даются с индо-пацифической областью, в меньшей степени — с умерен-
ными подобластями северного полушария и с восточно- и западноамери-
канской областями.
Таким образом, наибольшие связи естественно обнаруживают сельде-
вые' морские и проходные; распространение пресноводных как правило
ограничено какой-либо одной областью или подобластью.
Большинство морских рыб (например сем. Gadidae, Pleuronectidae,
Scombridae и др.), как известно, имеют пелагическую икру. Однако у ряда
морских рыб (например у сем. Blenniidae, Gobiidae и рр.) икра приклеи-
вающаяся. По этой особенности икры, как и по отношению к солености,
сельдевые сильно разнятся между собой. У преобладающего большинства
сельдевых икра пелагическая, у многих — демерсальная, некоторые
имеют приклеивающуюся икру. При этом приклеивающаяся икра свой-
ственна как морским (Clupea), так и проходным и пресноводным (Pomo-
lobus). Точно также и пелагическую икру имеют как почти все морские
сельдевые, так и проходные и пресноводные. Следует отметить, что икра
проходных сельдевых, например Alosa kessleri volgensis, может разви-
ваться при солености до 25—ЗО°/оо (Олифан, 1939 : 470), а наилучшие
условия для развития икры Alosa sapidissima, по экспериментальным
исследованиям (Leim, 1924 : 459), — солоноватая вода с содержанием
солей около 7.5°/оо. Икра некоторых сельдевых (например Clupeonella
delicatula, Alosa caspia) может развиваться как в пресной, так и в соло-
новатой воде. Ряд сельдевых, наоборот, развивается при повышенном
содержании солей (например Sardinella aurita, см. стр. 175). Следова-
тельно, судя по этой экологической особенности, сельдевых по происхо-
ждению следует считать морскими или солоноватоводными рыбами.1
Проходные или пресноводные сельдевые, невидимому, произошли от со-
лоноватоводных. Морское или солоноватоводное происхождение сельде-
вых подтверждается и нахождением их ископаемых остатков (в пресно-
водных отложениях сельдевых не найдено), все они известны и'з морских
отложений.
Таким образом, сельдевых по происхождению следует считать мор-
скими и солоноватоводными, а по отношению к температуре — тропи-
ческими и в меньшей степени умеренно тепловодными. Богатство как
сельдевых, так, по взглядам Экмана (1934 : 361; 1935 : 110), и других
тропических прибрежных животных в индо-пацифической области не сви-
детельствует о том, что эту область следует рассматривать в качестве
центра их происхождения. Прибрежная индо-пацифическая фауна, как
и фауна других тропических областей, есть наследие фауны мезозойского
моря Тетис, которое простиралось через среднюю часть современного
1 Приклеивающаяся икра Clupea harengus ни в коей мере не свидетельствует
в пользу пресноводного происхождения сельдевых и более поздней миграции этой
сельди из пресных вод в море (Есипов, 1939 : 164). Если у сельдевых, как полагает
В. К. Есипов, при переходе от пресноводного образа жизни к морскому икра из при-
клеивающейся становится пелагической, то почему же она пелагическая или демер-
сальная у пресноводных сельдевых?
4 Фауна СССР —314
50
ВВЕДЕНИЕ
Атлантического океана и Средиземное море к Индокитаю и Индо-малай-
скому архипелагу и объединяло восточную часть Тихого океана, среднюю
часть Атлантического, Средиземное море, Индийский океан и западную
часть Тихого в единое море. Фауна Тетиса была также единой и о дина -
ково богатой во всех частях его. В миоцене Тетис значительно сокра-
тился, потерял связь с Индийским океаном и западной частью Тихого;
приблизительно одновременно или несколько позднее (см. выше стр. 46)
в связи с поднятием Панамского перешейка утратилось соединение с во-
сточной частью Тихого океана. Вследствие одновременного похолодания
климата меловая и нижнетретичная фауна Тетиса в разобщенных частях
его сохранилась не везде в одинаковой мере. Все это и обусловило неоди-
наковое богатство и различные степени связи современных сельдевых
и других прибрежных животных разных тропических областей.
В ископаемом состоянии сельдевые и близкие к ним семейства Elo-
pidae и Мegalopidae известны с нижнего мела (Берг, 1940 : 222, 223),
сем. Leptolepidae — от верхнего триаса до середины мела (Берг, 1940 :
221; Woodward, 1895 : 500—530; Rayner, 1937 : 46—74). Из. области
Тетиса сельдевые известны как из неогеновых, так и из палеогеновых
отложений (Woodward, 1901 : 146—159; Arambourg, 1925 : 10—15; 1927 :
18—32, и др.). Фауна рыб Тетиса в палеоцене, эоцене и олигопене была
тропической (Leriche, 1902, 1905, 1906, 1910), но с похолоданием кли-
мата, который к концу миоцена стал почти современным, тропическая
фауна Тетиса исчезла. Уже в среднем миоцене климат в области Чокрак-
ского бассейна был близок к субтропическому — приблизительно такой,
как современный климат Мраморного моря (Жижченко, 1940 : 153).
Ископаемые сельдевые из области Тихого океана известны значительно
позднее, из калифорнийских отложений в миоцене (Jordan a. Gilbert,
1919 : 25—34; Jordan, 1921 : 241—248; 1925 : 8—12; David, 1943 : 3—9,
54—55, 89—95, 120—122). В южном полушарии в ископаемом состоянии
сельдевые известны из верхнеэоценовых и четвертичных отложений
Бразилии (Schaeffer, 1947 : 17—24).
Бореальные и субтропические сельдевые, как указывалось выше,
наиболее бедны в пацифической бореальной подобласти, между тем как
в соответствующих ей обеих атлантических подобластях их значительно
больше. В то же время известно, что фауна как рыб, так и других вод-
ных животных северных частей Тихого океана, имея большое сходство
с фауной соответствующих частей Атлантического океана, отличается
значительно большим числом и видов, и родов, и даже семейств (Gunther,
1880 : 178; Шмидт, 1904 : 394; Берг, 1918 : 1835; Broch,. 1936 : 42, и др.).
По общепринятым в настоящее время взглядам, современная фауна север-
ных частей Атлантического океана, а также отчасти и арктических морей
в основной своей массе есть обедненная фауна Тихого океана и ведет
начало от последней. Среди рыб исключение в этом отношении представ-
ляют тресковые, которые, наоборот, наиболее эндемичны и наибольшим
количеством видов и родов представлены в северной части Атлантиче-
ского океана. Этот общеизвестный и отмеченный уже давно (Gunther,
1880) факт был подробно рассмотрен автором (Световидов, 1940 : 50;
1948 : 41). Подобным же исключением, как указывалось выше и как
уже ранее отметил автор (Световидов, 1944 : 152), оказываются и сель-
девые. .
В северной части Атлантического океана, в атлантическо-европейской
и атлантическо-американской бореальных подобластях встречаются
14 видов сельдевых^ (см. табл. 11), относящихся к родам Clupea^. Alosa,
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
51
Pomolobus, Sprattus, Brevoortia, Sardina, Etrumeus и Dorosoma', виды
трех первых родов — бореальные, Sprattus и Brevoortia — несколько
более теплолюбивы, умеренно-субтропические, Sardina — субтропический,
виды трех последних родов наиболее теплолюбивы. Если принять во
внимание 12 видов (роды Alosa, Clupeonella и Sardinella), встречаю-
щихся, кроме того, в средиземноморско-атлантической подобласти, то
во внетропических областях северной части Атлантического океана всего
насчитывается до 26 видов. Из числа последних 12 видов 2 {Sardinella
aurita, S. eba) в основном тропические, встречающиеся и в субтропических
морях; остальные — бореальные.
В северной части Тихого океана, в пацифической бореальной подоб-
ласти, встречается всего лишь 2 вида, из которых один {Clupea harengus)
свойствен умеренным широтам, второй {Sardinops sagax) является субтро-
пическим. Кроме того, сюда заходят более теплолюбивые субтропические
и тропические {Etrumeus micropus, Clupanodon punctatus, Harengula
zunasi, Ilisha elongata).
Северной части Атлантического океана, как видим, свойственно зна-
чительно большее количество родов и преобладающее количество видов
и подвидов (см. табл. 11) сельдевых по сравнению с северной частью
Тихого океана. Кроме того, что самое существенное, в северной части
Атлантического океана сосредоточены все бореальные роды сельдевых
северного полушария. Не менее важно также то, что все бореальные
проходные роды и виды семейства (все виды Pomolobus и Alosa), многие
из которых образуют пресноводные формы, свойственны также северной
части Атлантического океана и прилегающим морям.
Численное преобладание в северной части Атлантического океана
бореальных и субтропических сельдевых, наличие здесь ряда эндемич-
ных и среди них в особенности проходных родов и видов, отсутствие
самобытности фауны сельдевых северной части Тихого океана и явная
зависимость единственного бореального представителя ее {Clupea haren-
gus pallasi) от североатлантических — все это с несомненностью указы-
вает на его атлантическое происхождение. Так как в умеренных частях
современного Атлантического океана в нижнетретичное время климат
и фауна были тропическими (Leriche, 1902, 1905, 1910), то бореальных
сельдевых, как и других рыб, в частности тресковых (Световидов, 1940 ;•
54; 1948 : 43), в них не было. Очевидно, бореальные сельдевые, подобно
тресковым, в нижнетретичное время держались в более холодноводном
бассейне — в полярном и прилегающем к нему скандском, впадины
которых, как показали исследования последних лет (Панов, 1946 : 29)ц
к началу третичного времени уже имели вполне морской характер и дог
статочные глубины. : и
В расселении й формировании современного распространения сельди
вых те изменения, которые претерпело в верхнетретичное время море
Тетис, а позднее, северная часть Атлантического океана и в области БериП-
гова пролива северная часть Тихого океана, и сопутствующее им пр$рг
йодание климата играли такую же существенную роль, как ;и ддЯ
тресковых (Световидов, 1940 : 57; 1948 : 44). При верхнетретичном похолрг
Дании климата бореальные представители сельдевых вместе с тресковым#
могли спуститься из полярного бассейна в северную часть Атлантичег
ского океана, а не Тихого, так как в области Берингова пролива в этр
время, как известно, простиралась суша. В северную часть Тихого океана
бореальные сельдевые могли попасть не ранее плиоцена и затем в после-
йедникойое время, когда в области Берингова пролива происходили
Ъ2
ВВЕДЕНИЕ
трансгрессии, а климат был более теплым (Берг, 1918 : 1839; 1934 : 73;
Smith, 1919 : 167).
Таким образом, неоднократно высказываемый взгляд (Дерюгин, 1928 :
444; Берг, 1934 : 77), согласно которому Clupea harengus проникла
в Белое море из Тихого океана, в силу изложенных выше фактов должен
быть изменен на обратный.
Современное распространение Clupea harengus может служить, как
и у тресковых (Световидов, 1940 : 58; 1948 : 47), указанием на пути про-
никновения его в Тихий океан. Наиболее северное распространение
в Атлантическом океане Clupea harengus имеет не у берегов Сев. Америки,
как одна из самых холодолюбивых форм Gadus morhua (G. morhua ogac—
западные берега Гренландии до 72.5—73.5° с. ш., Гудсонов прол, и зал.
Джемса), а у берегов северной Азии (CZ. harengus pallasi n. suworowi —
от Чешской губы на восток до Обской губы, Cl. harengus pallasi — на за-
пад до бухты Тикси близ дельты р. Лены: см. рис. 14). Это различие
в распространении совокупно с большей евригалинностью Clupea haren-
gus по сравнению с Gadus morhua является характерным примером раз-
личных путей миграции еври- и стеногалинной фауны из одного океана
В- другой.
Как известно, многочисленные и многоводные реки Сибири оказы-
вают значительно более опресняющее влияние на моря, омывающие
ее берега, чем немногочисленные и сравнительно маловодные реки Сев.
Америки на моря ее северного побережья. Благодаря этому все наиболее
стеногалинные элементы морской фауны мигрировали из одного океана
в другой вокруг Сев. Америки. К числу их относятся, например,
иглокожие, наиболее стеногалинные из морских животных. Миграции
иглокожих из Тихого океана в Атлантический происходили вокруг Сев.
Америки (Дьяконов, 1927 : 275; 1936 : 752; 1945 : 141). Этим же путем,
но в обратном направлении — из Атлантического океана в Тихий —
прошла и Gadus morhua, о чем свидетельствует современное распростра-
нение наиболее холодолюбивых широкоголовых подвидов этого вида
и морфологическая и экологическая близость тихоокеанской трески
(G. morhua macrocephalus) и гренландской (G. morhua ogac) (Световидов,
1940 : 58; 1944 : 154; 1948 : 48). Наоборот, Clupea harengus, и в особен-
ности малопозвонковый подвид его (Cl. harengus pallasi и его формы,
см. сравнительные замечания этого вида в «Систематической части» и Све-
товидов, 19496 : 59), более евригалинный, чем Gadus morhua, совместно
с другими евригалинными морскими организмами проник из Атланти-
ческого океана в Тихий вокруг северной Азии, о чем свидетельствует
распространение малопозвонковых подвидов его и морфологическая
и экологическая близость Cl. harengus pallasi и Cl. harengus pallasi n.
suworowi. Этим же путем из тресковых в Тихий океан из Атлантического
прошла, в частности, навага (Elegi us navaga — на восток до Обской губы,
Е. gracilis — на запад до бухты Питлекай), рыба значительно более еври-
галинная, чем треска (Световидов, 1940 : 58, 1948 : 48, фиг. 33). Clupea
harengus и Gadus morhua, как показал автор (1944 : 146), имеют большое
сходство в систематическом отношении и экологических особенностях
Отдельных подвидов, обладая в то же время рядом диаметрально проти-
воположных эколого-биологических отличий. Эти черты сходства и раз-
личия обоих видов и их подвидов, несомненно, обусловлены их совместным
' Существованием на протяжении по крайней мере верхнетретичного времени.
В настоящее время затруднительно сказать, когда Clupea harengus
Проник в Тихий океан — в плиоценовую или, как предполагал Дерюгин
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
53
(1928 ; 444), позднее, в послеледниковую трансгрессию. Все соображения,
высказанные автором (Световидов, 1940 : 57; 1948 : 47) на этот счет отно-
сительно Gadus morhua целиком приложимы и к Clupea harengus, т. е. наи-
более вероятно, что и этот вид прошел сюда в послеледниковую транс-
грессию. В связи с этим следует остановиться на рассмотрении вопроса
о возможности проникновения из одного океана в другой этим же путем
субтропических элементов фауны.
По мнению Берга (1934 : 76), в верхнеплиоценовом Сибирском
море должны были встречаться, а следовательно, и иметь возможность
проникнуть этим путем из одного океана в другой некоторые и субтро-
пические, называемые им средиземноморско-бореальные виды животных,
встречаемые в настоящее время лишь у берегов Калифорнии и Японии
и в форме тождественных или близких видов в Средиземном море.
К числу таковых он относит угрей Echelus (=Myrus) urop terus (берега
южной Японии) и Е. myrus (Средиземное море и Бискайский зал.)
и Cepola schlegeli (Токио и южнее) и С. taenia (Средиземное море и берега
Англии до Йоркшира). Оба эти рода, заключающие по 2 упомянутых
вида, в тропиках отсутствуют. Из моллюсков сходное распространение
имеют средиземноморские Gibbula adriatica и Cymatium carrigatum, пред-
ставленные близкими формами у берегов Калифорнии. Казалось, этим же
путем могли бы проникнуть в Тихий океан и некоторые субтропические,
сельдевые и тресковые, однако в действительности этого нет. Ряд фактов
заставляет признать, что субтропические организмы не имели возмож-
ности мигрировать вокруг Сев. Америки и северной Азии из одного
океана в другой. Более того, даже некоторые из бореальных тресковых,,
лишь несколько более теплолюбивые, чем Gadus morhua, пройти из Атлан-
тического океана в Тихий этим путем не могли. Так, например, Mela-
nogrammus aeglefinus и Pollachius virens и ряд других лишь слегка более
теплолюбивых тресковых, чем Gadus morhua, и не заходящих так далеко
на север, как эта рыба, в Тихий океан не проникли несомненно потому,
что температурные условия в Сибирском море ни в послеледниковую,
ни даже в плиоценовую трансгрессии для них не были подходящими.
Это станет особенно ясным, если принять во внимание, что из подвидов
Gadus morhua в Тихий океан проникла не узкоголовая (G. morhua morhua),
а более холодолюбивая широкоголовая форма (С. morhua macrocephalus,
близкая к G. morhua ogac). Равным образом из подвидов Clupea harengus
в Тихий океан проникла не многопозвонкова-я (Cl. harengus harengus),.
а более холодолюбивая малопозвонковая форма (Cl. harengus pallasi,
близкая к Cl. harengus pallasi n. suworowi). Температурные условия
в области Берингова пролива во время обоих трансгрессий, повидимому,
вообще не обладали широкой амплитудой. Верхний предел их в после-:
ледниковую трансгрессию, повидимому, был таков, что смогли пройти
лишь наиболее холодолюбивые подвиды Gadus morhua и Clupea haren-
gus — широкоголовая (G. morhua macrocephalus) и малопозво-нковая
(CZ. harengus pallasi) формы, а более теплолюбивые — узкоголовая
(C. morhua morhua) и многопозвонковая (Cl. harengus harengus) и некото-
рые другие, в частности уже упомянутые тресковые, пройти не смогли.
13озможно, в плиоценовую трансгрессию температурные условия в области
Берингова пролива были несколько выше, чем в послеледниковую, так
как иначе в Тихий океан не смогли бы проникнуть некоторые из треско-
вых (например Theragra chalcogramma), но не настолько высоки, чтобы
могли пройти субтропические организмы; в этом случае в Тихий океан
имел. бы возможность попасть ряд других, более теплолюбивых треско--
54
ВВЕДЕНИЕ
вых и сельдевых. .Что касается нижнего температурного предела, то он,!
судя по всему, ни в одну из трансгрессий не был ниже современных;
Это видно хотя бы из того, что Boreogadus saida проникла лишь в самую
северную часть Берингова моря и вследствие отсутствия вдоль восточных
берегов Камчатки южнее мыса Лопатки и у Алеутских о-вов льдов
не может пройти далее — в Охотское море, где эта рыба нашла бы для
себя подходящие условия. Очевидно, этот вид проник сюда лишь в самое
последнее время, по окончании более теплого послеледникового времени.
Таким образом, во время обоих трансгрессий было лишь сравнительно
небольшое потепление, давшее возможность пройти , через Берингов про-
лив, из одного океана в другой лишь части умеренных элементов фауны
обоих океанов. Об этом же свидетельствуют и многочисленные примеры
ископаемых моллюсков, приводимые Бергом (1934 : 74). Этим и обу-
словлено отсутствие в северной части Тихого океана субтропических
и даже более теплолюбивых из умеренных тресковых и сельдевых, близ-
ких к североатлантическим.
- Субтропический представитель сельдевых северной части Тихого
океана (Sardinops sagax), судя по всему, проник сюда из южного полу-
шария. Близкие между собой субтропические роды Sardinops и Sardina
наиболее близки в свою очередь к тропическому роду Sardinella и, неви-
димому, имеют общэе происхождение. Род Sardina обособился в субтропи-
ческих морях северного полушария, Sardinops, судя по его распростра-
нению (S. sagax sagax — тихоокеанские берега Южн. Америки, S. sagax
neopilchardus — у южных берегов Австралии и вокруг Новой Зеландии,
-S', sagax ocellata — берега южной Африки, S. sagax melanosticta — берега
юго-восточной Азии, S. sagax caerulea — тихоокеанские берега Сев. Аме-
рики, см. рис. 23) — в субтропических морях южного полушария. Совре-
менное биполярное распространение Sardinops sagax сложилось в лед-
никовое время, когда вследствие похолодания климата имел место обмен
субтропических элементов фауны обоих полушарий (Берг, 1920 : 273;
1947 : 128; Berg, 1933 : 449). Род Sardina в южное полушарие распро-
страниться не мог, так как наиболее близкое место, куда бы он мог в пер-
вую очередь попасть (берега южной Африки), оказалось занятым совер-
шенно сходным биологически родом Sardinops (S. sagax ocellata). В свою
очередь те же причины препятствовали распространению и S. sagax ocel-
lata в северную часть Атлантического океана к берегам Европы. Род
Sardinops имел возможность беспрепятственно расселиться лишь в север-
ную часть Тихого океана, куда он и проник как вдоль американских
(A. sagax caerulea), так и азиатских берегов (S. sagax melanosticta), дав
таким образом биполярное и амфипацифическое распространение (Андрия-
шев, 1939). Южное полушарие было, повидимому, центром происхожде-
ния не только рода Sardinops, но и рода Sprattus, большинство видов
которого распространено также здесь (см. рис. 13). Биполярный род
Sprattus имеет ту особенность, что он в отличие от преобладающего боль-
шинства других рыб, имеющих биполярное распространение, отсутствует
у берегов южной' Африки. Такое распространение, встречаясь в Атлан-
тическом океане у берегов Европы, с одной стороны, и у берегов Южн.
Америки, с другой, из биполярных рыб имеют немногие (например род
Мicromesistius) и обусловлено оно несоответствием температурных усло-
вий вод, омывающих южную Африку, температурным условиям нереста
этих рыб: поверхностная температура воды у берегов южной Африки
не бывает ниже 15° даже в холодное время года, икрометание же !
Sprattus sprattus в северной части Атлантического океана и в Средизем-
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
55
ном море происходит в среднем при 8—10° (Световидов, 1949). Южному
полушарию помимо двух упомянутых родов свойственны и другие энде-
мичные роды сельдевых (Ethmidium, Potamalosa, отчасти Byperolophus),
что дает основание считать здесь третий, менее богатый центр сельде-
вых.
Бедность морских и отсутствие проходных и пресноводных сельдевых
в арктическо-циркумполярной подобласти обусловлена теплолюбивым
характером семейства в целом. Так, например, более холодолюбивое семей-
ство тресковых, представленное наибольшим количеством родов и видов
в умеренных областях и отсутствующее в тропиках, в арктическо-циркум-
полярной подобласти имеет значительно большее количество видов, чем
сельдевые. Среди тресковых имеются не только арктические, но и высоко-
арктические, в том числе несколько эндемичных высоко-арктических
родов (Boreogadus, Arctogadus). Из значительно более теплолюбивых
сельдевых один из самых холодолюбивых видов (Clupea harengus)
проник лишь в умеренные части арктическо-циркумполярной под-
области. Холодолюбивых проходных, могущих проникнуть так далеко
на север, как Clupea harengus, среди сельдевых не оказалось. Это обусло-
вило отсутствие проходных сельдевых и в северной части Тихого океана,
потому что бореальные вокруг северной Азии и Сев. Америки пройти
не могли, а для проходных субтропических здесь нет подходящих тем-
пературных условий. Отсутствие проходных сельдевых в северной части
Тихого океана является одной из характерных ее особенностей (Свето-
видов, 1949в).
При сопоставлении состава фауны сельдевых Каспийского, Черного
и Азовского морей обращают на себя внимание несколько особенностей.
Одна из этих особенностей заключается в том, что фауна рыб Черного
моря, как известно, значительно более богатая и разнообразная по своему
составу, чем Каспийского, более богата и разнообразна и в отношении
сельдевых, но не видами и более низкими формами (подвидами), а родами.
Здесь, помимо общих с каспийскими родом Clupeonella и подродом Cas-
pialosa, имеются еще 3 рода из этого семейства — Sprattus, Sardina,
Sardinella и подрод Alosa s. str., широко распространенных, кроме Чер-
ного моря, в Средиземном море и в Атлантическом океане, а некоторые
из них, кроме того, в Индийском и Тихом океанах. Эта особенность чер-
номорской фауны сельдевых, свойственная, как отмечалось выше, вообще
фауне Черного моря, обусловлена, как известно, инвазией в Черное
море средиземноморской фауны после прорыва Босфора.
Еще больший интерес представляет другая особенность черноморских
и каспийских сельдевых, не отмеченная до сего времени1 и заключаю-
щаяся в том, что общие обоим морям род Clupeonella и подрод Caspialosa
в Каспийском море как в видовом отношении, так и по количеству более
низких форм (подвидов) представлены значительно более богато, чем
в Черном и Азовском морях.
Состав фауны сельдевых этих родов в Каспийском и Черном и Азов-
ском морях таков:1 2
1 Эта особенность была отмечена автором ранее в предварительном сообщении
(Световидов, 1941 : 807, предст. 13 VI 1940). Эта статья должна была быть напеча-
тана одновременно со статьей А. А. Михайловской (1941 : 559, предст. 24 VI 1940),
которая была знакома с выводами автора и, говоря о богатстве каспийских сельдей,
сделала ссылку на нее. Вследствие того, что статья автора была опубликована
позднее: статьи А. А. Михайловской, эта ссылка в ее статье помещена не была.
2 В скобках указано количество подвидов.
56
ВВЕДЕНИЕ
Каспийское
море
Черное
и Азовское
моря
1(1)
1
1
1(1)
Clupeonella grimmi .
Cl. engrauliformis . .
Cl. delicatula s. 1. . .
Всего видов и подвидов . 3(1)1 1(1)
Alosa saposhnikovi 1 —
A. sphaerocephala 1 —
A. caspia s. 1. ....... . 1(4) 1(3)
A. hrashnikovi s. 1 1(8) 1(1)
A. curensis ......... 1 —
A. kessleri s. 1 1(3) 1(1)
Всего видов и подвидов . 6 (15) 3 (5)
Род Clupeonella в Каспийском море представлен 2 эндемичными видами
и лишь одним — формой того же вида, что и в Каспийском, — в Черном
и Азовском морях. В Каспийском море из рода Alosa имеются 6 видов,
из которых 3 свойственны только этому морю; в Черном же и Азовском
морях из этого рода встречается только 3 вида, представленные здесь
формами видов, общих с каспийскими. Таким образом, в Черном и Азов-
ском морях нет ни одного вида, который не был бы представлен в Кас-
пийском и притом значительно большим количеством форм, чем в Чер-
ном и Азовском морях, в то время как в Каспийском море имеются 2 вида
из рода Clupeonella и 3 вида из рода Alosa, отсутствующие в Черном
и Азовском морях.
Богатство сельдевых обоих этих родов в Каспийском море обуслов-
лено преобладанием главным образом морских, непроходных видов
и подвидов. Таковыми из числа видов являются Clupeonella grimmi и Cl.
engrauliformis и Alosa saposhnikooi, A. sphaerocephala и A. curensis, в то
время как проходная (A. kessleri s. 1.) и полупроходная (A. caspia s. 1.)
сельди и тюлька (CZ. delicatula s. 1.) представлены в обоих морях.
Из числа морских, непроходных сельдей общими для обоих морей яв-
ляются лишь A. brashnikooi s. 1. Подвидами в Каспийском море особенно
богат морской, непроходной вид A. brashnikooi s. 1., представленный здесь
8 подвидами, против одного черноморско-азовского {A. brashnikooi таео-
tica). Полупроходные и проходные виды имеют в Каспийском море зна-
чительно меньшее количество подвидов. Так, например, A. caspia, одни
подвиды которого являются морскими, непроходными (A. caspia salina),
другие полупроходными или отчасти даже проходными (A. caspia caspia
и др.), представлен в Каспийском море 4 подвидами и, повидимому, еще
2 более низкими формами (nationes), а в Черном и Азовском морях —
3 подвидами. Типично проходной вид A. kessleri s. 1. имеет в Каспийском
море 3 подвида, а в Черном и Азовском лишь один, распадающийся
на 2 более низких формы (nationes).
Необходимо также отметить некоторые биологические особенности
каспийских и черноморско-азовских форм A. brashnikooi s. 1. и A. caspia
s. 1., а именно то, что каспийские формы этих видов являются более мор-
скими рыбами, чем черноморско-азовские. Все каспийские формы
1 Четвертый вид этого рода С1. abrau встречается в оз. Абрау и Абулиояд; о нем
сказано особо ниже.
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
57
A. brasknikovi s, 1. избегают пресной воды и размножаются только в море,
между тем как черноморско-азовская форма этого вида (A. brasknikovi
maeotica) заходит в совершенно опресненные участки Таганрогского зал.,
и в нижнюю часть дельты Дона. Имеются указания и на нерест A. brash-
nikovi maeotica почти в пресной воде. Среди каспийских форм A. caspia
s. 1. есть такие, которые мечут икру в солоноватой воде в море (A. caspia
salina) или в предустьевых пространствах (A. caspia caspia), в то время
как все черноморско-азовские формы этого вида мечут икру только
в пресной воде, заходя в реки, озера и лиманы. То же самое следует ска-
зать и о Clupeonella delicatula s. 1.: Cl. delicatula caspia мечет икру как
в пресной воде, так почти и по всему Каспийскому морю, между Тем как
Cl. delicatula delicatula в Азовском море нерестует в самых опресненных
частях его — в Таганрогском заливе, в дельте Дона, в кубанских опрес-
ненных лиманах и лишь отчасти в море.
Заслуживает внимания и еще одна особенность каспийских форм
обоих рассматриваемых родов, отмеченная ранее Киселевичем (1918
21), — их значительно большие размеры, по сравнению с черноморско-
азовскими. Clupeonella delicatula caspia достигает в длину до-
14 см, средние размеры ее около 8—10 см, между тем как размеры
Cl. delicatula delicatula в Азовском море не превышает 9 см, имея в сред-
нем около 7 см. Каспийские формы A. caspia s. 1. точно так же значи-
тельно крупнее черноморско-азовских. A. caspia caspia иногда достигает
в длину до 28 см, средние размеры его около 18—21 см; таковы же раз-
меры и остальных каспийских форм этого вида, в то время как черно-
морско-азовские формы не превышают в длину 20 см, средние размеры
их около 15 см; каспийские формы A. brasknikovi s. 1. достигают в длину
почти до 50 см, средние размеры их около 30 см; наибольшие размеры
черноморско-азовской формы этого вида (A. brasknikovi maeotica) не пре-
вышают 31 см, средние размеры крупной расы этой формы — от 16
до 20 см, мелкой расы — около 12—13 см. Наиболее крупная из каспий-
ских форм A. kessleri s. 1., A. kessleri kessleri, достигает в длину до 52 см,
в половозрелом состоянии во время хода в реку основная масса ее имеет
длину от 36 до 44 см. Более мелкая форма этого вида, A. kessleri volgensis,
достигает в длину до 40 см, средние размеры ее во время хода в реку
около 28 см, в то время как наибольшие размеры черноморско-азовской
формы (A. kessleri pontica) в Дону не превышают 30, а в Днепре
39 см.
Наиболее важная особенность сельдевых обоих рассматриваемых
родов заключается, однако, в том, что каспийские формы их различаются
значительно больше, чем черноморско-азовские формы тех же видов.
Различия между каспийскими формами A. caspia s. 1. значительны как
в количестве жаберных тычинок, так в некоторых случаях и внешне
(например A. caspia knipowitschi, подробнее см. об этом стр. 216). Черно-
морско-азовские формы A. caspia s. 1., не различающиеся между собой
внешне, значительно меньше, чем каспийские формы этого вида, отли-
чаются друг от друга и количеством жаберных тычинок. Разница в сред-
них значениях количества жаберных тычинок у наиболее различающихся
по этому признаку черноморско-азовских форм A. caspia s. 1., A. caspia.
tanaica и A. caspia nordmanni, равна только 4, а у менее различающихся
A. caspia tanaica и A. caspia palaeostomi — всего лишь 0.1, между тем
как у наиболее различающихся в этом отношении каспийских форм этого-
вида A. caspia salina и A. caspia knipowitschi разница в средних значениях
количеств жаберных тычинок равна 55.5. Даже у наименее отличающихся.
58
ВВЕДЕНИЕ
по количеству жаберных тычинок каспийских форм этого вида A. caspia
salina и A. caspia persica разница в средних значениях равна 7.8.
Такова же степень различия между каспийскими формами A. caspia s. 1.
с одной стороны, и черноморско-азовскими, с другой, и в остальных
признаках. Черноморско-азовская проходная сельдь (Л. kessleri pontica'),
как показали исследования последних лет, распадается на 2 формы,
существенно различающиеся биологически, но морфологически ни коли-
чеством и строением жаберных тычинок, ни какими-либо другими особен-
ностями, кроме размеров, не отличающиеся и являющиеся более низкими
таксономически формами (nationes, подробнее об этом см. стр. 285).
Обе каспийские проходные сельди (A. kessleri kessleri и A. kessleri vol-
gensis) существенно отличаются друг от друга количеством и строением
жаберных тычинок, некоторыми другими особенностями и отчасти даже
внешне. Еще более различаются между собой каспийские формы A. brash-
nikovi s. 1. (см. стр. 217), представленного в Черном и Азовском морях
одной формой, которая, подобно A. kessleri pontica,. повидимому, распа-
дается на 2 более низкие, чем подвиды, формы (nationes), различающиеся
лишь размерами и биологическими особенностями (см. стр. 255).
Менее различаются между собой в Черном море и виды A. brashni-
kovi s. 1. и A. kessleri s. 1. Наиболее близкая к A. brashnikovi s. 1. по
количеству жаберных тычинок форма A. kessleri s. 1., а именно A. kessleri
kessleri, имеет не менее 59 тычинок, в то время как у A. brashnikovi kis-
selevitshi, имеющей наибольшее количество жаберных тычинок из всех
каспийских форм' этого вида, количество их не превышает 49. Что
касается черноморско-азовских форм A. brashnikovi s. 1. и Л. kessleri s. 1.,
то у Л. brashnikovi maeotica наибольшее количество жаберных тычинок 46,
а наименьшее количество их у Л. kessleri pontica 47.
Богатство каспийских сельдевых родов Clupeonella и Alosa как в видо-
вом отношении, так и количеством форм общих видов, их гигантизм
по сравнению с черноморско-азовскими формами, отмеченные выше био-
логические особенности и большая степень отличий обусловлены
различиями в условиях развития и формообразования сельдевых как
в Каспийском и Черном и Азовском морях, так и в тех морях, которые
предшествовали им. Поэтому для рассмотрения условий развития и фор-
мообразования каспийских и черноморско-азовских сельдевых обоих
этих родов и выяснения причин такого резкого различия в составе их,
размерах, биологических особенностях и степени отличий необхо-
димо обратиться к истории развития этих морей, так как история разви-
тия фауны, по вполне справедливому замечанию Колесникова (1940 : 6),
не должна быть оторвана от истории развития бассейна, в котором она
обитает.
Понто-каспийский морской бассейн, как известно, претерпел сложную
геологическую историю. К концу миоцена, при сокращении Тетиса, одно-
временно с похолоданием климата, северо-восточная часть его отдели-
лась, образовался сарматский и ряд других пришедших ему на смену
бассейнов, фауна которых в дальнейшем развивалась в значительной
степени изолированно, находясь, в отличие от фауны образовавшегося
к этому времени Атлантического океана и стоявшего в связи с ним Среди-
земного моря, под сильным воздействием периодических опреснений
и осолонений. В меньшей степени опреснения и бассейны с затрудненным
•сообщением с нормально соленым морским бассейном или даже замкну-
тые бассейны в северо-восточной части Тетиса были и раньше, в нижнем
и среднем миоцене (Жижченко, 1940 : 42, 148).
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
59„
Таким образом, условия развития сельдевых в Атлантическом океане,
и замкнутых в сарматском море и других подобных ему бассейнах суще-;
с.тленно различались. В Атлантическом океане и в связанном с ним,
смежном с Черным, Азовским и Каспийским морями, Средиземном море,
условия существования и эволюции фауны были, повидимому, довольно
однообразны — здесь не было значительных и неоднократных изменений,
солености, при ледниковом похолодании климата теплолюбивые элементы
фауны могли отступить южнее. В связи с этим состав фауны Атланти-
ческого океана и Средиземного моря с конца неогена и начала четвертич-
ного периода больших изменений не претерпевал.
Совершенно в иных условиях протекало развитие сельдевых в сармат-
ском и других, сменивших его впоследствии бассейнах. При первом же
еще небольшом опреснении, в сарматском море, часть стеногалинных,
чисто морских сельдевых, наряду с частью чисто морской фауны, должны
были; погибнуть, что отчасти могло иметь место и раньше в нижнемиоцет
ловом и чокракском бассейнах (Жижченко, 1940 : 42, 151). Оставшиеся
сельдевые под влиянием дальнейшего последовательного осолонения
и мэотическом бассейне и опреснения в понтическом озере-море и после-
довательных изменений солености в ряде других более мелких морей,
сменивших разделившееся на части понтическое озеро-море, должны
были частично вымереть, а оставшиеся, повидимому, наиболее еврига-
линные, претерпеть ряд изменений, неоднократно приспособляясь к изме-
нявшейся солености и сопутствовавшим этим изменениям сменам фауны.
Каждый раз при осолонении часть сельдевых должна была вымирать
или отступать в опресненные участки, при опреснении же, пови-
димому, давали пышный расцвет. При этом необходимо отметить, что
при таких изменениях, повидимому, внутри вида могли появляться
вновь отдельные признаки, свойственные предшествовавшим фор-
мам* как это имело место при осолонении и опреснении в области
Балтийского моря у форм четырехрогого бычка Myoxocephalus
quadricornis (Берг, 1916 : 1343) и ракообразного Limnocalanus grimaldii
(Ekman, 1914 : 336), т. е. солоноватоводные формы, приспособившись
к морской воде и фауне и претерпев соответствующие изменения, при
повторном опреснении и сопутствовавшем ему изменении фауны приспо-
соблялись к новым условиям, могли давать формы, отчасти сходные
с формами предыдущих солоноватоводных бассейнов. На возможность
подобных обратных изменений у черноморских моллюсков указывает
Садовский (1934 : 61). Пример подобных изменений в размерах и форме
раковин являет также моллюск Planorbis multiformis (Plate, 1920 : 217).
Многочисленные случаи возврата (реверсии) прежних признаков приво-
дит Огнев (1946 : 3), давший сводку по этому вопросу.
В ископаемом состоянии из опресненных бассейнов понто-каспийской
области известна сравнительно бедная в родовом отношении (главным
образом роды Clupeonella и Alosa) фауна сельдевых из нижне-, средне-
и верхнемиоценовых отложений Апшеронского п-ова, б. Ставропольской
губ., окрестностей Дзауджикау и Бинагадов, Кировского района (Бога-
чев, 1913 : 219; 1933 : 30—37; 1938 : 42—52; 1942 : 89—92; Жижченко,
1940 : 19, 20, 34; Колесников, 1940 : 270, 448; Геккер и Мерклин, 1946 :
646, и др.).1 Некоторые из ископаемых сельдей достигали довольно круп-
1 Из плиоценовых отложений Болгарии и понтических Румынии ископаемые
Alosa nordmanni и Clupea delicatula и Cl. sulanae описаны в двух недоступных автору
статьях (Раиса, Bull. Acad. Roumaine, XIV, 1931 : 106—107, первый вид; Beregov,
Geol. Balkan, Sofia, III, 1938 : 18—22, все три вида).
60
ВВЕДЕНИЕ
ных размеров (22 и 44 см, один образец имеет в длину 58 см без головы)1
(Вогачев, 1933 : 35).
Следовательно, из богатой, чисто морской фауны Тетиса и пришедшей
на смену ей под влиянием верхнетретичного похолодания климата более-
холодолюбивой фауны, вследствие ряда последовательных опреснений
и осолонений в изолированных морях северо-восточной части его, ока-
залась отобранной небольшая обедненная фауна, дававшая временами
в некоторых бассейнах пышный расцвет, сменявшийся угнетением и от-
части вымиранием.
Этот расцвет обычно обусловливается богатством фауны не родами,,
а видами, что, например, констатировано для фауны моллюсков сармат-
ского моря (Колесников, 1940 : 313). Под влиянием последовательных
изменений солености выработалась своеобразная еврибионтная, главным
образом евригалинная фауна, представители которой обладают, как будет
указано ниже, меньшей жизненностью по сравнению с фауной Средизем-
ного моря и Атлантического океана.
Изоляция в периодически опресняемых бассейнах оказала влияние
не только на развитие и формообразование каспийско-черноморских
сельдевых, но и на состав их паразитофауны, причем все они освободи-
лись от некоторых паразитов, широко распространенных у многих сельде-.
вых Средиземного моря, Атлантического океана, Белого моря и Тихого-
океана. Так, например, в семенниках большинства сельдевых северного
полушария встречается кокцидия Eimeria. Е. sardinae или близкие к ней
формы известны у сельдевых Средиземного моря и Алтантического оке-
ана {Sardina pilchardus sardina, Clupea harengus harengus), Белого моря
(CZ. harengus pallasi n. maris-albi) и Тихого океана (CZ. harengus pallasi,.
Sardinops sagas, melanosticta, Etrumeus micropus). Этот паразит встречается
также и у Engraulis encrasicholus и его черноморских форм, но у всех
черноморско-азовских и каспийских сельдевых из родов Clupeunella и
Alosa отсутствует. Повидимому, Eimeria ранее была свойственна и кас-
пийско-черноморским сельдевым, но затем под влиянием Опреснений они
от нее освободились. В пользу этого предположения говорит тот факт,
что у CZ. harengus harengus n. membras в опресненном Финском заливе этого
паразита нет (Догель, 1938 : 903; 1941 : 33; 1947 : 298). Вместе с тем неко-
торые паразиты, свойственные другим сельдям, у каспийско-черноморских
сельдей сохранились несомненно с древних времен. Таковой является
миксоспоридия Mitraspor'a caspialosae, обнаруженная у каспийских и
черноморско-азовских сельдей. Близкий или идентичный вид этой миксо-
споридии известен у Alosa fallax fallax (Догель, 1938 : 903). Ряд парази-
тов, свойственных черноморско-азовским сельдям из рода Alosa
{A. kessleri pontica и A. caspia nordmanni) й у каспийских сельдей этого
рода отсутствующих, повидимому, получен черноморско-азовскими сель-
дями от других рыб, средиземноморских иммигрантов, уже после со-
единения Черного моря со Средиземным. К числу таких паразитов отно-
сятся черви сосальщики Hemiurus appendiculatus и Lecithaster confusus
и паразитические ракообразные Clavellisa marginata и Cymathoa pun-
ctata. Помимо широкого распространения в Черном и Азовском морях
все эти паразиты встречаются и в Средиземном море, а некоторые —
и у европейских берегов Атлантического океана. Отсутствие этих пара-
зитов у каспийских сельдей трудно объяснить иным образом, в частности
различиями условий существования их в Каспийском море и в Черном
и Азовском морях, так как, например, Н. appendiculatus найден
в сельдях, зашедших в Днепровский лиман, a Cl. marginata — у сельдей
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
61
в Азовском море и в низовьях впадающих в него рек (Османов,
1940 : 254).
Биологические взаимоотношения видов Clupeonella и Alosa с другими
рыбами как в настоящее время в Каспийском море и Черном и Азовском
морях, так несомненно и в морях, предшествовавших им в предыдущие
эпохи, различны. Пелагическая фауна открытых частей Каспийского
моря состоит исключительно из сельдевых, которые (все виды Clupeo-
nella и формы Alosa caspia s. 1.) являются здесь основными потребите-
лями планктона (см. об этом Бенинг, 1938 : 33). Других пелагических
рыб, кроме сельдевых, в галистатической области Каспийского моря в сущ-
ности нет. Население пелагиали более открытых частей Черного моря
составляют в основном средиземноморские иммигранты как из сельдевых,
но других родов {Sprattus sprattus phalericus, Sardina pilchardus sardina,
Sardinella aurita), так и из других семейств — Engraulis encrasicholus,
Trachurus trachurus, некоторые виды Syngnathus (повидимому S. schmidti
и S. typhle argentatus'), личинки и молодь Mugil sp., молодь Mullus bar-
batuS и Odontogadus merlangus euxinus, Scomber scomber, S. japonicus, Sarda
sarda и некоторые другие рыбы (см. об этом: Ильин, 1933 : 63; Малят-
•ский, 1938 : 96; 1940 : 237; Водянипкий, 1939 : 69; 1940 : 29). Послед-
няя из этих рыб (Борисенко, 1937 : 99) и скумбрия (Макаров, 1938 : 33)
являются хищниками, питающимися в основном рыбой (скумбрией, хам-
сой, шпротом, атеринкой), т. е. замещая в этом отношении здесь хищных
сельдей Каспийского моря, в частности A. brashnikovi s. 1. Почти все
остальные из этих рыб, за исключением Trachurus trachurus, питающейся
крупными ракообразными {Leander, Crangon, Gammaridae') и рыбой (Мака-
ров, 1939 : 1021), и все перечисленные выше сельдевые являются основ-
ными потребителями планктона Черного моря. К пелагическим рыбам
как Черного (Ильин, 1933 : 63), так и некоторых других морей (Гур-
вич, 1938 : 140) следует отнести и колюшку {Gasterosteus aculeatus), раз-
множающуюся, однако, у самых берегов. Все эти рыбы населяют те более
открытые части Черного моря, в которых виды Clupeonella и Alosa не
встречаются, временами подходят в прибрежную область, некоторые
из них заходят в Азовское море, многие {Е. encrasicholus, S. sprattus pha-
lericus и др.) встречаются в массовых количествах. Что касается сельде-
вых из родов Clupeonella и Alosa, то они вместе с остальной автохтонной
реликтовой фауной понтического озера-моря встречаются в опресненных
частях Черного моря и в Азовском море. Тюлька (Cl. delicatula delica-
tula) встречается здесь только в Азовском море, в лиманах и в опреснен-
ных участках у берегов северо-западной части Черного моря, Румынии,
Болгарии, в Феодосийском зал. и в оз. Палиастоми. Сельди в зимнее время
держатся вдоль берегов Кавказа, у берегов Крыма, летом заходят в опре-
сненные части Черного моря и в Азовское море и в реки.
В галистатической части Черного моря ни один из представителей
этих двух родов не найден.
Таким образом, виды рода Clupeonella, живущие только в море и при-
том в открытых его частях {Cl. grimmi и Cl. engrauliformis), и морские,
непроходные виды рода Alosa {A. saposhnikovi, A. sphaerocephala, A. brash-
nikovi s. 1.), мечущие икру в море, в Черном море не могли образоваться
или получить развитие потому, что. пелагиаль открытых частей его после
прорыва Босфора была заселена более сильными конкурентами, имми-
грантами из Средиземного моря. Наоборот, можно полагать, что сельде-
вые из этих двух родов в настоящую фазу существования Черного моря
испытывают в нем сильную депрессию, будучи оттеснены в наиболее
62
ВВЕДЕНИЕ
опресненные части его и в Азовское море более жизненными средиземно-
морскими иммигрантами. Успешная акклиматизация в Каспийском море
кефалей (Mugil auratus и М. saliens), креветки Leander adspersus, червя
Nerds succina и моллюска Mytilaster lineatus, причем последний в значи-
тельной степени вытесняет автохтонного моллюска Dreissena (невиди-
мому D. caspica), a L. adspersus каспийских мизид (Жадин 1*941': 10;
Броцкая и Неценгович, 1941 : 79), показывает, насколько более жизненны
средиземноморские иммигранты по сравнению с фауной автохтонной
(см. об этом: Зенкевич и Бирштейн, 1934 : 38; 1937 : 443).
Совершенно иные условия оказались в Каспийском море, которое
в средней и, в особенности, в южной части в настоящую фазу, его суще-
ствования представляет солоноватоводный, в южной части почти такой же
морской бассейн, как Черное море. В этом бассейне пелагических рыб
кроме сельдевых из родов Clupeonella и Alosa не оказалось, поэтому фауна
пелагиали его, в особенности в южной и средней частях, могла форми-
роваться только из этих рыб, и поэтому же они, в особенности морские
непроходные, при отсутствии конкуренции с другими видами и получили
здесь пышный расцвет; расцвет этот сопровождается и гигантизмом;
аналогичное явление наблюдалось и в понтической реликтовой фауне,
например в киммерийском бассейне (Колесников, 1940 : 930). Расцвет
в Каспийском море одного из наиболее богатого здесь формами видов,
A. brashnikooi s. 1., в особенности в южной части моря, где локализовано
большинство форм его, обусловлен не только отсутствием здесь других
пелагических рыб, кроме сельдевых, но также приспособлением неко-
торых форм его и к придонному образу жизни и питанию. При этом
некоторые формы A. brashnikooi s. 1., помимо существенных различий в об-
разе жизни, характере питания и в связанных с этим некоторых морфо-
логических особенностях, о чем подробно указывалось выше (см.
стр. 29), отличаются большим разнообразием и во времени нереста, имея
в этом отношении некоторое сходство с атлантической сельдью (Clupea
harengus harengus}. Среди форм этого вида имеются как наиболее холодо-
любивые (A. brashnikooi brashnikooi}, так и самые теплолюбивые (A. brash-
nikooi kisseleoitshi) из всех каспийских сельдей, причем по окончании
нереста одной формы (например A. brashnikooi grimmi, в июне и даже
в июле) на тех же местах позднее начинают метать икру другие
(A. brashnikooi kisseleoitshi}. ' - -
Сопоставив условия развития сельдевых в Каспийском, в Черном
и Азовском морях, нельзя не коснуться условий развития пелагических
рыб в третьем солоноватоводном бассейне — в Аральском море, по соле-
ности близком к Каспийскому (S 1О.19%0; Бадер, 1934 : 5) и в истори-
ческом развитии отчасти связанном с последним. Отсутствие по берегам
современного Аральского моря каких-либо древних (нижнечетвертичных
и плиоценовых) морских или озерных отложений и распространение
древнеаллювиальных отложений в центральной части Турана заставляет
предполагать, что Аральское море образовалось лишь во второй поло-
вине четвертичного периода (Архангельский, 1931 : 171 и сл.; Герасимов,
1937 : 58). Таким образом, геологически Аральское море значи-
тельно моложе понто-каспийского бассейна. Тем не менее условия фаз-
вития и формирования пелагической фауны Аральского моря имеют
некоторое сходство и вместе с тем различия с таковыми в Каспийском.
Вопрос о связи Аральского моря с Каспийским в настоящее время не мо-
жет считаться решенным. В частности остается ’.нерешенным вопрос
о времени, когда была трансгрессия с Cardium edule. Весь (1939 дА),
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
63
подвергнувшая этот вопрос детальному анализу, считает возможным
утверждать лишь то, что в период максимальной трансгрессии моря
с С. edule Узбой был еще оводнен. Отсутствие в Аральском море некото-
рых рыб средиземноморских (Atherina, Syngnathus) и понтических релик-
тов (бычки из сем. Gobiidae) Берг (1908 : 451) объясняет тем, что
это море прошло в своем развитии пресноводную фазу. Никольский
(1940 : 192) не считает, однако, это достаточным для объяснения причин
отсутствия в Аральском море упомянутых рыб и высказывает мысль,
что отсутствие здесь этих рыб обусловлено тем, что ихтиофауна Араль-
ского моря сформировалась из ихтиофауны Аму- и его древнего притока
(в период древнего плювиаля; Герасимов, 1937 : 57) Сыр-дарьи, а совре-
менные обитатели его представляют собой лимнофильные элементы плей-
стоценовой ихтиофауны этих рек, и, возможно, что первоначальная
фауна Аральского моря была несколько богаче современной. При после-
довавшем затем осолонении Аральского моря некоторые виды принуждены
были уйти в дельты и озера Аму- и Сыр-дарьи, а часть приспособилась
к изменившимся условиям и осталась в самом море.
Таким образом, пелагическая фауна рыб в Аральском море могла
формироваться только из сравнительно стенобионтных, пресноводных
рыб, так как здесь не оказалось в наличии ни средиземноморских рыб,
как в Черном море, ни пелагических из понтических реликтов, как
в Каспийском море. Пелагических в числе рыб, из которых формирова-
лась ихтиофауна Аральского моря, не оказалось, не оказалось и таких,
которые могли бы приспособиться к условиям жизни в пелагиали осо-
лонившегося бассейна. Вследствие этого рыб, постоянно живущих в об-
ширных пространствах открытых частей Аральского моря, подобных
видам Clupeonella и Alosa в Каспийском море и Engraulis, Sprattus и др.
в Черном, в этом море нет; зоопланктон его в качестве основного объекта
питания используется в сущности лишь колюшкой (Pungitius platygas-
ter aralensis), важнейшие же промысловые рыбы (лещ, вобла, судак,
белоглазка, чехонь, шемая) хотя и откармливаются в открытой части
моря с глубинами от 15 до 30 м, но среди них нет ни одной кормящейся'
только в пелагиали, так как все они питаются за счет и донной фауны
(ракообразные, моллюски), и пелагиаль этого моря остается в сущности1
незаполненной (Никольский, 1940 : 197). Весьма характерно также-
то, что ни одна рыба в открытых частях Аральского моря не размножается
(Никольский, 1940 : 194).
В Каспийском море, благодаря, как указывалось выше, особым усло-
виям развития и состава его ихтиофауны, сельдевые являются более мор-
скими рыбами, чем формы тех же видов в Черном и Азовском морях.
Вследствие тех же причин ряд рыб, которые в чернОморско-азовском и
каспийском бассейнах являются полупроходными или пресноводными,
в Аральском море живут в открытых, осолоненных частях его. Так,,
например, аральская вобла (Rutilus rutilus aralensis) встречается по-
всему Аральскому морю, даже в осолоненных заливах его восточного-
берега (Никольский, 1940 : 74), в то время как каспийская вобла (R. ru-
tilus caspicus) встречается только в опресненной северной части моря
и в опресненных заливах южной части его — заливы Гасанкулинский,’
Астрабадский (R. rutilus caspicus n. knipowitschi), Кизилагачскйй и,
вероятно, Энзелийский (R. rutilus caspicus n. kurensis). Близкая к араль-1
ской и каспийской вобле черноморско-азовская, называемая здесь та-
ранью, (R. rutilus heckeli), встречается также только в опресненных частях
Черного и Азовского морей. Каспийские формы воблы и тарань мечут
64
ВВЕДЕНИЕ
икру только в пресной воде (Берг, 1949 ; 502, 520, 527, 528), между тем
как аральская вобла выметывает икру главным образом в море по всем
берегам его как в пресной, так и в солоноватой воде с содержанием солей
до 11%0 (Никольский, 1940 : 77). Чехонь (Pelecus cultratus) в Аральском
море встречается по всем берегам и при любой солености, в то время как
в Каспийском, Черном и Азовском морях распространение ее ограничено
предустьевыми, опресненными пространствами. В Каспийском, Черном
и Азовском морях чехонь размножается только в пресной воде, аральская
же чехонь, повидимому, мечет икру и в солоноватой воде (Никольский,
1940 : 148). То же самое можно сказать и о ряде других рыб Аральского
моря. Даже чисто пресноводная рыба — красноперка (Scardinius eryth-
rophthalmus) в Аральском море держится по всем берегам и размно-
жается, по указанию Никольского (1940 : 191), при солености свыше i
10% о. Аральская шемая (Chalcalburnus chalcoides aralensis) широко рас- j
пространена по всему морю, где мечет икру как в опресненных предустье-
вых пространствах, так, главным образом, по берегам его при содержании
солей свыше Ю%0 (Никольский, 1940 : 111, 191). Каспийская шемая
{Ch. chalcoides typ.) встречается главным образом в южной части моря,
преимущественно в не слишком осолопенных районах ее, размножается
только в пресной воде, в реках (Кура, Терек и отчасти другие; Берг,
1949 : 736). Черноморская шемая (Ch. chalcoides danubicus и. Ch. chalcoides
scl iscl. kovi) встречается только в опресненных пространствах Азовского
и северо-западной части Черного моря, размножается только в реках, <
причем в Азовском море ведет себя как настоящая проходная рыба,
в Кубань заходит с осени и поднимается очень высоко, до Усть-Лабинской
и выше, заходит в притоки (Пшиш, Белая, Лаба; Берг, 1932 : 478).
В реках же Крыма и западного Закавказья шемая, отсутствующая у бере-
гов этих мест в море, представлена особыми пресноводными формами
{Ch. chalcoides mentoides, Ch. chalcoides derjugini', Берг, 1949 : 740, 741).
Таким образом, состав и распределение ихтиофауны в каждом из
трех рассматриваемых солоноватоводных морей различны. Вследствие
того, что ихтиофауна Аральского моря сформировалась из пресновод-
ных рыб, среди которых настоящих пелагических не оказалось, пела-
гиаль его остается незаполненной, а открытые части населяют, размно-
жаясь в самом море в прибрежной области, такие рыбы, которые
в Каспийском, Азовском и Черном морях держатся преимущественно
в опресненных предустьевых пространствах, а размножаются в пресной воде,
в реках. Открытые части Каспийского моря населены понтическими ре-
ликтами из сельдевых, настоящими пелагическими рыбами, давшими
здесь пышный расцвет и особенно богато представленными морскими
непроходными видами и подвидами. Часть этих рыб в открытых частях
Каспийского моря держится постоянно, здесь же и размножается, мно-
гие виды мечут икру в море в прибрежной области, некоторые для икро-
метания заходят в опресненные предустьевые пространства и в реки.
Эти же понтические реликтовые сельдевые, представленные в Черном
море значительно меньшим количеством близких подвидов, общих с не-
которыми из каспийских видов, в открытых частях этого моря не встре-
чаются, будучи вытесненными отсюда рядом средиземноморских пела-
гических рыб. Все эти сельдевые в Черном море держатся лишь вблизи
берегов и преимущественно в зимнее время, в северо-западной ча-
сти его и в Азовском море, преобладающее большинство их размно-
жается в пресной воде и лишь один-два представителя — в солоно-
ватой.
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
65
Нелагиаль открытых частей Средиземного моря и Атлантического
оксана, благодаря постоянству состава их ихтиофауны с конца миоцена,
была всегда заселена, помимо упомянутых для Черного моря, рядом
других пелагических рыб. В частности, в пелагиали бореальной области
Атлантического океана наиболее существенную роль играет атлантиче-
ская сельдь (Clupea harengus harengus). Поэтому средиземноморско-
атлантические сельди из Alosa, не имея подходящих условий для рас-
цвета в прошлом, не имеют и, вероятно, не имели и ранее ни одного вида,
который размножался бы в море или в солоноватой воде; все они
являются проходными видами. Более того, многие из них образовали
чисто пресноводные, речные или озерные формы, которых каспийско-
черноморские сельди не имеют. Таковыми являются: Alosa fallax lacu-
stris (озера Маджоре, Комо, Лугано), A. fallax gracilis (оз. Гарда),
A. ja.llax killarnensis (оз. Килларней в юго-западной части Ирландии),
A. alosa macedonica (оз. Бешик-гёль, бассейн Эгейского моря), A. ala-
bamae ohiensis (р. Огайо, бассейн Миссисипи).
Средиземноморско-атлантические сельди Alosa alosa и A. fallax
морфологически и биологически соответствуют каспийским проходным
сельдям A. kessleri kessleri и A. kessleri volgensis. A. alosa alosa и A. kes-
sleri kessleri — крупные и жирные сельди, заходящие в реки с еще не
вполне зрелыми половыми продуктами и подымающиеся для нереста
высоко вверх по течению. A. fallax fallax и A. kessleri volgensis — менее
крупные и жирные сельди, в реки заходят с вполне зрелыми половыми
продуктами и высоко вверх не подымаются (A. fallax fallax в Рейне мечет
икру в пределах Голландии, A. kessleri volgensis — в Волге в главной
массе ниже Сталинграда, в то время как обе первые сельди нерестятся
значительно выше). Черноморско-азовская проходная сельдь A. kes-
sleri pontica, как указывалось выше, распадается на 2 формы (nationes) —
крупную и мелкую. Крупная форма в реки входит раньше и с менее зре-
лыми половыми продуктами, чем мелкая, она более жирна (см. стр. 292).
В настоящее время вследствие возведения плотин на Днепре и на Дону
трудно сказать, подымается ли крупная форма A. kessleri pontica вверх
по течению выше, чем мелкая, но в прежние годы в Днепре на порогах
ловилась только крупная сельдь (см. об этом стр. 285, 288).
Как нетрудно видеть, крупная форма A. kessleri pontica биологиче-
ски соответствует A. kessleri kessleri и A. alosa alosa, а мелкая —
A. kessleri volgensis и A. fallax fallax, и все эти проходные сельди в трех
рассматриваемых морских бассейнах представляют 3 формы разной
степени обособления. Благодаря тому что в Атлантическом океане и
в Средиземном море с конца миоцена не было таких изменений солености
и сопутствующих им изменений в составе ихтиофауны, как в бассейнах,'
давших начало Черному и Каспийскому морям, в конечном итоге, в силу
изменчивости в одном направлении, при которой не появлялись формы,
имевшие признаки, отчасти свойственные предшествовавшим формам,
отличия между A. alosa и A. fallax оказались более значительными и они
обособились здесь до степени видов, имеющих и качественные различия.
Каспийско-черноморские проходные сельди, замкнутые в сарматском и дру-
гих сменивших его бассейнах, вследствие ряда последовательных опре-
снений и осолонений в этих морях, вызывавших, как указывалось выше,
появление форм, имевших некоторые признаки, отчасти свойственные
предыдущим формам, обособились менее. Каспийские сельди, явля-
ющиеся в настоящую фазу существования Каспийского моря единствен-
ными пелагическими рыбами, обособились до степени подвидов, имею-
5 Фауна СССР — 314
66
ВВЕДЕНИЕ
щих лишь количественные отличия, в то время как черноморско-
азовские проходные сельди, оттесненные средиземноморскими иммигран-
тами в опресненные части Черного моря и в Азовское море и нахо-
дящиеся в менее благоприятных условиях, обособились менее, до
степени менее обособленных форм (nationes). Большей степенью раз-
личий, чем черноморско-азовские, отличаются, как указывалось выше,
и другие каспийские формы общих с черноморско-азовскими формами
видов (A. caspia s. 1., A. brashnikovi s. 1.). Разная степень различия между
видами подрода Alosa s. str. и формами каспийских и черноморско-азов-
ских проходных сельдей подрода Caspialosa наблюдаются, между прочим,
и в количестве лучей в анальном плавнике. Количество лучей в анальном
плавнике у всех, даже у видов Alosa, трансгрессивно, но разница в сред-
них у видов Alosa значительно больше, чем у подвидов и более низких
форм (nationes) Alosa, что видно из нижеследующего: A. alosa alosa —
23.1, A. fallax fallax — 22.0, A. kessleri kessleri — 21.1, A. kessleri vol-
gensis — 20.8, A. kessleri pontica крупная форма — 20.7, A. kessleri pon-
tica мелкая форма — 20.5.
Подводя итоги всему сказанному об условиях развития и формо-
образования сельдевых из рода Clupeonella и Alosa, следует подчеркнуть,
чтр богатство их в Каспийском море обусловлено расцветом их в этом
море главным образом в настоящую фазу его существования, со вре-
мени последнего соединения его с морями, предшествовавшими Черному
и Азовскому, которое могло быть в послехвалынское и в, бакинское,
а ранее в апшеронское и акчагыльское время (см. об этом: Колесников.,
1940 : 928), а не в одном из морей, предшествовавших Каспийскому, как
полагал Киселевич (1918 : 24). При этом расцвет их обусловили не
«значительное протяжение и разнообразие климатических условий в раз-
личных частях бассейна» (Киселевич, 1918 : 24), а наличие в Каспийском
море незаселенной другими рыбами пелагиали, которую могли запол-
нить только сельдевые рассматриваемых двух родов. Что касается при-
водимого К. А. Киселевичем мнения Сарса, что каспийские сельди
«находятся в стадии незакончивщегося видообразования» (1918 :24),
то в стадии видообразования находится весь органический мир, даже
наиболее древние его представители.
Среди других видов рода Clupeonella по своему распространению
особый интерес представляет Cl. abrau. Этот вид встречается в небольшом
пресноводном озере Абрау и, кроме того, в качестве особого вида (С1.
muhlisi), идентичного Cl. abrau или самое большее являющегося формой
этого вида, описан из пресноводного озера Абулионд (басе. Мраморного
моря).
О реликтовом характере оз. Абрау, расположенного на значительной
(70 м) высоте над современным уровнем Черного моря, высказался первый
исследователь его Кричагин (1877 : 14). Его точка зрения была
поддержана и подкреплена новыми фактами рядом других исследова-
телей (Чернявский, 1879 : XI; Совинский, 1903 : 36; Державин,
1924 : ИЗ; 1925 : 10; Фадеев, 1925 : 13; Малятский, 1930 : 70; Водяниц-
кий, 1930 : 132), изучавших фауну оз. Абрау. Правда, высказывались
и иные взгляды на происхождение этого озера (Скориков, 1904 : XIX;
Арнольди, 1922 : 47), однако против них были сделаны серьезные возра-
жения, и реликтовый характер фауны оз. Абрау в настоящее время более
не оспаривается. Наличие в оз. Абрау некоторых форм с определенно'
выраженным реликтовым характером и среди них в особенности Cl. abrau
приводит к необходимости признать фауну этого озера за реликтовую.
ГЕОГРАФИЧЕСКОЕ РАСПРОСТРАНЕНИЕ
67
Относительно времени, когда оз. Абрау потеряло связь с морским
солоповатоводным бассейном, высказывались предположения, что это
могло произойти в начале плиоцена (связь с понтическим озером-морем;
Малятский, 1930 : 73) или в постплиоценовое, а может быть, и в более
позднее время (Державин, 1924). Геологическое строение Абрау-
ского п-ова не дает указаний на непосредственную связь оз. Абрау
с древним солоноватоводным морем (Ивченко, 1923), однако Держа-
вин (1924) на основании нахождения к юго-востоку от Новороссийска
(между Геленджиком и Джубгою) и далее постплиоценовых террас
с остатками современных каспийских моллюсков и средиземноморских
Balanus считает, что реликтовый характер озера не стоит в противоречии
с геологическими фактами.
Большинство форм оз. Абрау, которые по происхождению своему
связаны с морем (Heterope caspia, Ectinosoma abrau, Gammarus robustoi-
des, Corophium curvispinum, Jaera nordmanni, Mesomysis kovalevskyi,
Theodoxus fluaiatilis abrauensis, Clupeonella abrau), будучи в основной
своей массе автохтонными реликтами понтического озера-моря, имеют
довольно широкое распространение помимо оз. Абрау. Эндемичным
считается лишь Th. jluviatilis abrauensis, причем Водяницкий
(1930 : 133), со слов В. И. Жадина, указывает, что он чрезвычайно бли-
зок к встречающемуся в солоноватых частях Аральского, Каспийского,
Азовского и Черного морей Th. pallasi (=Neritina liturata Eichw.), кото-
рого Жадин (1933 : 184) считает родоначальной формой Th. danu-
bialis. Th. fluviatilis abrauensis является вообще формой мало изученной,
обладающей рядом промежуточных признаков между Th. jluviatilis и
Th. danubialis, вследствие чего Жадин (1933 : 184) относит его
частично к последнему виду. Что касается Cl. abrau, то он не может счи-
таться эндемичным потому, что, как указывалось выше, найден ив оз.
Абулионд. По ряду морфологических особенностей, положенных в основу
системы семейства и отдельных видов, Cl. abrau относится к числу наи-
более примитивных видов рода и наиболее близок не к встречающемуся'
также и в Черном и Азовском морях виду Cl. delicatula, а к видам, встре-
чающимся только в Каспийском море (см. стр. 14).
Геологических указаний на былую связь оз. Абрау с морским бас-
сейном, как уже указывалось, нет, точно так же как не известно и время,
когда в него проник Cl. abrau. Однако все изложенное выше все же дает
возможность относительно этого высказать некоторые соображения.
Из числа нескольких предположений, которые можно высказать на этот
счет, наиболее вероятно то, что форма, давшая Cl. abrau, заселила озера
Абрау и Абулйонд на самых ранних этапах видообразования, до об-
разования современных видов рода, так как в противном случае оз.
Абрау, несомненно, оказалось бы заселенным формой, наиболее близкой
к прибрежному и евригалинному виду — Cl. delicatula, который при на-
личии подходящих условий образует пресноводные формы (m. tsharcha-
lensis). Далее, можно предполагать, что проникновение формы, давшей
начало Cl. abrau в оз. Абрау, произошло, повидимому, во время одного
из соединений Черного и Каспийского морей, так как при повышении
современного уровня Черного моря до уровня оз. Абрау долина р. Ма-
ныча должна была бы быть затопленной, вследствие чего эти моря
соединились бы друг с другом. Такие условия после понтического
озера-моря позднее были, как указывалось выше, в акчагыльское,
ашперонское, а в четвертичный период в бакинское и послехвалынскоег
время (Колесников, 1940 : 928; Архангельский и Страхов, 1938 -
5*
68
ВВЕДЕНИЕ
165—192). Один из примитивных видов одного из этих времен и дал
начало Cl. abrau, который в условиях изоляции сохранил ряд осо-
бенностей, свойственных наиболее примитивным видам рода, причем
у него выработались своеобразные и биологические особенности (см.
стр. 208—209).
БИОЛОГИЯ1
Биологическими особенностями сельдевых, как указывалось в двух
предыдущих разделах, в значительной мере обусловлено их географи-
ческое распространение и пути расселения, точно так же как в известной
степени с биологическими же особенностями связаны и систематические
отношения сельдевых. Биологические особенности обусловливают и
характер хозяйственного использования сельдевых — места, время и
способы лова. Не менее важное значение для промысла имеет ряд других
рассматриваемых ниже биологических особенностей.
Почти каждую из рассматриваемых ниже биологических особенно-
стей во взаимоотношениях со средой, как то: отношение к температуре,
солености, глубине и др., имеет известный размах колебаний между край-
ними пределами, к которым приспособлен какой-либо вид. У одних видов
этот размах колебаний более, у других менее широк; наименее узок он
в период размножения, и в сущности характером отношения к основным,
факторам среды в этот период и определяется в значительной мере как
биологический облик вида, так и ряд других его особенностей, в част-
ности ареал (Световидов, 1949) и характер промысла.
Отношение сельдевых к температуре и солености охарактеризовано
отчасти выше (стр. 35—38, табл. 11).
По отношению к температуре семейство довольно разнородно, однако
в основном, по преобладающему большинству представителей, его сле-
дует считать достаточно теплолюбивым, так как подавляющее количество
сельдевых, как указывалось, является тропическими формами.
По общему характеру отношения к температуре сельдевых следует
отнести к наиболее евритер лным семействам костистых рыб. Действительно
среди морских рыб распространение большинства тропических семейств
ограничено тропиками, и лишь немногие из них встречаются в морях
субтропических и более высоких широт. Сельдевые благодаря широкой
евритермности семейства в целом являются единственным семейством
среди костистых рыб, распространение которого охватывает моря почти
всех широт, исключая высокоарктические.
Сельдевые встречаются даже при отрицательных температурах воды.
При таких температурах держатся в зимнее время, и отмечено даже на-
чало нерестовых подходов малопозвонковых форм Clupea harengus
(например у Cl. harengus pallasi n. maris-albi, Cl. harengus pallasi). Это
один из самых холодолюбивых видов семейства, ряд форм которого
зимнее время проводит подо льдом. Указать верхний предел температуры,
при которой встречаются сельдевые, затруднительно, так как наиболее
теплолюбивые, тропические, виды в этом отношении почти не изучались.
У Cl. harengus по сравнению с другими сельдевыми и икрометание про-
исходит при наиболее низкой температуре воды: у малопозвонковых
форм, в частности у Cl. harengus pallasi, нерест начинается при 2°,
1 В этом разделе содержится мало ссылок на литературные источники, так как
затрагиваемые вопросы более подробно изложены в «Систематической части», где
цитирована и относящаяся к ним литература.
БИОЛОГИЯ
69
а у некоторых форм (Cl. harengus pallasi n. maris-albi}— начиная от 0°,
а все развитие икры протекает при температуре от 0 до 5°. Многопозвон-
ковые формы Ch. harengus размножаются при несколько более высокой
температуре, причем у Cl. harengus harengus нерест осенних сельдей
происходит при более высокой температуре воды, чем весенних. Икро-
метание осенних сельдей происходит при температуре до 14°. Нерест
сельдевых, размножающихся в пресных водах, проходных и пресно-
водных, происходит при температуре воды, значительно более высокой,
чем морских. В качестве примера приведем роды Sprattus и Alosa, зани-
мающие в море приблизительно одинаковый в меридиональном направ-
лении ареал, S. sprattus phalericus размножается в Черном и Адриати-
ческом морях при температуре 6—10°, A. fallax nilotica — в реках Ита-
лии при 22—25°. Ареал Sardinops sagax в северной части Тихого океана
расположен несколько южнее, чем ареал A. sapidissima у тихоокеанских
берегов Сев. Америки (см. рис. 23 и 27), однако нерест первой происхо-
дит при более низкой температуре, чем нерест второй. Калифорнийская
сардина (S. sagax caerulea), как и дальневосточная (5. sagax melanosticta),
нерестует в основном при 13—15°, A. sapidissima — при 14—18°. При еще
более высокой температуре протекает размножение и развитие икры Hilsa
reeversii, встречаемо’й в южной части ареала (от Хайнана до Манчжурии)
S. sagax melanosticta. Развитие икры Н. reeversii происходит при 28°, между
тем как икра ряда других сельдевых погибает при значительно более низ-
кой температуре. Это различие в температурах икрометания и развития
икры морских, с одной стороны, и пресноводных и проходных сельдевых,
с другой, обусловлено более высокими температурами в пресных водах
по сравнению с температурами воды в морях тех же широт и является
важным биологическим приспособлением. Пелагическая икра сельдевых
в большей степени подвержена гибельным воздействиям в реке, чем
в море. Развитие же икры при высокой температуре, как известно, про-
исходит быстрее, чем при низкой. Таким образом, более быстрое разви-
тие икры сельдевых в пресных водах является крайне важным приспо-
соблением, способствующим уменьшению гибели ее при развитии, а сле-
довательно, и обеспечению численности вида.1
Всякое изменение температуры воды оказывает весьма существен-
ное влияние на сельдевых. В частности Clupea harengus harengus крайне
чутко реагирует даже на ничтожное изменение температуры воды до
0.2° (Shelford a. Powers, 1915). Особенно резко влияет на сельдевых
быстрое понижение температуры. Так, Sardinops sagax melanosticta при
быстром понижении температуры воды погибает при 6°, при медленном
же выживает и при 4° и даже при 2°. Сезонные изменения температуры,
под влиянием которых рыбы перемещаются в другие районы моря или
в другие слои по вертикали, обусловливают в основном миграции сель-
девых, их вертикальное распределение, места и время размножения,
многочисленные примеры чего приведены в описании биологии каждого
вида и формы сельдевых в «Систематической части». Изменения темпе-
ратурного режима моря в отдельные годы или под влиянием изменения
режима океанических течений более длительные, на протяжении ряда
лет, вызывают существенные изменения в распространении, а также и
1 Для икры, откладываемой на дно или другой субстрат, наоборот, условия раз-
вития в море неблагоприятны вследствие обилия здесь врагов ее. Условия для раз-
вития такой икры более благоприятны в рекзх, чем и обусловлены анадромные нере-
стовые миграции (Васнецов, Зоолог, журн., XXIII, 5, 1944:198—211; см.
также: Крыжановский, Тр. Инет, морфол. жив., I, 1948).
70
ВВЕДЕНИЕ
в состоянии численности отдельных видов и форм сельдевых. Изменение
температурного режима моря в отдельные годы оказывает влияние на
урожайность поколений этих лет. Так, поколения Clupea harengus pal-
lasi n. maris-albi в годы с низкой температурой воды Белого моря отли-
чаются большой численностью и рядом других особенностей, поколения
годов с более высокой температурой — малой численностью. В более
теплые годы в Белое море происходит в большем количестве заход С1.
harengus harengus, подвида более теплолюбивого, чем предыдущий. Осо-
бенно существенное влияние оказывают длительные изменения темпе-
ратурного режима моря. Так, в 1941—1942 гг. под влиянием похолодания
центральной части Японского моря катастрофически снизились в наших
водах уловы дальневосточной сардины (Sardinops sagax melanosticta),
являвшейся до этого важнейшей промысловой рыбой, а в 1943—1944 гг.
она встречалась лишь единично. Исчезновение сардины под влиянием
похолодания положило конец неясности в вопросе о том, была ли она
в наших водах в промысловых количествах ранее 1925 г., когда начался
ее промысел, или она пришла сюда вследствие наблюдавшегося в эти годы
потепления (см. стр. 185). Эти изменения температурного режима моря
оказали существенное влияние на распространение и численность и тихо-
океанской сельди (Clupea harengus pallasi), в частности ловимой у берегов
южной части Сахалина и у Хоккайдо (южносахалинско-хоккайдская
сельдь). Потепление, начавшееся в 1922—4923 гг., вызвало перемещение
южносахалинско-хоккайдской сельди из южных частей ареала в вос-
точные (зал. Анива) и отчасти северные (западное побережье южной
части Сахалина). Численность и общие уловы ее при этом не изменились,
так как уменьшению уловов в одних районах сопутствовало увеличение
их в других. Однако уловы к концу этой эпохи потепления резко снизи-
лись во всех промысловых районах. Наступление следующей эпохи похо-
лодания обусловило некоторое увеличение численности южносахалинско-
хоккайдской сельди, но сравнительно небольшое, так как меньшее коли-
чество нерестовой сельди вследствие небольшой численности ее не могло
дать таких поколений, которые давала эта сельдь в годы большой числен-
ности.
В теснейшей зависимости от температуры воды на- ранних стадиях
развития личинок находится и количество позвонков у сельдевых, как
и у всех других рыб. Как известно, средние числа позвонков у поколений
разных годов одной и той же сельди различаются, хотя и в небольшой
степени. Установлено (Rounsefell a. Dahlgren, 1932; Tester, 1938), что
среднее число позвонков находится в зависимости от температуры воды,
при которой происходит развитие личинок: у поколений сельди в годы
с низкой температурой воды в период развития личинок среднее число
позвонков больше, у поколений годов с более высокой температурой —
меньше. Этой зависимостью количества позвонков от температурных усло-
вий в период развития личинок объясняется и кажущееся на первый
взгляд противоречие общему правилу распространение у Clupea haren-
gus harengus многопозвонковэго и малопозвонкового подвидов. Известно,
что как среди морских рыб северные роды и виды имеют большее коли-
чество позвонков, чем южные, так и внутри вида у северных и океани-
ческих форм количество позвонков обычно также больше, чем у более
южных и. прибрежных (сводку этого вопроса см. у Расса, 1941). У С1.
harengus наблюдается обратное — малопозвонковые формы, в частности
Cl. harengus pallasi n. maris-albi и Ch. harenguspallasi n. suworowi, имеют
более северное распространение, чём многопозвонковые. Хотя икроме-
БИОЛОГИЯ
71
тание многопозвонковых сельдей и происходит при более высокой темпе-
ратуре воды, чем малопозвонковых, однако вследствие того, что икра их
•откладывается на значительной глубине и в отдалении от берегов, где
температура воды на протяжении длительного периода развития икры
меняется мало, развитие личинок происходит при температуре, мало
отличающейся от температуры нереста. У малопозвонковых сельдей,
несмотря на то, что они нерестуют при более низкой температуре, разви-
тие личинок в узко прибрежной области, где они откладывают икру,
в условиях быстрого прогревания и нарастания здесь температуры воды
происходит при более высокой температуре, чем у многопозвонковых.
Более высокие температурные условия, при которых происходит разви-
тие личинок и формирование позвоночника малопозвонковых сельдей,
и обусловили на протяжении длительного периода существования нали-
чие у них меньшего числа позвонков, несмотря на более северное распро-
странение, чем многопозвонковых. У Cl. harengus harengus икрометание
осенних сельдей, как указывалось выше, происходит при более высокой
температуре воды, чем весенних, однако позвонков у них меньше, чем
у последних. Обусловлено это тем, что, несмотря на более высокую темпе-
ратуру нереста, развитие личинок осенних сельдей происходит зимой или
поздней осенью уже в сильно охлажденной воде, развитие же весенних —
в условиях слабо нарастающей или неизменной температуры воды.
Наиболее различно отношение сельдевых к солености. Несмотря на зна-
чительное преобладание морских видов, количество которых превышает
половину общего числа их, среди сельдевых имеется также большое коли-
чество как проходных, так и пресноводных (табл. 11). В этом отношении
сельдевые почти не имеют себе подобных среди других семейств кости-^
стых рыб. Так, среди морских рыб преобладающее большинство семейств
является- исключительно морскими или отчасти и солоноватоводными,'
размножение преобладающего большинства их, если даже представители
некоторых из них и заходят в пресные воды, происходит в морской воде.
Точно так же и среди пресноводных рыб большинство семейств является
чисто пресноводными, ряд видов и даже родов некоторых семейств
является проходными, и лишь немногие виды некоторых семейств живут
и размножаются в солоноватой воде. Из числа семейств, обитающих
в основном в море, но представленных также и в пресных водах, можно
назвать сем. Cottidae, Gobiidae и Osmeridae. Первое семейство имеет прес-
новодные виды и роды, второе — только виды, последнее — формы про-
ходных видов. Проходные виды имеет лишь последнее семейство, у двух
первых их нет. Сем. Clupeidae, представленное в пресных водах большим
количеством видов и родов, чем первые два семейства, имеет значительно
большее количество и проходных видов и родов, чем последнее. Из дру-
гих евригалинных семейств укажем сем. Atherinidae и Mugilidae.
Особенно характерен для сельдевых рассмотренный в предыдущей
главе разнородный и смешанный характер по отношению к солености
не только семейства в целом, но и отдельных родов и даже видов, причем
некоторые виды и формы и сами по себе являются в значительной сте-
пени евригалинными. Из числа таких видов укажем Alosa caspia, одни
формы которого (И. caspia salina) живут и размножаются в море, встре-
чаясь местами (в зал. Мертвый Култук) при содержании солей до 34.1—
35.8%о, другие (Л. caspia caspia и др.) —- как в пресной, так
и в солоноватой воде. Clupeonella delicatula caspia также живет и раз-
множается как в солоноватой воде в море, так и в пресной. Не имея воз-
можности выйти из волжских затонов и ильменей в море, Cl. delicatula
72
ВВЕДЕНИЕ
caspia остается в них на зиму, причем пресноводная форма (m. tscharcha-
lensis) живет постоянно в оз. Чархал.
При переходе проходных сельдей из морской воды в пресную осмо-
тическое давление крови у них падает. Благодаря этому разница между
осмотическим давлением крови и воды в морс и в реке остается прибли-
зительно одинаковой, у Alosa caspia caspia равная 0.666—0.671. Эта раз-
ница несколько увеличивается, достигая своего максимума (до 0.747),
на границе между морской водой и пресной, и стимулирует регулятор-
ный механизм, позволяющий рыбе существовать как в соленой, так и
в пресной воде. Регуляторный механизм начинает функционировать не
сразу, а спустя некоторое время (Бетешева, 1938), и вследствие этого
происходит задерживание и скопление проходных сельдей на гра-
нице морской воды и пресной, что имеет важное значение для про-
мысла.
Сельдевые ’являются пелагическими рыбами поверхностных слоев
воды. Однако почти все представители семейства, более или менее изу-
ченные в этом отношении, в определенные периоды жизни и при некото-
рых условиях опускаются на глубины, иногда довольно значительные.
В частности, Clupea harengus harengus опускается на глубины до 300 м,
Sardinops sagax melanosticta находили в желудках рыб {Scombrops chilo-
dipteroides, Pterothrissus gisu и др.), выловленных на значительных глу-
бинах. Нахождение сельдевых на различных глубинах в разные сезоны
и в разные периоды их жизни обусловлено в основном температурой
воды. Так, тихоокеанская сельдь {Clupea harengus pallasi) весной, по
мере прогревания поверхностных слоев воды и по мере созревания поло-
вых продуктов, подымается в поверхностные слои воды из более глубо-
ких, где она находилась зимой. Более теплолюбивая дальневосточная
сардина {Sardinops sagax melanosticta), наоборот, в начале лета держится
в узко поверхностном и более прогретом слое воды. В дальнейшем, с про-
греванием глубоких слоев воды она распространяется и глубже, зани-
мая больший по вертикали горизонт воды. Равным образом ряд
сельдевых при повышении температуры поверхностных слоев воды выше
известного для каждого вида предела опускается в нижние горизонты
с более низкой температурой. Нахождение сельдевых на разных глуби-
нах на протяжении суток обусловливается вертикальными миграциями
пищи — планктона, вызванными, в свою очередь, влиянием света. Для
ряда планктоноядных сельдевых установлено, что в темное время суток
они держатся в поверхностных слоях воды, опускаясь днем в более глу-
бокие горизонты.
Влияние света обусловливает не только вертикальные суточные мигра-
ции, но в значительной степени и половое созревание сельдевых. Так,
например, интенсивное развитие половых желез каспийских сельдей из
рода Alosa начинается с марта месяца, когда температура воды по срав-
нению с зимними месяцами не изменяется, а интенсивность солнечного
сияния резко возрастает (Смирнов, 1946). В связи с влиянием солнеч-
ного освещения на сельдевых следует отметить воздействие на них
света, испускаемого искусственными источниками освещения. Свойство-
сельдевых положительно реагировать на свет применяется для лова неко-
торых из них. В .последнее время этот вопрос, имеющий перспективы
использования его промыслом, успешно разрабатывается на ряде сельде-
вых (виды рода Clupeonella, Sprattus sprattus и др.) и уже дал положи-
тельные результаты (ссылки на литературу см. при описании указан-
ных видов).
БИОЛОГИЯ 73
Сельдевые, подобно ряду других рыб, обладают хорошо развитым
электротаксисом. Так, Clupea harengus harengus в условиях опыта в ого-
роженных участках моря или в заливах весьма чутко реагирует на элек-
трический ток, поворачиваясь головой в сторону анода и перемещаясь
в электрическом поле постоянного тока только в этом направлении,
причем стаи можно удерживать на месте или передвигать в определенном
направлении. Сельдь реагирует на электрический ток при широком коле-
бании градиентов потенциала электрического поля от ничтожных до
высоких, наиболее сильно при последних. В недавнее время обнаружено,
что в морях существует природный электрический ток, при этом уста-
новлено, что электрический ток в море течет непрерывно, сохраняя неко-
торое постоянство преимущественного направления и имея суточную
периодичность колебания в усиленном развитии быстрых пульсаций
в часы, близкие к полудню, и в некотором повышении их вечером. Элек-
трические токи в море имеют большую плотность, вполне достаточную
для воздействия на сельдь. Этот факт (Миронов, 1948), повидимому,
поможет объяснить некоторые еще недостаточно ясные стороны биологии
сельдевых и других морских рыб, в частности причины заходов летней
и жирной сельди в губы. Установлено, что разные виды рыб неодинаково’
чувствительны к электрическому току, причем более чувствительны виды,
обладающие более развитой сетью нервных окончаний в коже (Бодрова
и Краюхин, 1948; Краюхин и Литвинова, 1950).
Преобладающее большинство сельдевых планктоноядные, сравни-
тельно немногие из них хищники. К числу планктоноядных относятся
виды, имеющие наибольшее хозяйственное значение: тихоокеанская
сардина (Sardinops sagax), океаническая сельдь (Clupea harengus), из
каспийских сельдей каспийский пузанок (Alosa caspia) и др. Некоторые
из планктоноядных сельдей, в частности волжская сельдь (Alosa kes-
sleri volgensis), питаются отчасти и мелкой рыбой. К числу хищных сель-
дей, питающихся рыбой, относятся преимущественно крупные виды
(Л. kessleri kessleri, A. brashnikovi), хотя все же самые большие по раз-
мерам сельди являются планктоноядными (например A. sapidissima).
Характер питания, как известно, теснейшим образом связан со строением
жаберного аппарата сельдевых — у всех планктоноядных видов коли-
чество жаберных тычинок значительно больше, а зубы отсутствуют или
развиты менее, чем у хищных или у питающихся крупными ракообраз-
ными (например Alosa saposhnikovi). Связь с характером питания имеется
п в строении пищеварительного тракта. Так, например, количество пило-
рических придатков у каспийских сельдей из рода Alosa находится
и обратной зависимости от состава пищи, чем количество жаберных тычи-
нок: у планктоноядных видов пилорических придатков меньше, чем
у питающихся более крупной пищей хищных (Световидов, 1932). У де-
тритоядных представителей семейства, о которых говорится ниже, как
И у сходных по характеру пищи кефалей, желудок имеет мускулистую
Масть, подобную зобу птиц, кишечник длинный, расположенный в не-
сколько петель.
Среди планктоноядных многотычинковых сельдевых имеются и такие,
Которые в значительной степени питаются, кроме мелких планктонных
оргпнизмов, как взвешенным в воде, так, судя по строению рта (как
у лоща), и захватываемым со дна детритом, заглатывая вместе с ним и ил.
/КпГю| шые тычинки, которые отфильтровывают частгцы детрита и ила,
у птих сельдевых (род Dorosoma и, повидимому, другие представители
подсем. Dorosomatinae) особенно многочисленные и тонкие, как и у
ВВЕДЕНИЕ
кефалей, имеющих сходное питание; зубы отсутствуют. Многочисленные
жаберные тычинки не только отфильтровывают пищу, но, судя по всему,
играют также роль фильтра, предохраняющего жабры от засорения взве-
.шенными в воде детритными и иловыми частицами. Невидимому, этим
следует объяснить распределение в Каспийском море более многотычин-
ковых форм Alosa caspia у западных, а малотычинковых — у восточных
•берегов (рис. 9). В воды у восточных берегов Каспийского моря почти
никаких взвешенных частиц с суши не поступает, так как притоков здесь
нет. К западным же берегам моря большое количество детритных и ило-
вых частиц выносится из Урала и Волги и сносится течением вдоль кав-
казского побережья к югу. В южной части моря сюда поступают еще
•более мутные воды Куры. Невидимому, вследствие этого жаберных тычи-
шок особенно много у A. caspia knipowitschi, локализованной в самой юго-
-западной части Каспийского моря, меньше у Л. caspia caspia от запад-
ных берегов и менее всего у A. caspia persica и A. caspia salina от восточ-
ных берегов. Сходное распределение имеют и черноморско-азовские
формы A. caspia (рис. 9): более многотычинковая форма (Л. caspia nord-
.manni) живет в северо-западной части Черного моря, куда поступают
выносы из многочисленных впадающих сюда рек (подробнее см.: Свето-
-видов, 1950 : 421).
Интенсивность питания сельдевых на протяжении года неодинакова.
Так, Clupea harengus в период нереста не питается, питается весной перед
нерестом и особенно интенсивно летом после икрометания. В период
нереста не питается и ряд других сельдевых, в частности почти все виды
каспийских сельдей из рода Alosa.
Икринки преобладающего большинства сельдевых пелагические, пла-
вающие в поверхностных или в придонных слоях воды, у немногих
'(роды Clupea, Pomolobus') икра клейкая, приклеивающаяся к подводному
•субстрату. В придонных слоях воды происходит развитие икры боль-
шинства сельдевых, размножающихся в пресных водах, в частности про-
ходных сельдей из рода Alosa. Так, например, икринки Л. kessleri vol-
tgensis, имеющие удельный вес немного меньше единицы, в спокойной
БИОЛОГИЯ
75
воде лежат на дне, легко поднимаясь вверх при перемешивании ее.
В реке икринки этих сельдей находятся во взвешенном состоянии в при-
донных слоях воды, сносясь вниз течением. Развитие икры некоторых
пресноводных сельдевых (Clupeonella abrau) происходит в поверхностных
слоях воды. Плодовитость сельдевых в зависимости от размеров
колеблется в широких пределах. Наименьшей плодовитостью отличаются
мелкие по размерам виды, наибольшей — крупные. Наименее всего
икринок (от 525 до 2416, в среднем 1.4 тыс.) имеет Sprattus sprattus phale-
ricus, обычные размеры которого 60—80 мм, наибольшее (от 135 до 312,
в среднем 218 тыс.) — одна из самых крупных сельдей, A. kessleri kes-
sleri. Виды, размножающиеся в пресных водах, при приблизительно
равной величине имеют большую плодовитость, чем виды, икрометание
которых происходит в море. В частности, среди каспийских сельдей
у A. brashnikooi brashnikooi (размеры наичаще 20—35, максимально до
49 см), размножающейся в море, плодовитость равна в среднем около
66 тыс. икринок; у проходных же сельдей количество икринок таково:
у A. kessleri oolgensis (размеры наичаще около 27—29, наибольшие до 39 см)
в среднем около 179 тыс., а у A. kessleri kessleri (размеры наичаще около
36—44), как указывалось, значительно больше.1 Это различие в плодо-
витости сельдевых, размножающихся в море и в реках, имеет такое же
важное приспособительное значение для обеспечения численности вида,
как и отмеченные выше различия в температурах икрометания и длитель-
ности развития их икры: для сельдевых, размножающихся в реках,
в условиях большей возможности гибели развивающейся икры, боль-
шая плодовитость имеет крайне важное значение. Такое же значение
имеет и порционное икрометание, свойственное многим, если не преобла-
дающему большинству, или всем сельдевым, размножающимся как
в пресных водах, так и в море. Последовательное, а не одновременное
созревание и выметывание икры дает возможность вместить в полости тела
большее ее количество, чем при одновременном. Плодовитость видов,
имеющих приклеивающуюся икру, больше, чем видов с пелагической
икрой. Так, у Clupea harengus средние количества икринок в зависимости
от размеров подвидов колеблются от 6.9 до 72.2 тыс. У Sardinops sagax
melanosticta, несмотря на ее почти такие же размеры (15—24 см), как
у самых мелких форм Cl. harengus pallasi n. maris-albi (12—20 см), сред-
нее количество икринок больше (45 тыс.) по сравнению с некоторыми
даже крупными формами Cl. harengus.
Икрометание сельдевых происходит вблизи берегов, иногда у самого
берега или в заливах и бухтах. В открытых частях моря на большом
отдалении от берегов сельдевые как правило не размножаются. Места
и время икрометания сельдевых определяются по 1) нахождению теку-
чих или близких к зрелости особей, 2) наичаще по уловам оплодотво-
ренной икры, в зависимости от особенностей ее и условий нерестилищ,
и поверхностных или придонных слоях воды или у видов с клейкой
икрой по нахождению ее на дне, 3) по нахождению личинок на первых
стадиях развития, 4) у Clupea harengus, икра которой поедается пикшей,
но нахождению в желудках этой рыбы икры сельдевых. Места икроме-
тании сельдевых, размножающихся в море над небольшими глубинами
или с приклеивающейся икрой, расположены, за немногими исключе-
ниями, на жестких или полужестких грунтах. В частности, среди
1 Однако южиокаспийские формы A. brashnikooi созревают раньше, в подавляю-
щей массе в двухгодовалом возрасте, и поэтому их абсолютная плодовитость выше,
чем у проходных сельдей, созревающих позднее (см.: Замахаев, 1949 : 550).
76
ВВЕДЕНИЕ
каспийских сельдей из рода Alosa, размножающихся на небольших глу-
бинах, на местах с мягкими и илистыми грунтами размножается лишь
A. brashnikovi agrachanica. Точно так же и Cl. harengus откладывает икру
на илистые и песчано-илистые грунты в тех случаях (Cl. harengus haren-
gus), когда дно покрыто растительностью. Места икрометания сельдевых
размножающихся в пресных водах, в частности проходных из рода Alosa,
расположены как в реках, так и в их придаточных системах — в ильме-
нях, на полоях и пр. В этом отношении виды этого рода делятся на две
группы — реофильных и стагнофильных, соответствующих группам сель-
дей и пузанков. Сельди размножаются в основном в реках. Так, например,
исключительно по руслу Дона происходит икрометание Alosa kessleri
pontica. A. kessleri volgensis в низовьях Волги размножается в реках
дельты, а не в ильменях. Нерест A. kessleri kessleri происходит на значи-
тельном протяжении Волги как в местах с замедленным течением, так
и на стрежне и, кроме того, отчасти в затонах. В ильменях, на полоях,
в лиманах и пр. размножаются пузанки. Нерестилища A. caspia caspia
расположены в мелководной северной части моря, в основном в предустье-
вом пространстве Волги, отчасти в ильменях дельты Волги. A. caspia
tanaica мечет икру на разливах притоков Дона, в лиманах дельты Кубани,
отчасти перед устьями Дона. Таким образом, деление видов рода Alosa
на пузанков и сельдей соответствует и их биологическим различиям.
Следует отметить, что в реках с быстрым течением и, кроме того, с боль-
шой мутностью воды за счет неорганических взвесей размножения сель-
девых не происходит (мутность воды, вызываемая органическими взве-
сями, большой роли не играет), поэтому проходные сельди из рода Alosa
не идут для нереста в такие быстрые и мутные реки, как, например, Кура,
Кубань; небольшое их количество заходит в Урал, а в основном они
размножаются в Волге, а также в Дону, Днепре и других менее быстрых
и мут ых реках бассейна Черного моря.
Отношение сельдевых в период икрометания к температуре охарак-
теризовано отчасти выше. Здесь следует отметить, что развитие икринок
в естественных условиях происходит при оптимальных условиях, край-
ние пределы которых в условиях опыта значительно шире. В частности,
крайние пределы температуры нахождения икринок A. kessleri volgensis
в естественных условиях колеблются от 12.7 до 25—27°, в условиях же
опыта от 10.5—12 до 31—32°. При развитии икринок при низкой темпе-
ратуре воды размеры выклюнувшихся личинок больше и морфологически
они более развиты, чем личинки, вышедшие из икринок, развивающихся
при более высокой температуре. Например, в районе Исландии только
выклюнувшиеся личинки Clupea harengus harengus имеют длину около
6 мм, в более южных районах — около 5 мм. Длительность периода
развития икринок у представителей семейства, как указывалось, неоди-
накова. Наиболее длителен он у самого холодолюбивого вида — Clupea
harengus. При 0.1° икринки Cl. harengus harengus проходят развитие в те-
чение 47—50 суток, при наиболее высокой температуре — 14—19° — в те-
чение 6—8 суток. Продолжительность развития икринок Clupeonella
delicatala как в Каспийском, так и в Азовском морях при наиболее обыч-
ных и естественных условиях температуры воды в период разгара нереста
и развития икры (10—22°) колеблется от 98 до 25 час. У размножающейся
в море Alosa brashnikovi brashnikovi развитие икринок при температура
разгара нереста (около 17°) длится от 67 до 77 час., у проходной A. kes-
sleri kessleri при наиболее обычной температуре в период развития ее
икры в реке (около 19°) — в течение 49 час.
БИОЛОГИЯ
77
Отношение сельдевых к солености наиболее характерно проявляется
в период икрометания и развития икры. Ряд видов размножается в воде
с нормальной океанической соленостью, причем у некоторых икроме-
тание происходит даже при повышенном содержании солей. Так, напри-
мер, у Sardinella aurita нерест и развитие икры происходит в среднем
при солености 38°/00, у Sardina pilchardus pilchardus — в среднем при
35.27—36.14°/00, у S. pilchardus sardina в Средиземном море —при 36.55—
38.240/0(), но последний размножается и в Черном море при значительно
более низкой концентрации солей. Некоторые виды размножаются при
еще более широком колебании солености. Так, икрометание одних форм
Clupea harengus harengus происходит при нормальной океанической соле-
ности, других —- при пониженной до 8°/00. При еще более низкой концентра-
ции солей размножается Cl. harengus harengus n. membras. Развитие икринок
Cl. harengus pallasi n. maris-albi на нерестилищах протекает при солености
от 21.3 до 26.О'’/оо; развитие может происходить и при значительно более
высокой солености — до 43—46°/оо, но выживает при этом лишь неболь-
шая часть икринок. При понижении солености до 5°/00 икра Cl. harengus
harengus развивается вполне нормально, причем и в естественных усло-
виях вода на нерестилищах может быть почти пресной. Нормально идет
развитие икры и пересаженной из морской воды в пресную, но личинки
в пресной воде погибают в течение суток. К числу наиболее евригалин-
ных видов относятся виды рода Alosa. У A. caspia salina икринки в есте-
ственных условиях развиваются при содержании солей до 22.0—32.2°/00,
у A. caspia caspia — как в пресной, так и в солоноватой воде с концен-
трацией солей до 4—-6 и даже 8.4°/00. В условиях эксперимента икра этой
сельди развивается при 12.5°/00, и, вероятно, верхним пределом, при кото-
ром икринки гибнут, следует считать соленость 15°/0(). Таким же еври-
галинным видом является Clupeonella delicatula, икринки каспийской
формы которой развиваются как в пресной, так и в солоноватой воде
до 2О°/оо, при которой они гибнут. Хотя проходные виды сельдей и раз-
множаются в пресной воде, однако некоторые (например A. kessleri
volgensis) иногда выметывают икру и в солоноватой воде в море, где
развитие их протекает при солености 1°/оо, а личинок — при 9.5°/оо.
В условиях опыта икра этой сельди может развиваться при 20—ЗО°/оо-
Как показали эксперимзнтальные исследования, развитие икринок дру-
гого проходного вида этого рода (Л. sapidissima) наилучшим образом
происходит при содержании солей около 7.5°/оо.
Икра некоторых сельдевых имеет свойство развиваться партеногене-
тически. Так, например, неоплодотворенная икра Alosa kessleri volgensis,
помещенная в воду, проходит начальные стадии дробления, но при этом
наблюдаются некоторые аномалии в дроблении, и процесс этот идет
медленнее, чем у оплодотворенной икры. Неоплодотворенная икра раз-
вивается при 17—18° в течение 29 час. до стадии гаструляции, после
чего до стадии глазных бокалов идет ее разрушение (Соин, 1941). Икра
A. fallax lariana в слабых гипотонических растворах некоторых солей
и под действием в течение короткого времени (20—30 сек.) слабого тока
(2—3 вольта) развивается вполне нормально, возможно даже более быстро,
чем оплодотворенная, и из нее выходят личинки, не отличимые от личи-
нок, вышедших из оплодотворенной икры (Lestage, 1934).
На развивающуюся икру оказывают существенное влияние механи-
ческие воздействия — удар, падение и встряхивание. Особенно гибельно
действуют на икру в условиях опыта и в рыбоводных аппаратах удары
и падение. Встряхивание, имеющее место и в естественных условиях,
78
ВВЕДЕНИЕ
оказывает меньшее влияние. Наиболее чувствительна ко всем этим воз-
действиям у проходной сельди Alosa kessleri volgensis икра, развивающаяся
при температуре около 19°, близкой к температуре развития ее в есте-
ственных условиях, в первые часы после оплодотворения на стадии 16—
64 бластомеров, особенно на 2—3-м часу, и в дальнейшем на время перед
выклевыванием личинок, на 35—50-м часу (Строганов, 1939). В связи
с этим следует отметить, что первый чувствительный период развиваю-
щейся икры у проходных сельдей приходится на наиболее тихие ночные
часы, так как икрометание у этих сельдей происходит в вечернее время
при закате солнца и непосредственно перед и после него.
Многие из сельдевых совершают миграции, протяженность которых
у некоторых значительна. Ряд сельдевых ведет более или менее локаль-
ный образ жизни в пределах своего, иногда ограниченного ареала. Раз-
меры миграций бывают различны иногда даже у форм одного и того же
вида и подвида. Так, одни подвиды Alosa caspia (A. caspia knipowitschi,
A. caspia persica) почти не выходят за пределы южной части Каспийского
моря,''другие (A. caspia caspia, A. caspia salina) совершают миграции
значительной протяженности с мест зимовок в южной части моря в север-
ную для икрометания. В южной части Каспийского моря, почти не вы-
ходя за пределы его, обитает и большинство подвидов A. brashnikovi
(A. brashnikovi orientalis, A. brashnikovi kisselevitshi и др., всего 6 подви-
дов), другие (4. brashnikovi brashnikovi, A. brashnikovi agrachanica) идут
для размножения весной из Южной части моря в северную. Точно так же
одни подвиды Clupea harengus (Cl. harengus pallasi, Cl. harengus pallasi
,n. suworowi, Cl. harengus pallasi n. maris-albi) ведут более, другие (Cl.
harengus harengus) менее локальный образ жизни. Cl. harengus harengus
может служить примером разной степени миграций и у разных форм
подвида. Наибольшие по протяженности миграции из всех форм С1.
harengus harengus совершают атлантическо-скандинавские сельди, в част-
ности норвежская и мурманская сельди; более локальны сельди, напри-
мер, датских проливов.
Большая протяженность миграций свойственна, как указывалось
(см. «Система семейства и принципы классификации», стр. 18 и сл.), видам
и формам, наиболее прогрессивным по комплексу морфологических осо-
бенностей, положенных в основу системы.
Миграции сельдевых, как и других рыб, в основном связаны с раз-
множением или питанием. Примеры миграций первого рода приведены
выше. В качестве миграций второго рода следует указать на миграции
дальневосточной сардины (Sardinops sagax melanos icta), которая после
зимовки и икрометания в южной части Японского моря и у южных остро-
вов Японии с тихоокеанской стороны в начале лета идет на север до са-
мой северной части Татарского прол, и в Тихом океане в годы потепления
до восточного побережья Камчатки. Такие же обширные миграции со-
вершает и калифорнийская сардина (б1, sagax caerulea). Эти миграции от-
носятся к числу самых больших по своей протяженности.
Миграции, связанные как с размножением, так и с питанием, во всех
приведенных примерах, а также и у проходных каспийских сельдей из;
рода Alosa имеют меридиональное направление, с юга на север. Эти мигра-
ции имеют одну, общую почти всем им особенность: продвигаясь на север
вдоль берегов на некотором расстоянии от них, обычно в области морского
течения, эти сельди при наличии положительного градиента температуры
воды подходят в прибрежную область, где и. ловятся закидными и став-
ными неводами и другими орудиями лова.
БИОЛОГИЯ
79>
Существуют миграции и более длительные по времени, продолжаю-
щиеся в течение нескольких лет; они начинаются уже в личиночной;
стадии, и совершают их некоторые формы Clupea harengus harengus. Личин-
ки мурманской сельди по выходе из икры, откладываемой в некотором от-
далении от берегов, попадают в сферу действия Североатлантического
течения и уносятся вдоль берегов северной Норвегии и Финмаркена
на север и восток. В дальнейшем мальки и подрастающая сельдь уже
активно расселяются в центральных и восточных частях Варенцова моря,
заходят частично в Белое море. После первого икрометания мурманская
сельдь отходит к северу, к Шпицбергену. Приблизительно таков же
характер миграций и у норвежской сельди (подробнее см. в системати-
ческой части). Повидимому, подобные миграции совершают и некоторые'
формы Cl. harengus pallasi, но меньшей протяженности, и охватывают
лишь часть ее жизненного цикла, так как личинки этих сельдей по выходе'
из икры, откладываемой на небольшой глубине у самого берега, здесь,
же на местах икрометания и остаются до превращения в мальков. Лишь,
после этого, отходя от берегов и попадая в область морского течения,,
мальки расселяются в сфере действия этого течения, но, по понятным;
причинам, на меньшие расстояния от мест икрометания. Такие миграции,,
судя по всему, совершает южносахалинско-хоккайдская сельдь. Боль-
шинство остальных форм Cl. harengus pallasi проводит жизнь вблизи мест-
икрометания, занимая часто очень ограниченный ареал (подробнее см.
Световидов, 19496). Следует отметить, что миграции сельдевые, как и
другие рыбы, совершают в области морских течений, проходящих
вблизи мест нереста; в сфере влияния этих течений и совершаются
миграции. При этом миграции совершаются как против морского
течения, так и цо течению. Так, например, Alosa caspia caspia и
A. kessleri kessleri идут в северную, часть Каспийского моря в основном
вдоль западных берегов против течения, A. brashnikovi brashnikovi и
A: kessleri volgensis — как вдоль западных, так и вдоль восточных,
против течения.
Миграции сельдевых, а также в первую очередь характер питания;
обусловливают весьма важное в хозяйственном отношении различно
в численности отдельных видов и форм сельдевых.1 Как известно, одни
из видов и форм сельдевых отличаются большей численностью и являются'
важными в промысловом отношении, численность других не велика, и
эти виды и формы не имеют промыслового значения или оно незначительно.
К числу видов, отличающихся большой численностью и высокими уло-
вами, относятся тихоокеанская сардина {Sardinops sagax), океаническая'
сельдь (Clupea harengus), сельдь, известная под названием менхэден
(Brevoortia tyrannus), атлантическая сардина (Sardina pilchardus) и неко-
торые другие (см. «Хозяйственное значение», стр. 81 исл.). Все эти виды
но характеру питания являются планктоноядными. Ни одна из хищных
сельдей не является по численности и уловам рыбой первостепенного
промыслового значения. Равным образом и среди, например, каспийских
сельдей наибольшей численностью, а в связи с этим и наибольшими уло-
нпми, отличается планктоноядный каспийский пузанок (Alosa caspia).
Хищные, питающиеся в основном рыбой, бражниковские сельди (A. brash-
nikovi), несмотря на большое количество форм, имеют значительно мень-
шее промысловое значение. Точно так же из форм A. kessleri в значительно-
1 Этот вопрос рассмотрен более подробно в статье автора (О некоторых факторах,,
обусловливающих численность сельдевых), публикуемой в Трудах конференции по-
пон росам рыбного хозяйства.
80
ВВЕДЕНИЕ
большем количестве ловится в основном планктоноядная волжская сельдь
(A. kessleri volgensis), чем черноспинка (4. kessleri kessleri), питающаяся
главным образом рыбой. Таким образом, численность и промысловое
значение того или иного вида и формы сельдевых обусловливается в пер-
вую очередь характером питания, планктоноядным или хищным. Хищ-
ные сельди питаются в основном рыбой, которая, в свою очередь, пи-
тается планктоном. Планктоноядные же рыбы минуют это промежуточ-
ное звено в пищевой цепи.
Далее, среди планктоноядных сельдей обращает на себя внимание
то, что одни виды отличаются большей численностью, другие меньшей.
Это различие в численности планктоноядных сельдей обусловлено от-
части размерами ареала и нерестилищ, а в основном протяженностью
миграций. Наибольшую численность среди сельдевых имеют те виды,
ареал которых на/.более широк, что вполне понятно.. На первом месте
по уловам среди сельдевых и вообще в уловах мирового промысла стоит
тихоокеанская сардина {Sardinops sagax), занимающая обширный ареал
по ебе стороны северной части Тихого океана и в южном полушарии
у берегов Южн. Америки и Австралии и у берегов Африки в Индийском
океане (рис. 23). Однако в южной части Тихого океана промысел тихо-
океанской сардины не развит, а основная масса ее добывается в северной
его части, т. е. на ареале, значительно меньшем ареала океанической
сельди {Clupea harengus), широко распространенной в северных частях
Атлантического и Тихого океанов (рис. 14), но вылавливаемой в мень-
шем количестве. Таким образом, численность обусловливается не одними
размерами ареала, а также в значительной мере, как указывалось, и про-
тяженностью миграций. S. sagax совершает наибольшие по своему раз-
маху миграции. Находясь в зимнее время в южной части ареала, X. sagax
melanosticta, повидимому, питается и в это время, устремляясь затем
весной на север, где также усиленно откармливается после икрометания.
Таким образом, S. sagax melanosticta наиболее полно использует свой
ареал для нагула. Из форм Clupea harengus harengus, отличающихся
большой численностью, следует отметить упомянутых выше норвежскую
и мурманскую сельдь, которые, занимая значительный ареал, совершают
в пределах его, как указывалось, миграции большой протяженности.
Наибольшей численностью из всех форм Cl. harengus pallasi отличается
южносахалинско-хоккайдская сельдь, которая, судя по всему, также,
как уже отмечалось, на протяжении жизненного цикла совершает мигра-
ции. Большинство форм Cl. harengus pallasi, если не все остальные, ведет
локальный образ жизни в пределах ограниченного ареала, и численность
их не велика. Из каспийских подвидов Alosa caspia наибольшей числен-
ностью отличается A. caspia caspia, совершающий, как указывалось,
миграции в северную часть моря, где после икрометания остается в тече-
ние некоторого времени и для нагула. Не совершающие таких миграций
южно-каспийские подвиды (A. caspia knipowitschi, A. caspiapersica)по чис-
ленности значительно уступают A. caspia caspia. Равным образом среди
подвидов A. brasknikovi наибольшей численностью отличается A. brashni-
kovi brashnikovi, совершающий, подобно A. caspia caspia, миграции в се-
верную часть моря; уловы южнокаспийских подвидов A. brashnikovi
значительно ниже уловов A. brashnikovi brashnikovi.
Наибольшая численность свойственна, как указывалось (см. «Система
семейства и принципы классификации», стр. 19), видам и формам, наи-
более прогрессивным по комплексу морфологических особенностей,
положенных в основу системы.
ХОЗЯЙСТВЕННОЕ ЗНАЧЕНИЕ £/
ХОЗЯЙСТВЕННОЕ ЗНАЧЕНИЕ1
Сельдевые имеют наиболее важное значение в промысле, занимая по
величине улова первое место среди рыб. В 1936—1937 гг. общий улов
сельдевых составлял 63.4 млн ц, или 37.3% мирового улова рыбы.
Наибольшее значение в уловах сельдевых, а вместе с тем и в общих
мировых уловах имела тихоокеанская сардина (Sardinops sagax), зани-
мавшая по величине улова первое место среди промысловых рыб. Уловы
тихоокеанской сардины, вернее двух ее подвидов северной части Тихого
океана, в 1936—1939 гг. колебались от 27.3 до 34.8 млн ц, составляя
около 43—-55% мировой добычи сельдевых. Из этого количества у бере-
гов юго-восточной Азии (дальневосточная сардина — A. sagax melano-
sticta) добывалось 21.7—27.9 млн ц, у берегов Сев. Америки (калифорний-
ская сардина — A. sagax caerulea) — 5.5—7.3 млн ц.
Второе место по величине улова среди сельдевых и вообще среди про-
мысловых рыб занимает атлантическая сельдь (Clupea harengus harengus),
которой в 1936 г. было добыто 16 млн ц, что составляет около 25 % общего
улова сельдевых. У берегов Европы из этого улова поймано 15.2 млн ц,
у берегов Сев. Америки — 0.8 млн ц.
Третье место по уловам среди сельдевых и четвертое в уловах миро-
вого промысла занимает тихоокеанская сельдь (Clupea harengus pallasi).
Уловы тихоокеанской сельди в 1936—1939 гг. колебались от 4 до 6.4 млн ц,
из которых 1.4—1.8 млн ц поймано у берегов Сев. Америки. В среднем
уловы тихоокеанской сельди составляют около 12% общего улова сель-
девых.
Существенное значение в уловах сельдевых имеет сельдь, ловящаяся
у атлантических берегов Сев. Америки и известная под названием мен-
хэден (Brevoortia tyrannus). Уловы этой сельди в 1936 г. достигали
.2.65 млн ц, или около 4.2% улова всех сельдей.
Почти такие же уловы дает и атлантическая сардина (Sardina pilchar-
dus), которой в 1936 г. добыто свыше 2.5 млн ц, т. е. около 3.9% общего
улова всех сельдей. Из этого количества в Атлантическом океане (A. pil-
chardus pilchardus) вылавливалось около 2.26 млн ц (1936 г.), в Среди-
земном море (A. pilchardus sardina) — 0.32—0.35 млн ц.
Весьма существенное значение в уловах мирового промысла сельде-
вых имеет салака (Clupea harengus harengus n. membras), которой добы-
валось около 0.79 млн ц, что составляет около 1.2% улова всех сельдей.
Из сельдевых, имеющих меньшее значение в уловах мирового про-
мысла, следует отметить шпрота, или кильку (Sprattus sprattus), уловы
которого не превышают 0.51 млн ц, т. е. 0.9% общего улова сельдей.
Уловы преобладающего большинства сельдевых, вылавливаемых как
мировым, так и нашим промыслом, кроме упомянутых выше, менее зна-
чительны и существенной роли в мировых уловах не имеют. Однако уловы
некоторых из сельдей, добываемых только в наших водах, имеют до-
вольно существенное значение и в мировых уловах.
Основная масса общего улова сельдевых, около 65% его, добывалась
в Тихом океане и в прилегающих к нему морях, значительно меньшая
часть (немного больше 30%) — в Атлантическом океане со смежными
морями. Сравнительно небольшая часть сельдевых вылавливается в соло-
новатых и пресных водах.
1 Цифры уловов как в этой главе, так и в «Систематической части» взяты из
книги «Промысловые рыбы СССР» и у Расса (1948).
6 Фауна СССР — 314
ВВЕДЕНИЕ
Общий улов сельдевых в СССР в • годы, предшествовавшие Великой
Отечественной войне, достигал в среднем свыше 3.5 млн ц, что составляет
около 6% мирового улова сельдевых и около1 24% общего- улова рыбы
СССР.
В уловах сельдевых СССР, так же как и в мировых, на первом месте
стояла дальневосточная сардина (Л1, sagax melanosticta), которая, однако,
в общих наших уловах занимала пятое место. Уловы тихоокеанской
сардины в 1931—1940 гг. колебались от 959 до 1397 тыс. ц. С 1943 г.
эта рыба, как известно, ловиться перестала.
Большое значение в уловах СССР имеет тюлька (CZ. delicatula),
которая в наших общих уловах сельдей занимает второе место.
Уловы азовской тюльки (Cl. delicatula delicatula} в 1936-—1938 гг. до-
стигли 749—832 тыс. ц; каспийской (CZ. delicatula caspia} вылавливалось
значительно меньше, в 1931 г. 169 тыс. ц.
Весьма существенное значение в уловах сельдевых СССР имеет океа-
ническая сельдь (Clupea harengus), общий улов которой в годы, предшест-
вовавшие Великой Отечественной войне, занимал в наших уловах одно
из первых мест, уступая первенство дальневосточой сардине лишь в неко-
торые годы. В наибольшем количестве из подвидов этой сельди вылавли-
вается тихоокеанская сельдь (CZ. harengus pallasi), уловы которой
в 1936—1940 гг. составляли от 425 до 523 тыс. ц, занимая но- величине
улова третье место. Уловы остальных подвидов океанической сельди
несколько менее значительны. Мурманской сельди (Cl. harengus harengus}
в год наибольшего захода (1935) добыто 975 тыс. ц, в 1939 г. — 162 тыс. ц,
в другие годы меньше. Балтийской сельди, или салаки (CZ. harengus
harengus n. membras), в 1937 г. в пределах теперешних государственных
границ поймано 230 тыс. ц. Уловы беломорской сельди (CZ. harengus pal-
lasi n. maris-albi) в 1933—1946 гг. колебались от 13 до 36 тыс. ц. Чёшеко-
печорской сельди (CZ. harengus pallasi n. suworowi) в 1937—1939 гг.
вылавливалось 1.5—5.6 тыс. ц.
Каспийско-черноморские сельди, составлявшие когда-то основную
массу добываемых в наших водах сельдей, в недавнее время по вели-
чине общего улова стояли на третьем месте после океанической сельди и
тихоокеанской сардины.
На первом месте среди каспийско-черноморских сельдей по величине-
улова стоит каспийский пузанок (Alosa caspia caspia), который занимает
видное (третье-четвертое место) и среди других форм сельдей. В 1936—
1939 гг. уловы каспийского пузанка колебались от 56 (1936 г.) до 750-
(1939 г.) тыс. ц. Другие формы каспийского пузанка ловятся в значитель-
но меньшем количестве и обычно учитываются вместе с основной формой.
Уловы черноморско-азовских форм этого вида незначительны.
Приблизительно в таком же количестве -вылавливаются проходные
сельди. За период времени с 1936—1939 гг. волжской сельди (A. kessleri
volgensis) вылавливалось от 75 (1936 г.) до 691.7 (1939 г.) тыс. ц, черно-
спинки (A. kessleri kessleri) от 13.7 до 57.5 тыс. ц, азовско-черномор-
ской сельди (4. kessleri pontica) от 52.3 до 76.9 тыс. ц.
Бражниковские сельди (A. brashnikovi) играют в уловах меньшую
роль. Основная масса уловов этих сельдей приходится на долгинскую
сельдь (4. brashnikovi brashnikovi), которой в 1936—1939 гг. вылавлива-
лось от 73.9 до 126.9 тыс. ц. В небольшом количестве добывается агра-
ханская сельдь (A. brashnikovi agrachanica)', уловы ее в 1935—1940 гг.
составляли от 3.2 до 16.1 тыс. ц. Гасанкулинская сельдь (4. brashnikovi
kisselevitshi) за период времени с 1934 по 1938 гг. вылавливалась в коли-
ХОЗЯЙСТВЕННОЕ ЗНАЧЕНИЕ 83
честве от 3 до 29.5 тыс. ц. Остальные формы этого вида вылавливаются
еще в меньшем количестве.
Большеглазый пузанок (4. saposhnikovi) имеет еще меньшее значе-
ние, чем бражниковские сельди; в 1936—1939 гг. уловы его колебались
от 38 до 88 тыс. ц.
Шпрот, или килька {Sprattus sprattus), ловится в наших водах в на-
стоящее время в незначительном количестве, так как вылавливается лишь
часть имеющихся запасов, в частности в Черном море; в Балтийском море
в границах современных вод СССР в 1936 г. добыто (б', sprattus balticus)
около 22 тыс. ц, в Черном море в 1937—1938 гг. (S. sprattus phalericus)
13.2—34.7 тыс. ц.
Наибольшее значение в уловах сельдевых в СССР имеют дальневос-
точные моря, где в годы, предшествовавшие Великой Отечественной
войне, вылавливалось до 45% всего количества добываемой нашим
промыслом сельди, или около 12—13% общего улова рыбы в Беринговом
и Охотском морях и свыше 80% улова в Японском. В связи с падением
промысла сардины уловы сельди в настоящее время имеют здесь мень-
ший удельный вес, однако они могут быть значительно увеличены, так
как запасы тихоокеанской сельди недоиспользуются. На втором месте
по уловам сельдей стоит Каспийское море, дававшее в те же годы почти
30% нашего улова сельдевых, или около 25% общего улова рыбы этого
бассейна. Уловы сельдей в Каспийском море могут быть значительно уве-
личены за счет лова тюльки (так называемой каспийской кильки). Третье
место по уловам сельди занимают Черное и Азовское моря, где добывается
свыше 20% нашего общего улова сельдевых, или почти 30% общего улова
рыбы в Азовском море и около 15% в Черном. Уловы здесь могут быть
также увеличены за счет организации промысла шпрота. Остальные
морские промысловые районы имеют меньшее значение в наших уловах
сельдевых. Баренцово море, имеющее значительные запасы сельди, в на-
стоящее время по уловам ее не играет существенной роли в общих уло-
вах сельдевых. В годы, предшествовавшие Великой Отечественной войне,
уловы сельди в Баренцовом море и Чешской губе составляли всего лишь
около 2% общего улова сельдевых или менее 3% общего улова здесь
рыбы. В отдельные годы, как, например, в 1935 г., уловы сельди в Ба-
ренцовом море имели больший удельный вес в общих уловах сельдевых
СССР. Уловы сельдевых в Балтийском море в общих уловах их состав-
ляют несколько более 1 %, но могут быть значительно увеличены. В Белом
море вылавливается несколько менее 1 % общего улова сельдевых СССР,
однако в общих уловах этого моря сельдь составляет свыше 20%.
ЛИТЕРАТУРА1
Александров А. И. 1927. Анчоусы Азовско-черноморского бассейна, их про-
исхождение и таксономические обозначения. Тр. Керченск. научн. рыбохоз.
ст., I, 2 : 39—99.
Андрияшев А. П. 1939. Об амфипацифическом (японо-орегонском) распростра-.
нении морской фауны в северной части Тихого океана. Зоолог, журн., XVIII,
2 : 181—194.
АрнольдиВ. И. 1922. Две экскурсии на озеро Абрау. Журн. Русск. ботанич.
общ., VIII : 47—51. . .
Архангельский А. Д. 1931. Геологические исследования в низовьях Аму-
дарьи. Тр. Главн. геологоразвед. управл., 12 : 1—194, 2 карты.
1 В список включены работы, цитированные во «Введении» и при характеристике,
семейства и подсемейств в «Систематической части». '
6*
84
ВВЕДЕНИЕ
-Архангельский А. Д. и Н.М. Страхов. 1938. Геологическое строе-
ние и история развития Черного моря. Изд. АН СССР : 1—226, 21 фиг.,
XX табл.
Надер Ф. Ф. 1934. Состав воды Аральского моря. Исслед. озер СССР, 6 : 5—12.
Б е н и н г А. Л. 1938. Основной пищевой ряд пелагиали Каспийского моря. При-
рода, 9 : 33—36.
Б ерг Л. С. 1908. Аральское море. Опыт физико-географической монографии. Изв.
Туркестанск. отд. Русск. геогр. общ., V, 9 : XIII-J-580, 78 фиг., 2 карты.
Б е р г Л. С. 1909. Рыбы бассейна Амура. Зап. Акад. Наук (VIII), XXIV,
9 : IV+270, 2 табл.
Б е р г Л. С. 1913. Каспийские сельди, собранные экспедицией 1912 года вдоль
западного берега моря. Мат. позн. русск. рыбол., II, 3 : 1—50, XIV табл.
Б е р г Л. С. 1916. О распространении рыбы Myoxocephalus quadricornis (L.) из сем.
Cottidae и связанных с этим вопросах. Изв. Акад. Наук (VI), X : 1343—1360.
Б е р г Л. С. 1918. О причинах сходства фауны северных частей Атлантического
и Тихого океанов. Изв. Акад. Наук (VI), XII, 2 : 1835—1842.
Б е р г Л. С. 1920. Биполярное распространение организмов и ледниковая эпоха.
Изв. Акад. Наук (VI), XIV : 273—302.
Борг Л. С. (В erg L. S.). 1933. Die bipolare Verbreitung der Organismen und die
Eiszeit. Zoogeographica, I, 4 : 449—484.
Б e p г Л. C. 1934. Об амфибореальном (прерывистом) распространении морской
фауны в северном полушарии. Изв. Геогр. общ., LXVI, 1 : 69—78.
Берг Л. С. 1940. Система рыбообразных и рыб, ныне живущих и ископаемых.
Тр. Зоолог, инет. АН СССР, V, 2 : 87—517, 190 фиг.
Б е р г Л. С. 1947. Климат и жизнь. 2-е изд., Гос. издат. геогр. лит. : 1—356.
Б е р г Л. С. 1949. Рыбы пресных вод СССР, 2 : 468—925.
Бетешева Е. 1938. Осмотическое давление крови у каспийского пузанка во
время миграций. Рыбн. хоз., 8 : 36—37.
Богачев В. В. 1913. О фауне соленосных^ отложений русской Армении. Еже-
годн. по геолог, и минералог. России, XV, 8—9 : 213—224, табл. XI.
Богачев В. В. 1933. Материалы по изучению третичной ихтиофауны Кав-
каза. Тр. Азербайджанок, нефт. иссл. инет., геол, отд., XV : 1—62, 3 фиг.,
XII табл.
Богачев В. В. 1938. Рыбы из понтических отложений Кировского района. Тр.
Азербайджанок, фил. АН СССР, геол, сер., IX/39 : 36—60, табл. 6—12.
Богачев В. В. 1942. Материалы по ихтиофауне мэотического моря. Докл. АН
СССР, XXXVIII, 2 : 89—92.
Бодрова Н. В. и Б. В. К р а ю х и н. 1948. До спостереження над впливом
електричного струму на морських риб. 36ipH. пам. Леонтовича, вид. АН
УРСР : 132—140.
Борисенко А. 1937. Питание пеламиды (Sarda sarda) в северо-западном углу
Черного моря. Природа, 3 : 99—100.
Б р о ц к а я В. А. и М. Р. Неценгович. 1941. Распространение Mytilaster
lineatus в Каспийском море. Зоолог, журн., XX, 1 : 79—99.
Васнецов В. В. 1941. Функции плавников костистых рыб. Зоолог, журн., XXXI,
5 : 503—506.
В од яницкий В. А. 1930. К познанию фауны озера Абрау. Раб. Новорос-
сийск. биолог, ст., I, 4 : 131—162.
Водяницкий В. А. 1939. К изучению биологии пелагической области Чер-
ного моря. Природа, 4 : 69—71.
Водяницкий В. А. 1940. К экологии и истории рыб Черного моря. Тр. Ново-
российск. биолог, ст., II, 3 : 22—29.
ГеккерР. Т. и Р. Л. Меркли н. 1946. Об особенностях захоронения рыб
в майкопских глинистых сланцах северной Осетии. Изв. АН СССР, биолог.,
6 : 646—674, 9 рис., 2 табл.
Гентнер В. Г. 1936. Общая зоогеография. Биомедгиз : 1—548, 140 рис.
Герасимов И. П. 1937. Основные черты развития современной поверхности
Турана. Изв. Инет, геогр. АН СССР, XXV : 1—152.
Г у р в и ч Г. С. 1938. Колюшка (Gasterosteus aculeatus L.) и ее значение в рыб-
ном хозяйстве Белого моря. Природа, 7—8 : 140—141.
Державин А. Н. 1924. Пресноводные Paracarida черноморского побережья
Кавказа. Русск. гидробиолог, журн., III, 6—7 : ИЗ—129.
,Д е р ж а в и н А. Н. 1925. Материалы по понто-азовской карцинофауне (Mysi-
dacea, Cumacea, Amphipoda). Русск. гидробиолог, журн., IV, 1—2 : 10—35.
Д е р ю г и н К. М. 1915. Фауна Кольского залива и условия ее существования.
Зап. Акад. Наук (VIII), XXXIV, 1 : 1X4-929, XIII табл.
ЛИТЕРАТУРА
85
Дерюгин К. М. 1924. Баренцево море по Кольскому меридиану (33°30' в. д.)_
Тр. Северн, научно-промысл. эксп., 19 : 1—102.
Дерюгин К. М. 1928. Фауна Белого моря и условия ее существования. Исслед.
морей СССР, 7—8: XII+511.
ДехтяреваА. И. 1940. Опознавательные признаки сеголетков сельдей Север-
ного Каспия. Тр. Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океа-
ногр., XIV : 47—76, 17 рис.
Догель В. А. 1938. Некоторые итоги работ в области паразитологии. Зоолог,
журн., XVII, 5 : 889—904.
Догель В. А. 1941. Кокцидии семенников Clupeidae и их зоогеографическое зна-
чение. Тр. Ленингр. общ. ест., LXVIII, 4, отд. зоолог. : 33—39, 4 фиг.
Догель В. А. 1947. Курс общей паразитологии. Учпедгиз : 1-—371, 252 рис.
ДьяконовА. М. 1927. Фауна иглокожих северных частей Тихого океана. Тр.
Второго съезда зоологов, анатомов и гистологов СССР (1925) : 274—276.
Дьяконов А. М. 1936. Монографический очерк морских звезд северо-западных
частей Тихого океана. Тр. Зоолог, инет. АН СССР, IV, 5 : 749—914, 20 табл..
Дьяконов А. М. 1945. Взаимоотношения арктической и тихоокеанской морских
фаун на примере зоогеографического анализа иглокожих. Журн. общ. биолог.,
VI, 2 :125—155.
Е с и п о в В. К. 1939. Размножение сельди (Clupea harengus L.). Тр. Полярн. на-
учно-исслед. инет, морск. рыбн. хоз. и океаногр., 4 : 149—222.
Жадин В. И. 1933. Пресноводные моллюски СССР. Ленснабтехиздат : 1—231,.
233- рис.
Ж а д и н В. И: 1941. Проблема реконструкции фауны Волги и Каспия в связи
с волжским гидростроительством. Тр. Зоолог, инет. АН СССР, VII, 1 : 6—30.
Жижченко Б. П., В. П. Колесников и А. Г. Эберзин. 1940..
Неоген СССР. Стратиграфия СССР, XII : 1—687, 210 фиг.
Замахаев Д. Ф. 1949. Сравнение роста отдельных видов каспийских сельдей..
Зоолог, журн., LXXVIII, 6 : 545—552.
Зенкевич Л. А. и Я. А. Бирштейн. 1934. О возможных мероприятиях
по повышению продуктивных свойств Каспия и Арала. Рыбн. хоз. СССР,
3 : 38—40.
Зенкевич Л. А. и Я. А. Бирштейн. 1937. К вопросу об акклиматиза-
ции в Каспийском и Аральском морях новых видов животных. Зоолог, журн.,
XVI, 3 : 443—447.
Ивченко П. И. 1923. Обзорное описание геологического строения Черноморского'
округа. Черноморский округ и его производительные силы (сборник статей),.
I, Новороссийск : 307—327.
Ильин Б. С. 1933. Галистатический биоценоз Черного моря. Природа,
7 : 63—65.
К е с ь А. С. 1939. Русло Узбой и его генезис. Тр. Инет, геогр. АН СССР, XXX : 1—
121.
Киселевич К. А. 1918. К систематике и происхождению каспийских сельдей.
Изв. Отд. рыбовод, и научно-промысл. исслед., I : 1—17—32.
Колесников В. П. 1940. См.: Жижченко, Колесников и Эбер-
зин.
Колесников В. П. 1940. Параллелизация неогеновых и четвертичных отло-
жений Понтокаспийской области. Докл. АН СССР, XXVI, 9 : 928—931.
К р а ю х и н Б. В. и М. А. Л и т в и н о в а. 1950. О роли нервной системы в ме-
ханизме влияния электрического тока на рыб. Тр. Карадагск. биолог, ст.,.
9 : 64—69.
К р и ч а г и н Н. А. 1877. Отчет об экскурсии на северо-восточный берег Черного,
моря летом 1874 г. Зап. Киевск. общ. ест., V : 14—16, 30—33, табл. II,
фиг. 12—33.
Майорова А. А. 1939. Систематика азовско-черноморских сельдей рода Caspia-
losa. Тр. Научи, рыбохоз. и биолог, ст. Грузии, II : 1—49.
Макаров А. К. 1938. Питание скумбрии в северо-западной части Черного моря.
Рыбн. хоз. СССР, 12 : 33—34.
Макаров А. К. 1939. Питание ставриды (Trachurus trachurus) в 1936 г. в Чер-
ном море у Одессы. Зоолог, журн., XVIII, 6 : 1021—1025.
МалятскийС. М. 1930. Новый реликтовый вид сардельки из оз. Абрау (Haren-
gula abrau n. sp.). Тр. Азовско-черноморск. научн. рыбохоз. ст., 6 : 65—74.
Малятский С. М. 1938. Ихтиологические исследования в открытых частях'
Черного моря. Природа, 5 : 96—97.
Малятский С. М. 1940. Материалы по экологии населения пелагиали Черного
моря. Тр. Новороссийск, биолог, ст., II, 3 : 237—258.
86
ВВЕДЕНИЕ
Миронов А.Т. 1948. Электрический ток в море и действие его на рыбу. Тр. Морск.
гидрофизич. инет. АН СССР, I : 56—74.
Михайловская А. А. 1941. О формообразовании у каспийской морской
сельди Caspialosa brashnikovi (Borodin). Докл. АН СССР, XXX, 6 : 559—561.
Никольский Г. В. 1940. Рыбы Аральского моря. Мат. позн. фауны и флоры
СССР, изд. Моск. общ. исп. прир. (н. с.), отд; зоол., I (XVI) : 1—216, 39 рис.
О г н е в С. И. 1946. Обратим ли процесс эволюции? Бюлл. Моск. общ. исп. прир.,
отд. биолог., L, 1—2 : 3—16.
О л и ф а н В. И. 1939. Экспериментальные эколого-физиологические наблюдения
над икрой и личинками севрюги, леща и волжской сельди. (Тезисы доклада).
Зоолог, журн., XVIII, 3 : 470—471. -Я
Османов Г. У. 1940. Материалы по паразитофауне рыб Черного моря. Учен. зап.
Ленингр. Гос. пед. инет. Герцена, XXX : 187—265.
Панов Д. Г. 1946. История развития полярного бассейна. Научн. бюлл. Ленингр.
Гос. унив., 13 : 29—31.
Пучков Н. В. 1941. Физиология рыб. Пищепромиздат : 298, 101 рис.
Р а с с Т. С. 1936. О типах строения икринок и их значении для классификации рыб.
Докл. АН СССР, II (XI), 7 (93) : 299—302, 3 фиг.
Расс Т. С. 1941. Географические параллелизмы в строении и развитии костистых
рыб северных морей. Изд. Моск. общ. исп. прир. : 1—60, 9 рис.
Р а с с Т. С. 1948. Мировой промысел водных животных. Изд. «Советск, наука» : 1—
64, 19 рис.
Садовский А. А. 1934. К вопросу о промежуточном положении некоторых
черноморских моллюсков между атлантическими и средиземноморскими. Тр.
Зоолог, сект. Грузинок, отд. Закавказск. фил. АН СССР, I : 61—85.
Световидов А. Н. 1932. О зависимости между характером пищи и числом
пилорических придатков у сельдей. Докл. АН СССР, А, 8 : 202—204.
Световидов А. Н. 1940. О географическом распространении тресковых и дру-
гих семейств отряда Gadiformes. Бюлл. Моск. общ. исп. прир., отд. биолог.,
XLIX, 1 : 50—59.
Световидов А. Н. 1941. О происхождении Clupeonella abrau в связи с усло-
виями развития фауны сельдевых в Каспийском и Черноморско-азовском бас-
сейнах. Докл. АН СССР, XXXI, 8 : 805—809.
Световидов А. Н. 1943. О каспийских и черноморско-азовских сельдевых из
рода Caspialosa и Clupeonella и об условиях их формообразования. Зоолог,
журн., XXII, 4 : 222—233. '
Световидов А. Н. 1944. О чертах сходства и различия в распространении,
экологии и некоторых других особенностях между треской и океанической
сельдью. Зоолог, журн., XXIII, 4 : 146—155, 2 рис.
Световидов А. Н. 1946. Морфологические основы системы тресковых. Изв.
АН СССР, отд. биолог, наук, 2—3 : 183—198, 3 рис.
Световидов А. Н. 1948. Трескообразные. Фауна СССР, Рыбы, VII, 4 : 1—221,
39 фиг., LXXII табл.
Световидов А. Н. 1948а. О некоторых сходных особенностях фауны рыб Кас-
пийского и Черного морей и северных частей Тихого и Атлантического океа-
нов. Докл. АН СССР, LXII, 5 : 721—724.
Световидов А. Н. 1949. Об особенностях некоторых биполярных ареалов мор-
ских рыб и о причинах, их обусловивших. Изв. Всесоюзн. Геогр. общ., 81,
1 : 44—52, 5 рис.
Световидов А. Н. 1949а. О географическом распространении сельдевых в связи
с некоторыми вопросами зоогеографии северных частей Атлантического и Ти-
хого океанов. Тр. Второго Всесоюзн. геогр. съезда, III : 184—191.
Световидов А. Н. 19496. О некоторых биологических особенностях тихоокеан-
ской сельди и о причинах, их обусловивших. Изв. Тихоокеанск. научно-
исслед. инет, морск. рыбн. хоз. и океаногр., 31 : 59—64.
Световидов А. Н. 1949в. Возможность заселения наших дальневосточных
морей новыми промысловыми рыбами. Рыбн. хоз., 2 : 34—39.
Световидов А. Н. 1950. О параллельном изменении некоторых признаков
у каспийских и черноморско-азовских форм Caspialosa caspia. Докл. АН СССР,
LXXII, 2 : 421—423, 1 фиг.
Световидов А. Н. 1950а. Об особенностях строения плавательного пузыря
сельдевых. Докл, АН СССР, XXIV : 643—644.
Скориков А. С. 1904. К истории фауны озера Абрау (близ Новороссийска).
Ежегодн. Зоолог, муз. Акад. Наук, IX : XIX—XXII.
СмирновА. Н. 1946. О влиянии света на сроки нерестовой миграции каспийских
сельдей. Докл. АН Азербайджанок. ССР, II, 2 : 60—63.
ЛИТЕРАТУРА 87
Смирнов В. П. 1936. Рыбы северо-кавказского олигоцена (Чернореченский
район). Тр. Узбекск. Гос. унив., V : 43—131, 21 рис., XII табл.
Совиновна В. К. 1903. Введение в изучение фауны Понто-Каспийско-Араль-
ского бассейна, рассматриваемой с точки зрения самостоятельной зоогеогра-
фической провинции. Зап. Киевск. общ. ест., XVIII : XIII+487+189,
4 табл.
С о и н С. Г. 1941. Некоторые данные о признаках партеногенетического развития
Caspialosa volgensis. Докл. АН СССР, XXX, 3 : 262—264.
Строганов Н. С. 1939 (при участии Р. И. Мухиной). Резистентность икры волж-
ской сельди к некоторым факторам внешней среды. Учен. зап. Моск. Гос. унив.,
33 : 185—200.
Третьяков Д. К. 1938. Сейсмосензорные каналы сельдевых. Зоолог, журн.,
XVII, 5 : 763—774.
Третьяков Д. К. 1950. Сравнительноморфологический анализ сейсмосенсор-
ных органов сельдевых. Тр. Инет. зоол. АН Укр. ССР, V : 64—73.
Фадеев Н. Н. 1925. Реликтовое озеро Абрау и его обитатели. (Гидробиологи-
ческий этюд). Раб. Северокавказск. гидробиолог, ст. Горек, сельскохоз.
инет., I, 2 : 1—18.
Чернявский Н, 1879. Отчет о поездке к Черному морю и к озеру Абрау на
Кавказе. Тр. Харьковск. общ. исп. прир., XIII, прилож. : XI—XX.
Ш м и д т П. Ю. 1904. Рыбы восточных морей. Изд. Русск. геогр. общ., XI-f-466,
31 рис., 6 табл.
ЭберзинА. Г. 1940. См.: Жижченко, Колесников и Эберзин.
Angel F., L. Berlin et J. Gruibe. 1946. Note relative a la nomenclature
d’un amphibien et d’un poisson. Bull. Mus. Nat. Hist. Nat. (2), XVIII : 473—
474.
Arambourg C. 1925. Revision des poissons fossiles de Licata (Sicile). Ann. Pa-
leont., XIV, 2—3 : 1—96, X pls.
Arambourg C. 1927. Les poissons fossiles d’Oran. Mat. carte geolog. Algerie (1),
Paleont., 6 : 1298, 49 figs., XLVI pls.
Bamford Th. W. 1941. The lateral line and related bones of the herring. Ann. Mag.
Nat. Hist. (11), VIII : 414—438, 7 figs.
В er t i n L. 1940. Catalogue des types des poissons de Museum National d'Histoire
Naturelle. 2е partie. Dipneustes, Chondrosteens, Holosteens, Isospondyles. Bull.
Mus. Nat. Hist. Nat. (2), XII : 244—322.
В e r t i n L. 1943. Revue critique des Dussumierides actuels et fossiles. Description
d’un genre nouveau. Bull. Inst, oceanogr., 853 : 1—32, 8 figs.
В er t in L. 1946. См.: Angel, Berlin et Gruibe.
Bige 1 ow H. B. a. W. W. W e I s h. 1925. Fishes of the Gulf of Maine. Bull.
U. S. Bureau Fisher., XL, I (1924) : 1—567, 278 figs.
Blackburn M. 1941. The economic biology of some Australian Clupeoid fish.
Bull. Council Sci. Industr. Res., 138, Div. fisher., 6 : 1—152, 1 pl., 29 figs.
Boulenger G. A. 1904, 1910, 1922. Fishes (Systematic accout of Teleostei). Cambr.
Nat. Hist. ed.. by S. F. Harmer a. A. E. Shipley, VII : 541—727.
В r e d e г С. M. 1942. The re-appearance of Chirocentrodon taeniatus (Poey) in Cuba,
with notes on its taxonomy and relationships. Copeia, 3 : 133—138, 1 fig.
В г о c h H. 1936. Einige Probleme der biogeographischen Abgrenzung der arktischen
Region. Mitt. Zool. Mus., Berlin, XIX : 1—20.
Chabanaud P. 1933. Sur divers poissons de la Mer Rouge et du Canal de Suez.
Description de deux especes nouvelles. Bull. Inst, oceanogr., 627 : 4—8.
Cuvier G. 1829. La regne animal, II, ed. II : XV-|-406.
Dahl F. 1921. Grundlagen einiger okologischen Tiergeographie. Jena, I : VIII-]-113.
David L. R. 1943. Miocen fishes of Southern California. Geol. Soc. Amer., Spec,
pap., 43 : XIII-|-193, 39 figs., 16 pls.
Ekm an Sv. 1914, Studien fiber die marinen Relicte der nordeuropaische Binnenge-
wasser. II. Die Variation der Kopfform bei Limnocalanus grimaldii und L. mac-
rurus. Intern. Rev. ges. Hydrob. u. Hydrogr., VI, 4/5 : 335—371, 3 figs. pl. X.
E k m a n Sv. 1934. Indo-Westpazifik und Atlanto-Ostpazifik, eine tiergeographische
Studie. Zoogeographica, II, 3 : 320—374, 11 figs.
Ekm an Sv. 1935. Tiergeographie des Meeres. Leipzig : XII +542, 244 figs.
F a g e L. 1911. Recherches sur la biologie de 1’anchois [Engraulis encrasicholus (L.)].
Races—age—migration. Ann. Inst, oceanogr., II, 4 : 1—37.
F a g e L. 1920., Engraulidae, Clupeidae. Rept. Danish Oceanogr. Exped. 1908—1910
to the Mediterranean and adjacent seas, 6, II (Biology), A. 9 : 1—128, 48 figs.
Fitch J. E. 1950. Life history notes and the early development of the bonefish, Al-
bula vulpes (Linnaeus). Calif. Fish. a. Game, 36, 1 : 3—6, 2 figs.
88
ВВЕДЕНИЕ
Ford Е. 1930. Herring investigations at Plymouth. VIII. The transition from larva
to adolescent. Journ. Mar. Biol. Assoc, (n. s.), XVI, 3 : 723—752, 11 figs.
Fowler H. W. 1941. The fishes of the groups Elasmobranchii, Holocephali, Iso-
spondyli, and Ostariophysi obtained by the United States Bureau of Fisheries
steamer «Albatross» in 1907 to 1910, chiefly in the Philippines Islands and ad-
jacent seas. U. S. Nat. Mus., Bull. 100, v. 13 : IX-|-879, 30 figs.
Goodrich E. S. 1909. Vertebrata Craniata. (First fascicle: Cyclostomes and Fi-
shes). A treatize on zoology ed. by R. Lankester, IX, London : XVI-|-518, 514
figs.
Gunther A. 1868. Catalogue of the Physostomi etc. in the collection of the British
Museum, VII :XX-|-512.
Gunther A. 1880. An introduction to the study of fishes. Edinb. : 1—720, 363 figs.
Hardenberg L. D. F. 1941. Fishes of N. Guinea. Treubia, Buitenzorg, 18 : 217—
231, 4 figs.
Hein eke Fr. 1898. Naturgeschichte des Herings. Abh. Deutsch. Seefischerei-Ver.,
II : CXXXVI + 128+XI+223, XXV pls.
H i 1 d e n b r a n d t S. P. 1941. An annotated list of salt and brackish water fishes,
with a new name for menhaden, found in North Carolina since the publication.
Copeia, 4 : 220—232.
Hildenbrandt S. P. 1946. A descriptive catalog of the shore fishes of Peru.
U. S. Nat. Mus., Bull. 189 : 1—530, 95 figs.
H u b b s C. L. a. R. R. M i 1 1 e r. 1941. Dorosoma smithi, the first known giz-
zard shad from the Pacific drainage of M. America. Copeia, 4 : 232—238, 1 fig.
Hofsten N. 1915. Die Echinodermen des Eisfjords. K. Svenska Vetensk.-Akad.
Handl., 54, 2 : 1—282, 2 pls.
J ord an D. S. 1921. The fish fauna of the California tertiary. Stanf. Univ. Publ.,
Univ. Ser., Biol. Sci., I, 4: 237—299, 57 pls.
Jordan D. S. 1923. A classification of fishes, including families and genera as far
as known. Stanf. Univ. Publ., Univ. Ser., Biol. Sci., Ill, 79—2434-1—X.
Jordan D. S. 1925. The fossil fishes of the miocene of Southern California. Stanf.
Univ. Publ., Univ. Ser., Biol. Sci., IV, 1 : 1—50, 21 pls.
J о r d a n D. S. , a. B. W. Evermann. 1896. The fishes of North and Middle
America. I. Bull. U. S. Nat. Mus., 47 : LX-f-1240.
J о r d a n D. S. a. Ch. H. Gilbert. 1919. Fossil fishes of Southern California.
II. Fossil fishes of the miocene (Monterey) formations of Southern California.
Stanf. Univ. Publ., Univ. Ser., Biol. Sci. : 13—60.
J о r d a n D. S. a. A. Ch. H e r r e. 1906. A review of the Herring-like fishes of
Japan. Proc. U. S. Nat. Mus., XXXI : 613—645, 5 figs.
Jordan D. S. a. A. Seale. 1926. A review of the Engraulidae, with descrip-
tions of new and rare species. Bull. Mus. Comp. Zool. Harv., LVII, 11 : 355—418.
К a u p J. J. 1856. Catalogue of Apodal fish, in the collection of the British Museum,
London : VIII4-163, XIX pls.
Kishinouye K. 1907. Notes on the natural history of the sardine (Clupea mela-
nosticta Schlegel). Journ. Imp. Fisher. Bureau, Tokyo, XIV; 3 : 71—105, XXI pls.
L e b о u r M. 1921. The larval and post-larval stages of the pilchard, sprat and her-
ring from Plymouth district. Journ. Mar. Biol. Assoc, (n. s.), XII : 427—457,
12 figs.
L e i m A. N. 1924. The life history of the shad [Alosa sapidissima (Wilson)j with refe-
rence to the factors limiting its aboundance. Contrib. Canad. Biol. Fisher, (n. s.),
II, 11 : 161—284, 41 pls.
Leriche M. 1902. Les pOissons paleocenes de la Belgique. Mem. Mus. Roy. Hist.
Nat. Belg., II : 1—48, 8 figs., 3 pls.
Leriche M. 1905. Les poissons eocenes de la Belgique. Mem. Mus. Roy. Hist. Nat.
Belg., Ill : 49—228, 55 figs., 9 pls.
Leriche M. 1906. Contribution a I’etude des poissons fossiles du Nord de la France
et des regions voisines. Mem. Soc. Geol. NoM, V : 1—430, 17 pls.
Leriche M. 1910. Les poissons oligocenes de la Belgique. Mem. Mus. Roy. Hist.
Nat. Belg., V : 229—263, 92 figs., 15 pls.
Lestage J. A. 1934. L’industrialisation de la parthenogenese artificielle chez
1’agone (Clupeidae: Paralosa lacustris lariana Pir.). Ann. Soc. Roy. Zool. Belg.,
LXIV (1933) : 69—74.
Lonnberg E. 1924. Uebersicht der wichtigsten Systeme. Bronn’s Klassen u. Ord-
nungen d. Tier-Reichs, VI, 1 : 43—63.
Lonnberg E. 1932. Some remarks on the relict forms of Cottus quadricornis L.
in Swedish freshwater lakes. Ark. Zool., XXIA, 7 : 1—23.
Matthews J. D. 1887. Structure of the herring and other Clupeids. Fifth Rept.
ЛИТЕРАТУРА
89
Fish. Board. Scotl., Append. F, Sessial Papers, House of Commons, 21 (1886) :
274—292.
McCulloch A. R. 1929. A check-list of the fishes recorded from Australia.
I. Austr. Mus., Sydney, Mem. V : 1—144.
Muller J. 1843. Beitrage zur Kenntniss der natiirlichen Familien der Fische. Arch.
Naturgesch., 9 Jahrg., 1 Bd. : 292—330.
Muller J. 1846. Ueber den Bau die Grenzen der Ganoiden und fiber das natiirliche
System der Fische. Abhandl. Konigl. Akad. Wissensch. Berlin (1844) : 117—216,
M у e r s G. S. 1929. Mutanda Ichthyologica II. Heringia vs. Rhinosardinia (Clupei-
dae), Medipellona vs. Chirocentrodon (Clupeidae), and Entonanthias vs. Miro-
labrichthys (Anthiidae). Copeia, 170 : 1—2.
Norman J. R. 1923. A revision of the Clupeoid fishes of the genus Ilisha and al-
lied genera. Ann. Mag. Nat. Hist. (9), XI : 1—22.
Norman J. R. 1936. A new fish of the genus Clupea from Chile. Ann. Mag. Nat.
Hist. (10), XVII : 491—492'.
Norman J. R. 1937. Coast fishes. II. The Patagonian region. Discovery Rept.,
XVI : 1—150, 76 figs., V pls.
О r t m a n n A. F. 1895. Grundziige der marinen Tiergeographie. Jena : IV4-91.
P e a r s e A. S. 1936. The migration of animals from sea to land. Duke University
Press : X 4-176.
Pelseneer P. 1906. L’origine des animaux d’eau douce. Bull. Acad. Roy. Belg.,,
(cl. sci.), 12 (1905) : 699—741.
Phillips J. B. 1942. Osteology of the sardine (Sardinops caerulea). Journ. Morph.,.
70, 3 : 463—500, 23 figs.
Plate L. 1920. Bemerkungen fiber die deszendenztheoretische Bewertung,der Unwand-
lung von Planorbis multiformis. Jenaische Zeitschr. f. Naturwissensch., 56
(N. F. 49) : 217—224.
Rayner D. 1937. On the Leptolepis bronni Agass. Ann. Mag. Nat. Hist. (10), IX
46—74.
Regan С. T. 1916. The British fishes of the subfamily Clupeinae and related species
in other seas. Ann. Mag. Nat. Hist. (8), XVIII : 1—19, III pls.
Regan С. T. 1917- A revision of the'Clupeoid fishes of the genus Pellonula and rela-
ted genera in the rivers of Africa. Ann. Mag. Nat. Hist. (8), XIX : 198—207..
Regan С. T. 1917a. The fishes of the genus Clupea. Ann. Mag. Nat. Hist. (8),.
XIX : 226—229.
Regan С. T. 1917b. A revision of the Clupeoid fishes of the genera Pomolobus, Bre-
voortia and Dorosoma, and their allies. Ann. Mag. Nat. Hist. (8), XIX : 297—
316.
Regan С. T. 1917c. A revision of the Clupeoid fishes of the genera Sardinella, Haren-
gula etc. Ann. Mag. Nat. Hist. (8), XIX : 377—395.
Regan С. T. 1922. Fisches of the Clupeoid genera Clupeoides and Potamalosa, and
allied genera. Ann. Mag; Nat. Hist. (9), X : 587—590.
Ridewood W. G. 1892. The air bladder of British Clupeoid fishes. Journ. Anat.
Physiol., XXVI (n. s. VI) : 26—42.
Ridewood W. G. 1904. On the cranial osteology of the fishes of the families Elo-
pidae and Albulidae, with remarks on the morphology of the skull in the lower
Teleostean fishes generally. Proc. Zool. Soc. London, II : 35—81, figs. 8—16.
Ridewood W. G. 1904a. On the cranial osteology of the Clupeoid fishes. Proc.
Zool. Soc. London, II : 448—493, figs. 118—143.
Rivas L. R. 1946. A new Dussumierid fish of the genus Jenkinsia from’ Bermuda.
Smiths. Misc. Coll., 106, 14 : 1—4, 1 fig., I pl.
RounsefellG. A. a. E. H. Dahlgren. 1932. Fluctuations in the supply
of herring, Clupea pallasii, in Prince William Sound, Alaska. Bull. U. S. Bu-
reau Fisher., XLVII, 9 : 263—291.
Schaeffer B. 1947. Cretaceous and tertiary Actinopterygian fishes from Brazil.
Bull. Amer. Mus. Nat. Hist., 89, 1 : 1—39, 7 pls., 6 text. figs.
S h e 1 f о r d V. E. a. E. B. Powers. 1915. An experimental study of the mo-
vements of herring and other marine fishes. Biol. Bull. Woods Hole, Mass.,
XXVIII : 315—334.
Scheuring L. 1929. Die Wanderungen der Fische. Ergebn. d. Biol., V : 405—
691, 33 figs.
Schultz L. P. 1943. Fisches of the Phoenix and Samoan Islands collected in 1939
during the expedition of the U. S. S. «Bushnell». U. S. Nat. Mus., Bull. 180 : 1—
316, 27 figs., 9 pls.
Smith J. P. 1919. .Climatic relations' of the Tertiary Quarternary faunas of the Cali-
fornia region. Proc. Calif. Acad. Sci. (4), IX, 4 : 123—173.
90
ВВЕДЕНИЕ
I!
1
.'S m i 11 F. A. 1895. A history of Scandinavian fishes. II : 567—1240. |
Starks E. Ch. 1926. Bones of the ethmoid region of the fish skull. Stanf. Univ. i
. Publ., Univ. Ser., Biol. Sci., IV, 3 : 139—338, 58 figs.
S.tore.y M. 1938. West Indian Clupeoid fishes of the genus Harengula with notes
on H. thrissina from the Pacific coast. Stanf. Ichthyol. Bull., I, 1 : 3—56, 17 figs.
Test er A. L. 1938. Variation in the mean vertebral count of herring (Clupea pal-
lasii) with water temperature. Journ. Cons., XIII, 1 : 71—75.
'Tracy H. C. 1920. Clupeoid cranium in its relation to the swimbladder diverticu-
lum and the membranous labyrinth. Journ. Morph., 33 : 439—474, 5 pls.
W e e d A. C. 1925. A review of tee fishes of the genus Signalosa. Field Mus. Nat. Hist.,
. Zool., XII, 11 : 137—146.
'W h i 11 ё у G. P. 1943. Ichthyological notes and illustrations. (Part 2). Austr. Zool.,
10, 2 : 167—187.
Wjj h 1 f a h r t Th. A. 1936. Das Ohrlabyrinth der Sardine (Clupea pilchardus Walb.)
und seine Beziehungen zur Schwimmblase und Seitenlinie. Zeitschr. f. Morph,
u. Okol. d. Tiere, 31, 3 : 371—410, 28 figs.
'Wohlfahrt Th. A. 1937. Anatomische Untersuchungen uber die Seitenkanale der
Sardine (Clupea pilchardus Walb.). Zeitschr. f. Morph, u. Okol. d. Tiere, 33,
3 : 281—411, 15 figs.
"WoodwardA. S. 1895. Catalogue of the fossil fishes in the British A.useum,
\III : XXXIV + 544., XVIII pls.
'Woodward A. S. 1901.'Catalogue of the fossil fishes in the British Museum.
IV : XXXVIII+636, 22 figs., XIX pls.
'Wunder W. 1936. Physiologie der Siisswasserfische Mitteleuropa. Handb. d. Bin-- 7
nenfischerei Mitteleur., II : XI+ 340, 213 figs. .
СИСТЕМАТИЧЕСКАЯ ЧАСТЬ
Сем. CLUPEIDAE —СЕЛЬДЕВЫЕ
Clupeidae 'Cuvier, Regne' animal, ed. II, II, 1829 : 316 (частью). — Clupeo-
idei Muller, Arch. Naturgesch., 9 Jahrg., 1 Bd., 1843 :324 (частью).'—Clupe-
idae Muller, Abh. Akad. Wiss. Berlin (1844), 1846 : 136 (частью), Gunther,
Cat. fish., VII, 1868 : 381 (частью). — Clupeidae-\-Dorosomidae Jordan a. Ever-
man n, Fish. N. a. M. America, I, 1896 : 415, 417. — Clupeidae-\-Dussumieriidae-\-
Dorosomidae Jordan, Classif. fish., 1923 : 120, 121, 122. — Clupeidae Берг,
Система рыб, 1940 : 223. —Dorosomidae-\-Stolephoridae-\-Clupeidae Fowler, U. S.
Nat. Mus., Bull. 100, v. 13, 1941 : 547, 561, 578.
Боковая линия на теле отсутствует, развита лишь в самой передней
пасти в виде короткого канала с порами на первых 2 (у Sardina)—5
(у Clupea) чешуях сразу за головой. Каналы системы боковой линии
на голове на черепных костях заключены в костных каналах, пронизан-
ных местами наружу отверстиями, или (на подглазничных и отчасти
на нижнечелюстных) расположены под гребнями костей; от этих каналов
•ответвляются многочисленные более мелкие каналы, расположенные
в кожных покровах на многих костях черепа, жаберной крышки, челю-
стей (исключая interoperculum, praemaxillare и maxillare) и на чешуях
сзади головы сверху и у некоторых {Alosa, Sardina и др.) достигающие
сильного развития; такой короткий канал, не заключающий нервных
органов, имеется в кожных покровах на верхней части operculum.1
Отверстопузырные. Плавательный пузырь посредством выростов, заклю-
ченных в prooticum и pteroticum (у Sprattus и Clupeonella pteroticum
выростов плавательного пузыря не заключает) соединяется с ушными
капсулами;1 2 задний конец плавательного пузыря продолжен в канал,
открывающийся наружу слева ostium genitale между анальным и моче-
вым отверстиями или заканчивающийся слепо.3 Рот окаймлен посред-
ством praemaxillaria и maxillaria или только посредством praemaxillaria
(у большинства Dorosomatinae). В верхней челюсти 1 или 2 supramaxil-
laria. У некоторых {Pomolobus, Sardinops) есть praeethmoidalia.4 Соеди-
, нительнотканная связка между задним концом praemaxillare и середи-
ной maxillare у некоторых {Pellona, Pliosteostoma) превращена в кость,
несущую зубы.5 Миодом открыт и сзади черепа. Есть верхние (epipleu-
ralia) и нижние (epicentralia) межмышечные косточки и нижние и верх-
1 См.: Wohlfahrt, 1937 : 381—411; Третьяков, 1938 : 763—774; В а т-
f ord, 1941 : 414—438. Названия как этих, так и цитируемых далее работ и изда-
ний, где они опубликованы, см. в списке литературы (стр. 83 и сл.).
2 См.: Wohlfahrt, 1936 : 371—410.
s См.: Световидов, 1950а : 643—644.
4 См.: Starks, 1926 :. 148, 149.
з См.: Norman, 1923 : 17, 21.
92
CLUPEIDAE
ние ребра; дистальная часть последних хрящевая, проксимальная — со-
единительнотканного происхождения. Postcleithrum 3, прикрепляются
с наружной стороны cleithrum. Мезокоракоид, базисфеноид и орбито-
'сфеноид есть. Спинной плавник по середине тела, иногда {у Pristigaste-
rinae) над анальным, у Raconda отсутствует. Брюшные плавники на
брюхе, иногда отсутствуют (.у некоторых Pristigasterinae). Брюхо закру-
гленное или сжатое с боков, брюшные килевые чешуи есть или отсут-
ствуют (у Dussumieriinae), чешуя циклоидная или у некоторых {Brevoortia,
Ethmalosa и Ethmidium) на заднем крае гребенчатая. Как и у других
современных семейств подотряда Clupeoidei, жирового плавника нет, па-
рапофизы не приращены ,к телам позвонков, грудные radialia располо-
жены в один ряд, praedentale отсутствует, есть нормальные яйцеводы. Из
признаков, свойственных другим Clupeiformes, следует отметить гомоцер-
кальный хвостовой плавник, отсутствие фулькр и веберова аппарата, не-
парные сошник и мезэтмоид, есть hypuralia и эндохондральное supraoccipi-
tale.
Из'характерных особенностей эмбрионального развития необходимо:
указать на положение спинного плавника у личинок далеко позади тела,
над анальным; этот плавник по мере роста личинок перемещается над.
миотомами 1 и ко времени превращения личинки во вполне сформировав-
шегося малька занимает положение, свойственное взрослым. Икринки
имеют малое или большое кругожелтковое (перивителлиновое) простран-
ство, без жировой капли или с одной крупной или многочисленными
мелкими, быстро исчезающимй каплями.2
Около 50 родов и до 190 видов в тропических, субтропических, умерен-
ных и единично в арктических морях и в соответствующих им широтах
в пресных водах обоих полушарий. В ископаемом состоянии с нижнего мела.
По некоторым особенностям внутри семейства можно провизорно-
выделить следующие подсемейства.
I. Dussumieriinae. Брюшных килевых чешуй нет, брюхо закругленное.
Верхняя челюсть без медиальной вырезки. Supraorbitale 1 (у Dussumieria,
Etrumeus, Spratelloides). На хвост,овом плавнике удлиненных чешуй.
(ala) нет. Жировые веки есть или отсутствуют (у Spratelloides), у Etrumeus
и, невидимому, у Dussumieria целиком закрывают глаза. Внутренняя
стенка fossa praeepiotica перепончатая, не отделена костной перегородкой,
от fossa temporalis posterior (у Dussumieria, Etrumeus, в меньшей степени
у Spratelloides).
Роды Dussumieria, Etrumeus, Jenkinsia (включая Elalecula Jordan,.
1925), Spratelloides {—Stolephorus auct., включая Gilchristella Fowler,.
1935, и Sauvagella Berlin, 1940 — Spratellomorpha Angel, Berlin et Gruibe,
1946). Морские рыбы тропических и субтропических морей: S. malaba-
ricus — в эстуариях и реках.
Обзор индо-пацифических родов см. у Фаулера (Fowler, 1941 ::
561—578), рода Jenkinsia у Джордэна и Эвермана (Jordan a. Evermann,
1896 : 418—421), подсемейства у Бертена (Berlin, 1943), описание.
D. productissima у Шабано (Chabanaud, 1933 : 4).
II. Clupeinae. Брюшные килевые чешуи, как и у всех следующих,
обычно хорошо развитые и явственно заметные или реже менее развитые
и заметные. Брюхо сжатое с боков или реже закругленное. Верхняя
челюсть без заметной медиальной вырезки. Сочленение нижней челюсти
1 См.: Lebo иг, 1921:427; Ford, 1930:723.
2 См.: Расс, 1936 : 301.
CLUPEIDAE
93
с черепом и задний конец верхнечелюстной кости впереди или под верти-
калью середины глаза, у Sardinops немного позади него. Жировое веко
есть, у некоторых {Clupeonella) зачаточное или почти не развитое. Удли-
ненных чешуй при основании лопастей хвостового плавника нет, реже
(у Sardinella, Sardinops, Sardina) имеются. У Sardinella, Sardinops, Sardina
и Clupeonella два последних луча анального плавника удлиненные. У Opi-
sthonema последний луч спинного плавника вытянут в длинную нить.
Роды Clupea, Sprattus, Harengula, Clupeonella, Sardina, Sardinops,
Sardinella, Opisthonema, Lile, Rhinosardinia {—Heringia).1 Морские и
отчасти солоноватоводные и пресноводные рыбы тропических, субтропи-
ческих, умеренных и частично арктических морей. Harengula tawilis
и Clupeonella abrau — в пресноводных озерах, Cl. delicatula — отчасти
проходной и пресноводный, Rhinosardinia amazonica —• в Амазонке и
реках Гвианы.
Обзор рода Clupea, включая виды рода Sprattus, см. у Ригэна (Regan,
1916 : 1—6; 1917а : 226—229) и Нормана (Norman, 1936 : 491—492; 1937 :
37—39), Harengula, Sardinella, Opisthonema, Lile, Rhinosardinia —
у Ригэна (Regan, 1917c : 377—395), индо-пацифических видов Haren-
.gula и Sardinella—-у Фаулера (Fowler, 1941/ 584—620), ост-индских
Harengula у Сторей (Storey, 1938 : 1—-56), Sardina, включая Sardinops,—
у Ригэна (Regan, 1916 : 11—19).
III. Pellonulinae. Брюхо сжатое с боков, реже (у Stolothrissa и Oda-
xothrissa) впереди брюшных плавников закругленное, со слабым килем.
Верхняя челюсть без медиальной вырезки. Supramaxillare только 1.
Сочленение нижней челюсти с черепом под вертикалью середины глаза
или впереди него, задний конец верхнечелюстной кости слегка прости-
рается за вертикаль переднего края глаза или не достигает ее. Жиро-
вого века нет или у некоторых едва развито. У Corica и Clupeichthys
позади анального плавника 2 плавничка. У Potamalosa и Hyperolophus
между затылком и спинным плавником ряд килевидных щитков.
Роды Pellonula, Poecilothrissa, Мicrothrissa, Potamothrissa, Cynothrissa,
Odaxothrissa, Stolothrissa, Limnothrissa, Kowala, Clupeoides, Corica, Clu-
peichtys, Potamalosa, Hyperlophus. Пресноводные тропические или реже
субтропические рыбы Африки (первые 8 родов), Индо-малайского архи-
пелага и отчасти Индии и Австралии,- Kowala thoracata — в море вдоль
берегов западной Индии, Явы и других островов; оба вида Hyperolophus,
невидимому, также морские.
Обзор родов см. у Ригэна (Regan, 1917 : 198—207; 1922 : 587—590),
последних шести родов — также у Фаулера (Fowler, 1941 : 635—648),
который род Clupeoides считает идентичным роду Kowala, так же как род
Clupeichthys роду Corica.
IV. Alosinae. Верхняя челюсть с заметной медиальной вырезкой.
Сочленение нижней челюсти с черепом позади или реже (у Pomolobus)
впереди вертикали заднего края глаза, задний конец верхнечелюстной
кости простирается за вертикаль середины глаза или заднего края его.
Есть жировое веко. При основании хвостового плавника на каждой
лопасти по удлиненной чешуе (ala), отсутствующей у Hilsa и Gudu-
sia. У Brevoortia, Ethmalosa и Ethmidium чешуя на заднем крае гребен-
чатая и между затылком и основанием спинного плавника имеется
по 2 ряда увеличенных чешуй (у Brevoortia и Ethmalosa) или щитков
(у Ethmidium).
1 Heringia есть nomen praeoccupatum (Diptera). См.: Myers, 1929 : 1.
94
CLUPEIDAE
Роды Alosa, Pomolobus, Brevoortia, Ethmidium, Ethmalosa, Hilsa (=Mac~
rura),1 Gudusia. Проходные, некоторые пресноводные {Gudusia, озерные
и речные формы видов Alosa s. str. и некоторых видов Pomolobus) или
отчасти солоноватоводные {Brevoortia, некоторые каспийские виды и формы
Alosa', бпопогпя Ethmidium и Ethmalosa не известна) рыбы умеренных,
тропических и менее субтропических широт.
Обзор родов см. у Ригэна (Regan, 1917b : 297—308), родов Hilsa и
Gudusia также у Фаулера (Fowler, 1941 : 626—635). Биологию видов-
Pomolobus и Brevoortia см. у Бигелоу и Уелша (Bigelow a. Welsh, 1925 ;
105—124), описание В. smithi у Гильдебрандта (Hildebrandt, 1941 : 224)..
V. Dorosomatinae. Верхняя челюсть с медиальной вырезкой. Supra-
maxillare 1, реже 2 (у Signalosa). Рот без зубов, нижний или конечный,,
окаймлен посредством только praemaxillaria или посредством как ргае-
maxillaria, так и maxillaria (у Clupanodon). Последний луч спинного плав-
ника у всех, исключая Gonialosa и Anodonto stoma, вытянут в длинную-
нить. Есть жировое веко. По внешнему, виду большинство, исключая
Clupanodon, высоким и сжатым с боков телом, небольшим нижним ртом^
и длинным анальным плавником (у Dorosoma имеющем до 38 лучей) напо-
минают леща.
Роды Dorosoma, Clupanodon, Signalosa, Nematalosa,1 2 3 Gonialosa, Anodon-
tostoma. Проходные или пресноводные и отчасти морские рыбы заливов:
и эстуариев тропических или отчасти субтропических широт.
Обзор родов см. у Ригэна (Regan, 1917b : 308—316), четырех послед-
них родов также у Фаулера (Fowler, 1941 : 547—561), Signalosa — у Уида
(Weed, 1925 : 137—146), описание D. smithi — у Хэббса и Миллера
(Hubbs a. Miller, 1941 : 232—238).
VI. Pristigasterinae: Анальный плавник длинный, более чем с 30 (33—
92) лучами. Верхняя челюсть без медиальной вырезки. Брюшные килевые
чешуи развиты и на горле. Брюшные плавники малы или отсутствуют
(у Pristigaster, Opisthopterus, Odontognathus, Raconda). Спинной плавник
расположен за брюшными, впереди анального, над или позади начала
его, у Raconda отсутствует. Соединительнотканная связка между зад-
ним концом praemaxillare и серединой maxillare у некоторых {Pellona,
Р lio steo stoma) превращена в кость, несущую зубы.
Роды Ilisha, Pellona {=Neosteus),s Chirocentrodon 4 (=Medipellona),5'
Pristigaster, Pliosteostoma, Opisthopterus, Odontognathus, Raconda. Мор-
ские рыбы тропических морей, немногие виды некоторых родов встре-
чаются в пресных водах. Ilisha indica — входит в реки, I. macrogaster —
в реках, I. xanthoptera — в солоноватой воде и в реках, I. elongata, I. afri-
сапа, I. pristigasteroides, I. megaloptera — заходят в устья рек, Opistho-
pterus macrognathus — в море и эстуариях, Pellona castelnaeana — в море
и в реках, Р. altamazonica — в реках.
Обзор родов см. у Нормэна (Norman, 1923 : 1—22), индо-паци-
фических видов Pellona, Ilisha, Opisthopterus, Raconda — у Фаулера
(Fowler, 1941 : 648—666), рода Chirocentrodon — у Бредера (Breder,.
1942 : 133—138).
Некоторые из этих групп по характеру признаков, положенных
1 См.: Fowler, 1941 : 626.
2 Включая Flvviadosa, Whitley, 1943 : 170.
3 См.: Fowler, 1941 : 648.
1 Включая Pseudochirocentrodon Miranda-Ribeiro (1920), описание которого дано-
в недоступном автору издании. Отличается положением спинного плавника.
5 См.: Jordan a. Seale, 1926 : 417 и Myers, 1929 : 1.
CLUPEIDAE
95
н основу их разграничения, следует рассматривать скорее как трибы,,
•юм как подсемейства. При более детальном изучении морфологии, в част-
ности остеологии, всех представителей семейства, несомненно, будут обна-
ружены и другие, более существенные особенности, на основании кото-
рых окажется возможным внести изменения и дополнения и .дать более-
обое,повинное разделение на подсемейства. Наиболее примитивным по
комплексу признаков, положенных в основу системы семейства (см.
<•( Система семейства»), в частности по положению спинного и анального-
плавников и размерам последнего, следует считать подсем. Pristigaste-
riiidti, наиболее высокоорганизованным — Dussumieriinae.
Следует отметить некоторые особенности строения черепа сельдевых
(рис. 10). Fenestra auditiva (слуховое отверстие) располагается с каждой,
стороны сбоку черепа; спереди она ограничена посредством prooticum,
снизу — basioccipitale, сверху — occipitale laterale и сзади — обоими
последними костями; она закрыта перепонкой. Bulla prootica—-шаро-
видное вздутие на prooticum, в котором помещены отростки. перед-
него конца плавательного пузыря; оно снаружи на черепе слабо развито-
у Sardinops и еще менее у Sardinella', более всего развито у Sprattus и
Clupeonella. Bulla pterotica (squamosa) — такое же, но 'обычно меньшее
по размерам вздутие на pteroticum, заметное у одних (Clupea, Sardina)'
сбоку и сверху на этой кости, у других (Sardinops, Sardinella) только-
сверху, у третьих (например у Sprattus и Clupeonella) отсутствующее
не только снаружи, но и внутри (рис. И). Полости bulla prootica и Ь.
pterotica каждой стороны посредством узких костных каналов соеди-
няются в верхней части oedipitalia lateralia несколько выше отверстия,
через которое каждый-отросток плавательного пузыря входит в череп.
Это отверстие расположено впереди отверстия n. vagus и отделено-
от последнего гребнем, идущим от основания occipitale laterale и отчасти
прикрывающим сверху продольное углубление в этой кости, в котором!
расположен каждый отросток плавательного пузыря. У некоторых (Clu-
pea) это углубление целиком закрыто гребнем, образующим на occipitale
laterale с каждой стороны черепа продолговатое вздутие; отвер-
стия для отростков плавательного пузыря расположены снизу этой кости.
Относительные размеры bullae prootica и pterotica у разных родов семей-
ства различны — у одних крупнее b. prootica, у других b. pterotica.
Соотношение размеров их отчетливо видно на рентгеноснимках, по кото-
рым оно и установлено. Foramen temporale (височное отверстие) распо-
ложено с каждой стороны в верхней части черепа; оно ограничено снизу'
и сверху в передней части лобной и теменной костями и в задней части:
теменной. Fossa praeepiotica — большая ямка непосредственно позади
foramen temporale с каждой стороны в верхней части сбоку черепа;
образована спереди, сверху и сзади посредством теменной и epioticum
и снизу посредством pteroticum. Fossa temporalis posterior — меньшая
по размерам ямка с каждой стороны сзади черепа, имеющаяся у Etru-
meus, Sardinella, Sardinops, Sardina и Clupanodon, почти не развитая
у Sprattus, Clupea, Harengula и Clupeonella и отсутствующая у Alosa,
Pomolobus, Brevoortia и др.; образована сверху посредством epioticum
и снизу посредством occipitale laterale. Fossa subtemporalis (lateralis) —
еще меньшая по размерам ямка .с каждой стороны черепа сзади над отрост-
ком opisthoticum между этой костью и pteroticum; она есть сравнительно-
у немногих (Clupea, Sardinella, Sardinops, Alosa и некоторых других).
Prooticum у переднего края bulla prootica сверху пронизано отверстием,
n. trigeminus; такое же отверстие, обычно меньшее по размерам, имеется:
Рис. 10. Череп Clupea harengus.
'Р крылья парасфеноида, у основания их отверстие ведущвв в
миодом; b. pr —bulla prootica; b. pi —bulla pterotica (squamosa)-
/. a — fenestra auditiva; f. p — fossa praeeplotica; f. s — fossa sub-
temporalis; f. t — foramen temporale; f. t p — fossa temporalis poste-
nor; n. v— отверстие n. vagus; n. t— отверстие n. trigeminus ниже
него под bulla prootica второе отверстие; p. Ь — нисходящий отро
сток базисфеноида.
CLUPEIDAE
97
у переднего нижнего края или снизу bulla prootica. В occipitale laterale
с каждой стороны сбоку черепа располагается по большому отверстию
п. vagus. Каждое ethmoidale laterale пронизано отверстием n. olfacto-
rius. По такому же отверстию имеется в basisphenoideum с каждой сто-
роны от нисходящего отростка этой
вилкообразно раздваивается, об-
разуя крылья парасфеноида, рас-
ширенные в вертикальной пло-
скости и образующие боковые
стенки мио дома; у основания
каждого крыла парасфеноида рас-
положено по небольшому отвер-
стию, ведущему в миодом. Над
сочленовной поверхностью hyo-
mandibulare с каждой стороны
черепа расположено по одному
отверстию в лобной кости и по 3 в
pteroticum, которые ведут в ка-
налы системы боковой линии, со-
единяющиеся впереди в надглаз-
ничный канал. Этот канал, идущий
вдоль наружного края в каждой
из лобных костей, имеет в перед-
ней половине сверху по отверстию;
впереди каждый канал из лобных
костей выходит над ethmoidalia
lateralia. Между передними кон-
цами лобных костей и мезэтмои-
дом обычно есть большая или
меньшая по размерам фонтанель.
Окологлазничное окостенение со-
стоит из 7—8 костей: 2, иногда
1 (у Dussumieriinae) supraorbitalia,
1 praeorbitale (lacrimale), 4 infra-
orbitalia и небольшой dermosphe-
noticum; сверхуsupraorbitalia рас-
положена небольшая nasale.
Измерение сельдей производи-
лось по схеме (рис. 12), предло-
женной Бергом (1913 : 8—9):
абсолютная длина тела (а—Ь) —
расстояние от конца рыла (т. е. во
всех случаях от переднего конца
нижней челюсти при закрытом
рте) до перпендикуляра, восста-
новленного от конца нижней ло-
кости. Задняя часть парасфеноида
Рис. 11. Рентгеноснимки черепов Sprattus
sprattus balticus (1), Clupea harengus ha-
rengus (2), Clupeonella grimmi (3), Alosa
kessleri kessleri (4). b. pr — bulla prootica,
b. pt — bulla pteroti'ca.
пасти хвостового плавника; длина тела по Смитту (а — е) — рас-
стояние от конца рыла до конца средних лучей хвостового плавника;
антеанальное расстояние (а—d) — расстояние от конца рыла до начала
основания анального плавника; антедорсальное расстояние (а—е) —
расстояние от конца рыла до начала основания спинного плавника;
антевентральное расстояние (а—g) — расстояние от конца рыла до осно-
вания брюшного плавника; длина грудного плавника (/—Л); длина
7 Фауна СССР —314
98
CLUPEIDAE
брюшного плавника (g—i); высота тела наибольшая (е—Л); высота тела
наименьшая (Z—тп); расстояние между концом анального и началом
хвостового плавников (п—о);1 длина головы (а—р) — расстояние от конца
рыла до заднего края жаберной крышки (обычно совпадает с местом
соединения operculum с interoperculum, перепонка в расчет не прини-
мается); длина рыла (а—г) — расстояние от вершины нижней челюсти
при закрытом рте до переднего края глаза; диаметр глаза (г—s) — диа-
метр глазного яблока (продольный равен вертикальному; у рыб с жиро-
вым веком последнее надрезалось и частично удалялось); заглазничный
отдел головы (s—р) — расстояние от заднего края глаза до заднего края
жаберной крышки (как при измерении головы); высота головы (Z—и) —•
расстояние по вертикали от верхнего края supraoccipitale; ширина меж-
глазничного промежутка — ширина frontalia над серединой зрачка
в том месте, где располагаются задние концы supraoccipitalia (кожные
покровы в расчет не принимаются).
I
Рис. 12. Схема измерения сельдевых.
А — удлиненные чешуи при основании лопастей хвостового плавника; В — жировые веки;
' остальные обозначения см. в тексте.
Измерения частей головы выражены в процентах ее длины, измере-
ния частей тела — в процентах абсолютной длины тела, кроме сельдей
из родов Clupeonella 2 и Alosa, у которых измерения принято выра^кать
в процентах длины тела до конца средних лучей хвостового плавника.
Расчисление темпа роста сельдей ведется по длине тела до конца сред-
них лучей хвостового плавника, в тех же случаях, когда говорится о раз-
мерах рыбы, обычно принято употреблять абсолютную длину тела.
К сожалению, этого правила придерживаются не все исследователи,
и поэтому в тех случаях, когда приводится длина тела, измеренная
каким-либо иным образом, каждый раз делается специальная 'оговорка.
В частности, у сельдей из родов Clupeonella и черноморских и каспий-
ских видов Alosa длина тела в последнее время преобладающим боль-
шинством исследователей измеряется только до конца средних лучей
1 Оно характеризует длину хвостового стебля, который обычным способом, как
у других рыб и как это рекомендует в своем «Руководстве к изучению рыб»
И. Ф. Правдин, у сельдей измерить невозможно.
2 Так как род Clupeonella относится к подсем. Clupeinae, у всех родов которого
длину тела принято измерять до конца хвостового плавника, то для этого рода в под-
строчных примечаниях приведены некоторые признаки, выраженные в процентах
и к последней длине.
ТАБЛИЦА РОДОВ
хвостового плавника. Поэтому для обоих этих родов, когда говорится
о длине тела, то имеется в виду длина тела до конца средних лучей хво-
стового плавника. При просчете жаберных тычинок принимались во вни-
мание и зачаточные тычинки на концах жаберных дуг. Количество позвон-
ков, если это особо не оговорено, всюду приводится вместе с уростилем.
В некоторых случаях к просчетам позвонков другими авторами, не при-
нимавшими во внимание уростиль, прибавлялся один позвонок. Чешуи
не просчитывались вследствие того, что они на теле сельдевых сохра-
няются плохо, а просчет их по кармашкам влечет к ошибкам.
Ввиду различий в методах измерения сельдей, применявшихся раз-
ными исследователями, причем измерения зачастую производились
по рыбам, не всегда хорошо законсервированным, иногда даже по засо-
ленным, из результатов исследований сельдей другими авторами здесь
приводятся лишь счетные признаки.
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА РОДОВ
1 (2). Брюшных килевых чешуй нет. Брюхо закругленное. Брюшные
плавники позади заднего края основания спинного плавника. Жиро-
вое веко полностью закрывает глаз. (Подсем. Dussumieriinae) 1
.....................................................1. Etrumeus
2 (1). Брюшные килевые чешуи есть, обычно хорошо развитые, реже
слабые и менее заметные. Брюхо сжатое с боков и заостренное
в виде киля или закругленное. Брюшные плавники под спинным
или впереди него.
3 (20). Брюшных килевых чешуй на горле нет. Анальный плавник
менее чем с 30 лучами, начало его далеко позади заднего конца спин-
ного, брюшные плавники позади начала спинного или реже немного
впереди.
4 (19). Последний луч спинного плавника не удлинен. Supramaxilla-
ria 2.
5 (18). Верхняя челюсть без заметной медиальной вырезки. Сочленение
нижней челюсти с черепом впереди вертикали заднего края глаза
или под ней. (Подсем. Clupeinae).
6 (11). Последние два луча анального плавника не удлинены в виде
лопасти. Удлиненных чешуй при основании хвостового плавника
на лопастях его нет.
7 (10). На вертикальной части ключицы двухлопастного кожистого
выроста нет.
8 (9). Брюшные килевые чешуи хорошо развитые. Брюхо сжатое
с боков, с явственным килем на всем Протяжении от горла до аналь-
ного плавника. Брюшные плавники впереди или под началом спин-
ного. Небольшие рыбы длиной до 18 см.................2. Sprattus
9 (8). Брюшные килевые чешуи слабые.- Брюхо впереди брюшных плав-
ников закруглено, позади несколько сжатое с боков, со слабым
килем. Брюшные плавники позади начала спинного. Крупные
рыбы, в половозрелом состоянии от 10—20 см и более . . . .
................................................... 3. Clupea
10 (7). На вертикальной части ключицы двухлопастный кожистый
вырост (рис. 16). Последние два луча анального плавника слегка
1 В определительной таблице характеристика подсемейств касается лишь родов
встречающихся в фауне СССР. Более полно см. стр. 92—94.
7*
100
CLUPEIDAE
удлинены, но не образуют выдающейся свободной лопасти (рис. 15)
............................................4. Harengula
11 (6). Последние два луча анального плавника удлинены в виде лопасти
(рис. 17, 21, 24).
12 (17). Удлиненные чешуи (ala, рис. 12) при основании лопастей хво-
стового плавника есть.
13 (14). На вертикальной части ключицы двухлопастный кожистый
вырост (рис. 18). На крышечной кости радиальных бороздок нет
....................................................5. Sardinella
14 (13). На вертикальной части ключицы двухлопастного кожистого
выроста нет. На крышечной кости радиальные бороздки.
15 (16). Жаберные тычинки нижней части жаберной дуги укороченные
в углу дуги, на них налегают сверху тычинки верхней части дуги
(рис. 22). Рот большой, сочленение нижней челюсти с черепом позади
вертикали середины глаза, задний конец верхнечелюстной кости
достигает или почти достигает середины глаза, у крупных прости-
раясь и далее. Чешуи одинакового размера . . . 6. Sardinops
16 (15). Жаберные тычинки нижней части жаберной дуги в углу дуги не
укороченные, одной длины с тычинками верхней части дуги, не нале-
гающими на них сверху (рис. 25). Рот небольшой, сочленение ниж-
ней челюсти с черепом впереди вертикали середины глаза, задний
конец верхнечелюстной кости не достигает середины глаза. Чешуи
на боках тела неодинакового размера — крупные и скрытые под
ними мелкие . ........................................7. Sardina
17 (12). Удлиненных чешуй (ala) при основании лопастей хвостового
плавника нет. Двухлопастного кожистого выроста на вертикаль-
ной части ключицы и радиальных бороздок на крышечной кости
нет......................... ......................8. Clupeonella
18 (5). На верхней челюсти есть медиальная вырезка. Сочленение нижней
челюсти с черепом за вертикалью заднего края глаза. При основа-
нии лопастей хвостового плавника есть удлиненные чешуи (ala,
рис. 12). (Подсем. Alosinae) .............. 9. Alosa
19 (4). Последний луч спинного плавника вытянут в длинную нить.
Supramaxillare 1. (Подсем. Dorosomatinae) .... 10. Clupanodon
20 (3). Брюшные килевые чешуи есть и на горле. Анальный плавник
длинный, более чем с 30 лучами, начало его под спинным плавни-
ком или сразу за задним концом его. Брюшные плавники малы,
расположены впереди начала спинного. (Подсем. Pristigasterinae)
..................................................... И. Ilisha
1. Род ETRUMEUS BLEEKER
Etrumeus Bleeker, Verb. Bat. Gen., XXV, 1853 : 58 (тип : Clupea micropus
Schl.).—Perkinsia R. S. Eigenmann, Amer. Nat., XXV, 1891 : 153 (тип:
P. othonops =E. micropus). —• Montalbania 1 F о w 1 e r, Proc. Acad. Nat. Sci. Phila.,
LXXXV, 1933 : 244 (подрод, тип: E. albulina Fowler).
Верхняя челюсть без медиальной вырезки. Брюшных килевых чешуй
нет, брюхо закругленное. Жировые веки хорошо развитые, целиком
закрывают глаза. Supraorbitale 1. Удлиненных чешуй (ala) на хвостовом
плавнике у основания лопастей нет. Рот конечный, сочленение нижней
1 Бертен (Berlin, 1943 : 7) под неверным названием «Montalbiana» считает за
особый род.
1. ETRUMEUS
101
челюсти с черепом под вертикалью середины глаза, задний конец верх-
нечелюстной кости слегка заходит за вертикаль переднего края глаза.
Зубы слабые, есть на сошнике, расположены на широком гребне головки
его, на нижнечелюстных, верхнечелюстных, нёбных, мезоптеригоиде и
па языке. Жаберные тычинки верхней части жаберной дуги не налегают
па тычинки нижней части дуги, короткие, слегка утолщенные, 25—35
па нижней половине дуги. Отростки плавательного пузыря помещаются
в prooticum и pteroticum. Брюшные плавники позади заднего края осно-
вания спинного, основание спинного плавника в бороздке из увеличен-
ных чешуй, последние из них удлиненные. Рыбы средних размеров, 150—
250, иногда до 330 мм.
Скелет.1 Bulla prootica и b. pterotica почти одинаковых размеров.
Вздутие Ъ. prootica снаружи на черепе сбоку (табл. XXVII, Л) неболь-
шое, почти не выделяется над поверхностью этой кости, b. pterotica
образует небольшое вздутие сбоку и большое и выпуклое сверху черепа
под серединой основания fossa praeepiotica. Fenestra auditiva сравни-
тельно небольшая, овальной формы, далеко отстоит спереди от bulla
prootica и от гребня вдоль отростка плавательного пузыря сзади. Fossa
praeepiotica большая, в виде треугольника, обращенного углом вниз,
основанием вверх, внутренняя стенка ее перепончатая, не отделена кост-
ной перегородкой от fossa temporalis posterior. Foramen temporale неболь-
шое, почти овальной формы, невысокое, немного более высокое спереди,
по длине значительно меньше верхнего края fossa praeepiotica. Сочле-
новная поверхность для hyomandibulare состоит из двух обособленных
частей на sphenoticum и pteroticum, далеко отстоящих друг от друга;
Сошник прямой, передняя часть парасфеноида изогнутая, тонкая, сверху
закругленная, крылья парасфеноида не выдаются вниз под миодомом,
а наоборот, круто подымаются кверху, едва выдаются сзади черепа.'
Базисфеноид без нисходящего отростка. Задний край supraoccipitale
на черепе сверху (В) слегка выпуклый и закругленный, без гребня,,
с боков от него каждое epioticum расходится по обе стороны под тупым;
углом. Pteroticum сзади с длинным острым шипом. Передние концы
sphenoticum выдаются в стороны в виде, треугольников, заостренных
на концах. Ethmoidalia lateralia едва выдаются с боков черепа из-под
переднего конца лобных костей. Фантанели между передними концами,
лобных костей и мезэтмоидом нет. Поперечные отростки мезэтмоида
отходят в стороны, закругленные, выпуклые спереди, вогнутые сзади.
Череп широкий, ширина его между краями pteroticum менее 2 раз
в длине, ширина лобных костей 4—4% раза в длине его. Сошник снизу
черепа (5) широкий, плоский и короткий; передняя часть парасфеноида-
широкая и вогнутая спереди, сзади узкая к началу крыльев его; крылья
парасфеноида расходятся под серединой prooticum, вначале тесно сопри-
касаются. Opisthoticum сзади оканчивается притупленным на конце
отростком. Fossae temporales posteriores с каждой стороны на черепе сзади .
(Z) большие, глубокие. Fossae subtemporales довольно значительных;
размеров, каждая ограничена снизу посредством pteroticum и occipi-
1 Фотографию черепа Е. micropus см. у Кишинуйе (Kishinouye, 1907, pl. XXI,
f. 3). Рисунки и описание скелета головы близкого рода подсем. Dussumieriinae —
Dussumieria (D. acuta) см. у Райдвуда (Ridewood, 1904а : 468—472, figs. 130—132).
У этого вида внутренняя перегородка fossa praeepiotica, как и у Е. micropus, пере-
пончатая, но частично образована тонким пластинчатым разрастанием окружающих,
костей, фонтанели между передними концами лобных костей и мезэтмоидом нет, нет
и гребня на supraoccipitale и нисходящего отростка базисфеноида, supraorbitale 1.
102
CLUPEIDAE
tale laterale, сверху посредством epioticum; сверху внутреннего края
ямки видна bulla pterotica. На hyomandibulare сверху две обособленные
и далеко отстоящие друг от друга сочленовные головки. Quadratum без
выемки в верхнем крае. Сочленовная кость короче и ниже нижнечелюст-
ной. Предкрышечная и крышечная кости широкие. Описание дано
по одному скелету Е. micropus.
Морские рыбы.
3—4 вида в субтропических .и тропических частях Тихого, Индийского
и Атлантического океанов и в прилегающих морях у берегов юго-вос-
точной Азии, по обе стороны Сев. Америки, у южных берегов Австралии
и южной оконечности Африки. В наших водах один вид.
*1. Etrumeus micropus (Schlegel) — Уруме-иваси (табл. I).
Clupea micropus Schlegel, in: Tomminck et Schlegel, Fauna
Jap., Pisces, 1846 : 236, t. CVII, f. 2 (Нагасаки). — Etrumeus micropus В 1 e e k e r,
Verb. Bat. Gen., XXV, 1853:48 (Нагасаки); Gunther, Cat. fish., VII,
1868.; 467 (Япония). — Perkinsia othonops R. S. Eigenmann, Amer. Nat.,
XXV, 1891 : 153 (м. Лома у Сан-Диего в Калифорнии). —Etrumeus micropus Jor-
dan a. Herre, Proc. U. S. Nat. Mus., XXXI, 1906 : 628 (берега южной Япо-
нии: Ншасаки, Ваканоура, Мисаки, Аомори, Токио); Kishinouye, Journ.
Imp. Fish. Bureau, Tokyo, XIV, 3, 1907 : 100, t. XVIII, f. 1; Fowler, U. S. Nat.
Mus., Bull. 100, v. 13, 1941 : 576 (частью:1 Япония, Корея, Калифорния, Наталь). —
Etrumeus sadina Berlin, Bull. Inst, oceanogr., 853, 1943 : 9 (частью: юго-западные
берега южной Африки, юго-западные берега Японии, Гавайские о-ва). — Perkinsia
othonops Berlin, 1. с. : 13 (Сан-Диего). — Etrumeus orthonops Clothier, Fish
bull., 79, 1950 : 35, pl. I (строение позвоночника, 53—55 позвонков).
Распространение, биология. Jenkins, Bull. U. S. Fish.
Comm., XXII, (1902), 1904:432; Snyder, ibid. : 521; Jordan a. Ever-
man n, ibid., XXIII, (1903), 1905 : 58 (Гавайские о-ва: Гонолулу); Gilchrist
a. Thompson, Ann South Afr. Mus., VI, 1908—1910 : 268 (Наталь); Franz,
Abh. Bayer. Akad. Wiss., IV, Suppl.-Bd. 1, 1910 : 5 (Иокогама, Абуратсубо); Fow-
ler, Copeia, 112, 1922 : 82 (Гавайские о-ва); Barnard, Ann. South Afr. Mus.,
XXI, I, 1925 : 108 (порт Елизаветы, Наталь); Jordan a. Hubbs, Mem. Car-
negie Mus., X, 2, 1925 : 120 (восточные берега Японии: Мисаки, Токио, Тоба, Осака,
Кобе, Цоси); Fowler, Mem. Bernice Р. Bishop Mus., X, 1929 : 29 (Гавайские о-ва:
Гонолулу, Гило, Оау); Солдатов и Линдберг. Обзор рыб дальневост,
морей, 1930 : 37 (зал. Петра Вел.); Шмидт, Изв. АН СССР, отд. мат. и ест.
наук, 1931 : 103 (Нагасаки); Тр. Тихоокеанск. комит. АН СССР, II, 1931 : 18 (Каго-
сима); Mori a. Uchida, Journ. Chosen Nat. Hist. Soc., 19, 1934 : 4 (Вонсан,
Пусан); Fowler, Proc. Acad. Nat. Sci. Phila., LXXXVI, (1934) 1935 : 410 (Наталь);
Румянцев, Зоолог, журн., XXVI, 1, 1947 : 47 (зал. Петра Вел., после 1914
по 1938 г.).
D III—IV 16—18 (16.7), общим числом 20—22 (20.6), А II 8—9 (18.3),
общим числом 10—11 (10.3), 7 17, sp. Ъг. 42—50 (47.3), на нижней поло-
вине жаберной дуги 32—35 (34.2), vert. S. 52—54 (53.50), caud. vert.
37—39 (38.25). Брюшко закругленное, без килевых чешуй. Голова сравни-
тельно небольшая и узкая, длина ее 20.0—21.2 (20.6)% длины тела, меж-
глазничный промежуток 19.1—20.8 (20.1)% длины головы, глаза 27.8—
33.7 (29.6)% той же длины. Тело низкое, наибольшая высота его 12.3—
15.5 (13.6)%, высота половы у затылка 11.9—12.7 (12.4)% длины тела.
Тело грязно-синее, голубоватое на боках, брюшко серебристо-белое.
Длина обычно от 70 до 228 мм, наибольшая до 330 мм. По Фаулеру
(Fowler, 1941), sp. Ъг. 14—16 33—35, squ. (повреждены) 47—55. Опи-
сание сделано по 7 экз. длиной от 166 до 250 мм из Японского моря" * Е.
1 Фаулер считает идентичным этому виду Е. jaksoniensis Macleay от берегов
Австралии, так как исследованный им небольшой экземпляр не отличался от
Е. micropus.
2. SPRATTUS
103
от берегов о-ва Хондо против зал. Тоями (май—июнь) и от берегов южной
Японии (Кагосима).
Этому виду, возможно, идентичен Е. jacksoniensis Macleay (Proc.
Linn. Soc. N. S. Wales, III, 1879 : 36, t. IV, f. 1). Если это действительно
так, то широкий и прерывистый ареал Е. micropus (см. ниже) включает
также западные, южные и восточные берега Австралии.
Распространение. Тихий океан, западная часть Индий-
ского океана и прилегающие моря. В Японском море на север до зал.
Петра Великого и Ваканоуры на о. Хондо, на юг вдоль берегов Кореи
до Пусана, вдоль берегов Японии до Нагасаки и Кагосимы в Восточно-
Китайском море; вдоль восточных берегов Японии на север до Сангар-
ского прол. (Аомори). Гавайские о-ва. Однажды был обнаружен у бере-
гов Калифорнии (м. Лома у Сан-Диего). Юго-восточные берега южной
оконечности Африки (порт Елизаветы и Наталь).
Биология изучена мало. Наиболее обычен у берегов южной
Японии, в заливах с песчаными грунтами. В наших водах появился
в связи с потеплением после 1914 г. и ловился с середины июня до сере-
дины октября по 1938 г. включительно. В июле 1945 г. один экземпляр
был пойман в зал. Посьета.
Хозяйственного значения в наших водах не имеет.
У берегов Японии добывается свыше 200 тыс. ц, основная масса —
у южных берегов ее тихоокеанского побережья.
2. Род SPRATTUS GIRGENSOHN — КИЛЬКИ ИЛИ ШПРОТЫ
Sprattus Girgensohn, Mem. savans etrangers Acad. Sci. Petersb., V, Janv.,
1846 : 534 (тип: 5. haleciformis Girgens.=N. sprattus х). — Spratella N alencien-
nes, inrCuvier et Valenciennes, Hist. nat. poiss., XX, 1847 : 356
(тип N. pumila Vai.=5'. sprattus sprattus). — Meletta Valenciennes, 1. c. : 366
(тип M. vulgaris Vai.=5. sprattus sprattus). — Maugeloclupea Whitley, Rec.
Austr. Mus., XVIII, 6, 1932 : 332 (тип: Clupea bassensis McCulloch). —Spratella Берг,
Рыбы пресных вод, I, 1932 : 99.— Sprattus Берг, Рыбы пресных вод, I, 1948 : 157.
Верхняя челюсть без заметной медиальной вырезки. Жировые веки
слабо развитые, прикрывают глаза сзади и отчасти спереди. Удлинен-
ных чешуй (ala) при основании хвостового плавника у основания лопа-
стей нет. Последние два луча анального плавника не длиннее предыду-
щих. На вертикальной части ключицы двухлопастного кожистого выро-
ста нет. Крышечная кость гладкая, без радиальных бороздок. Брюхо
сжатоэ с боков, брюшные килевые чешуи хорошо развиты на всем про-
тяжении от горла до анального плавника, 16—25 впереди брюшных
плавников, 8—13 позади них, образуют ясно заметный киль как позади,
так и впереди брюшных плавников. Сочленение нижней челюсти с чере-
пом и задний конец верхнечелюстной кости между вертикалями перед-
него края глаза и середины его, нижняя челюсть выдается вперед. Сла-
бые зубы есть у некоторых на сошнике (S. antipodum, S. muelleri, иногда
у S. sprattus1 2), расположены на узком и высоком продольном гребне
на головке, ряд слабых зубов на нёбных костях (нет у S. arcuatus и неко-
торых других) и на мезоптеригоиде (у S. sprattus). Жаберные тычинкй
верхней части жаберной дуги не налегают на тычинки нижней части
дуги, тычинки довольно длинные и тонкие, 25—41 на нижней половине
дуги (у S. sprattus 30—41). Отростки плавательного
1 Это, повидимому, i£. sprattus balticus.
2 По указанию Гейнке (Heincke, 1898 : LXX).
104
CLU PEIDAE
пузыря помещаются т о. л ь к о в prooticum, в ptero-
ticum отсутствуют. Брюшные плавники впереди или под вертикалью
переднего края спинного, V у одних I 6,1 у других I 7. Основание спин-
ного плавника в бороздке из небольших чешуи. Позвонков 42—50
(у S. sprattus 45—49). Пилорических придатков 6—10. Пятен на боках
тела и за жаберной крышкой нет. Икринки пелагические, без жировой
капли и с малым околожелтковым пространством. Небольшие рыбы
длиной менее 200 мм.
Скелет.1 2 Bulla prootica крупная, образует большое вздутие и сна-
ружи на черепе сбоку (табл. XXVIII, Л). Отросток плавательного пузыря
каждой стороны тела помещается в углублении вдоль переднего края
occipitalia lateralia. Fenestra auditiva большая, продолговатая, передний
конец ее сразу за bulla prootica, задний отделен от отверстия n. vagus
узким промежутком. Fossa praeepiotica большая и высокая, края ее
образуют треугольник, обращенный углом вниз, задний верхний угол
закруглен. Foramen temporale небольшое и низкое, длина его менее
длины fossa praeepiotica. Сочленовная поверхность для причленения
hyomandibulare одна, не разделена на две части на sphenoticum и pte-
roticum. Парасфеноид слегка изогнутый, крылья его не выдаются вниз
под миодомом, длинные и заостренные сзади. Нисходящего отростка бази-
сфеноида нет.3 * * Задний край supraoccipitale и каждого epioticum на черепе
сверху (В) расходится в стороны и назад под тупым углом. Pteroticum
сзади без шипа. Передний конец каждого sphenoticum направлен в сто-
роны и вперед, с тупым концом. Из-под переднего конца лобных костей
по обе стороны выдаются задние и слегка передние крылья ethmoidalia
lateralia. Поперечные отростки мезэтмоида направлены в стороны и впе-
ред, закругленные на концах. Череп сравнительно узкий, наибольшая
ширина его около 2Уг раз в длине, наибольшая ширина лобных костей
около 22/з раз. Сошник снизу черепа (В) с узким длинным гребнем, про-
стирающимся почти на половину длины сошника. Передняя часть пара-
сфеноида с продольной вогнутостью, немного более узкая сзади, крылья
парасфеноида широко разделяются под передним концом prooticum.
Fossae temporales posteriores на черепе сзади (Z7) почти не развиты.
Довольно широкие, но неглубокие fossae subtemporales располагаются
с каждой стороны черепа между задними концами opisthoticum и р!ё-
roticum. Hyomandibulare сверху с одной головкой для сочленения с чере-
пом, слегка суженной в передней части. Quadratum без выемки в верх-
нем крае. Нижнечелюстная и сочленовная кости высокие, сочленовная
короче нижнечелюстной. Описание дано по многим скелетам S. sprattus
balticus и нескольким A. sprattus phalericus.
Морские рыбы.
Один вид в субтропическо-умеренных частях Атлантического океана
у берегов Европы (рис. 13). Кроме того, к этому же роду относятся из юж-
ного полушария: 5. antipodum (Hector, 1872) (1 экз. длиной 122 мм, прол.
Фово между о. Стюарта и южной оконечностью Новой Зеландии); S. rnuel-
leri (Klinzinger, 1880) (размеры 90—100 мм, Новая Зеландия); S. bas-
1 У S. sprattus изредка на одной стороне бывает I 5 и I 7 при нормальном числе
(I 6) на другой.
2 Описание черепа и рисунки см. в работах Мэтьюза (Matthews, 1887 : 274—292>
и Райдвуда (Ridewood, 1892 : 36, fig. 6; 1904а : 454—459).
3 Вряд ли он мог быть обломан, так как разыскивался на многих черепах при
их препаровке. У салаки таких же размеров, как балтийский шпрот, нисходящий
отросток на базисфеноиде есть постоянно.
Рис. 13. Распространение рода Sprattus.
. sprattus sprattus; 2 — S. sprattus balticus; 3 — S. sprattus phalericus; 4 — S. antipodum; $ — S. muelleri; S — S. bassensis; 7— S, melanostoma;
9 — s. arcuatus.
GO
1
106
CLUP'ETDAE
sensis (McCulloch, 1911) (размеры 110—130 мм, южные берега Австра-
лии и Тасмании); S. arcuatus (Jenyns, 1842) (размеры 60—90 мм, от Уру-
гвая до Огненной Земли); S. melanostoma (Eigenmann, 1907) (размеры
•65—80 мм, Рио де ла Плата; близок к предыдущему виду, отличается
более низким телом и меньшим количеством лучей в D и А). Различия
между большинством этих видов незначительные, как это видно из нижо-
•следующего.1
V S. sprattus sprattus .... I 6—7 8. sprattus phalericus ... I 6 6’. sprattus lalticus . . . .16(7) N. arcuatus I 6 5. melanostoma I 6 8. antipodum I 7 S. muelleri I 7 8. lassensis I 7 D A 15—19 17—21 16—18 17—21 15—19 17—21 16—18 22—23 15—16 17—22 16—17 16—18 15—16 16—18 Squ. са 42 са 42 48 43—44 46—48
.8. 8. 8. 8. .8. s. .8. 8. sprattus sprattus . ... . sprattus phalericus .... sprattus lalticus arcuatus melanostoma antipodum muelleri bassensis Килевых чешуй 20—24-Ц8) 10- 20—22-[-10—12 20-234-10—13 16—19-j- 9—10 17—204- 9—10 21-4-12 19—204- 9—11 13 Vert. Сошник 47—49 Без зубов1 2 46—49 » » 47—50 » » — » » 43 » » 46 Пучок зубов 42 » . » 46 Без зубов Sp. br. 34—40 34—40 30—41 са 28 25 38 36—39
Род Sprattus большинством авторов объединяется с родом Clupea.
Однако оба рода отличаются такой существенной морфологической осо-
бенностью, как отсутствие отростков плавательного пузыря в pteroticum
у первого и наличием bulla pterotica у второго. По этому признаку к роду
Sprattus, кроме S. sprattus, с несомненностью относятся S. bassensis и
.S. arcuatus, у которых отсутствие bulla pterotica установлено по рент-
геноснимкам. У остальных видов, отсутствующих в наших коллекциях,
эта важная анатомическая особенность остается невыясненной. Оба рода
также существенно различаются значительно более развитыми и острыми
килевыми чешуями у Sprattus, образующими острый киль на всем протя-
жении от горла до анального плавника. По этому признаку, а также
по положению брюшных плавников впереди или под вертикалью перед-
него края спинного к роду Sprattus относятся S. melanostoma, S. muelleri
и S. antipodum. Относительно Cl. bentincki и Cl. juegensis, предположи-
тельно относимых автором (1949 : 47, рис. 4) к этому роду, см. сравни-
тельные замечания к роду Clupea (стр. 117)., Различие между видом север-
ного полушария и большинством видов южного заключается главным
•образом в меньшем числе килевых чешуй у последних, в наличии у боль-
шинства их 7 разветвленных лучей в брюшном плавнике и у некоторых —
-зубов на сошнике. Однако, как указывалось выше, у A. sprattus, как
исключение, в брюшном плавнике также бывает 7 разветвленных лучей и
1 Данные для таблицы взяты из работ следующих авторов: Ригэна (Regan,
1916 : 4—6; 1917а : 226), Нормана (Norman, 1936 : 491; 1937 : 37), Гейнке (Heincke,
1898 : 191 —количество позвонков у N. sprattus sprattus)', для подвидов <S. sprattus
— по нашим данным.
2 У экземпляров из Скагеррака на сошнике иногда бывают зубы (Heincke,
'.1898. : LXX).
2. SPRATTUS
107
зубы на сошнике. Некоторые из перечисленных видов, изученные еще
л малой степени, возможно идентичны.1
*1. Sprattus sprattus (L.)—Шпрот.
Clupea sprattus Linne, Syst. nat., ed. X, 1758 : 318 (Habitat in oceano Eu-
opeo).
Сошник обычно без зубов, реже имеются зубы, есть слабые зубы
па нёбных костях и на мезоптеригоиде, V I (5) 6 (7), общим числом обычно
7, изредка 6 и 8, А 17—21, sp. br. 42—59, на нижней половине жаберной
дуги 30—-41, vert. 46—50.
Морские рыбы, но заходят и в солоноватые воды, некоторые подвиды
живут и размножаются в морях с пониженным содержанием солей.
Разделяются на 3 слабо различающихся подвида, каждый из которых
распадается на несколько еще менее различающихся более низких систе-
матических форм.
Распространение. Атлантический океан у берегов Европы
от Гибралтарского прол, до Лофотенских о-вов, Балтийское море, евро-
пейские берега Средиземного и прилегающих к нему морей, Черное море
(рис. 13).
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА ПОДВИДОВ
1 (4). Общее число килевых чешуй в среднем не менее 33, за брюшными
плавниками в среднем не менее 11.2. Голова широкая, межглаз-
ничный промежуток 16.5—21.5%, в среднем не менее 18.5% длины
головы.
2 (3). Килевых чешуй позади брюшных плавников в среднем более 11.5.
Атлантический океан у берегов Европы. Северное море.............
....................................S. sprattus sprattus (L.)1 2
3 (2). Килевых чешуй позади брюшных плавников в среднем . менее
11.5. Балтийское море. . . *lb. S. sprattus balticus (G. Schneider)
4 (1). Общее число килевых чешуй в среднем не более 33, за брюшными
плавниками в среднем не более 11.3. Голова узкая, межглазнич-
ный промежуток 15.5—18.9%, в среднем около 16.5% длины головы.
Средиземное, Адриатическое и Черное моря........................
...........................* la. S. sprattus phalericus (Risso)
*la. Sprattus sprattus phalericus (Risso) — Черноморская (среди-
земноморская) килька, шпрот, сардель (у Одессы), сардинка (у Очакова)
(табл. I).
Clupanodon phalerica Risso, Hist. nat. Europ. merid., Ill, 1826 : 452 (берега
приморских Альп, залив у Ниццы). — Clupea papalina Bonaparte, Cat. met.
pesci Europ., 1846 : 34 (Адриатическое м.). — Meletta phalerica Moreau, Hist,
nat. poiss. France, III, 1881 : 445, f. 196 (Средиземное м.: Ницца, Тулон, Сетт).—
Clupea phalerica S m i t t, Scand. fish., II, 1896 : 976 (Генуя; 1 экз.). — Clupea suli-
nae A n t i p a, Denkschr. Akad. Wiss. Wien, math.-naturw. KI., LXXVIII, (1905),
1906 : 38, t. H, t.^III, f. 1—6 (Черное м. перед Сулинским гирлом Дуная); В р а у-
нер, Тр. Бессарабск. общ. естеств.. II, 2, 1912 : 127 (Бугаз у устья Днестровского
лимана; 3 экз.). — Clupea sprattus (Meletta phalerica} F a g e, Rept. Danish Ocea-
nogr. Exped. 1908—1910, 6, II (Biology), A. 9, 1920 : 94 (Средиземное м. от Испании
до Греции). — Clupea papalina Page, 1. с. : 94, 108 (Адриатическое м.). — Clupea
1 Например antipodum и б1, muelleri (см.: Whitley, Mem. Quensl. Mus.,
XI, 1937 : 118).'
2 Для S. sprattus sprattus величины, приводимые в определительной таблице и
во введении, получены по 30 экз. от берегов Испании (Виго).
108
CLUPEIDAE
sulinae F age, 1. c. : 96, 109 (Черное м. к северу от Босфора). — Spratella serdinka
Никольск и й, Билл. Гос. черном.-азовск, научно-пром, опытн. ст., 6—7,
1923 : 2 (Очаков); там же, 8—9, 1923 : 6, фиг. — Clupea maeotica (non Grimm)
Д p e н с к и, Тр. Българск. природоизпит. друж., XI, 1924 : 57 (обычен у берегов
Болгарии). —Spratella sprattus phalerica Д р е и с к и, Свед. землед., XII. 7—8,
1931 : 8 (Бургас, Месемврия, Варна); Берг, Докл. АН СССР, А, 1931 : 123 (срав-
нение с другими формами вида, синонимы). — Sprattus sprattus phalericus Берг,
Рыбы пресных вод, I, 1948<: 158; Казанова, в: Промысловые рыбы СССР,
1949 : 140.1
Распространение, биология. Devedjian, Pcche el peche-
ries en Turquies, Constant., 1926 : 52 (у берегов Турции); В о д я и и ц к и й, Раб.
Новоросс. биолог, ст., I, 4, 1930 : 101 (Новороссийская бухта; икринки с половины
ноября до апреля при температуре воды от 15 до 5°); С ы р о в а т с к и й, Зап.
Гос. ихт. опыти. ст., IX, 21—22, 1930 : 49 (Березанский лиман); Попов, Докл.
АН СССР, 9, 1930 : 211 (у берегов Крыма); Книпович, Тр. Азовско-черпом.
научно-пром, эксп., 5, 1932 : 361 (южная часть Азовского м.); Сыровато кий,
Докл. АН СССР, II, 3, 1934 : 199 (у о. Тепдра и Одессы; нерест в июне); В о д я-
н и ц к и й, Тр. Севастоп. биолог, ст., V, 1936 : 1, 7, 35 (нерест в мае—июне); П ч е-
л и п а, Тр. Новоросс. биолог, ст., II, 1, 1936 : 27 (у Новороссийска; икринки);
К л е й н е н б е р г, Бюлл. Моск. общ. испыт. прир., отд. биолог., XLV, 5, 1936 : 349
(ролйв питании дельфина); Докл. АН СССР, XV, 8, 1937 : 510 (Черное море против
Ялты и северокавказского побережья; круглый год); Пилявская, Рыбп. хоз.
СССР, 1937, 8 : 18 (миграции, возраст, уловы); Косякина, Тр. Новоросс. био-
лог. ст., II, 2, 1938 : 14 (у Новороссийска; икринки с начала ноября до середины
мая, в массовом количестве в январе и феврале); Малятский, Природа, 1938,
5 : 96 (Черное м. между Очемчири и м. Пицунда на глубине 20—40 м, в галистати-
ческой области отсутствует); Page, Homage a oeuvre G. Antipa, Bucur.,
1938 : 201 (верхний предел температуры размножения); Ц а л к и н, Тр. Азовско-
черном. научно-исслед. инет, морск. рыбн. хоз. и океаиогр., И, 1938 : 218 (роль
в питании дельфина); П ч е л и н а, Тр. Новоросс. биолог, ст., II, 3, 1940 : 52
(у Новороссийска; личинки в феврале—апреле); К л е й и е н б е р г, Моск,
общ. испыт. прир., юбил. изд., 1940 : 13 (роль в питании дельфина); Голенченко,
Рыбн. хоз., 1940 : 6—14 (распределение в море против берегов Кавказа); Кро-
тов, Докл. АН СССР, XXXIII, 2, 1941 : 162 (плодовитость); Голенченко,
Рыбн. хоз., 1948, 4 : 5, рис. 2 (скопления); Смирнов, Докл. АН СССР, LXX,
1, 1950 : 129, рис. 1 (порционность икрометания); Алеев, там же, LXXXII, 1,
1952 : 161, рис. 1 (порционность икрометания, продолжительность нерестового
периода); Павловская, там же : 165, рис. 1 (места и время икрометания).
D IV—V 11—14 (12.6), общим числом 16—18 (17.0), А II—IV 15—
19 (16.8), общим числом 17—21 (19.0), 7 16, sp. Ъг. 49—59 (52.7), на ниж-
ней половине жаберной дуги 34—40 (36.8), килевых чешуй 20—22 -|-
10—12 (20.9 + 10.6), общим числом 30—34 (31.4), vert. S. 47—49 (47.50),
caud. vert. 28—31 (29.45). Голова узкая и удлиненная, межглазничный
промежуток 15.3—17.8 (16.5)% длины головы, длина головы 19.9—22.0
(21.0)% длины тела. Тело низкое, наибольшая высота 15.0—18.3 (le.O)0/^
длины его, высота головы у затылка 12.8—14.9 (14.5)% той же длины.
Спина сине-аспидного цвета, переходящего без резких границ в серо-
серебристый цвет боков тела. Вершина рыла и нижней челюсти черно-
ватые. Радужина серебристая с черными продолговатыми пятнами сверху.
Размеры в Черном море наичаще 60—80 мм, наибольшие до 130, изредка
до 160 мм. Описание дано по 30 экз. длиной от 89 до 112, в среднем
103.5 мм, из северо-западной части Черного моря у Очакова.
Морская форма, заходит в опресненные предустьевые пространства.
По данным А. А. Майоровой, у экземпляров из восточной половины Чер-
ного моря длиной 65—428 (90.8) мм sp. Ьг. 46—62, позвонков 46—49
(47.7), килевых чешуй 29—33 (31.1); по ее исследованиям, шпроты
1 Выше не упомянута работа, опубликованная в недоступном автору издании
(Borcea, С. R. Acad. Sci. Roumaine, I, 1936 : 219—221).
2. SPRATTUS
109
из разных районов восточной половины Черного моря не различаются.
Но исследованиям Фажа (Fage, 1920), у экземпляров из Адриатического
моря килевых чешуй 20—22-j-lO—42 (21.0+10.3), общим числом 30—
32 (31.3), позвонков 46—-49 (47.5) (146 экз.); у экземпляров из Лион-
ского зал. килевых чешуй 20—22-J-10—12 (21.3-J-11.3), общим числом
31—34 (32.7) (23 экз.)
Этот подвид, повидимому, распадается на несколько форм. В част-
ности, у экземпляров из Адриатического моря антедорсальное расстоя-
ние меньше, чем у экземпляров из Черного моря, а количество килевых
чешуй меньше, чем у экземпляров из Лионского зал. Идентичность
этому подвиду Spatella serdinka Nikolsky установлена Бергом (1931).
Неправильность мнения Фажа (Fage, 1920), ошибочно принявшего про-
центные отношения длины головы и антедорсального расстояния за абсо-
лютные величины и считавшего поэтому Clupea sulinae Antipa особым
видом, установлена также Бергом (1931).
Распространение. Европейские берега Средиземного моря
и прилегающих к нему морей от Испании до Греции, наиболее обычен
в Адриатическом море; Черное море. В Черном море повсеместно, но в наи-
большем количестве временами у юго-восточных берегов Крыма, Кав-
каза в районе Поти—Новороссийска и в северо-западной части моря
в районе Тилигульский берег—Аджиаск—Очаков. Заходит в Керчен-
ский прол, и прилегающие к нему части Азовского моря, в Днепровско-
Бугский, Березанский, Днестровский лиманы, в теплое время года
в Тилигульский, Григорьевский, Дофиновский и Сухой.1 Нерест против
всего советского побережья Черного моря, как у берегов, так и в отда-
лении до 60—80 миль,1 2 главным образом в северо-западной и юго-вос-
точной частях моря, менее интенсивно у южного берега Крыма и в северо-
восточной части.
Биология. Икрометание происходит в течение почти всего года,
с конца 'июля по май; начало его приходится на более ранние сроки и
длительность больше в западной части моря, чем в восточной. В северо-
западной части моря икринки встречаются с конца июля по май, у берегов
Крыма, к югу от Керченского прол, и у северных берегов Кавказа —
с конца августа по май, у берегов Грузии (Сочи—Батуми) — с конца
сентября по март. В начале икрометания, с конца июля по 'сентябрь
в западной половине моря и с августа по ноябрь в восточной, нерестуют
отдельные особи, на глубине 40—80 м при температуре воды 7—10°.
В конце икрометания, в апреле—мае, на этих же глубинах встречаются
единичные икринки. В северо-западной части моря единичные икринки
обнаружены в конце июля на глубинах не менее 15—20 м при темпера-
туре воды 8—9°. Интенсивный нерест здесь начинается с конца октября,
в наибольшем количестве икринки найдены в опресненной части, при-
мыкающей к Днестровскому лиману. Против южного берега Крыма,
к югу от Керченского прол, и у северных берегов Кавказа единичные
икринки найдены в конце сентября на глубине 45—80 м при темпера-
туре воды 6—-8°. В поверхностных слоях при температуре 20—23° икри-
нок здесь не было; они обнаружены в поверхностных слоях в конце сен-
тября при температуре воды 16.5°. В период массового нереста шпрот
держится как у берегов, так и в отдалении от них (до 60—80 миль), как
1 Проникает единичными экземплярами, по всей вероятности, из моря при про-
рывах пересыпей, отделяющих лиман от моря.
2 Здесь и далее — морские мили (1.85 км).
CLUPEIDAE
у поверхности, так и до глубины 100 м, не образуя больших промысло-
вых концентраций, а встречаясь в виде небольших разреженных кося-
ков. У берегов Грузии единичные икринки обнаружены в конце сентября
на глубине 25—50 м при температуре воды 9.5—1(3°. В апреле здесь
встречались только личинки и мальки, обнаруженные в этом районе
в наибольшем количестве (Павловская, 1952). У берегов Румынии икро-
метание длится до июля (ст. ст.) (Antipa, 1906), в Средиземном море и
в прилегающих морях нерестует с декабря по апрель, в северной части
Адриатического моря при температуре 8—10° и солености не ниже 35°/ос>
(Fage, 1920). Плодовитость от 575 до 2398 икринок (Пилявская, 1937),
по другим указаниям (Кротов, 1941), — от 1180 до 2416, в среднем 1398
икринок (длина рыб 50—75 мм). Икрометание порционное, икра выме-
тывается в три порции, причем большая длительность нерестового пери-
ода обусловлена, судя по всему, не растянутостью нереста отдельных
особей (Смирнов, 1950), а неодновременностью их созревания (Алеев,
1952). Личинки выклевываются через 4—5 дней по оплодотворении (Водя-
ницкий, 1930). С повышением температуры воды молодь от берегов, пови-
димому, отходит, так как в теплое время года мальков-сеголетков в Ново-
российской бухте не найдено (Водяницкий, 1936; Косякина, 1938; Пче-
лина, 1940). Наибольшее количество мальков, по наблюдениям А. А.
Майоровой, встречалось на расстоянии от 3 до 5 миль от берега, в наи-
большей концентрации в районе Абхазии и Анакрии. В Средиземном,
море встречается в незначительном количестве, наиболее обычен в глу-
бине заливов, перед устьями в наибольшем количестве встречается
в Адриатическом море. У берегов северной Африки отсутствует по при-
чине высоких температур воды, близких даже в зимнее время (декабрь—
февраль, в среднем 14°) к верхнему пределу температурных условий
нереста (Fage, 1920). В открытых частях Черного моря, повидимому,
держится в значительном количестве круглый год, образуя временами
в отдельных местах более значительные концентрации, но в галистати-
ческой области, по наблюдениям С. М. Малятского, отсутствует. В вос-
точной части Черного моря образует скопления весной, в марте—маег
в 30—40 милях против берегов Кавказа между Туапсе и Новороссий-
ском. Позднее, в мае—июне, образует скопления в 20—30 милях против
берегов Крыма между м. Сарыч и м. Меганом, которое держится на одном
месте около 3 месяцев, исчезая в августе—сентябре. Осенью, в сентя-
бре—ноябре, образуется скопление против берегов Кавказа на тех же-
местах, что и весной.1 Эти скопления сопровождаются косяками дельфи-
нов, усиленно питающимися шпротами (Голенченко, 1940; Цалкин, 1938;
Клейненберг, 1936, 1940). В летнее время против кавказских берегов
в открытом море (в 80 милях от берега) держится мелкий шпрот длиной
около 30 мм, ближе к берегу (в 15 милях) — более крупный, длиной
около 50 мм; в прибрежной зоне над глубинами 20—30 м встречается
шпрот длиной от 50 до 70 мм и крупнее. После нереста производители
подходят к берегам, молодь же первый год жизни, по наблюдениям
С. М. Малятского, проводит в открытом море, отходя от берегов в теплое-
время года (Пчелина, 1940). В прибрежную область в промысловом коли-
честве у анатолийских берегов вместе с хамсой ловится с декабря по март
и с мая по конец сентября вместе с атеринкой (Devedjian, 1926). К кав-
1 По сообщению Н. Аслановой, Черноморской экспедицией ВНИРО такие по-
стоянные скопления в открытых частях Черного моря не наблюдались. Повидимому,.
в нерестовое время держится разреженно на большом пространстве, как об этом сви-
детельствует и Павловская (1952).
2. SPRATTUS
11Г
казским берегам подходит в ноябре—декабре и держится в течение всей
зимы до мая—июня. В районе Адлера вылавливается вместе с хамсой,
с декабря по апрель, составляя, по наблюдениям А. А. Майоровой,
в большинстве случаев преобладающую массу улова. По ее же наблю-
дениям, в большом количестве зашел в Азовское море в 1930 г., ловясь-
в июне—августе вдоль северного побережья Керченского прол. (Мама,
Юргаков кут), а также в 1925 г. (Книпович, 1932). Единичными экзем-
плярами был обнаружен весной 1935 г. в Керченском прол. (Пилявская,.
1937). В северо-западной части Черного моря в промысловом количе-
стве подходит к берегам с апреля—мая и ловится до сентября—октя-
бря, наибольшие уловы бывают в июле, в некоторые годы в июне и авгу-
сте, иногда в мае. В годы слабого подхода младших возрастных групп,
(двухгодовалых) наибольшие уловы бывают в мае и в июне. В годы массо-
вого подхода мелкой кильки наибольшие уловы бывают в июле и авгу-
сте. Вначале подходят старшие возрастные группы, в конце апреля,,
в мае и июне главным образом трехгодовалые, частично четырехгодо-
валые, в июле—августе — двухгодовалые. Косяки обычно состоят в основ-
ном из одной возрастной группы, иногда с небольшой примесью рыб
другого возраста. Подходят главным образом в районе Тилигульский
берег—Аджиаск—Очаков, к о. Тендру обычно подходит незначи-
тельное количество (Пилявская, 1937). К берегам Румынии в массе под-
ходит в июне и октябре (Antipa, 1906). У берегов Болгарии обычен летом
(Дренски; 1931). К берегам в наибольшем количестве подходит при тем-
пературе воды 15—20°, при 11—-12° уловов нет или они незначительны,,
точно так же как и при повышении температуры воды до 25° (Пилявская,.
1937). В северо-западной части Черного моря наибольшие уловы со-
впадают с северо-западными и восточными ветрами. Молодь здесь в массе
подходит к берегам в июле—августе, когда температура воды здесь наи-
более высока (Пилявская, 1937). Размеры шпрота, ловимого у берегов
Кавказа, колебались от 35 до 110 мм, наичаще 55—80 мм, причем
у Сухуми, по наблюдениям А. А. Майоровой, шпрот ловится ’более-
крупный, чем у Батуми. В северо-западной части Черного моря
ловится шпрот несколько более крупный, чем в восточной половине
моря, размеры его от 35 до 130 мм, средние размеры колеблются от 61
до 80 мм, предельный возраст 5 лет. Рост, по данным Пилявской (1937),
происходит следующим образом:
Возраст....... 1 2 3 4 5
Длина (мм) . . . 27.9 48.1 71.9 83.5 90.9
Содержание жира сравнительно не велико, в северо-западной части
Черного моря около 2.34%.
Хозяйственное значение в Черном море в настоящее-
время небольшое, но ул">вы могут быть во много раз увеличены, так как
имеющиеся большие запасы не используются. Уловы в Черном море-
в 1937—1938 гг. составляли 13.2—34.7 тыс. ц, из них в северо-западной
части моря добыто 11.2—31.6 тыс. ц, у берегов Крыма и у входа в Кер-
ченский прол. 0.8, у берегов Кавказа 1.2—-2 тыс. ц. В Средиземном море
и прилегающих к нему морях, кроме Адриатического, промыслового зна-
чения не имеет. Ловится у берегов совместно с другой рыбой в северо-
западной части моря с апреля по август, отчасти до октября, у берегов
Крыма — в июне—-июле, у берегов Кавказа — в декабре, затем.
в апреле—мае.
112
CLUPEIDAE
*lb. Sprattus sprattus balticus (G. Schneider) — Балтийская килька,
шпрот (табл. I).
Clupea sprattus Linne, Fauna Svecica, ed. II, 1761 : 128 (Habitat in mari);
Pallas, Zoogr. rosso-asiat., Ill, 1811 : 214 (Ревель, Балтийский порт). — Meletta
vulgaris Кесслер, Рыбы СПб. губ., 1864 : 19О'(Финский зал., на восток до устья
Наровы, по указанию рыбаков — до Кронштадта). — Clupea sprattus Smi t t,
Scand. fish., II, 1895 : 974, pl. XLIV, f. 2 (частью: Балтийское и., Финский и Бот-
нический заливы); Heincke, Naturgesch. d. Herings, I 1898 : LXIX, 177—185,
202—203, Taf. VII, f. 3, 5, 6, Taf. XX, f. 1, 2 (Киль, Гела, Стокгольм; измере-
ния). — Clupea sprattus balticus G. Schneider, Korrespondenzbl. Naturf.-Ver.
Riga, XLVII, 1904 : 66 (nomen). — Clupea sprattus var. baltica G. Schneider,
Rapp. Proces-Verb., IX, 1908 : 94, 96 и след. (Балтийское м.; измерения, нерест,
рост).1 — Spratella sprattus baltica Берг, Рыбы пресных вод, I, 1932 : 99. —
Sprattus sprattus balticus Берг, Рыбы пресных вод, I, 1948 : 157; Т е л е г и н,
в : Промысловые рыбы СССР, 1949 : 137, табл. 34.
Распространение, биология Henecke, Fische, Fischer, u.
Fischz. Ostpreuss., 1881 : 172 (мертвые после нереста); Mobius u. Heincke,
Fische d. Ostsee, 1883 : 139 (Балтийское м.); H i n k e 1 m a n n, Mitt. Deutsch.
Seefischerei-Ver., XVI, 6, 1899 : 127 (Кильский канал); Schneider u. Levan-
d er, Acta Soc. Fauna Flora fennica, XX, 1, 1900 : 9, 46 (питание, нерест и развитие
икры); G. Schneider, Zool. Anz., XXV, 659, 1901 : 9 (Финский зал.; нерест);
Acta Soc. Fauna Flora fennica, 22,4, 1901 : 50 (время нереста); ibid., 22, 2, 1902 : 50
(паразиты); Jenkins, Wiss. Meeresunters. (N. F.), Abt. Kiel, VI, 1902:35
(Кильская бухта, Кильский канал; рост); Ehrenbaum u. Strodmann,
Wissensch. Meeresunters. (N. F.), Abt. HelgoL, VI, 1904 : 51—126 (диаметр икринок);
Strodmann, ibid., VII, 2, 1906 : 133—216 (биология); Mela, Vert. Fennica,
1909 : 478 (Ботнический зал., в северной части); Суворов, Тр. Балтийск, эксп.,
I, 1910.: 91, 94, 97, 98, 99, 100, 101, 107 (Финский и Рижский заливы; биология);
там же, II, 1913 : 54, 59—60, 62, 96—97, табл. X (измерения, нерест, питание); Heid-
rich, Wissensch. Meeresunters. (N. F.), Abt. Kiel, XX, 1, 1923—1925 : 3—38 (Кильская
бухта; размножение); Михин и Антипова, Изв. Всесоюзн. Научно-исслед.
инет, озерн. и речи. рыбн. хоз., XV, 1932 : 54 (Нарвская.губа: Шепелеве);. Dixon,
Rapp. Proces-Verb., СП, Append., 1933 : 1—12 (Данцигская бухта; уловы, возраст-
ной состав, рост, жирность); Robertson, Fish. Invest., ser. II, XVI, 2,
1938 : 3—103 (сводка наблюдений и литературных данных для вида в целом); Н б g-
1 u n d, Svensk. Hydrogr.-Biol. Komiss. Skrift. (N. S.), II, 3, 1938 : 3 (Скагеррак
и Каттегат; распределение икринок); Molander, ibid., II, 4, 1940 : 5 (западвые
берега Швеции); Верг, Изв. Всесоюзн. Научно-исслед. инет, озерн. и речи. рыбн.
хоз., XXIII, 1940 : 6 (Финский зал., на восток до Бьёркэ и Шепелева; рост, питание);
Дементьева, Рыбн. хоз., 1947, 8 : 27 (нерест); Борисов, там же, 1948,
8 : 31 (берега Эстонии и Латвии; возрастной состав); Канд и Горбачев,
Рыбн. хоз., 1950, 5 : 39 (содержание жира); Д р я г и н, Вести. Ленингр. унив.,
8, 1950 : 27 (улов в советских водах Финского зал. 1 тыс. ц, уловы в водах Эстонии
могут быть увеличены в 3 раза).
D III—V 12—16 (13.6), общим числом 15—19 (17.1), А II—III 14—18
(16.1), общим числом 17—21 (18.3), V I 6,1 2 sp. Ъг. 42—55 (50.0), на ниж-
ней половине жаберной дуги 30—41 (34.9), килевых чешуй 20—23+10—13
(22.0 + 11.4), общим числом 31—35(33.3), vert. S. 47—50(48.06), caud.
vert. 29—32(31.01). Голова широкая и укороченная, межглазничный
промежуток 16.7—21.3(18.9)% длины головы, дли а головы 18.4—
20.6 (19.6)°/0 длины тела. Тело сравнительно высокое, наибольшая высота
13.2—19.6(17.6)%, высота головы у затылка 12.8—14.8(13.7)% длины
его. Спина темноголубая, бока и брюхо блестяще-серебристые. Размеры
наичаще 11—13 см, наибольшие до 15—17 см. Описание дано по 50 экз.
длиной от 10.1 до 14.0, в среднем 12.1 см, собранным в марте 1941 г.
в Финском зал. между Койвисто и Кургаловым.
1 Более подробные ссылки на литературу, главным образом по биологии, см.
в этой работе.
2 Гейнке указывает К I 5 (1898 : 178, 179, 183) и один случай V I 7 (1898 : 185).
2. SPRATTUS
ИЗ
По данным Гейнке (Heincke, 1898), у шпрота из Кильской бухты,
от Гела и от Стокгольма килевых чешуй 20—24 + 9—13 с колебаниями
средних от 21.7 до 22.3 и от 11.2 до 11.5, позвонков 45—49 с колебаниями
средних от 47.5 до 48.1.
Морская форма, держащаяся и размножающаяся в воде как с почти
нормальным, так и с пониженным содержанием солей.
По исследованиям Гейнке, распадается на несколько форм, незна-
чительно различающихся некоторыми систематическими и биологи-
ческими особенностями. У экземпляров из восточной части моря
икринки крупнее, количество их меньше и развиваются они в менее
соленой воде, чем у экземпляров из западной части моря и из Ска-
геррака. По скорости роста и количеству позвонков в Каттегате
и Скагерраке различают (Molander, 1940) шпрота трех типов: морского —
наиболее быстрого роста и с наибольшим количеством позвонков (в сред-
нем от 47.9 до 48.1), фиордового — наиболее медленного роста и с наи-
меньшим количеством позвонков (в среднем от 47.6 до 47.7) и открытых
фиордов (skargard) — с ростом и количеством позвонков (в среднем
от 47.7 до 47.9), промежуточным между первыми двумя типами. Обо-
собленности нерестилищ этих типов шпротов не наблюдается; эти типы
рассматриваются как результат развития и роста в различных условиях.
Распространение. Балтийское море, где встречается почти
йовсеместно, но в наибольшем количестве у входа в Финский зал. в районе
Таллина, Хельсинки и Ханко, в Рижском зал. у входа и у западных бере-
гов его, у островов Саарема и Хиума, у берегов Пруссии, в Мекленбургской
и Кильской бухтах и ряде других мест. В Финский зал. на восток по се-
верному берегу заходит до Бьёркэ, по южному до Шепелева, отмечался
у Кронштадта.1 В Ботническом зал. встречается повсюду, до 64—65° с. ш.
На запад — до Кильской бухты и, возможно, южной части Каттегата
(у Гётеборга, судя по всему, типичная форма вида). Нерест, повидимому,
по всему морю, на север до Аландских о-вов, в Рижском зал., в Финском
зал. на восток до Хельсинки и Таллина, в северной части Каттегата
и в восточной Скагеррака, в фиордах этих проливов, как правило, за не-
которыми исключениями (фиорд Уддевалла) нереста нет.
Биология. Икрометание происходит весной и летом,1 2 в западной
части ареала с конца апреля по конец августа, к востоку от о. Борнгольм
с начала мая по начало августа включительно, к востоку от о. Готланд
и в Рижском зал. с апреля—мая по начало августа (Schneider, 1908;
Дементьева, 1947). Нерестится как в открытом море, так и в заливах,
но не у самых берегов и не в фиордах, а на некотором расстоянии от них,
в Каттегате и в Скагерраке главным образом над глубинами 50—100 м
(Molander, 1940). В открытом море икринки во второй половине июня
1947 г. были обнаружены на всем пространстве от Данцигской бухты
до Ирбинского прол. (Борисов, 1948). Икринки в воде как почти с нор-
мальным содержанием солей (в восточной части Скагеррака), так и с по-
ниженным (6—8°/оо у о. Борнгольм, в Финском зал. даже 4—5°/оо) дер-
жатся в поверхностных слоях воды или на некоторой, главным образом
25—50 м, глубине, что обусловлено более крупными размерами их
1 По указанию рыбаков (Кесслер, 1864).
2 Гейнке (Mobius u. Heincke, 1883) указывает на нерест в Кильской бухте весной и
осенью, считая весенне- и осенненерестующего шпрота разными расами. Осенний
нерест шпрота (в сентябре) отмечает также Бенеке (Benecke, 188'1), сообщая одновре-
менно о гибели после нереста в Данцигском зал. у Путцига.
8 Фауна ссСР —314
114
CLUPEIDAE
и меньшим удельным весом в восточной части ареала, чем в западной.
Диаметр икринок в Финском зал. равен 1.1—1.7 мм, у о. Борнгольм
1.25—1.48 мм, у типичной формы вида в Северном море у о. Гельголанд
лишь 0.83—1.13 мм (Schneider, 1908). Икра откладывается несколькими,
по наблюдениям в Кильской бухте (Heidrich, 1923), 8—9 порциями
с интервалами в .8—10 дней и весь процесс икрометания каждой самки
длится около 2%—3 месяцев. В каждой порции соответственно возрасту
(одно-, двух- и трехгодовалые) выметывается в среднем 1230, 2760 и 3560
икринок. Общая плодовитость соответственно тем же возрастам исчис-
ляется приблизительно в 11, 27 и 36 тыс. икринок. Развитие икринок
длится 3—4 дня (Hoglund, 1938). Взрослые по окончании нереста под-
ходят к берегам и держатся здесь с сентября до весны (Schneider, 1908),
у Таллина на короткое время появляется в мае (Суворов, 1913). Заходит
в шхеры, фиорды и бассейны, временами отделяющиеся от моря; в Киль-
ском канале ловилась вместе с сельдью, камбалой и пресноводными
рыбами — плотвой, окунем (Hinkelman, 1899). Питается ракообраз-
ными — Calanidae, в Нарвской губе главным образом Erytemora affinis
var. hirundoides и его яйцами (Берг, 1940). Самки численно, повидимому,
преобладают над самцами, количество их колеблется от 55.5 до 73.5%,
количество самцов —• от 26.5 до 44.5% (Jenkins, 1902; Mobius u. Heincke,
1883; Schneider, 1908). Половой зрелости достигает при длине, начиная
с 12 см, в двух- трехгодовалом возрасте, шпрот Каттегата — на втором
году жизни, реже в возрасте одного года при длине 8.5—9 см. В уловах
в западной части ареала (у берегов Швеции) встречаются двух- и трех-
годовалые, четырехгодовалые редки, в Нарвской губе — трех- и четырех-
годовалые (Jenkins, 1902; Molander, 1940; Берг, 1940). Весной у северо-
западных берегов Рижского зал. (1946 г.) и юго-западных Финского'
(1947 г.) в уловах преобладали двухгодовалые (93.7—95.5%), в незна-
чительном количестве (4.5—6.3%) встречались трехгодовалые (Борисов,
1948). В Скагерраке и Каттегате шпрот урожайных годов мельче шпрота
менее урожайных лет. Основной возрастной группой в уловах Скагеррака
и Каттегата являются одногодовалые, двухгодовалые встречаются в не-
большом количестве, трехгодовалые — единицами процентов и не каждый
год, причем процент двух- и трехгодовалых бывает тем больше, чем
меньшие размеры имеют двухгодовалые поколения этого года. В самих
проливах процент старших возрастных групп выше (Molander, 1940).
Рост в Финском зал. (Нарвская губа; Берг, 1940), Кильской бухте
(Jenkins, 1902) и в Каттегате и его фиордах (Molander, 1940) происходит
следующим образом (абсол. длина, в см):
Возраст..............
Нарвская губа........
Кильская бухта . . . .
Каттегат 1...........
1+ 2+
— 11.2
7.5 11.0
1) 9.7—11.8 10.6—12.5
2) 12.0—12.8 12.2—14.1
3) 11.9—12.6 13.6—14.0
3+
12.7
13.0
12.6—13.1
14.3—14.9
14.4—15.0 '
Содержание жира у шпрота Каттегата (фиорд Уддевалла) колеблется
от 4.11 до 15.19%, наименее жирен в период нереста — в апреле—июле
(3.30—7.40%), в августе содержание жира повышается (до 9.30%), наи-
более жирен бывает в сентябре—январе (10.62—15.19%) (Molander,
1 Колебания средних шпрота 1) фиордового типа, 2) типа открытых фиордов
и 3) морского типа.
3. CLUPEA
115
1940). В Данцигской бухте наибольшее количество жира содержит
в декабре—январе (14.2%), наименьшее — в июне (3.6%) (Dixon, 1933),
в Финском зал. наименьшее количество — в мае—августе (6.5—8.1%),
наибольшее — в сентябре—феврале (10.6—13.7%) (Канд и Горбачев,
1950).
Хозяйственное значение. Важная промысловая рыба
Балтийского моря. Общий улов не превышает, невидимому, 250 тыс. ц.
Большая часть его добывается в западной части моря: в 1936—1939 гг.
у берегов Польши поймано 104—151 тыс. ц, Германии — 5.5—70 тыс. ц.
В восточной части моря у берегов Финляндии добывалось 4—7 тыс. ц,
Швеции — около 1.5 тыс. ц, Эстонии — 9—43 тыс. ц, Латвии — 6—
10 тыс. ц, Литвы — до 0.4 тыс. ц. У берегов РСФСР ловится в неболь-
шом количестве в Нарвской губе Финского зал. Уловы могут быть уве-
личены в открытом море. Ловится главным образом осенью, в сентябре—
ноябре, и отчасти весной и летом.
Род 3. CLUPEA LINNE — МОРСКИЕ, ИЛИ ОКЕАНИЧЕСКИЕ СЕЛЬДИ
Clupea L i n n e, Syst. nat., ed. X, 1758 : 317 (тип: Cl. harengus). — Rogenia
Valenciennes, in: Cuvier et Valenciennes, Hist. nat. poiss., XX,
1847 : 340 (тип: R. ай>а = молодь Cl. harengus).
По отсутствию заметной медиальной вырезки в верхней челюсти,
удлиненных чешуй (ala) на лопастях хвостового плавника, удлиненных
двух последних лучей анального плавника и кожистого двухлопастного
выроста на вертикальной части ключицы и по гладкой крышечной кости
без радиальных бороздок подобен Sprattus. Жировые веки сравнительно
хорошо развиты, прикрывают глаза сзади и немного спереди. Брюшные
килевые чешуи слабые, хорошо заметные лишь позади брюшных плав-
ников, 24—32 впереди брюшных плавников, 11—18 позади них; брюхо
впереди брюшных плавников закругленное, со слабым килем позади них.
Сочленение нижней челюсти с черепом и задний конец верхнечелюстной
кости под вертикалью середины глаза или у мелких впереди и у круп-
ных позади нее, нижняя челюсть заметно выдается вперед. Сравнительно
слабые зубы есть на сошнике, расположены на продольном гребне
головки, несколько зубов на межчелюстной и на переднем конце нижне-
челюстной кости, едва развитые на нёбных, иногда на языке, средняя
часть нижнего края верхнечелюстной кости с мелкими зубчиками;
на мезоптеригоиде зубов нет. Жаберные тычинки верхней части жабер-
ной дуги налегают на тычинки нижней части дуги, тычинки довольно
длинные и тонкие, 40—51 на нижней половине дуги. Отростки плава-
тельного пузыря помещаются в prooticum и pteroticum. Брюшные плав-
ники расположены позади начала спинного, обычно под передней третью
его, иногда немного далее середины основания, V обычно I 8, иногда I 7
и I 9, как редкое исключение I 6 и даже I 5.1 Основание спинного плав-
ника лежит в бороздке, образованной расширенными чешуями, более
крупными у начала плавника. Позвонков 45—60. Пилорических при-
датков 18—29.1 2 Пятен за жаберной крышкой и на боках тела нет. Икра
прилипающая, откладываемая на грунт или подводную растительность,
без жировой капли, с малым околожелтковым пространством. Крупного
1 Иногда при нормальном числе лучей на одной стороне на другой бывает I 9,
на одной стороне I 5—на другой I 6 (Heincke, 1898 : 99, Taf. VIII, figs. 1—4).
2 Как очень редкое исключение бывает 6 и даже 4 (Heincke, 1898, Taf. VIII,
figs. 13—14).
8*
116
CLUPEIDAE
и среднего размера рыбы, в половозрелом состоянии от 10—15, некото-
рые более крупные формы от 25—30 см.
Скелет.1 Bulla prootica немного крупнее, чем b. pterotica. В. proo-
tica образует на черепе сбоку (табл. XXIX—XXXI, А) большое и резко
выпуклое вздутие, вздутие b. pterotica сбоку небольшое, несколько
большее сверху под fossa praeepiotica. Отростки плавательного пузыря
на occipitalia lateralia помещаются в костном канале, образующем
с каждой стороны черепа небольшое продолговатое вздутие между fenestra
audit!va и отверстием n. vagus; отверстие, через которое отростки пла-
вательного пузыря заходят в череп, расположены у нижнего края occi-
pitalia lateralia. Fenestra auditiva небольшая, несколько продолговатая,
немного более широкая сзади, чем спереди, передний край ее отделен
значительным промежутком от bulla prootica, задний — от отверстия
n. vagus. Fossa praeepiotica большая и высокая, края ее образуют равно-
бедренный, почти равносторонний треугольник, обращенный основанием
вверх, углом вниз. Foramen temporale сравнительно небольшое, удли-
ненное, по длине почти равное длине fossa praeepiotica, но значительно ме-
нее высокое. Сочленовная поверхность для hyomandibulare на sphenoticum
и prooticum сплошная, почти не разделенная на две части. Парасфеноид
слегка изогнутый, крылья его не выдаются вниз под миодомом, широкие
как с боков миодома, так и за задним отверстием его; передняя часть
парасфеноида сверху с килем, более высокая спереди. Нисходящий от-
росток базисфеноида выдается вперед из-под prooticum. Задний край
supraoccipitale на черепе сверху (2>) расходится от середины под тупым
углом, задний край epioticum заостренный или притупленный. Pteroticum
сзади оканчивается небольшим, загнутым немного вниз шипом. Перед-
ний конец каждого sphenoticum отходит вперед и в сторону, заострен
на конце. Ethmoidalia lateralia слегка выдаются из-под переднего края
лобных костей, направлены в стороны и вперед, варьируя в этом отно-
шении. Поперечные отростки мезэтмоида направлены несколько вперед,
не заострены на концах. Череп довольно широкий, ширина его между
краями pteroticum около 2 раз в длине его, наибольшая ширина между
краями лобных костей от 2% до 3% раз. Сошник на черепе снизу (В)
слегка закругленный, с более или менее широким и коротким, равным
около 1/з длины его, гребнем; передняя часть парасфеноида плоская,
слегка суживающаяся назад; крылья парасфеноида разделяются и сразу
широко расходятся под передним концом prooticum. Opisthoticum сзади
оканчивается коротким и тупым отростком. Углубления fossae temporales
posteriores на черепе сзади (Z7) слабые. Fossae subtemporales глубокие
и значительных размеров, овальной формы, вытянуты в горизонтальном
направлении, каждая располагается над отростком opisthoticum в ptero-
ticum и occipitale laterale. Головка для сочленения с черепом сверху
hyomandibulare одна, почти одинаковой ширины на всем протяжении.
Quadratum без выемки в верхнем крае. Нижнечелюстная кость широкая,
сочленовная также высокая, короче нижнечелюстной. Описание сделано
по многим скелетам Cl. harengus harengus, Cl. harengus pallasi и несколь-
ким Cl. harengus harengus n. membras, Cl. harengus pallasi n. suworowi,
Cl. harengus pallasi n. maris-albi.
Морские рыбы.
1 Из работ, касающихся описания скелета головы, следует отметить работы Мэ-
тьюза (Matthews, 1887 : 274—287, pls. XVII—XVIII, figs. 18—25), Смитта (Smitt,
1895 : 947—951, figs. 237—238), Райдвуда (Ridewood, 1904a : 453—459, fig. 125).
3. CLUPEA
117
Один вид в умеренных частях северного Атлантического и Тихого
океанов и в прилегающих как умеренных, так отчасти и в арктических
морях (рис. 14). Кроме того, к этому или, возможно, особому, новому
роду относится Cl. bentincki Norman, 1936 (размеры 110—115 мм, берега
Чили от 37° ю. ш. до Магелланова прол., Гальегос к востоку от входа
в этот пролив) и Cl. fuegensis Jenyns, 1842 (размеры 140—170 мм, Магел-
ланов прол., Патагония — Фольклэндские о-ва), предположительно отно-
симые автором (1949 : 47, рис. 4) к роду Sprattus. У Cl. bentincki, в отли-
чие от рода Sprattus, отростки плавательного пузыря помещаются как
в prooticum, так и в pteroticum. Кроме того, у этого вида килевые чешуи
слабо развиты и брюхо впереди брюшных плавников без острого киля,
закругленное; брюшные плавники расположены под или позади верти-
кали начала спинного; сочленение нижней челюсти с черепом под вер-
тикалью середины глаза. По всем этим признакам Cl. bentincki относится
к роду Clupea, но зубов на сошнике у него нет, что однако, не является
существенным, так как у одних видов Sprattus зубы на сошнике есть,
у других отсутствуют. Наличие или отсутствие зубов на некоторых костях
не является существенным и у рода Alosa. От Cl. harengus и всех видов
рода Sprattus этот вид отличается большим количеством жаберных тычи-
нок (75—95 на нижней части жаберной дуги, у Cl. harengus — 40—51,
у видов Sprattus — 33—41), и, что самое существенное, жаберные тычинки
нижней части 1-й жаберной дуги у исследованного экземпляра налегают
снаружи на тычинки верхней части дуги, между тем как у С I. harengus
жаберные тычинки верхней части 1-й жаберной дуги налегают на тычинки
нижней части дуги, а у Sprattus (S. sprattus, S. arcuatus, S. bassensis,
у других видов не установлено) налегания жаберных тычинок одной
части жаберной дуги на тычинки другой части дуги нет. По количеству
килевых чешуй (18—20+10—12) этот вид ближе к Sprattus (19—24+
+8—13), чем к Cl. harengus (24—32+11—18). Таким образом, этот вид
ничего общего, кроме последнего признака, с родом Sprattus не имеет,
существенно отличаясь налеганием жаберных тычинок и от рода Clupea.
У Cl. fuegensis, отсутствующего в наших коллекциях, наличие или отсут-
ствие bulla pterotica установить не представилось возможным, равным
образом также и характера налегания жаберных тычинок одной части
жаберной дуги на тычинки другой части ее. Килевые чешуи у этого вида
также слабо развиты и не образуют впереди брюшных плавников острого’
киля; брюшные плавники расположены под или позади вертикали перед-
него конца спинного плавника, т. е. по всем этим признакам он подобен
предыдущему виду и Cl. harengus, однако зубы на сошнике, как и у С1.
bentincki, отсутствуют, по числу килевых чешуй (22—25+10—13) он
ближе к Sprattus, жаберных тычинок на нижней части жаберной дуги
меньше (38—42), чем у Cl. bentincki. До более детального изучения строе-
ния скелета и других особенностей, в частности икринок (пелагические
они или донные, приклеивающиеся) и числа пилорических придатков,
трудно сказать, относятся ли оба эти вида к роду Clupea или к особому
роду.
*1. Clupea harengus L. —Морская, или океаническая сельдь.
Литературу см. при подвидах.
Зубы на сошнике есть. Sp. br. 58—73, на нижней части дуги 40—51.
Морской вид, но некоторые формы размножаются и отчасти живут
в солоноватой воде.
Рис. 14. Распространение Clupea harengus.
Cl. harengus harengus; 2 — Cl. harengus harengus n. membras; 3 — Cl. harengus pallasi; 4— Cl. harengus pallasi n, suworowi 5 — Cl. harengus pallasi
n. maris-albi.
3. CLUPEA
11У
Разделяется на два подвида, которые в свою очередь распадаются
на ряд форм, причем подвиды и их формы по количеству позвонков, сте-
пени развития зубов и ряду биологических особенностей разделяются
на две группы — многопозвонковых и малопозвонковых сельдей. К много
позвонковым сельдям относятся атлантическая (Cl. harengus harengus}
и балтийская (Cl. harengus harengus n. membras) сельди, к малопозвонко-
вым — тихоокеанская (Cl. harengus pallasi), чёшско-печорская (Cl. haren-
gus pallasi n. suworowi) и беломорская (Cl. harengus pallasi n. maris-albi)
сельди. Биологические различия обеих групп сводятся к следующему.
1) У многопозвонковых сельдей икрометание происходит на протяжении
всего года, в связи с чем среди них, в частности у атлантической сельди,
по времени нереста различают весенних, осенних, летних и зимних сель-
дей. Малопозвонковые сельди размножаются весной, и поэтому у них
по времени икрометания есть только весенние сельди. 2) Икрометание
у мяогопозвонковых сельдей происходит в общем при несколько более
высокой температуре, чем у малопозвонковых. 3) Нерестилища много-
позвонковых сельдей располагаются наичаще на значительном отдалении
от берегов, иногда на банках среди моря, и на больших глубинах, чем
у малопозвонковых, у некоторых форм атлантической сельди на глубине
до 200 м. Нерест малопозвонковых сельдей происходит в узко при-
брежной зоне на небольших глубинах, максимально до 10—15 м.
4) В связи с этим икра малопо.звонковых сельдей, как правило, отклады-
вается на подводную растительность, между тем как у многопозвонковых
сельдей икра откладывается на грунт, так как на таких глубинах, где
они размножаются, подводной растительности обычно нет. 5) Малопо-
звонковым сельдям свойственна большая по сравнению с многопозвонко-
выми приуроченность в период икрометания к опреснениям. 6) Формам
малопозвонковых сельдей свойственна большая локальность и привязан-
ность к узким районам распространения и в общем меньшие по размерам
миграции, чем многопозвонковым, причем у последних миграции проис-
ходят и в личиночной стадии в виде пассивного дрейфа их с течениями
(см. об этом «Биология», стр. 79). Эти биологические различия
обеих групп сельдей обусловлены различным происхождением их. Биоло-
гические особенности малопозвонковых сельдей выработались в условиях
арктических морей, где большинство их (Cl. harengus pallasi n. maris-
albi и Cl. harengus pallasi n. suworowi) обитает и в настоящее время.
В арктических морях температурные условия, при которых происходит
икрометание и развитие икры и личинок Cl. harengus, кратковременны,
и, чтобы иметь, соответствующую температуру для развития икры и личи-
нок, размножаться эта сельдь здесь может лишь весной. Поэтому в аркти-
ческих морях и имеются лишь весенние сельди. По этой же причине
и у Cl. harengus harengus в северных частях ареала (у Норвегии, Ислан-
дии, склонов континентального плато Северного моря и др.) имеются
лишь весенние сельди, размножающиеся весной и отчасти в конце зимы
и летом, а осенние свойственны южным частям ареала (Северное море,
Ламанш и др.). Температурными условиями арктических морей обуслов-
лено и икрометание малопозвонковых сельдей на небольшой глубине
у самых берегов, так как вода только здесь и прогревается до той темпе-
ратуры, при которой возможны икрометание и развитие икры и личинок.
Склонность малопозвонковых сельдей к опреснениям в период икроме-
тания обусловлена тем, что более теплая вода рек и поверхностного
стока оказывает отепляющее влияние на прибрежные воды, вследствие
чего в арктических морях икрометание частично и происходит вблизи'
120
clupeidae
устьев рек. Биологические особенности Cl. harengus pallasi, аналогичные
биологическим особенностям других малопозвонковых сельдей, вырабо-
тались несомненно также в арктических морях. Попав из арктических
морей в умеренные части Тихого океана, малопозвонковая сельдь обра-
зовала здесь особый подвид, широко расселившийся здесь, но сохранив-
ший все биологические особенности этих сельдей арктических морей.
В силу консерватизма своей наследственности этот подвид оказался
неспособным дать формы, размножающиеся на больших глубинах в отда-
лении от берегов и в другое время кроме весны, вследствие чего у него
нет и осенних форм (подробнее об этом см.: Световидов, 19496).
Беломорская и чёшско-печорская сельди приняты Л. С. Бергом
за nationes Cl. harengus pallasi, что безусловно правильно отражает их
родственное и подчиненное отношение к последней. Балтийская сельдь,
имеющая от С . harengus harengus такие же отличия, как формы мало-
позвонковых сельдей от Cl. harengus pallasi, и являющаяся в сущности
одной из местных форм атлантической сельди, принята им в качестве
подвида; следует отметить, что некоторые из подвидов других видов
семейства (например Sprattus sprattus, Sardinops sagax, отчасти Sardina)
pilchardus и др.) имеют такую же степень различия, что и формы много-
позвонковых и малопозвонковых сельдей и поэтому следовало бы считать
и формы обеих групп также подвидами, подобно тому как это принято
для Gadus morhua, который также разделяется на две группы подвидов,
аналогичных группам и формам Cl. harengus и имеющих сходные и био-
логические особенности, обусловленные их происхождением (Световидов,
1944, 1948). Однако при таком наименовании разделения Cl. harengus
на две группы подчиненного значения форм каждой из этих групп
не видно. Кроме того, и степень различия форм обоих подвидов Cl. haren-
gus значительно меньше, чем подвидов обоих групп G. morhua. Поэтому
в данном случае удобнее, несмотря на громоздкость наименования, при-
нять разделение Cl. harengus на два подвида — многопозвонковых (С1.
harengus harengus) и малопозвонковых (Cl. harengus pallasi) сельдей,,
а формы их за nationes. При этом балтийскую сельдь, принимая во вни-
мание то, что она является такой же формой Cl. harengus harengus, как,,
например, атлантическо-скандинавские сельди или близкие к ней сельди
датских проливов, следует считать за natio атлантической сельди. Резких
различий между этими подвидами в основных систематических признаках,
так же как и в других, приводимых ниже в диагнозах, нет. Развитие зубов,
на сошнике, более сильных и многочисленных у атлантической сельди,
имеет также переходный характер, так как одинаковая степень развития
встречается у той и другой. Наблюдаемые между многопозвонковыми
и малопозвонковыми группами сельдей резкие различия личинок в поло-
жении анального отверстия (на 47—49-м сегменте и под 82—83-й клет-
кой хорды у Cl. harengus harengus и на 42—45-м сегменте и под 62—67-й
клеткой хорды у Cl. harengus pallasi n. maris-albi) и в числе клеток хорды
(более 100 у Cl. harengus harengus и приблизительно 90 у Cl. harengus
pallasi n. maris-albi) обусловлено малым числом исследованных личинок»
При исследовании большего числа их и при этом у всех форм как. С1,
harengus harengus, так и Cl. harengus pallasi, эти, несомненно варьирую-
щие в значительно более широких пределах признаки, в особенности;
число клеток хорды, будут иметь заходящий характер. Наоборот, в ниже-
следующем описании подвидов hiatus имеется в некоторых признаках
между атлантической и балтийской сельдями, с одной стороны, и тихо-
океанской и чёшско-печорекой и беломорской, — с другой.. Различия эти
3. CLUPEA
121
обусловлены тем, что характеристика атлантической сельди дана лишь
по одной весенней форме (атлантическо-скандинавской), так же как
и балтийской (весенняя сельдь). При дальнейшем исследовании обеих
этих сельдей, основанном на изучении и других форм их, в частности
и осенних той и другой и более мелких по размерам форм атлантической,,
имеющиеся резкие различия в некоторых признаках (длина головы, раз-
меры глаз) несомненно сгладятся. Равным образом и описание подвидов и
малопозвонковых сельдей дано лишь по одной из форм каждой из них: тихо-
океанской — по южносахалинско-хоккайдской, беломорской — по мелкой
сельди Онежского зал., а чёшско-печорской — вообще по недостаточному
числу экземпляров.Резкие различия и между этими подвидами наблюдаются
в тех же признаках, что и между атлантической и балтийской сельдями,
и в обоих случаях обусловлены, помимо указанных причин, в значитель-
ной степени и разными размерами их (более крупными атлантической
и тихоокеанской сельдей и более мелкими остальных).
Когда работа была закончена и сдана в Издательство, автор позна-
комился со статьей Пономаревой (1951), цитируемой при описании
Cl. harengus harengus и Cl. harengus pallasi. В этой статье Л. А. Поно-
марева рассматривает многопозвонковых и малопозвонковых сельдей
за самостоятельные виды — Cl. harengus тз.С1. pallasi, а все формы — за под-
виды: Cl. harengus membrps, Cl. pallasi maris-albi и Cl. pallasi suworowi.
Однако все приводимые ею в пользу этого доводы основаны на малой
компетенции в рассматриваемом вопросе и на недостаточном знакомстве-
с литературой. Л. А. Пономарева, считая число позвонков важнейшим
признаком, положенным в основу. систематики рода Clupea, утверждает
(стр. 181), что «по этому признаку многопозвонковые или океанические-
и малопозвонковые или восточные сельди всегда резко различны» и в ка-
честве «наглядной иллюстрации» приводит кривые числа позвонков
(рис. 3). Однако даже на этом рисунке кривые числа позвонков атланти-
ческой сельди и малопозвонковых — тихоокеанской и ее форм явно-
трансгрессивны.1 Если же принять во внимание пределы колебаний коли-
чества позвонков, известное по литературным данным, то в действитель-
ности мы имеем дело не с трансгрессией, а почти с полным совпадением,,
так как у тихоокеанской сельди количество позвонков колеблется от 47
до 57, а у атлантической сельди, если принять во внимание все ее формы,
а не одну лишь мурманскую, — от 51 до 60. У атланточеской сельди даже
средние числа позвонков у разных рас колеблются от 54.7 до 57.5, между
тем как на кривой пределы колебаний указаны от 55 до 59, что свойственно
лишь мурманской сельди. Другим признаком, по которому многопозвон-
ковые и малопозвонковые сельди резко различаются, Л. А. Пономарева!
считает развитие зубов на сошнике. В подтверждение Л. А. Пономарева
ссылается на П. Ю. Шмидта и Л. С. Берга, которые однако считают обеих
этих сельдей лишь за подвиды. Со ссылкой на стр. 182 на рисунок «сош-
ников сельдей группы harengus и группы pallasi, наглядно подтверждаю-
щий справедливость указаний, упомянутых автором», получилось явное-
недоразумение, так как этого рисунка в статье нет. На этом рисунке изобра-
жена карта распространения атлантической сельди. Что касается раз-
личий в числе поперечных рядов чешуй (перед спинным плавником),
по которому «всегда легко отличить группу harengus от группы pallasi»,.
1 Нельзя не отметить несоответствия между количеством позвонков на этих кри-
вых и в описаниях. Так, у атлантической сельди по кривой позвонков 55—59, а в опи-
сании 53—55, у чешской сельди по кривой позвонков 52—56, в.описании 54, в среднем,-
53.5 и т. д.
122
CLUPEIDAE
то число и, как видно из табл. 3, также трансгрессивно: у форм первой
колеблется от 13 до 15, у второй — от 9 до 13 (на стр. 189 от 10 до 13).
Относительно различий в числе сегментов у личинок сказано выше.
'Следует лишь отметить, что в этой части статьи имеется также ряд оши-
бочных утверждений. Так, личинки беломорской сельди, по данным
Каринского (1938), имеют не 53 сегмента, а 53 и более, анальное отвер-
стие у них находится не на 43—44 сегменте, а на 42—45 и т. д.
Распространение. Северные части Атлантического и Тихого
океанов и прилегающие моря. В Атлантическом океане у берегов Европы
от Бискайского зал. до Шпицбергена, Новой Земли, в Балтийском, Белом
и Карском морях, у берегов Сев. Америки от м. Гаттераса до Девисова
шрол. и Гренландии. В Тихом океане у берегов Азии от западного побе-
режья Кореи в Желтом море и зал. Тояма в Японском, на север до Ана-
дырского зал., в бухте Тикси и Оленёкском зал. у берегов Сибири,
у берегов Сев. Америки от Калифорнии до Аляски (рис. 14).
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА
1 (4). Число позвонков 51—60, наичаще 55—57. Килевые чешуи более
или менее развиты как позади, так и впереди основания брюшных
плавников. Между брюшными и анальным плавниками 12—16 киле-
вых чешуй. Зубы на сошнике сравнительно хорошо развиты. Север-
ная часть Атлантического океана и прилегающие моря.
2 (3). Позвонков в среднем от 54.8 до 57.5. Грудные плавники короткие,
менее 14% длины тела. Голова короткая и широкая, длина ее менее
23% длины тела, межглазничный промежуток более 16% % длины
головы. Глаза небольшие, менее 24% длины головы. Северная1 часть
Атлантического океана и прилегающие моря — Северное, Барен-
цево и отчасти Белое...............*la. Cl. harengus harengus L.
3 (2). Позвонков меньше, в среднем от 55.2 до 55.7. Грудные плавники
длиннее, не менее 13%% длины тела. Голова длиннее и уже, длина
ее более 23 % длины тела, межглазничный промежуток менее
17%% длины головы. Балтийское море.............................
..................*lb. Cl. harengus harengus n. membras L.
4 . (1). Число позвонков 49—57, наичаще 52—55. Килевые чешуи более
или менее развиты лишь позади брюшных плавников. Между брюш-
ными и анальным плавниками 10—14 килевых чешуй. Зубы на сош-
нике менее развиты. Северная часть Тихого океана и арктические
моря.
5 (6). Голова короткая, менее 21% длины тела. Грудные плавники менее
14%% длины тела. Глаза менее 23% длины головы. Крупные рыбы,
в половозрелом состоянии длиной от 20 до 40 см й более. Северная
часть Тихого океана и прилегающие моря.........................
.............................*lc. Cl. harengus pallasi Vai.
6 (5). Голова длиннее, более 21% длины тела. Грудные плавники более
13% длины тела. Глаза более 23% длины головы. Размеры меньше,
до 30—34 см, в половозрелом состоянии — от 10—20 см. Белое
море, Мезенский зал., Чешская губа, Карское море на восток
до Обской губы.
"7 (8). Высота головы более 13% длины тела.1 Белое море .......
.................*ld. Cl. harengus pallasi n. maris-albi Berg
1 Берг (1948 : 148) в определительной таблице в качестве отличительного
признака между Cl. harengus pallasi n. maris-albi и Cl. harengus pallasi n. suwo-
3. CLUPEA
123
8 (7). Высота головы менее 14% длины тела. Мезенский зал., Чёшская
губа, Карское море.............................................................
• . . . . . . . *1е. Cl. harengus pallasi n. suworowi Rabinerson.
*la. Clupea harengus harengus L. — Атлантическая сельдь, много-
позвонковая сельдь, также мурманская сельдь, норвежская сельдь и дру-
гие, чисто местные названия (табл. II).
Clupea harengus L i n п ё, Syst. nat., ed. X, 1758 : 317 (Атлантический океан
у берегов Европы). — Cyprinus esca Walbaum, in: A r t e d i, Gen. pise.,
1792 : 36 (white bait, ex Pennant, Brit, zool., Ill, 1776 : 371, t. 69). — Clupea halec
Mitchill, Trans. Lit. a. Philos. Soc., I, 1815 : 451 (Нью-Йорк). — Clupea vit-
tata Mitchill, 1. c.:456 (Нью-Йорк). — Clupea caerulea (non Girard) M i t-
s h ill, 1. c. : 457 (Нью-Йорк). — Clupea elongata L e Sueur, Journ. Acad. Nat.
Sei. Phiia., I, 1817 : 234 (Массачузетс). — Clupea latulus Cuvier, Regne animal,
ed. II, II, 1829 : 318. — Clupea alba 1 Y а г г e 1 1, Zool. Journ., IV, 1829 : 137, 465,
pl. V, f. 2. — Clupea leachii 1 Y a r r e 1 1, ibid., V, (1830), 1832 : 277, pl. Xll (Анг-
лия). — Clupea minima (Peck) Storer, Rept. fish. Mass., 1839 : 113 (Ныо-
Гемпшир). — Clupea lineolata Cuvier et Valenciennes, Hist. nat. poiss.,
XX, 1847 : 256. — Bogenia alba Cuvier et Valenciennes, 1. c. : 341,
pl. 508. — Clupea harengus S m i t t, Scand. fish., II, 1895 : 954 (частью); Hein-
cke, Naturgesh. d. Herings, I, 1898 : VII, Tab. I, III—IV,. VI—LXV, LXX—
GXLI (частью: европейские моря; измерения рыб и черепов, расы). — Clupea haren-
gus harengus Берг, Рыбы пресных вод России, 1923 : 500 (Кольский зал.);
Rabinerson, Zool. Jahrb., Abt. Syst., Bd. 58, 1929 : 294 (Мурманское побе-
режье); Schnakenbeck, Zeitschr. f. Morphol. u. Okol. d. Tiere, Bd. 21,
1931 : 525, 529, f. 10, 16, 17, 19, 20 (банковские сельди Северного моря). — Clupea
harengus britannicus Schnakenbeck, 1. c. : 526, 529, f. 11, 20, 23 В (сельди
Ламанша). — Clupea harengus atlanticus Schnakenbeck, 1. c. : 526, 529, f. 33
(сельди южного входа в Ирландское море). — Clupea harengus ivernicus Schna-
kenbeck, 1. с. : 526, 529, f. 39 А (клайдские сельди). — Clupea harengus caledoni-
cus. Schnakenbeck, 1. c.: 527, 529 (сельди западного побережья Шотлан-
дии). — Clupea harengus scoticus Schnakenbeck, 1. c. : 527, 529, f. 18 (зал.
Фёре оф Форс). — Clupea harengus frisicus Schnakenbeck, 1. c. : 528, 529,
f., 34, 35, 36 (зал. Зюдерзее). — Clupea harengus cimbricus Schnakenbeck,
1. c. : 259 (Ютландская банка). — Clupea harengus scandicus Schnakenbeck,
1. c. : 529 (норв'ежская сельдь, форма A). — Clupea harengus norvegicus Schna-
kenbeck, 1. c. : 529 (норвежская сельдь, форма В). — Clupea harengus septerr.tri-
onalis Schnakenbeck, 1. c. : 529 (фарерские сельди). — Clupea harengus bo-
realis Schnakenbeck, 1. c. : 529 (весенняя сельдь Исландии). — Clupea
harengus islandicus Schnakenbeck, 1. c. : 529 (летняя сельдь Исландии). —
Clupea harengus L i s s n e r, Journ. Conseil, IX, 3, 1934 : 346, 364 (частью: атлан-
тическая сельдь, разделение на два подвида — весенних и осенних сельдей); L е
Gall, Ann. Inst, oceanogr., XV, 1, 1935 : 19, 99, 155, 162—165 (частью: восточная
половина северной части Атлантического океана; расы). — Clupea harengus haren-
gus n. murmanica Тих о н о в, Тр. Полярн. научно-исслед. инет, морск. рыбн.
хоз. и океаногр., 7, 1941 : 26 (Баренцево море). —Clupea harengus harengus Расс,
в : Промысловые рыбы СССР, 1949 : 120, табл. 30. — Clupea harengus Понома-
рева, Учен. зап. Горьк. Гос. унив., XIX, 1951 : 177, рис. 1.
Распространение, биология. Fulton, 9th Ann. Rept. Fish.
Board. Scotl., Ill, 1891 : 267 (число икринок); A p s t e i n, Schrift. Naturwissensch.
Ver. Schleswig-Holst., XI, 2, 1898 : 222 (p. Шлей; нерест, плодовитость); H i n k e 1-
m a n n, Mitt. Deutsch. Seefischerei-Ver., XIV, 2, 1898 : 45; ibid., XV, 6, 1899; ibid.,
XVIII, 1, 7, 12, 1902 : 15, 362, 606 (Кильский канал; нерест); J e n k i n s, Wiss.
Meeresunters. (N. F.), Abt. Kiel, VI, 1902 : 83 (плодовитость); Ehrenbaum,
Fauna Arct., II, 1902 : 138 (Тромсе и Сёре-Сунд, Трольд-фиорд; личинки); Н in-
kelm a n п, Mitt. Deutsch. Seefischerei-Ver., XIX, 3, 1903 : 88 (Кильский канал;
нерест); Н j о г t, Rapp. Proces-Verb., XX, 1914:14 (колебания уловов); L е-
rowi указывает длину основания анального плавника, меньшую у первого (около
10х/2% длины тела), чем у второго (более 11%). Данные эти взяты из работ разных
авторов. По нашим данным, длина основания анального плавника больше у Cl. ha-
rengus pallasi n. maris-albi (10.9%), чем у Cl. harengus pallasi n. suworowi (10.4%).
' 1 Clupea alba и Cl. leachii см. также: Y a r r e 1 1, Brit, fish., ed. I, II, 1836;: 117,
126.
124
CLUPEIDAE
b о ur, Journ. Mar. Biol. Assoc, (n.s.), XII, 2, 1918:36 (питание личинок); Johan sen,.
Meddel. Komm. Havundersog., Fisk., V, 8, 1919 : 1 (Исландия, Фарерские о-ва, Hop- .
вегия; биометрика); J espersen, ibid., VI, 1, 1920 : 4 (Исландия, Фарерские-
о-ва; личинки); Johansen, ibid., VI, 3, 1921 :1 (Исландия; летняя сельдь,
биометрика, размножение); ibid., VI, 4, 1921 : 1 (Фарерские о-ва; весенняя сельдь,
биометрика, размножение); Labour, Journ. Mar. Biol. Assoc, (n.s.), XII,3, 1921:278,
459 (питание личинок); ibid., XII, 4, 1922 : 644; ibid., XIII, 1, 1923 : 70 (значение-
личинок в питании планктонных организмов); ibid., XIII, 2, 1924 : 325, 402 (верти-
кальное распределение и питание личинок); L е Danois et Held, Notes et
Mem. 1’Office Sci. Techn. Peches Marit., 36, 1924 : 1 (южная часть Ирландского моря;
расы); J ohansen, Wiss. Meeresunters. (N. F.), Abt. Helg., XV, 1923—1924 : 1
(Каттегат; зимние сельди, расы, места и время нереста); Meddel. Komm. Havunder-
sog., Fisk., VII, 5, 1924 : 1 (Ламанш, Северное море, датские проливы; расы и места
нереста); Bigelow a. Welsh, Fish, gulf Maine, 1925 : 92 (берега Сев. Аме-
рики; места и время нереста, биология); Рабинерсон, Изв. Отд. прикл. ихт.,.
Ill, 1, 1925 : 67; там же, IV, 1, 1926 : 121 (Кольский зал.; рост, отношение к бело-
морской и мурманской сельди); J ohansen, Rapp. Proces-Verb., XXXIX,.
1926 : 114—138 (берега Исландии; расовый анализ, нерест весенней и летней сельди);
L е Gall, Noles et Mem. 1’Office Sci. Techn. Peches Marit., 48, 1926 : 1 (берега
Ирландии); Rapp. Proces-Verb., XLIV, 1927 : 115 (Ламанш; рост, зрелость); J ohan-
sen, Rept. Danish Biol. St., XXXIII, 1927:17 (прол. Б. Вельт; личинки
зимних сельдей в начале марта, осенние сельди мечут икру в сентябре и октябре);
Journ. Conseil., II, 1, 1927 : 3 (берега Норвегии, Исландии и Фарерских о-вов, Север-
ное м., прол. Зунд; места нереста, миграции); Аверинцев, Тр. Инет. рыбн.
хоз., II, 1, 1927 : 66 (Белое м.: Кандалакшский зал., близ устья р. Онеги, Двин-
ский зал.); Lissner, Вег. Deutsh. Wiss. Komm. Meeresforsch. (N. F.), Ill, 2,
1927 : 47 (западная часть Северного м.; расы); Schnakenbeck, ibid. : 95
(Северное м.; расы); Storrow, Dove Mar. Labor., Cullercoat, Northumb, (n. s.),
XVI, 1927 : 9; XVII, 1929 : 9; XVIII, 1929 : 9; XIX, 1931 : 9; XX, 1931 : 8; XXI,
1932 : 11 (размеры, возраст, рост, колебание численности возрастных групп, зре-
лость, нерест); Рабинерсон, Тр. Инет. изуч. Севера, 38, 1927 : 64 (рост); Ка-
рело-Мурманск. край, 1928,10—11 : 47 (отношение мурманской сельди к норвежской);
М а к у ш о к, Русск. зоолог, жури., VIII, 3, 1928 : 39; там же, VIII, 4, 1928 : 41
(отношение мурманской сельди к норвежской); Hodgson, Journ. Conseil, III,
2, 1928 : 224 (южная часть Северного м.; места нереста по икринкам из желудков
пикши); Ford, Journ. Mar. Biol. Assoc, (n. s.), XV, 1,1928 : 237, 267, 279, 305; ibid.,
XVI, 1, 1929 : 1, 25 (Ламанш; количество позвонков, возрастной состав); J ohan-
sen, Rept. Danish Biol. St., XXXV, 1929 : 5 (Лимфиорд; весенняя и осенняя
сельди); Lea, Journ. Conseil., IV, 1, 1929 : 1 (океаническая стадия сельди); Rapp..
Proces-Verb., LIV, 1929 : 21 (годичные кольца на чешуе в связи с образом жизни);
М i е 1 с k, ibid. : 99 (Северное м.; личинки, ноябрь—апрель); Schnakenbe с.к,.
Вег. Deutsch. Wiss. Komm. Meeresforsch. (N. F.), V. 2, 1929 : 23 (развитие личинок);.
Петров, Изв. Гос. Инет, опытн. агроном., VII, 6, 1929 : 689 (отношение мурман-
ской сельди к норвежской); Бородатова, Тр. Научн. инет. рыбн. хоз., V, 4,
1930 : 47 (отличие мурманской сельди от норвежской, личинки из Ура-губа); L е-
Gall, Rap. Proces-Verb., LXIX, 1930 : 1 (сельди Ламанша и южной части Север-
ного м.); Wood, Scient. Invest., Fish. Board Scot!., 1930, I : 1 (места и время раз-
множения сельдей у берегов Шотландии); Schnakenbeck, Zool. Anz., 94,
1931 : 21 (р. Эльба у Гамбурга); Петров, Тр. Инет. изуч. Севера, 48, 1931 : 103j
Суворов, Вадова и Сынков а, там же : 150 (отношение мурманской:
сельди к норвежской); М а к у ш о к, Тр. Гос. Океаногр. инет., I, 4, 1932 : 3 (от-
ношение мурманской сельди к норвежской); Танасийчук, Карело-мурмапск.
край, 1932, 7—8 : 40 (отношение мурманской сельди к норвежской); Вазова;
Сборн. научно-промысл. работ на Мурмане, 1932 : 159 (отношение, мурманской
сельди к норвежской); Poulsen, Meddel. Komm. Danmarks Fiskeri- og Havun-
ders., Fisk., IX, 4, 1932 : 1 (Северное м., Скагеррак, Каттегат; места нераста); Wat-
kin, Rapp. Proces-Verb., LXXXIV, 1933 : 41 (сельди южного входа в Ирландское
м., зрелость, размеры, возраст, рост); Clark, ibid., LXXXV, 3, 1933 : 11 (берега
Шотландии, Гебридских, Оркнейских и Шетландских о-вов; личинки); Ford, Journ.
Mar. Biol. Assoc, (n. s.), XIX, 5, 1933 : 305 (Ламанш; места и время нереста, рост,
расы); Runnstrom, Journ. Conseil, VIII, 2, 1933 : 235 (расовая неоднородность
сельди у берегов Норвегии); М а к у ш о к, За рыбн. индустр. Севера, 1933, 8 : 20
(западное побережье Канина: устье рр. Кии, Шойны и Торны); там же, 1934, 8 : 33
(восточное побережье Канина: устье р. Сев. Камбальницы; устье р. Индиги, открытая
часть Чёшской губы); Saemundsson, Rapp. Proces-Verb., LXXXVI, 1934 : 4
(нерест у берегов Исландии); Ottestad, ibid., LXXXVIII, 1934 : 3 (берега
3. CLUPEA
125
(Норвегии; северная и южная формы по темпу роста); Runnstr dm, ibid.,
LXXXVIII, 1934:3 (берега Норвегии; личинки, места нереста); Clark, ibid.,
LXXXIX, 2, 1934 : 23 (Фарерские о-ва; личинки в мае и июне); Wood, ibid.,
LXXXIX, 3, 1934 : 57 (северная часть Северного м.; расы); Storrow a. Co-
wan, Dove Mar. Labor., Cullercoat, Northumb. (3), 2, 1934; 9; 3, 1935 : 11; 4,
1938 : 10 (размеры, возраст, рост, колебание численности возрастных групп, зрелость,
нерест); Awerinzew, Journ. Conseil, X, 1, 1935 : 66 (отношение мурманской
сельди к норвежской); Н an sen,1 Beretning, Vestgr0nlands Sryrelse, 2, 1935 : 16
(Гренландия; расовый состав, нерест); Runnstrom, Rept. Norw. Fisher. Mar.
Invest., V, 2, 1936 : 5 (строение годичных колец—кольца южного и северного типов,
океанические и нерестовые); Taning, Meddel. Komm, Danmarks Fiskeri- og
Havunders., Fisk., X, 3, 1936 : 8 (Фарерские о-ва; личинки, время нереста весенних
и летних сельдей); Wood, Scient. Invest., Fish. Board Scotl., 1936, III, 1 (расовый
.анализ весенних и осенних сельдей Шотландии); Tailing, Rapp. Proces-Verb.,
XCIX, 1936 : 1 (Исландия; личинки, места нереста); Andersson, ibid., С, 2,
1936 ; 11 (Скагеррак, Каттегат, Зунд; расовый состав, нерест); Poulson, ibid. :
20 (Скагеррак, Каттегат, Зунд, В. Вельт и западная часть Балтийского м.; расы и
места нереста); Runnstrom, ibid. : 24 (атлантическо-скандинавские сельди;
распространение); Tailing, ibid. : 32 (Фарерские о-ва, Исландия, Гренландия;
расы и нерест); Агапов и Топорков, Пробл. Арктики, 1937, 2 : 104 (губы
Грибова и Белушья, западное побережье Новой Земли); Marshall, Nicholls
а. О г г, Journ. Mar. Biol. Assoc, (n. s.), XXII, 1, 1937 : 245 (зал. p. Клайд; рост и
питание личинок); Runnstrom, Journ. Conseil, XII, 2,1937 : 123 (различия между
сельдями с разных нерестилищ у берегов Норвегии); F а г г a n, ibid., XIII, 2,
1938 : 91 (размеры и количество икринок у сельди от берегов Ирландии); Е г d ш а п п,
Rapp. Proces-Verb., CVII, 3, 1938 : 31 (расовый анализ весенних сельдей Шотландии);
Р ы ж е н к о, Рыбн. хоз. СССР, 1938, 2 : 12 (личинки от Лофотенских о-вов до Мо-
товского зал., мальки в Мотовском и Кольском зал. и у Териберки, сеголетки на
Гусиной и Канинской банках, отход их от берегов в открытое море); Ю д к и и, Тр.
Моск, технич. инет. рыбн. хоз., 1, 1938 : 59 (Пала-губа, Териберка, Титовка; мальки);
Глебов, Тр. Полярн. научно-исслед. инет, морск. рыбн. хоз. и океаногр., 1,
1938 : 5 (условия захода летней и жирной сельди в губы); Карантонис,1 2 там
же : 59 (строение и сочленение костей .жаберной крышки и плечевого пояса, три
«типа» сельдей); Мурашкинцева, там же : 74 (типы зимних колец на чешуе);
Мантейфель и Болдовский, там же : 88 (причины заходов жирной
сельди в губы); Болдовский, там же : 102 (питание в губах); Алеев,
там же : 120 (распределение в Варенцовой море по нахождениям в желудках трески);
Есипов, там/ же : 160 (библиография работ о мурманской сельди до 1937 г.);
К. о 11 h a u s, Wiss. Meeresunters., Abt. Helg., I, 3, 1939 : 349; S c h a c h, ibid. : 359
(искусственное оплодотворение икринок, выращивание личинок, питание их);
Redeke, Journ. Conseil, XIV, 3, 1939 : 337 (Зюдерзее, исчезновение сельди после
отделения его от моря); Jensen, Kgl. Danske Videnskab. Selsk., Biol. Meddel.,
XIV, 8, 1939 : 14 (у западных берегов Гренландии на север до 72.5° с.ш., у восточ-
ных — в Датском прол.; нерест и выметанные икринки в августе); Р ы ж е н к о,
Рыбн. хоз., 1939, 4 : 20 (Чешская и Индигская губы, устья Индиги и Сев. Камбаль-
ницы, летом); Наумов, там же, 11 : 34 (одновременность икрометания); Р ы-
ж е н к о, Сборн., посвящ. Книповичу, 1939 : 394 (личинки и мальки мурманской
сельди); Марти,3 Сборн. «Биология и пром. Мурманск, сельди», 1939 : 54 (рас-
пределение в поверхностных слоях воды); Болдо вский, там же : 41 (пищевые
конкуренты); Тихонов, Тр. Полярн. научно-исслед. инет, морск. рыбн. хоз.
и океаногр., 4, 1939 : 5 (распределение в южной части Варенцова м. зимой); Ман-
тейфель и Марти, там же : 41 (места и условия нереста мурманской сельди);
IO д а н о в а, там же : 95 (содержание жира); П челкина, там же : 109 (рас-
пределение в связи с составом зоопланктона); Есипов, там же : 149 (литератур-
ная сводка по размножению у берегов Европы); Расс, там же, 6, 1939 : 93 (раз-
множение, биология молоди); Дмитриев, Рыбн. хоз., 1940, 10 : 26 (Белое м.);
Тихонов Тр. Полярн. научно-исслед. инет, морск. рыбн. хоз. и океаногр., 7,
1941 :3 (систематическое положение мурманской сельди); Марти, там же:
38 (жизненный цикл мурманской, сельди); М антейфель, там же : 125
‘(распределение в связи с планктоном); Болдо в ский, там же : 219 (питание
в море); S u n d, Ann. Biol., I, (1939—1941), 1943 : 45 (возрастной состав уловов
1 Цит. по: Т a n i n g, 1936.
2 Статья напечатана без фамилии автора.
3 См. также статьи других авторов этого сборника, кратко резюмирующие био-
логию мурманской сельди.
126
CLUPEIDAE
норвежской нерестовой сельди с 1907 по 1942 г.); Март и, Рыбн. промышл. СССР,
3, 1945 :3 (современное состояние промысла); Дмитриев, Биолог, и пром,
сельди в Белом м., изд. Всесоюзн. Научпо-исслед. инет, морск. рыбн. хоз. и океа-
ногр., 1946 : 41 (Белое м.); Тамбовцев, Рыбн. хоз., 1947, 6 : 30 (Белое м.,
западное побережье п-ова Канина); там же, 1949, 4 : 48 (Белое м., многочисленные
заходы в 1942, 1944, 1946 и 1948 гг.); Rasmussen, Fiskeridirekt. Skrift.,
Havunders., IX, 7, 1950 : 3 (идентичность норвежской и исландской сельди);
F ridriksson a. Aasen, ibid., IX, 11, 1950 : 7 (мечение, миграции между Нор-
вегией и северной Исландией).
D (III) IV 14—17 (15.0), общим числом 17—21 (18.9), А III 13—17
(15.0), общим числом 16—20 (18.0), sp. br. 66—73(70.1), килевых чешуй
позади основания брюшных плавников 13—16(14.3)_, vert. S. 56—
59 (57.06), caud. vert. 31—34 (32.57). Брюшные килевые чешуи развиты как
позади основания брюшных плавников, так и впереди от них. Зубы
на сошнике сравнительно хорошо развиты. Голова укороченная и широ-
кая, длина ее 20.2—22.8(21.1)% длины тела, межглазничный промежу-
ток 16.6—19.3(17.7)% длины головы. Глаза небольшие, 20.8—23.9
(22.2)% длины головы. Основание анальйого плавника 9.0—11.1(10.0)%
длины тела. Длина до 36 см, у экземпляров от берегов Исландии —
до 42 см. Описание дано по 38 экз. длиной от 28.9 до 34.4, в сред-
нем 32.5 см, собранным 17 III 1947 у берегов Норвегии (Алезунд).
По Гейнке (Heincke, 1898), позвонков 51—60, килевых чешуй 11—17;
по Ле Галю (Le Gall, 1935), средние числа позвонков у форм подвида
колеблются от 54.8 до 57.5, килевых чешуй от 13.3 до 15.6; по Тихонову
(1941), у мурманской сельди позвонков 55—59, средние за ряд лет
колеблются от 57.15 до 57.35-
Морская форма.
В пределах обширного ареала распадается на ряд локальных форм
(рас, популяций), различающихся некоторыми морфологическими (ко-
личеством позвонков, килевых чешуй, размерами) и биологическими
особенностями, в частности местами и временем нереста. По времени
нереста среди форм атлантической сельди различают весенних, лет-
них, осенних и зимних, из которых наиболее многочисленны весенние
и осенние. Начало детальному систематическому изучению рас атланти-
ческой сельди в конце прошлого столетия положил Гейнке (Heincke, 1898),
давший классификацию их для европейской части Атлантического океана.
В дальнейшем исследования многих авторов способствовали более углублен-
ному изучению рас сельди. На основе этих исследований новую классифи-
кацию их предложил Ле Галь (Le Gall, 1935), разделивший сельдей восточ-
ной половины Атлантического океана на следующие группы, среди которых
он различает ряд популяций (=расам или локальным формам Heincke).
I. Атлантическо-скандинавские весенние
сельди, куда относятся сельди Исландии, Фарерских о-вов, склонов;
континентального плато Северного моря, Норвегии. К ним относится нор-
вежская и наша мурманская сельдь. Средние числа позвонков выше 57.0 (от
57.0 до57.5), килевых чешуйв среднем от 13.3 до 14.1. Характерны быстрым
ростом и крупными размерами в половозрелом состоянии. Икрометание
происходит весной при температуре воды от 4 до 8° и солености от 34.5'
до 35.3°/оо., Атлантическо-скандинавские весенние сельди, судя по всему,
есть и у берегов Сев. Америки, где, кроме того, имеются летние и осен-
ние сельди; наибольшее значение здесь имеют весенние и осенние сельди,
которые детально еще не изучены.
II. Зимние шотландские сельди — сельди северо-
западного побережья Шотландии, северного и западного побережья
3. C LU РИА
127
Ирландии и края келыийского континентального нлато (восточного
побережья Ирландии). Средние числа нозвонков приближаются к 57.0
(56.9—57.0), килевых чешуй в среднем от 13.8 до 14.3. Характерны также
быстрым ростом и крупными размерами. Икрометание в конце зимы
и весной при температуре воды от 7 до 9° и солености от 34.6 до 35.3°/00..
К этой же группе провизорно относятся близкие по всем признакам,,
но размножающиеся позднее летние сельди Исландии и Фарерских о-вов.
Сюда же, судя по всему, относится и летняя сельдь Гренландии.
III. Сельди Ламанша встречаются по всему проливу-
и в южной части Северного моря и представляют смешанную группу..
Средние числа позвонков ниже 57.0 и выше 56.5 (от 56.6 до 56.8), киле-
вых чешуй в среднем от 14.3 до 15.0. Растут медленнее и менее крупны,,
чем сельди предыдущих двух групп, половой зрелости достигают при
длине около 25 см. Размножаются осенью и зимой при температуре воды
от 7.5 до 12.5° и солености от 33.5 до 35.0°/да.
IV. Сельди южного входа в Ирландское море-
(Smalls herring) близки к сельдям предыдущей группы. Среднее число,
позвонков менее 57.0 (от 56.6 до 56.9), килевых чешуй 14.1. По темпу
роста более близки к сельдям двух первых групп, чем к сельдям Ламанша.,
Нерестуют в зимне-весеннее время. Места, время и условия нереста точно,
не установлены.
V. Осенние сельди Северного моря (банковские-
сельди) встречаются по всему Северному морю и временами в восточной
части Ламанша. Среднее число позвонков близко к 56.5 (от 56.3 до 56.5),
килевых чешуй в среднем от 14.75 до 15.25. Рост еще более медленный,
чем у сельдей Ламанша. Размножаются осенью и в начале зимы при тем-
пературе воды от 9 до 13° и солености от 34 до 35°/оо.
VI. Сельди датских проливов представляют смешан-
ный комплекс популяций, промежуточных по своим признакам между
предыдущими группами и балтийской сельдью. Среди этих сельдей раз-
личаются следующие. 1) Зимние сельди Каттегата. Сред-
нее число позвонков близко к 57.0 (от 56.75 до 56.90), среднее число киле-
вых чешуй от 14.1 до 14.8. Размеры небольшие, значительно меньше-
сельдей двух первых групп того же возраста. Близки к атлантическо-
скандинавским весенним сельдям. Нерестуют в конце зимы при низкой,
температуре (4—5°) и солености воды (29—34°/00). 2) Осенние
сельди северо-восточной части Каттегата. Сред-
нее число позвонков немного менее 56.5 (от 56.1 до 56.4), килевых чешуй
в среднем от 14.40 до 14.65. Размеры в среднем около 25 см. Близки
к прибрежным сельдям Северного моря. Размножаются осенью при срав-
нительно высокой температуре (11—13°) и пониженной солености.
(29—34и/оо). 3) Осенние сельди южной части Катте-
гата и Зунда. Количество позвонков небольшое, близкое к числу,
их у балтийской сельди, в среднем около 55.5, килевых чешуй в среднем
14.2—14.5. Мелкие сельди. Икрометание осенью при высокой темпера-
туре воды (12—14°) и низкой солености (8—22°/00). 4) Весенние
сельди Скагеррака, Каттегата и Бельта. Среднее,
число позвонков близко к 56.0 (от 55.9 до 56.2), килевых чешуй в сред-
нем 14.0—14.5. Мелкие сельди, размножающиеся весной при темпера-
туре воды от 6 до 12° и солености от 8 до 24°/оо.
VII. Сельди Зюдерзее — солоноватоводного залива Север-
ного моря, образовавшегося в исторический период из пресноводного,
озера, отделенного от моря узким перешейком. Позвонков в среднем.
128
CLUPEIDAE
от 54.8 до 55.3. Размеры небольшие, темп роста замедленный. Близки
к балтийской сельди. Нерест весной при температуре воды от 7 до 13°
и слабой солености — от 9 до 11%0. В 1932 г. залив был отделен от моря
плотиной и превратился вновь почти в пресноводное озеро, в котором
сельдь уже в 1933 г. была поймана в ничтожном количестве, а в 1934 г.
исчезла совершенно.
Под названием атлантических сельдей Ле Галь объединяет сельдей
первых двух групп (атлантическо-скандинавских весенних и зимних
шотландских сельдей), живущих вблизи края континентального плато,
для которых характерно среднее число позвонков, большее или близ-
кое к 57.0, крупные размеры и быстрый темп роста, весенний нерест.
В более обширную группу прибрежных сельдей им объединены следую-
щие три группы (III—V), живущие ближе к берегам. Для них харак-
терно среднее число позвонков ниже 57.0, средние размеры и более замед-
ленный теми роста, осенний или зимний нерест. Под названием сельдей
солоноватых вод Ле Галь объединяет сельдей Зюдерзее, а также фиордо-
вых сельдей Норвегии и Швеции, сельдей дельт рек Эмс, Яд и Морле,
для которых характерно среднее число позвонков меньше 56.2, мелкие
размеры и замедленный темп роста, весенний нерест при пониженной со-
лености. К этим сельдям относятся и балтийские сельди, рассматривае-
мые здесь в качестве особого подвида.
Ряд популяций Ле Галя и несколько более мелких подразделений
внутри них, считая их за подвиды и дав им латинские наименования,
охарактеризовал Шнакенбек (Schnakenbeck, 1931). Все подвиды Шна-
кенбека целиком включены в классификацию Ле Галя. Что касается
подвидового значения подразделений Шнакенбека, то подвидом является
сама атлантическая сельдь, и, следовательно, им следует придавать мень-
шее систематическое значение, считая их за nationes, каковые для атлан-
тической сельди при современном состоянии изученности ее, по нашему
мнению, выделять не следует.
Лисснер (Lissner, 1934) разделяет атлантических сельдей на два более
крупных подразделения, предлагая считать их подвидами: 1) весенних
сельдей, к которым он провизорно относит и зимних, и 2) осенних сель-
дей. Немногочисленные летние сельди, как указывалось выше, относятся
к зимним, т. е. также к весенним сельдям.
Мурманская сельдь до сравнительно недавнего времени, по одним
взглядам (Рабинерсон, 1926, 1927, 1928; Петров, 1929, 1931; Суворов,
Вадова и Сынкова, 1931; Вадова, 1932; Аверинцев, 1935 и др.1), рас-
сматривалась как неполовозрелая норвежская сельдь, заходящая в Ба-
ренцево море в молодом возрасте, по другим (Макушок, 1928, 1932; Боро-
датова, 1930; Танасийчук, 1932; Юдкин, 1938) — считалась отличной
от нее. Позднее благодаря работам ряда советских исследователей,
в особенности сотрудников Полярного научно-исследовательского инсти-
тута морского рыбного хозяйства и океанографии (Рыженко, 1938, 1939;
Мантейфель и Марти, 1939; Расс, 1939; Марти, 1941), а также Рунстрем
(Runnstrom, 1933, 1934, 1936, 1937), установлены места нереста мур-
манской сельди, распространение ее в Баренцевом море и отношение
к норвежской. На основании сравнительно небольших отличий от послед-
ней мурманская сельдь была выделена как natio murmanica, что вряд ли
является целесообразным, так как за natio следовало бы считать, если
1 Подробнее о взглядах упомянутых и других авторов см. у Тихонова (1941);
см. также: Awerinzew (1935).
C LU PH. I 129
вообще нужно давать латинские названия этим группам, атлантическо-
скандинавских весенних сельдей, а мурманская, норвежская и другие
сельди этой группы систематически стоят ниже natio, и кроме того, эту
сельдь, судя по всему, уже описал Шнакенбек. По исследованиям Караи-
тониса (1938), сельдь, ловимая в Баренцевом море, по строению и сочле-
нению костей жаберной крышки и плечевого пояса, разделяется на три
гак им называемых типа. Сельдь III типа предположительно относилась'
им к норвежской сельди, сельди II и I типов — к мурманской, причем
сельдь I типа, согласно первоначальным исследованиям распространен-
ная только в прибрежных частях Варенцова моря, принималась за мур-
манскую фиордовую сельдь, сельдь II типа, встречаемая как в прибреж-
ных, так и в открытых частях моря, — за мурманскую океаническую,
В дальнейшем было обнаружено, что сельдь I типа имеет такое же широ-
кое распространение в открытых частях моря, как и сельдь II типа. Одно-
временно было констатировано, что различия между сельдями обоих
этих типов в строении operculum (наличие или отсутствие выемки на зад-
нем крае этой кости) обусловлены возрастной изменчивостью. Не было
найдено реальных различий между сельдями этих двух типов и в счет-
ных и пластических признаках, а также и в темпе роста (Тихонов, 1941).
Несомненно в сильной степени варьирует и признак отличия норвежской
сельди от мурманской (сочленение костей жаберной крышки).
Распростра. некие. Северная часть Атлантического океана
и прилегающие моря. На юг у берегов Сев. Америки до мыса Гаттераса,
на север — в Девисовом прол., у восточных (до 66—67° с. ш.) и запад-
ных (приблизительно до 72.5° с. ш.) берегов Гренландии, у западных
берегов Шпицбергена (до 77—78° с. ш.) и Новой Земли (до широты
Маточкина Шара), на восток в Баренцовом море до 50—52° в. д., вокруг
Исландии, Фаррерских, Шетландских и Оркнейских о-вов, Великобри-
тании и Ирландии, в Скагерраке и Каттегате, в западной части Балтий-
ского моря до о. Эланд — Данцигская бухта, на юг у берегов Европы
до Бискайского зал. Заходит в Белое море (Терский берег, Кандалакш-
ский, Онежский, Двинский заливы, Соловецкие о-ва), Мезенский зал.
и летом в юго-восточную часть Варенцова моря к востоку от о. Колгуева,
в Чешскую и Индигскую губы, в западную часть Печорского зал.
и в устья рек (Индиги, Сев. Камбальвицы и др.1).
Нерест атлантическо-скандинавской весенней
сельди происходит: 1) вдоль берегов северной Норвегии к северу
от Вест-фиорда, главным образом вблизи о. Рёст, у западных берегов
о-вов Лофотенских и Вестеролен — на банках против о-вов Вество-
гей, Лангей, Андей, Квалей, Рингвассе и фиорда Маланген (мурманская
сельдь, с начала февраля до середины мая, основной нерест в конце фев-
раля до середины апреля); к северу от Тромсе, вдоль Финмаркета и Мур-
мана, нерест, судя по имеющимся данным, происходит в очень малых раз-
мерах в Мотовском (Малая Лица, Вичанское озерко) и Кольском зали-
вах (губы Полярная Гавань, Варламова, Сайда, Ваенга, Рослякова),
губе Орловка (у Териберки), где найдены только личинки, предположи-
тельно относимые к мурманской фиордовой сельди1 2 (с марта—апреля
по май—июнь, в более северных и восточных районах позднее: у Фин-
маркета — в мае, в Кольском зал. — в мае—августе); 2) у берегов
1 В р. Эльбе отмечена у Гамбурга (Schnakenbeck, 1931).
2 Мурманская фиордовая сельдь изучена севершенно недостаточно; единого
мнения о реальности ее существования нет (Расс, 1939; Тихонов, 1941). Судя по
имеющимся данным, оснований для признания ее нет.
9 Фауна СССР —314
130
CLUPEIDAE
Норвегии к югу от 63° с. ш., наиболее интенсивно между 58 и 60° с. ш.
у юговосточных (в Скагерраке) и юго-западных (от Листер-фиорда до Але-
зунда), между 62 и 63° с. ш. в районе Мёре и на банке Викингов (нор-
вежская сельдь, с февраля по май); в районе между нерестилищами
мурманской и норвежской сельдей нерест происходит в крайне незначи-
тельном размере, единичные нахождения личинок известны только
от Тронделаген, в Бейстад-фиорде и других фиордах к северу до Склина-
банки (норвежская фиордовая сельдь); 3) вблизи Шетландских о-вов
(с января по апрель); 4) в некоторых южных фиордах Фарерских о-вов
(весенние сельди Фарерских о-вов, с марта, возможно с февраля, по май
включительно); 5) у южных берегов Исландии от м. Рейкьянес на западе
до V. и Е. Horn на востоке (весенние сельди Исландии, в марте—апреле);
6) у берегов Гренландии в Датском прол, (были находимы близкие к зре-
лости сельди в июле, что указывает на возможность нереста здесь весен-
них сельдей). Зимние шотландские сельди мечут икру:
1) в районе Гебридских о-вов и к северу от Шотландии (сельди западного
побережья Шотландии, с января по март включительно); 2) па банках
против устья р. Клайд у побережья Айршайр и юго-западного побережья
о-ва Аррэн (клайдские или клондайкские сельди, конец .февраля или
начало марта); 3) у южных берегов Ирландии и в западном входе в Ла-
манш (сельди кельтийского плато, с января по апрель включительно);
4) у Фарерских о-вов, места точно не известны (летние сельди Фарерских
о-вов, в августе—сентябре); 5) у южных и юго-западных берегов Ислан-
дии (летние сельди Исландии, с конца июня до середины августа);
6) у берегов Гренландии вблизи мыса Фэруэл (летние сельди Гренландии,
недавнего, невидимому исландского происхождения, август). Сельди
Ламанша нерестуют по всем берегам пролива и в южной части Се-
верного моря — у берегов Англии в Плимутском зал. и у Сёссекса, у бе-
регов Франции в Сенекой бухте и от м. Антифер до м. Гри Нэ (с сентября
по март включительно е максимумами в ноябре—декабре и в декабре—
январе, в Плимутском зал. в декабре—феврале). Места нереста сель-
дей южного входа в Ирландское море точно не изве-
стны (с января по март—апрель зимне-весенние и с октября по декабрь
осенние). Осенние сельди Северного моря (банковские
сельди) размножаются во всей восточной части Северного моря, на Дог-
гер, Малой Рыбачьей, Ютландской банках и на банке Герман Байт
(с июня по декабрь, по направлению к южной части моря позднее, чем
в северной). Сельди датских проливов, ведущих в Бал-
тийское море, нерестятся: 1) в восточной части Каттегата и в северной
части Б. Бельта (зимние сельди Каттегата, с января по март включи-
тельно) ; 2) в северо-восточной части Каттегата (район Кобер-Грунд —
к юго-западу от о. Лесё, осенние сельди северо-восточной части Катте-
гата, в сентябре—декабре); 3) в южной части Каттегата, в Зунде,
Б. Бельте и в западной части Балтийского моря к югу от о. Лоланда
и у о. Борнгольм (осенние сельди южной части Каттегата и Зунда, в ав-
густе, сентябре и октябре); 4) в южной части Скагеррака, в западной
части Каттегата, в Бельте и в западной части Балтийского моря к юго-
западу и югу от о. Лоланд до Рюгена и к западу от него (весенние сельди
Скагеррака, Каттегата и Бельта, вблизи берегов, места нереста изме-
няются, с марта по июнь включительно). Сельди Зюдерзее
до отделения его от Северного моря размножались в наиболее глубоких
частях залива (с апреля по май включительно). Особо следует сказать
о нересте сельдей в Лим-фиорде, пересекающем Ютландский п-ов в его
3. CLUPEA 131
северной части. Здесь размножаются две формы: 1) восточная, древнего
происхождения, проникшая сюда из Каттегата, которая размножается
весной, с апреля по начало июня, и 2) западная, недавнего происхожде-
ния, зашедшая сюда после прорыва в 1825 г. перешейка, отделявшего
фиорд от Северного моря, и нерестующая осенью; последняя сельдь
близка к осенним сельдям Северного моря, в частности к размножаю-
щимся на банках Ютландской и Герман Байт. Более позднего происхо-
ждения сельди, размножающиеся весной и осенью в нескольких местах
Кильского канала, который с 1896 г. соединяет Северное море с запад-
ной частью Балтийского через Ютландский п-ов у его основания. Нерест
у берегов Сев. Америки происходит с апреля по ноябрь. В зал. Св. Лав-
рентия нерестует весенняя и осенняя сельди, в зал. Фёнди — весенняя
и поздне-летняя, у западного побережья Новой Шотландии — весенняя
и осенняя, южнее до м. Код — позднелетняя и осенняя, причем нерест
здесь происходит позднее, чем в более северных районах.
Биология. Икрометание у подвида в целом, как видно из всего ска-
занного выше, происходит круглый год, причем даже у сельдей одной и
той же группы по сезону нереста, например у весенних или какой-либо дру-
гой группы, сроки его значительно изменяются в зависимости от географи-
ческой широты положения нерестилищ. Нерестилища располагаются вблизи
берегов, в фиордах и заливах, в проливах между островами или отделяю-
щих острова от материка, на банках среди моря, на глубине от несколь-
ких метров до 200 м, различной для разных форм сельдей. На сравни-
тельно небольшой глубине мечут икру сельди, размножающиеся в про-
ливах, заливах и вблизи берегов: сельдп датских проливов (осенние
сельди Каттегата и Зунда на глубине от 8 до 22 м, весенние сельди Ска-
геррака, Каттегата и Бельта — от 8 до 24 м, осенние сельди северо-во-
сточной части Каттегата и зимние сельди Каттегата — от 29 до 34 м),
клайдские сельди (от 15 до 40 м) и весенние сельди Фарерских о-вов
(до 50 м). На еще меньшей глубине вблизи берегов нерестует еще мало
изученная летняя сельдь Гренландии (0.5 м). На наибольшей глубине
расположены нерестилища сельдей, размножающихся в отдалении от бе-
регов, в частности осенних (банковских) сельдей Северного моря
(до 200 м). Приблизительно на такой же глубине нерестует мурманская
сельдь. Норвежская сельдь размножается на глубине до 100—120 м,
по более ранним указаниям, на значительно меньшей — от 0 до 70 м.
Икра, в отличие от икры преобладающего большинства сельдевых, клей-
кая, приклеивающаяся к различному субстрату на дне моря, отклады-
вается на дно преимущественно с твердыми, песчанистыми, гравиевыми
и каменистыми грунтами, где она располагается тонким слоем по поверх-
ности дна — по камням, битой ракуше, приклеивается к песчинкам,
иногда к подводной растительности. На илистых и песчано-илистых грун-
тах сельдь, как правило, икру не откладывает, за исключением редких
случаев, в частности, когда дно покрыто растительностью. В отношении
солености нерестилища, расположенные в Атлантическом океане и в Се-
верном море, довольно однообразны — соленость на них близка к нор-
мальной океанической. Наиболее широки пределы колебания содержа-
ния солей на нерестилищах мурманской сельди (31.9—=35.9°/00), покрывая
пределы колебаний солености на нерестилищах остальных, размножаю-
щихся в Атлантическом океане и Северном море форм. При значительно
более низком и изменчивом содержании солей происходит размножение
сельдей в проливах, ведущих в Балтийское море, и в некоторых заливах.
Осенние сельди северо-восточной части Каттегата и зимние сельди
9*
1 >2
clupeidae
Каттегата мечут икру при солености 29—34%о- Осенние сельди южной
части Каттегата и Зунда нерестуют при еще более низком содержании солей
(от 8 до 22°/оо). При наиболее низкой солености размножались сельди Зю-
дерзее (от 9 до 11°/по). Температурные условия нереста подвида в целом
довольно широки, с амплитудой колебаний от 4 до 14°, но для разных
форм значительно уже и в общем довольно постоянны, с колебаниями
в несколько градусов. Весенние сельди нерестятся при более низкой
температуре воды, чем сельди с летним и осенним икрометанием. При
наиболее высокой температуре воды размножаются осенние сельди дат-
ских проливов (осенние сельди северо-восточной части Каттегата при 11—
13°, осенние сельди южной части Каттегата и Зунда при 12—14°). При
наиболее низкой температуре происходит размножение зимних сельдей
Каттегата — от 4 до 5°. Плодовитость для подвида в целом, по исследо-
ваниям ряда авторов, колеблется в довольно широких пределах. Наи-
меньшее количество икринок указывается в 10 тыс., наибольшее —
до 100 тыс. Пределы колебаний, указываемые разными авторами, значи-
тельно уже, средние значения существенно отличаются, что обусловлено
принадлежностью исследованных сельдей к разным формам и неодинако-
выми размерами их. Так, например, сельди от восточных берегов Шот-
ландии имеют от 21.5 до 47.5 тыс., в среднем 31 768 икринок (Fulton,
1891), сельди из устья р. Шлей — от 21 до 95 тыс., в среднем 44.5 тыс.
икринок (Apstein, 1898),: осенние сельди из Кильской бухты — от 13
до 65.4 тыс. икринок, весенние тех же мест — от 26 до 40 тыс. икринок
(Jenkins, 1902). Мурманская сельдь длиной от 23 до 25 см имеет от 14.8
до 23.3 тыс. икринок (Есипов, 1939). Икра выметывается одновременно
(Наумов, 1939). Диаметр икринок у сельди из района р. Шлей колеблется
от 1.125 до 1.350 мм, в среднем равен 1.238 мм (Apstein, 1898). У сельди,
размножающейся в Кильском канале, икринки крупнее, от 2 до 3 мм
(Hinkelmann, 1899). У берегов Ирландии икринки весенних сельдей
имеют диаметр от 0.8 до 1.48 мм, осенних мельче, 0.36—1.06 мм, причем
у рыб одного размера икринки весенних сельдей приблизительно на 25%
тяжелее икринок осенних (Farrап, 1938). Период развития икры в зави-
симости от температуры воды длится от 6 до 50 суток, при 14—19° он
продолжается 6—8 суток, при 0—1° — от 47 до 50 суток, при наиболее
обычных в естественных условиях температурах 9—10° — 12 суток,
при 3—4° — 15 суток. При выклевывании из икры личинки имеют раз-
меры от 5 до 8 мм, причем вышедшие из икры, развивавшейся более дли-
тельный срок при более низкой температуре воды, крупнее вышедших
из икринок, развитие которых происходило в более короткий период
при высокой температуре воды. Благодаря этому личинки сельдей, раз-
множающихся в холодные сезоны в северных частях ареала, имеют более
крупные размеры, чем личинки сельдей, нерестующих в теплые сезоны
или в южных частях ареала. Личиночная стадия с желточным мешком
длится от 3 до 21 суток, причем срок развития тоже определяется темпе-
ратурой воды. В районе Плимута желточный мешок всасывается, начи-
ная с размеров личинки в 8 мм, наичаще при 10 мм, реже при несколько
больших, до 12 мм (Lebour, 1921). По всасывании желточного мешка
личинки переходят к активному питанию, но указываются случаи пита-
ния личинок и до всасывания ^келточного мешка (Lebour, 1922; Marshall,
Nicholls and Orr, 1937). По выходе из икры большинство личинок сразу же
поднимается в поверхностные слои воды, причем они совершают верти-
кальные суточные миграции, встречаясь в большем количестве у поверх-
ности ночью. В поверхностных слоях воды держится преобладающее
3. CLUPEA
133
большинство питающихся личинок, в придонных — большая часть еще
не питающихся; в промежуточных слоях воды и те и другие личинки
встречаются в значительно меньших количествах (Lebour, 1924). Тече-
ниями, в сфере действия которых находятся места размножения, личинки
и мальки некоторых форм сельди далеко уносятся от нерестилищ.
В частности, личинки и мальки норвежской сельди в прибрежной ветви
Североатлантического течения перемещаются к северу и в возрасте
1—2 лет достигают берегов Финмаркена (Johansen, 1927; Lea, 1929; Расс,
1939). Сходным образом переносятся течением с мест нереста личинки
и мурманской сельди. Единичные экземпляры близких к нересту мур-
манских сельдей найдены в юго-западной части Варенцова моря зимой
и. весной, наиболее часто в январе и феврале, реже в декабре, марте,
апреле и июле, еще реже в другие месяцы. Сельдь со зрелыми половыми
продуктами найдена у северных берегов Норвегии в апреле, в Кольском
заливе в мае и июне—августе. Отнерестившиеся сельди единично найдены
у берегов северной Норвегии, на Финмаркенской и Мурманской банках
весной, в феврале и апреле, и еще'реже летом, в июне и июле (Расс, 1939).
Икринки мурманской сельди найдены И апреля в желудке трех пикш,
пойманных на глубине 209 м в районе о-ва Вествогей (Мантейфель
и Марти, 1939) и, кроме того, в большом количестве в желудках пикши,
ловимой в апреле 1939 г. на Малангенской банке, где одновременно пой-
мана и нерестующая сельдь (Расс, 1939). Личинки с желточным мешком
за период исследований с 1899 по 1938 гг. найдены рядом авторов у се-
верных берегов Норвегии от Вест-фиорда на западе до Трольд-фиорда
на северо-востоке (Ehrenbaum, 1902; Runnstrom, 1934; Рыженко, 1938,
1939; Мантейфель и Марти, 1939). В наибольшем количестве личинки
в этой стадии обнаружены на банках против островов Вествогей, Ланг-
вей, Андей, Квалей, Рингвассе и фиорда Маланген, преимущественно
с внешней стороны островов; со стороны материковой, в фиордах, шхе-
рах и проливах, личинки встречаются единично или (в Вест-фиорде)
отсутствуют совершенно (Мантейфель и Марти, 1939). У Финмаркена
и Мурмана нерест, судя по имеющимся данным, более обычен в шхерах
(Сёре-Сунд) и фиордах (Кольский зал.). В наибольшем количестве ли-
чинки пойманы в марте и апреле, в мае — единично. Наибольшее коли-
чество личинок попадается над глубинами от 50 до 150 м и наичаще от 150
до 200 м, куда простирается сфера действия Североатлантического тече-
ния, а вообще найдены над глубинами от 7 до свыше 700 м, но над глуби-
нами менее 50 и свыше 300 м обнаружены лишь в единичных случаях.
Судя по нахождению личинок с желточным мешком, в марте сельдь нере-
стится на несколько большей глубине, чем в апреле. Температура при-
донных слоев воды в местах нахождения личинок колеблется от 5.6
до 6.9°, в местах нахождения личинок над большими глубинами (600—
700 м) — ниже, до 2.3°. Соленость в придонных слоях воды здесь колеб-
лется от 34.87 до 35.95%о (Расс, 1939; Мантейфель и Марти, 1939). Грунт
на местах нереста песчаный и гравиевый. Личинки мурманской сельди
первых двух стадий по всасывании желточного мешка размерами
до 35 мм в южной, где дрейф наиболее изучен, и в северной ветвях Севе-
роатлантического течения уносятся от мест нереста вдоль берегов север-
ной Норвегии и Финмаркена на север до 72° с. ш. и на восток до 33° в. д.
Мальки в литоральной стадии размерами 35—60 мм, в возрасте около
5 месяцев найдены у самых берегов Мурмана от губы Титовка (Мотов-
ский зал.) до губы Вороньей (35°50' в. д.), главным образом в местах
впадения рек, пройдя, таким образом, около 800 миль от мест нереста,
134
CLUPEIDAE
что близко согласуется со скоростью Нордкапской ветви. Вполне сфор-
мировавшиеся мальки размерами свыше 60 мм (до 90—100 мм) осенью
и зимой (с середины октября и почти до конца марта) обнаружены вдоль
берегов от Мотовского зал. до восточной части Мурмана и в открытом
море до Канинской и Гусиной банок, до 47°50' в. д. на восток и 71°51'
с. ш. на север, опускаясь в этот период в придонные слои воды (Расс,
1939). На втором и третьем году жизни мурманская сельдь занимает
наиболее широкий ареал в Баренцовом море, летом активно распростра-
няется в центральной и восточной частях моря на север до 76°48' с. ш.,
проникая на восток до п-ова Канина, о. Колгуева и заходя в Белое море,
зимой отходит в центральные и западные районы моря. В этом возрасте
сельдь обнаруживает усиленный рост в длину, но жировых отложений
не накапливает и поэтому почти не прекращает питаться и зимой. Летом,
начиная с половины мая по июнь, одно- и двухгодовалые с небольшой
примесью трех- и четырехгодовалых заходят в губы Мурманского побе-
режья (так называемая летняя сельдь), причем в одних стаях преобла-
дают одногодовалые, в других двухгодовалые. Возрастной состав летней
сельди для отдельных лет, по данным Глебова (1938), таков (в процентах):
Возраст . • 1+ 2+ 3—j— 4-Ь
1932 г. . . . . 12.9 84.8 1.9 0.4
1933 г. . . . . 41.7 11.0 46.6 0.7
1934 г. . . . . 45.8 43.8 9.6 0.8
1935 г. . . . . 18.6 70.3 10.3 0.8
1936 г. . . . . 66.1 20.1 11.9 1.9
1937 г. . . . . 76.4 23.5 0.1 —
Заходы летней сельди в губы не носят регулярного характера —
в некоторые годы опа заходит в большом количестве, в иные — в незна-
чительном. Большим колебаниям подвержены и сроки начала заходов
сельди. Летние подходы сельди к берегам и заходы ее в губы обусловлены
в основном большим прогреванием их вод по сравнению с открытым
морем. Заходы летней сельди в губы начинаются при наличии более,
высокой температуры воды поверхностных слоев в прибрежной области
и в губах, чем в открытом море. Особенностями термического режима при-
брежных вод в отдельные годы обусловливается и нерегулярность под-
ходов летней сельди. В годы с более ранним прогреванием поверхностных
слоев воды в прибрежной области и в губах сельдь заходит раньше. Наи-
большие заходы сельди бывают в годы с более резко выраженным повы-
шением температуры поверхностных слоев воды по направлению из моря
в губы. Летняя сельдь заходит главным образом в губы Кольского зал.,
в губы Мотовского зал. заходит обычно в значительно меньшем коли-
честве и позднее, что обусловлено различиями в термическом режиме
этих заливов — поверхностные слои воды в более узком Кольском зал.
нагреваются быстрее и больше, чем в Мотовском зал. Кроме того, на терми-
ческий режим Кольского зал. существенное влияние оказывает посту-
пающая в него в большем количестве пресная вода, летом более теплая
и значительно отепляющая поверхностные слои его воды. Подходам летней
сельди в прибрежные воды и заходу ее в губы благоприятствуют слабые
береговые ветра, выносящие дальше в море прогретые прибрежные воды.
Сильные ветра, перемешивающие воду, на подходы сельди действуют
отрицательно (Глебов, 1938). Начиная с четвертого года жизни, сельдь
не имеет такого широкого распространения в Баренцовом море на север
и на восток, как в предыдущие возрасты, за лето накапливает в мышцах
3. CLUPEA
135
и на внутренностях жировые отложения. С наступлением осени, сокра-
щая ареал по сравнению с летним, сельдь перемещается из восточных
районов в западные, сперва в район южного склона Мурманской банки,
позднее на северо-западный, весной (в марте) в район Нордкапской и
Пордкинской банок. Зимой опускается в придонные слои воды и обычно
перестает питаться. С наступлением лета вновь распространяется к вос-
току — до северного склона Мурманского мелководья и меридиана Святого
11оса. В этом, а также в несколько меньшем и большем возрастах (2-j—6+)
сельдь (так называемая жирная сельдь) в массе заходит в прибрежную
область и в губы Мурманского побережья, составляя основу прибрежного
промысла. В отличие от летней сельди жирная сельдь, подходя в при-
брежную область ежегодно, в губы может и вообще не заходить, если
опа в течение лета не накапливает в теле в достаточном количестве жира,
продолжая отчасти питаться и зимой, хотя наполнение желудков бывает
большей частью незначительным (Болдовский, 1938). В прибрежные
воды заходит лишь достаточно упитанная и жирная сельдь. Заходы жир-
ной сельди в прибрежную область и в губы обусловлены термическим
режимом, причем, в отличие от заходов летней сельди, происходят при
более низкой температуре воды здесь, чем в открытом море.1 Подходам
сельди благоприятствуют сгонные ветра, вызывающие выход на
поверхность холодных нижних слоев воды. Первые подходы жирной
сельди в прибрежную область наблюдаются с августа, иногда даже с июня.
Массовые заходы в губы начинаются с октября—начала декабря, окан-
чиваются с начала января по середину марта. В небольшом количестве
жирная сельдь заходит в губы и раньше, в августе и сентябре. В отличие
от летней жирная сельдь заходит преимущественно в губы Мотовского
зал. и значительно реже в губы Кольского (Глебов, 1938). Заходы атлан-
тической сельди в Белое море аналогичны заходам ее в губы Мурманского
побережья. Старше трехгодовалого возраста в Белом море атлантическая
сельдь не встречается, и основную массу в уловах составляют особи
с одним и двумя зимними кольцами на чешуе. В наибольшем количестве
встречается в горле и центральной части моря, составляя в отдельных
уловах до 50 и 100%. Заходы в последние годы (1938, 1942, 1944, 1946,
1948) в связи с потеплением возросли (Тамбовцев, 1947, 1949). Выход
подросшей атлантической сельди из Белого моря в Баренцево совпадает
с превращением мелкой сельди в жирную (Дмитриев, 1946). В открытом
море осенью сельдь держится при температуре воды 5—7°. Зимой жирная
сельдь в губах, в прибрежной области и в море держится при темпера-
туре воды около 2—3.6°, опускаясь в море в придонные слои (Мантейфель
и Болдовский, 1938). В море в поверхностных слоях воды в наибольших
концентрациях мурманская сельдь держится на Финмаркенской банке
и на северо-западном склоне Мурманской банки, а в июле—августе,
кроме того, на северо-восточном и юго-западном склонах последней и
в прибрежной области. В сентябре—октябре и позднее в значительных
количествах сельдь была обнаружена нд Мурманской, Финмаркенской
и Рыбачьей банках, во вторую половину зимы — к западу от Финмар-
кенской банки и в районе нерестилищ (Марти, 1939). В придонных слоях
воды в ноябре—декабре основные скопления сельди обнаружены в восточ-
1 Вопрос об условиях захода жирной сельди в губы все же не совсем ясен, если
принять во внимание, что при отходе в западные районы моря та же жирная сельдь
ориентируется на более высокую температуру воды. Следует также отметить, что
массовые заходы жирной сельди за время с 1930 по 1941 гг. наблюдались только для
урожайного поколения 1930 г. в 1933 и 1934 гг. (Марти, 1941 : 117).
136
clupeidae
ных районах — на Гусиной банке, в Центральном районе, на Мурманскрм
мелководье и на Святоносской банке при температуре воды 3.4—4.8° у дна
и 3.5—4.9° у поверхности; в прибрежных районах держится крупная
сельдь, более мелкая — далее в открытом море. В январе—феврале
крупная сельдь встречается в западной части моря — на Мурманской,
Финмаркенской, Нордкинской, Нордкапской и Демидовской банках^
откуда зрелые идут к местам нереста, а неполовозрелые с прогреванием
верхних слоев воды (с апреля) поднимаются к поверхности (Тихонов,.
1939). На пятом году значительная часть мурманской сельди впервые
становится зрелой. С наступлением осени созревающая сельдь начинает
отходить на запад, в октябре—ноябре, в некоторые годы в январе дер-
жится по восточному склону Мурманской банки и вблизи северных скло-
нов Рыбачьей банки. В марте сельдь с совершенно зрелыми половыми
продуктами держится далее к западу, в районе Нордкапской банки.
Сельди, нерестующие впервые, размножаются главным образом в районе
от Малангенской банки до о. Сёре, сельди более старших возрастов идут
для нереста в более южные части нерестилищ. После первого нереста
мурманская сельдь в шести- семигодовалом возрасте держится предполо-
жительно на границе Варенцова и Норвежского морей к югу от о. Медве-
жий, в восточную часть моря не заходит. Сельдь более старшего возраста
(восьми- двенадцатигодовалая) мигрирует для питания после нереста
по Шпицбергенской ветви Североатлантического течения на север до
широты западных берегов Шпицбергена (77—78° с. ш.) (Марти, 1941).
Схема жизненного цикла мурманской сельди по имеющимся данным
в общих чертах такова. Личинки с нерестилищ у о-вов Лофотенских и
Вествогей в Нордкапской ветви Североатлантического течения дрейфуют
на север и восток и проходят литоральную стадию в возрасте 4—5 месяцев
у берегов Финмаркена и Мурмана. По окончании метаморфоза мальки
в струях течений активно расселяются в центральных и восточных частях
Варенцова моря. На втором и третьем годах жизни сельдь в летнее время
имеет в Варенцовой море наиболее широкий ареал, зимой, отходя в цен-
тральные и западные районы моря, занимает меньший ареал, летом захо-
дит в губы Мурманского побережья. Начиная с четвертого года жизни,
ареал сельди смещается к западу. Летом сельдь этого возраста распро-
страняется в восточном направлении, осенью и зимой отходит к западу
и подходит в прибрежную область, в некоторые годы в массе заходя
в губы Мурманского побережья. Созревающая сельдь, начиная с осени,
в течение зимы из западной части моря постепенно отходит к местам икро-
метания и впервые размножается в северных частях нерестилищ. После
первого икрометания пяти- и шестигодовалые сельди отходят с нерестилищ
в западную часть Варенцова моря и, повидимому, держатся на границе
его с Норвежским. Повторно нерестующие сельди (восьмигодовалые
и выше) размножаются в более южных частях нерестилищ и после икро-
метания отходят к северу, до Шпицбергена (Марти, 1941; Расс, 1939).
Схема жизненного цикла норвежской сельди в общих чертах сходна
с таковой мурманской сельди, отличаясь в некоторых деталях. Личинки
норвежской сельди с нерестилищ у южных берегов .Норвегии прибрежной
ветвью Североатлантического течения сносятся вдоль берегов к северу,
достигая в возрасте 1—1% лет Финмаркена, где ловятся в виде мелкой
сельди (smaasild, small-herring). У берегов Финмаркена сельдь отходит
от берегов и мигрирует обратно к югу, подходя вновь к берегам средней
части Норвегии и в возрасте 2)4—4 лет ловится здесь в виде жирной
сельди (fetsild, fat-herring). С началом созревания половых продуктов
3. CLUPEA
137
сельдь вновь отходит от берегов, на этот раз значительно дальше и в тече-
ние одного или нескольких лет в возрасте 2—7 лет проходит в открытом
море так называемую океаническую стадию жизни, отсутствующую у мур-
манской сельди. Созревающие сельди в возрасте 4—7 лет подходят к местам
нереста и ловятся здесь в виде так называемой крупной (storsild, large-
lierring) и весенней (vaarsild, spring-herring). По окончании нереста нор-
вежская сельдь отходит далеко к северу, заходя в западную часть Варен-
цова моря и достигая о. Медвежьего и широты южной оконечности Шпиц-
бергена, откуда через год возвращается для нереста вновь и мечет икру
в более южных частях нерестилищ, чем сельдь, размножающаяся впервые
(Lea, 1929; Runnstrom, 1937; Расс, 1939). Однако последующими исследо-
ваниями (Марти, 1941) установлено, что по Шпицбергенской ветви тече-
ния к северу совершает миграции лишь мурманская сельдь. В последние
годы получены данные, свидетельствующие о сходстве между норвежской
сельдью и сельдью от северных берегов Исландии (Rasmussen, 1950),
а также о миграциях сельди между Норвегией и северной Исландией
(Fridriksson a. Aasen, 1950). Вследствие различия в условиях существо-
вания в южных и северных частях вытянутого почти в меридиональном
направлении ареала норвежская сельдь в первые годы жизни (мелкая
сельдь) по характеру роста и строению зимних колец на чешуе существенно
различается. Сельдь, проведшая первые годы жизни в южной части запад-
ного побережья Норвегии, имеет неясно выраженные зимние кольца
(так называемого южного типа зимние кольца). Сельдь, попавшая к север-
ному побережью Норвегии, имеет на чешуе резко очерченные зимние
кольца (так называемого северного типа). Сельдь, ловимая у западных
и средней части северных берегов Норвегии, по строению зимних колец
представляет смесь обоих типов. Количество сельдей с кольцами южного
типа увеличивается к югу, с кольцами северного типа — к северу. Кольца
северного типа имеются в количестве 3—6, южного — не более чем 3.
R течение океанической стадии на чешуе сельди откладываются 1—2 менее
резко выраженных, чем северного, — но более резко, чем южного типа,
кольца (так называемого океанического типа). Наконец, на чешуе нересто-
вой сельди откладываются более определенные и резко очерченные кольца
нерестового типа (Lea, 1929; Runnstrom, 1936). Чешуя мурманской сельди
по строению зимних колец в преобладающей массе относится к северному
типу; сельдей с кольцами южного типа у ней не обнаружено. Колец океа-
нического типа у мурманской сельди также не найдено. Однако на чешуе-
части сельди урожайного поколения 1930 г. у 74% общего количества'
исследованных рыб этого поколения обнаружены 1—2 зимних кольца,
значительно более широких, чем кольца северного типа, похожие на-
океанические кольца норвежской сельди, но значительно менее широкие,
чем последние. Сельди с чешуёй такого типа (названного морским) лови-
лись в течение нескольких лет, начиная с конца лета или осенью, т. е..
в то время, когда у берегов Мурмана появляется норвежская сельдь,
и, повидимому, относятся к последней. Судя по более быстрому темпу
роста лет с морским типом колец, сельдь эта держится вдали от бере-
гов Мурмана. Среди норвежских сельдей, заходящих в Баренцево море,
сельдей с кольцами южного типа, по исследованиям последних лет, не’
найдено (Мурашкинцева, 1938). Годичный цикл питания мурманской
сельди таков: наиболее интенсивно сельдь питается летом, главным об-
разом в июне и июле; с августа по октябрь интенсивность питания сни-
жается, в ноябре становится крайне незначительной; с декабря по март
сельдь почти совсем не питается, за исключением сельди, зимующей
1.38
CLUPEIDAE
в открытом море, которая понемногу начинает питаться с января. Одно-
и отчасти двухгодовалые сельди в море не прекращают питаться и зимой.
Неполовозрелая одно- пятигодовалая сельдь в открытом море наиболее
интенсивно питается летом, поедая в это время в Массе Calanus finmar-
chicus. Весной и осенью основными компонентами питания сельди в море
являются Euphausiidae и отчасти С. finmarchicus, кроме августа, когда
сельдь поедает преимущественно молодь рыб (Болдовский, 1941). В при-
брежной области в период перед зимними заходами в губы интенсивность
питания сельди слабая, поедаются почти исключительно Euphausiidae
{Thyssanoessa inermis и Th. raschii), в некоторые годы Limacina retroversa.
В период зимних заходов в губы, с октября по апрель, желудки сельдей
всех возрастов (1+— 5+) пустые. По окончании зимней концентрации
сельди в губах она начинает понемногу питаться, поедая главным образом
Euphausiidae, Sagitta и Calanidae (С. finmarchicus, С. hyperboreus, Metridia
longa, M. luceus). Во время летних заходов в губы сельдь питается менее
интенсивно, чем в открытом море. В июне основу питания летней сельди
в губах составляют С. finmarchicus и отчасти личинки Euphausiidae и неко-
торые другие ракообразные. В июле интенсивность питания сельди в губах
снижается еще более, основной пищей в это время являются С. finmar-
chicus и, кроме того, мелкие Copepoda, Gladocera, личинки Girripedia
и Lamellibrachiata. В августе сельдь в губах питается еще менее интенсивно
поедая в основном Euphausiidae, мальков рыб и отчасти С. finmarchicus
и мелких Copepoda, Gladocera и др. За весь период пребывания сельди
в губах основу питания ее составляют личинки Girripedia (37.6%), С. fin-
marchicus (34.2%) и Euphausiidae (13.9%), которые в общем итоге дают
95% общего компонента по весу. В желудках мальков литоральной стадии,
размерами 30—45 мм в губах (Пала-губа) Мурманского побережья,
пойманных в начале августа 1933 г., обнаружены ювенальные стадии и
nauplii Copepoda (Oithona similis), Microstella norvegica, личинки Lamelli-
branchiata и единично Peridinium depressum. Сеголетки в губах не пре-
кращают питаться и зимой (Болдовский, 1938). Только что выклюнувшиеся
личинки у берегов Великобритании вначале, еще до всасывания желточ-
ного мешка, поедают личинок моллюсков и nauplii Copepoda, затем по мере
роста, после всасывания желточного мешка, пища личинок состоит из
взрослых Copepoda (Pseudocalanus elongata clausii, Corycaeus angilis и др.),
диатомей (главным образом Paralapia sulcata и др., заглатываемых отчасти
•вместе с организмами, питающимися ими), инфузорий и др. (Lebour, 1918,
1921, 1924; Marshall, Nicholls a. Orr, 1937). Личинки сельдей поедаются
рядом рыб (треской, пикшей и др., даже самой сельдью) и некоторыми бес-
позвоночными (медуза Rathkea octopunctata, ктенофора Pleurobrachia
pileus, червь S agitta bipunctata и др.; Lebour, 1922, 1923). Существенными
пищевыми конкурентами мурманской сельди являются гребневики (Bolina,
Вегое), питающиеся планктоном и имеющие массовое развитие с августа,
иногда с июня, причем сельдь в период интенсивного питания (в июне
и июле) в местах массового скопления гребневиков держалась в меньшем
количестве, чем в местах, свободных от гребневиков. В периоды менее
интенсивного питания сельди массовое скопление гребневиков обычно
-сопровождается большими концентрациями и сельди (Болдовский, 1939).
На распределение сельди в море отрицательное влияние оказывает периоди-
ческое массовое развитие водорослей, отмеченное рядом авторов и в Север-
ном море. В Баренцовом море массовое развитие водорослей (Phaeocystis,
Ghaetoceros) происходит в мае в центре южной части моря в поверхностных
-слоях воды (до глубины 25—50 м), вследствие чего сельдь здесь в это время
‘I. CLUPKA
139
доржится на глубине 50—100 м. В июне области массового развития
водорослей перемещаются к востоку от Мурманской банки, а затем к северо-
западу, в связи с нем сельдь поднимается в поверхностные слои воды,
скапливаясь у границ распространения водорослей и перемещаясь по мере
отодвигания их. Существенное влияние на распределение сельди оказы-
вает развитие водоросли Rhizosolenia, наблюдаемое нередко в западных
частях Варенцова моря в Июле, в связи с чем сельдь из этих районов
отходит (Болдовский, 1939; Мантейфель, 1941). Половой зрелости преоб-
ладающее большинство форм атлантической сельди достигает в трех-
чотырехгодовалом возрасте. Норвежская сельдь впервые мечет икру
в трех- восьмигодовалом возрасте, причем массовое созревание (46.8%)
происходит в пятигодовалом возрасте, несколько меньшее (21.7°/0) —
и четырехгодовалом. Мурманская сельдь впервые начинает размножаться
и четырех- семигодовалом возрасте, массовое созревание (43.5%) происхо-
дит в шестигодовалом возрасте, несколько меньшее (31.4%) — в пятигодо-
валом, в четырехгодовалом—-в незначительном количестве (7.1%),
трехгодовалые еще неполовозрелые (Тихонов, 1941). Рост мурманской
и норвежской сельди по приводимым для последней Тихоновым (1941)
данным Рунстрема для категории 1930 г. происходит следующим образом
(см):
U 1
Ь 1з
Мурманская сельдь
Норвежская ,
. L 9.65 14.72 .18.93 23.07 25.86
. 10.30 15.80 20.60 25.90 29.90
Возрастной состав, как и у других промысловых рыб, в отдельные
годы различен. Колебания возрастного состава обусловливаются раз-
личной урожайностью отдельных поколений, причем урожайное поко-
ление имеет преобладающее значение в промысловых уловах в течение
ряда лет. Наиболее урожайное поколение норвежской сельди 1904 г.
впервые стало ловиться по достижении половой зрелости в трехгодовалом
возрасте в 1907 г. (1.6% улова), преобладало в уловах в 4—14-годовалом
возрасте в 1908—1918 гг. (78.1—31.6%), т. е. в течение И лет, составляло
значительную часть улова в 15—18-годовалом возрасте в 1919—1922 гг.
(24.8—9.6%) и встречалось еще в уловах до 23-годовалого возраста
в 1923—1927 гг. (3.9—1.5%) (Sund, 1943). У мурманской сельди одним
из урожайных было поколение 1930 г., которое являлось основным в уло-
вах летней сельди в губах в 1931 и 1932 гг. и зимой 1933—1934 и 1934—
1935 гг. Далее урожайным было поколение 1934 г., которое особой роли
в уловах летней сельди в губах не играло, но имело существенное значе-
ние в прибрежных дрифтерных уловах в 1936 г. и особенно в морском
дрифтерном промысле в 1937 и 1938 гг. Вследствие того что вблизи бере-
гов Мурмана держится неполовозрелая сельдь в возрасте до 6 лет вклю-
чительно, влияние урожайных поколений у мурманской сельди в нашем
промысле сказывается в течение только нескольких лет. Количество жира,
отлагаемого в теле и на внутренностях сельди, сильно изменяется в зави-
симости от возраста и сезона лова. G возрастом жирность сельди возра-
стает. Наибольшее содержание жира в мясе бывает после интенсивного
летнего питания, достигая в августе у двухгодовалых сельдей (длина
17 см) около 9%, у четырех- пятигодовалых (длина около 24—25 см) —
до 23—26%. В дальнейшем, с понижением, а позднее почти с прекращением
питания происходит уменьшение жирности до апреля месяца, когда содер-
жание жира падает в среднем до 1.28% . У мелкой сельди после уменьшения
жирности в сентябре наблюдается небольшое повышение ее в октябре,
140
CLUPEIDAE
причем, судя по имеющимся данным, до декабря количество жира умень-
шается мало. Наибольшее содержание жира на внутренностях у крупных
сельдей приходится на сентябрь, у мелкой — на октябрь—ноябрь. Общее
содержание жира в теле у крупных сельдей (длиной около 22 см) в августе
достигает 22.6%, в мае падает до 4.7%. У мелкой сельди (17 см длиной)
общее содержание жира достигает максимума в октябре—ноябре (12.3—
12.7%), снижаясь в апреле до 2.3% (Юданова, 1939).
Хозяйственное значение. Занимает по уловам второе
место. Общие уловы составляют 15—16 млн. ц, т. е. 40—50% улова Зап.
Европы. В наибольшем количестве вылавливается в Северном море
(9.1—10.3 млн ц), у берегов Норвегии (2.2—2.5 млн ц) и Исландии (1.5—
2.3 млн ц). Уловы СССР в Баренцовом море в годы наилучших подходов
достигали до 975 тыс. ц (1935 г.), в обычные годы менее, в 1939 г. 162 тыс. ц.
Уловы в наших водах могут быть значительно увеличены. В море у Тер-
ского берега Белого моря в июне—июле ловится молодь сельди (так
называемая килька) и мелкая летняя сельдь; в Баренцовом море у восточ-
ных берегов Мурмана и в центральных и западных районах в августе—
ноябре ловят жирную сельдь, в западных районах в декабре—-марте —
преднерестовую сельдь, в Медвежинско-Шпицбергенском районе в июле—
октябре — крупную сельдь. В заливах и губах Мурманского побережья
в декабре—-июне ловят молодь (килька) и мелкую летнюю сельдь, в ноя-
бре—феврале — мелкую жирную и жирную сельдь.
*1Ь. Clupea harengus harengus n. membras L. — Балтийская сельдь,
салака (табл. III).
Clupea harengus (i membras L i n n e, Fauna suecica, ed. II, 1761 : 128 (Strom-
ling, vero minor ex mari Bothnico); Pallas, Zoogr. rosso-asiat., Ill, 1811 : 211
(частью: Балтийское м., у берегов Лифляндии и у о. Эзеля). — Clupea harengus
Кесслер, Рыбы СПб. губ., 1864 : 185 (частью : близ устья Наровы, у Крон-
штадта); S m i t t, Scand. fish., II, 1895 : 954, 961 (частью: var. membras). —
Clupea harengus sr&r. membras Heincke, Naturgesch. d. Herings, I, 1898 : LXIV,
Tab. CXLII—CLXIX, Taf. I, II, V, VI, IX, X, XIV, XVII, XVIII (восточная часть
Балтийского м. к востоку от Пиллау и о. Готланда, Ботнический и Финский заливы;
измерения рыб и черепов); Суворов, Тр. Балтийск, эксп., II, 1913 : 44 (Бал-
тийское м.; малоглазая и большеглазая формы). — Clupea harengus membras R a bi-
ne г s о n, Zool. Jahrb., Abt. Syst., Bd. 58, 1929 : 300 (Финский зал.); Берг,
Рыбы пресных вод, I, 1932 : 95 (Балтийское м.). — Clupea harengus L е Gall,
Ann. Inst, oceanogr., XV, 1, 1935 : 155—161 (частью: Балтийское м.). — Clupea
harengus membras Телегин, в: Промысловые рыбы СССР, 1949 : 124, табл. 31.
Распространение, биология. Mobius u. Heincke,
Fische d. Ostsee, 1883 : 265 (частью: var. membras)-, Reuter, Meddel. Soc. Fauna
Flora fennica, XX, 1894 : 52 (пресноводные озерки па островах Абосского архи-
пелага); Schneider u. Levande г, Acta Soc. Fauna Flora fennica, XX,
1, 1900 : 5, 35 (питание, развитие икры, инкубационный период); Nordquist,
ibid., XX, 7, 1901 : 8 (нерест); G. Schneider, Rapp. Proces-Verb., IX, 1908 : 66 '
(Балтийское м. к востоку от южной конечности о. Эланд и Данцигской бухты, в прес-
новодном озерке пров. Кальмар; нерест, возраст, литература); М и х и н, Изв.
Отд. прикл. ихтиол., Ill, 1, 1925 : 40 (подходы к берегам); Р а б и и е р с о и,
там же, III, 2, 1925 : 134 (Копорская губа, у Шепелева; измерения, рост); Н е s s-
1 е, Publ. Circonst.,' 89, 1925 : 1 (расы, миграции, питание, размеры); Journ. Сон-
seil, II, 2, 1927 : 169 (осенвие сельди, возрастной состав); Lundbeck, Mitt.
Deutsch. Seefischerei-Ver., 46, 1930: 310 (рост, возрастной состав, распределение);
Н е s s 1 е, Journ. Conseil, VI, 1, 1931 : 21 (соотношение в уловах осенних и весен-
них сельдей); Kanerva, Fiskeritidskr. f. Finland. 1931 : 117 (возраст, нерест);
Михин и Антипова, Изв. Всесоюзн. Научно-исслед. инет, озерн. и речи.,
рыбн. хоз., XV, 1932 : 28, 92 (подходы к берегам, размеры, рост, возрастной состав,
уловы); Andersson, Rapp. Proces-Verb., С, 2, 1936 : 11 (частью: Балтийское м.
у берегов Швеции; расы, нерест); Н е s s 1 е, Svenska Hydrogr.-Biol. Kommiss.
Skrifter (n. s.), Biol., II, 2, 1937 : 1 (питание, половозрелость, нерест, миграции);
з. c lu ph л
141
Andersson, Rapp. Proces-Verb., CVIII, 1, 1938:67 (осенние сельди, рост);
VI annsfeld, Korr.-Bl. Naturf.-Ver. Riga, LXIII, 1939 : 43 (p. Латвийская Aa
и 9 км от устья); Берг, Изв. Всесоюзн. Научно-исслед. инет, озерн. и речи. рыбн.
хоз., XXIII, 1940 : 6 (Финский зал.; уловы, нерест, биология); A I a n d е г, Ann.
Biol., I, (1939—1941), 1943 : 177; ibid., Il, (1942—1945), 1947 : 172 (южная и централь-
ная части Балтийского м., Ботнический зал.); Cieglewicz a. Posadzki,
ibid. : 159 (Данцигская бухта; нерест, возраст, рост); Дементьева, Рыбн. хоз.,
1947, 8 : 23 (Рижский зал. и балтийское побережье СССР; нерест, возрастной состав);
Маркова, Изв. Всесоюзн. Научно-исслед. инет, озерн. и речи. рыбн. хоз., XXIX,
1949 : 106 (влияние солености и температуры па газообмен); Б р и з и и о в а,
гам же : 143 (интенсивность пищеварения в зависимости от температуры); Кожев-
нике в, там же : 172 (подходы у Койвисто); Л е в и е в а, Рыбн. хоз., 1950,
5 : 34 (содержание жира); Д р я г и и, Вести. Ленингр. унив., .8, 1950 : 27 (общий
улов в некоторые годы свыше 1 млн ц, запуск в военные годы не повлиял пи па раз-
меры, ни на возрастной состав).
D (III) IV 14—16 (15.0), общим числом 17—21 (18.9), Л Ill 12—16
(14.0), общим числом 15—19 (17.0), sp. br. 60—71 (66.0), килевых чешуй
позади основания брюшных плавников 12—14 (13.1), vert.S. 54—57 (54.7),
caud. vert. 29—33 (30.5). Брюшные килевые чешуи развиты как позади
брюшных плавников, так и впереди них. Зубы на сошнике сравнительно
хорошо развитые. Голова крупнее, чем у предыдущей формы, 23.4—
25.9 (24.9)% длины тела; межглазничный промежуток несколько уже,
14.4—17.5 (16.1)% длины головы. Глаза крупнее, 24.7—28.7 (26.7)% длины
головы. Основание анального плавника короче, 8.3—10.8 (9.7)% длины
тела. Размеры меньше, чем предыдущей формы, в среднем 14—16 см,
но гигантские стремлинги (см. ниже) достигают размеров до 37.5 см.
Описание дано по 30 экз. длиной от 12.1 до 18.7 см, в среднем 14.9 см,
собранным 22 V 1948 в районе Мерсрагс-. По Гейнке (Heincke, 1898),
позвонков 54—57, килевых чешуй И—15, по Гессле (Hessle, 1925), средние
числа позвонков у форм подвида колеблются от 55.2 до 55.7, килевых
чешуй от 13.3 до 14.2, т. е. и позвонков и килевых чешуй в среднем не-
сколько меньше, чем у атлантической сельди.
Морская форма, живущая и размножающаяся в воде с пониженным
содержанием солей.
Балтийская сельдь является такой же локальной формой, как и атлан-
тическо-скандинавские сельди или более близкие к ней сельди датских
проливов, и рассматривается здесь в качестве особой формы лишь вслед-
ствие ее большей, чем других форм Cl. harengus harengus, географической
обособленности.
Распадается на ряд еще мало изученных форм. По времени нереста
различают (Hessle, 1925) две большие группы: осенние и весенние сельди.
Осенние сельди характеризуются средним числом позвонков
более 55.40 (от 55.40 до 55.71), туловищных позвонков более 25.25 (от
25.25 до 25.85), килевых чешуй более 13.50 (от 13.55 до 14.17); рост резко
замедленный после наступления половой зрелости, мигрирующие, нерест
преимущественно во внешних частях архипелага островов и вдоль побе-
режья моря. Весенние сельди в архипелаге островов у берегов Швеции
образуют ряд форм, среди которых различаются: 1) весенние
сельди открытого моря — среднее число позвонков около
55.50 (от 55.37 до 55.73), туловищных позвонков около 25.00 (от 24.80 до
25.10), килевых чешуй меньше 13.60 (от 13.32 до 13.60), рост резко замед-
ленный после наступления половой зрелости, мигрирующие, нерест
вдоль берегов у архипелага островов; 2) весенние фиордовые
сельди средней части моря — среднее число позвонков
меньше 55.40 (от 55.17 до 55.32), туловищных позвонков меньше
142
CLUPEIDAE
24.80 (от 24.52 до 24.77), килевых чешуй меньше 13.60 (от 13.10
до 13.53), рост равномерно замедленный, локальные, нерест в архипелаге
островов; 3) ледовые сельди южной части Ботни-
ческого зал. — среднее число позвонков больше 55.50 (от 55.70
до 55.74), туловищных позвонков больше 25.00 (от 25.09 до 25.25),
килевых чешуй больше 13.50 (от 13.66 до 13.77), рост равномерно замедлен-
ный, мигрирующие, нерест в архипелаге островов. Кроме того, по величине
глаз у наших берегов установлены среди осенних сельдей две формы:
большеглазая (диаметр глаза 5.7—6.0% длины тела, экз. от Либавы)
и малоглазая (диаметр глаза 5.0—5.2% тойже длины, экз. от Домеснеса).
В Финском зал. обе формы встречаются вплоть до его восточной части.
Среди весенних и осенних сельдей встречаются крупные, так называемые
гигантские стремлинги (Riesenstromlinge), достигающие свыше 300 (до
330 и даже 375) мм длины. Гейнке (Heincke, 1898) и Шнейдер (Schneider,
1908) рассматривают гигантских стремлингов как старых особей салаки,
так как никаких морфологических отличий они не имеют. По основным
признакам гигантские стремлинги ближе всего к весенним фиордовым
сельдям, причем в значительной степени питаются рыбой, почему Шней-
дер и считает их старыми особями с хищным характером питания. Однако
из сопоставления роста салаки и гигантского стремлинга явствует, что
последний представляет особую форму, обладающую более быстрым
ростом (Kanerva, 1931; Берг, 1940; см. также ниже).
Распространение. Балтийское море к востоку от линии,
проходящей к западу от южной оконечности о-ва Эланд (Карлскруна}
и Данцигской бухты,1 в Ботническом зал. на север до самого конца его,
в Финском зал. на восток до Сестрорецка, заходит в Нарвскую, Лужскую
и Копорскую губы. Заходит и живет в совершенно пресной воде — в не-
большом пресном озере в Швеции (пров. Кальмар, близ Ytterhult, к северу
от устья р. Virboa), соединенном с морем небольшим мелким ручьем,
в некоторых небольших пресных озерках на архипелаге островов Турку
(Або), в р. Латвийской Аа при северных ветрах зашла на 9 км выше устья.
Нерест вдоль берегов моря и заливов. Осенние сельди мечут икру у бере-
гов средней части моря (с августа по конец сентября), на банках у берегов
Ботнического зал. (с июля по ноябрь, наиболее интенсивно в августе
и сентябре), у берегов Латвии к западу от Домеснеса (в августе и начале
сентября), во внешних частях шхер по северному берегу Финского зал.
к западу от Ловизы (в августе и сентябре), здесь же изредка и во внутрен-
них частях шхер, восточнее у островов Нарви и Секкер (до сентября),
у Курголова (половозрелые наблюдались в конце августа). Весенние
сельди нерестятся вдоль берегов средней части моря (весенние сельди
открытого моря, с мая по начало июля), в фиордах между островами
'западного берега Ботнического зал. (весенние фиордовые сельди, с апреля
по начало июля, реже по август, наиболее интенсивно в июне), в архипе-
лаге островов у берегов Ботнического зал. (ледовые сельди Ботнического
зал., июнь), в Финском зал. во внутренних (в апреле—мае и в начале
июня) и внешних частях шхер (в конце мая и начале июня) северного берега
к западу от Ловизы, восточнее (у Бьёркэ) близ берегов, в заливах, и позд-
нее дальше от берегов (с конца мая по начало июня), у южных берегов
к востоку от Нарвы (в конце мая — начале июня). Позднее, летом, нерест
у открытого моря в незначительных размерах происходит во внешних
1 Возможно, далее к западу, в частности для осенних сельдей’лзключая побе-
режье о. Борнгольма.
3. CLUPEA
113'
частях шхер у Сиббо (к востоку от Хельсинки, в июне и июле) и на гра-
нице Копорской и Лужской губ и в Кодорской губе дальше от берегов,
чем весной (в конце июня—начале июля).
Биология. Нерест, как видно из всего сказанного выше, проис-
ходит весной, осенью и отчасти летом. Время нереста находится в зависи-
мости от географического положения; например, в северных частях
моря, в Ботническом зал., осенние сельди размножаются с июля, в сред-
них частях моря — с августа. В северных и восточных частях моря весен-
няя сельдь размножается позднее, осенняя — раньше. Осенний период
нереста более растянут, чем весенний. Нерест происходит вблизи
берегов, в заливах, во внешних и внутренних частях шхер. Весенние-
сельди размножаются ближе у берегов, чем осенние, как во внешних,,
так и во внутренних частях шхер, на глубине от 3—4, даже 2, наичаще
7—10 м. В Финском зал. весенний нерест начинается раньше ближе
к берегам, во внутренних частях шхер, позднее — в отдалении от берегов,
во внешних частях шхер, в Ботническом зал. наоборот. Осенние сельди
нерестятся дальше от берегов, у открытого моря, во внешних, реже во-
внутренних частях шхер, на глубине от 5 до 20 м. Летний нерест проис-
ходит также дальше от берегов, у открытого моря, во внешних частях
шхер. Икра откладывается, в местах с твердым грунтом, каменистых и
гравиевых. Нерест происходит при довольно низкой солености. Прц
наиболее низком содержании солей размножаются весенние сельди,
нерестящиеся ближе к берегам (фиордовые и ледовые сельди) — при
4—10%о. При более высокой солености (12—20 %о) мечут икру весенние
сельди открытого моря и осенние сельди. Осенние сельди нерестятся
при более высокой (И—14°) температуре воды, чем весенние (6—10°).
Период развития икринок при 14—15°равен 6—8 дням, при 15°— 5—7 дням..
Выклюнувшиеся в последнем случае личинки имели размеры 6.0—6.5 мм.
Таковы же были размеры личинок, выведенных из икринок, пойманных
во внешних частях шхер северного берега Финского зал. к югу от Порк-
кала 17 VII 1900 на глубине 4-—10 м (Nordquist, 1901; Schneider, 1908).
В зимнее время держится вдали от берегов. К берегам подходит весной,,
в Финском зал. начиная с середины мая или начала июня и после нереста,
отходит на большие глубины. В конце июня — начале июля вновь под-
ходит к берегам, но не так близко, как весной (Михин и Антипова, 1932).
В районе Койвисто (внешняя часть Выборгского зал.), кроме весеннего
нерестового подхода, наблюдается осенний со второй половины августа
по начало ноября. В этот период держится на глубине от 7—8 до 20 м при
температуре до 15—17° (в сентябре) и солености до 5%о. Кроме того,,
салака подходит зимой с февраля, отчасти с января и держится по март,
в некоторые годы до начала апреля. В это время она держится на склонах
подводных гряд с придонной температурой воды 1—2° и соленостью
3—4%о (Кожевников, 1949). В весенних подходах (в мае и июне) в восточ-
ной части Копорской губы в 1932 г. встречались рыбы в возрасте от одно-
до восьмигодовалых, преобладали четырех- и пятигодовалые, в Курголове
в весеннее время (в мае), а также и в начале осени (в августе) того же года
преобладали трех- и четырехгодовалые, двух-, пяти- и шестигодовалых
встречалось мало. При осенних подходах в Лужскую (Усть-Луга) и Копор-
скую губу в 1934 г. преобладали двухгодовалые, трехгодовалые встреча-
лись в небольшом количестве, в еще меньшем количестве — другие
возрастные группы (Берг, 1940, по Михину). В восточной части Финского
зал. основу питания составляет Eurytemora afjinis var. hirundo ides и ее
яйца и сперматофоры, отчасти Bosmina obtusirostris var. maritima, Coro-
144
clupeidae
phium, Mysis, Limnocalarms, Cyclops (Берг, 1940, по Шевчене). В желудках
гигантских стремлингов, помимо беспозвоночных, из средней части моря
находили также рыб (колюшку, молодь салаки или шпрота) длиной до 12 см
(Schneider, 1908). В Финском зал. (у Бьёркэ) гигантские стремлинги
весной питаются ракообразными и салакой длиной до 45 мм, осенью —
колюшкой (преимущественно Gasterosteus aculeatus, реже Pungitius рип-
gitius) длиной до 30 мм (Kanerva, 1931). В Ботническом зал. осенние сельди
наиболее интенсивно питаются с июня по сентябрь включительно. Основу
питания составляют Copepod a (Limnocalanus grimaldii), в средней части
моря — Acartia longiremis, A. bifilosa и Тemora longicornis и отчасти мизиды.
В архипелаге островов против Стокгольма главную роль в питании играют
Eurytemora hirundoides, Bosmina maritima и Daphnia cucullata', первый
составляет основу питания зимой, два последних — петом и осенью.
В меньших количествах в желудках были находимы Limnocalanus grtmal-
. (Hi и My sis relicta. Кроме того, некоторую роль в питании крупных сель-
дей играют донные животные — Gammarus locusta, Chiridothea entonion и
мелкие рыбы (Gasterosteus aculeatus и молодь Zoarces viviparus', Hessle,
1937). Половой зрелости большая часть весенних сельдей в архипелаге
островов против Стокгольма достигает в двухгодовалом возрасте, причем
большинство мелких сельдей в этом возрасте (длиной около 12 см) как
правило еще незрелые. Неполовозрелых двухгодовалых встречается
. больше в возрастных группах урожайных лет (например 1932 г.), чем
в менее урожайных (1933, 1934 и 1935 гг.; Hessle, 1937). У берегов Швеции
размеры сельдей в уловах уменьшаются с юга на север. В северной части
Ботнического зал. пяти- шестигодовалые сельди имеют размеры около
16 см, в южной части — около 17 см, у северных берегов средней части
моря — около 18 см, у южных — около 19.5 см (Hessle, 1925). Осенние
сельди составляют основу промысла, причем в средней части моря они
в уловах обычно составляют больший процент, доходящий в нормальные
годы до 90°/о и выше, чем в Ботническом зал.; весенние сельди — наоборот.
В некоторые годы, однако, весенние сельди ловятся в значительном коли-
честве, составив, например, в 1929 г. в Ботническом зал. свыше 30% улова
> (Hessle, 1931). В Финском зал. более многочисленны весенние сельди,
чем осенние. В начале нерестовых подходов преобладают крупные сельди
старших возрастных групп, которых сменяют более мелкие младших
возрастных групп (Дементьева, 1947). После икрометания от берегов
отходят, причем осенняя сельдь держится ближе к берегам, на мелко-
водьях. Ранней весной и поздней осенью короткое время держится над
. большими глубинами, зимой опускается в придонные слои воды, в места'
с крутыми обрывами склонов или уходит в глубокие впадины шхер
. (Lundbeck, 1930). В Финском и Рижском заливах и по балтийскому побе-
режью весенние и осенние сельди ловятся в двух- семигодовалом во-
зрасте, преобладают трех- и четырехгодовалые, иногда двухгодовалые.
Половой зрелости достигает к концу второго года, но в основной массе
к концу третьего.
Рост весенней и осенней сельди в Финском зал. происходит следующим
. образом (Михин и Антипова, 1932; мм):
Возраст................2
Веееюшс сельди:
Копорская губа . . 143
Лужская » . . —
Нарвская » . . —
157 171 179
140 168 184
149 163 185
184
3 4 5 6
3. CLUPEA
145
Осенние сельди:
Копорская губа . . 144
Лужская » . . 127
154 165
149 165
149 157
Нарвская » . . 139
В Данцигской бухте рост обеих сельдей происходит следующим обра-
зом (Cieglewicz a. Posadzki, 1947; мм):
Весенние сельди..........90 138
Осенние » ........118 157
1з 1< U 1»
165 183 197 211
178 194 204 214
Рост в Рижском, а также и в Финском зал. более замедленный, тем
в открытых частях моря (Дементьева, 1947). На границе распростра-
нения (у Карлсгамна) рост происходит следующим образом (Schneider,
1908; мм):
Возраст.............3 4 5 6
Средние размеры . . . 174 182 188 203
Гигантские стремлинги, пойманные у входа в Ботнический зал. (у Эре-
грунд), имели такие размеры (Schneider, 1908; мм):
Возраст............ 5 6 7 8 9 10 11
Средние размеры . . . 273 284 285 315 316 321 338
Пятигодовалые гигантские стремлинги, как видно из этих данных,
значительно превосходят размеры салаки того же возраста. То же самое
указывается и для Финского зал. Пятигодовалая зрелая самка гигантского
стремлинга из Лужской губы имела размеры 317 мм, в то время как салака
из этой губы в этом же возрасте достигает в среднем 174 мм (Берг, 1940).
Четырехгодовалые гигантские стремлинги из окрестностей Бьёркэ имели
размеры 240 мм (Kanerva, 1931). Содержание жира уменьшается к маю
(до 3.2—4.1%), наибольшее наблюдается в сентябре (8.4—9.8%) (Левиева,
1950).
Хозяйственное значение. Главная промысловая рыба
Балтийского моря, уловы которой составляют около половины улова
этого моря и до 60% улова в водах СССР. Общий улов в некоторые годы
превышал 1 млн ц, в 1937 г. достигал 786.8 тыс. ц. В пределах СССР
в 1936—1939 гг. уловы колебались от 210—220 тыс. ц, из них у берегов
РСФСР добыто 39—53.5 тыс. ц, Эстонии — 85.6—101.9 тыс. ц, Латвии —
65.6—76.5 тыс. ц, Литвы — около 0.4 тыс. ц. У берегов Швеции добывается
около 303—325 тыс. ц, Финляндии — 139—179 тыс. ц. Ловится круглый
год, главным образом у берегов, ставными сетями, ставными и закидными
неводами. Уловы могут быть увеличены организацией лова в открытом
море.
*lc. Clupea harengus pallasi Vai.—тихоокеанская, восточная сельдь
(табл. III).
Clupea harengus Pallas, Zoogr. rosso-asiat., Ill, 1811 : 209, 210 (частью: «in Oceano
lotam Camtschatcam alluente et in sinu Ochotensi»; p. Камчатка). —Clupea pallasii
Cuvier et Valenciennes, Hist. nat. poiss., XX, 1847 : 253 (Камчатка). —
Clupea mirabilis Girard, Proc. Acad. Nat. Sci. Phila., L, 854 : 138 (Сан-Фран-
циско). — Clupea inermis В asi lew sk y, Nouv. Mem. Soc. Nat. Moscou, X, 1855 :
242 (Шаньдун в Чжилийском зал.).1 — Spratelloides bryoporus Cope, Proc. Amer.
1 Экземпляр сельди, доставленный Базилевским, хранится в коллекциях Зооло-
гического института Академии Наук СССР (№ 5655, China sept.).
10 Фауна СССР —314
Illi
CLUPEIDAE
Phil. Soc., XIII, 1873 : 25 (Ситка, молодь). — Clupea harengus var. pallasi Шмидт,
Рыбы восточных морей, 1904 : 258. — Clupea harengus pallasi Берг, Рыбы пресных
вод России, 1923 : 502. — Clupea pallasii Н u b b s, California Fish a. Game Commiss.,
Fish Bull. 8, 1925 : 5 (Брит. Колумбия, Калифорния; количества позвонков);
Fujita а. К о k u b о, Proc. Third Pan-Pacific Sci. Congr., Tokyo, 1926 : 2253;
Bull. Scool Fish., Hokkaido Imp. Univ., Sapporo, I, 1, 1927 : 1—127 (берега Японии;
расы). — Clupea harengus pallasi Рабинерсон, Изв. Тихоокеанск. научно-
промысл. ст., I, 1, 1928 : 143, 156 (зал. Петра Вел.; биометрика). — Clupea harengus
pallasi mirabilis Рабинерсон, там же: 156 (берега Сов. Америки). 2— Clupea
harengus pallasi Rabinerson, Zool. Jahrb., Abt. Syst., Bd. 58, 1929 : 292, 301. —
Clupea harengus pallasi mirabilis Rabinerson, 1. c. : 293. — Clupea pallasii
Rounsef ell, Bull. U. S. Bureau Fisher., XLV, (1929), 1930 : 227 (берега Сев.
Америки; расы, места нереста, рост, уловы). — Clupea harengus pallasi Амброз,
Изв. Тихоокеанск. научи, инет. рыбн. хоз., 6, 1931 : 1 (зал. Петра Вел.; возраст,
рост, нерест, миграции, питание). — Clupea pallasii Rounsefell a. Dahl-
gren, Bull. U. S. Bureau Fisher., XLVIII, 1935 : 119 (юго-восточная Аляска; расы,
количества позвонков, рост, мечение); Tester, Journ. Biol. Board Canada, III, 2,
1937 : 108 (берега Брит. Колумбии; число позвонков, измерения, возраст); К о-
k u b о а. Т е z u k a, Sci. Rept. Tohoku Imp. Univ., Ser. 4 (Biol.), XII, 4, 1938 :
639 (озерная сельдь оз. Обучи, сравнение с сельдью оз. Хипумц биология). — Clupea
harengus pallasi Берг, Рыбы пресных вод, I, 1948 : 155; Суворов, в: Промысло-
вые'рыбы СССР, 1949:127, табл. 31; Фролов, Изв. Тихоокеанск. научно-
исслед. инет. рыбн. хоз. и океаногр., 32, 1950 : 65, рис. 1—4 (западное побережье
Сахалина, зал. Анива; измерения, просчеты). — Clupea pallasi Пономарева,
Учен. зап. Горьк. Гос. унив., XIX, 1951 : 179, рис. 2.
Распространение, биология. Steller, Beschr. Kamtschatka,
1774 : 167, 175 (Берингово м. от Авачинской губы до Олюторского зал., Вилючин-
ское оз., устье р. Камчатки, о. Карагинский); Крашенинников, Описание
земли Камчатки, 1755 : 326 («водятся в Восточном море, а в устьях рек, текущих,
в Пенжинское море, бывают гостем», «В осень заходят оне в великие озера, и там
плодятся и зимуют, а весною выплывают в море»); Turner, Contrib. nat. hist.
Alaska, И, 1886 : 111, pl. 14 (о. Михаила; нерест в середине июня); Nelson, Rept.
nat. hist, collections Alaska, III, 1887 : 320 (о. Михаила; условия размножения);
Гребницкий, Вести, рыбопр., XII, 6—7, 1897 : 339 (Командорские о-ва);
Heincke, Naturgesch. d. Herings, I, 1898 : LXVI (восточные берега Японии);
С л ю и и н, Охотско-камчатск. край, 1900 : 335 (р. Пятибратная, в 1893 г. зашло
руно, которое потом уснуло); Шмидт, Морск. пром, о-ва Сахалина, СПб., 1905 ;
50—93 (биология); Evermann a. Golds borough, Fish. Alaska, 1907 :
232 (Аляска, от Порт-Кларенс к югу); Сокольников, Тр. Общ. судох., Про-
мысл. отд., VI, 1911 : 52 (Анадырский лиман); Jordan a. Metz, Mem. Car-
negie Mus., VI, 1, (1913), 1914 : 6 (Пусан, Нампхо в северо-западной Корее);
Павленко, Мат. позн. русск. рыбол., III, 10, 1914 : 1—144 (зал. Петра Вел.
и Татарский прол.; биология, р. Суйфун в 15 в. от устья); Берг, Ежегодн. Зоолог,
муз. Акад. Наук, XIX, 4, (1914), 1915 : 555 (р. Тумень-ула, в 3 в. выше устья);
Fraser, Contrib. Canad. Biol., VI, (1921), 1922 : 105 (берега Канады; биология);
Державин, Русск. гидробиолог, журн., II, 8—10, 1923 : 193 (оз. Нерпичье в устье
р. Камчатки; единичный заход); Jordan a. Hubbs, Mem. Carnegie Mus.,
X, 2, 1925 : 121 (Кусиро, Хакодате); Ам б роз, Произв. силы Дальн. Вост., IV,
1927 : 61 (зал. Петра Вел.; биология); Рабинерсон, Изв. Отд. прикл. ихт.,
VIII, 1928 : 47 (зал. Петра Вол.; возрастной состав, рост); Правдин, Изв. Тихо-
океанск. научно-промысл. ст., I, 1928 : 192 (Авачинская губа, Усть-Болыперецк);
Tanaka, Fish. Japan, XLIII, Tokyo, 1928 : 844, f. 484 (у берегов Японии на юг
в Японском м. до Тояма, в Тихом океане до Хинума, пров. Хитати); Линдберг
и Д у л ь к е й т, Изв. Тихоокеанск.' научно-промысл. ст., III, 1929 : 7 (Шантар-
ские о-ва; единично); К у р н а е в, Рыбн. хоз. Дальн. Вост., 1930, 2 ; 34 (запад-
ная Камчатка; химический состав); Амброз, там же, 1930, 2 : 30 (Амурский
лиман, Охотск, Тауйск, Гижига, Ича на западном берегу Камчатки, Авачинская
губа, заливы Карагинский, Олюторский, Корфа и Анадырский); там же, 1930, 7—8 :
38 (зал. Де-Кастри; возраст); там же, 1930, 9—10 : 55 (оз. Халыгер на Камчатке,
Авачинская губа, Болыперецкий район); Соц. реконстр. рыбн. хоз. Дальн. Вост.,
1931, 5—7 : 129 (заливы Ныйво и Чайво на Сахалине; возраст, размеры); там же,
1931, 8—10:3 (Приморье; возрастной состав, возраст, рост); Rounsefell,
Bull. U. S. Bureau Fisher., XLVII, 2, 1931 : 15 (юго-восточная Аляска; колебание
уловов); Rounsefell a. Dahlgren, ibid., XLVII, 9, 1932 : 263 (Аляска;
размеры, возрастной состав, колебание уловов); Journ. Conseil, VIII, 3, 1933 : 371
(юго-восточная Аляска; мечение); Кагановский, Вести. Дальневост. фил.
3. CLUPEA
147
ЛИ СССР, 1—2—3, 1933 : 139 (Анадырский лиман); Mori a. U с h i d a, Journ.
Chosen Nat. Hist. Soc., 19, 1934 : 4 (Сейсин, Вонсан, Пусан); Hart a. Tester,
Trans. Amer. Fish. Soc., LXIV, Wash., 1934 : 307 (берега Брит. Колумбии; коли-
чественный учет икры на нерестилищах, плодовитость); Rounsefell, Рас.
Fishorm., 32, 3, Febr. 1934 : 31 (юго-восточная Аляска; расы, миграции); Wailes,
Journ. Biol. Board Canada, I, 6, 1935 : 477 (берега Брит. Колумбии; питание); К u-
rngami а. К aw an a, Bull. Jap. Soc. Sci. Fish. Tokyo, V, 2, 1936 : 93 (зависи-
мость интенсивности нереста и уловов от солнечных пятен); Dahlgren, Journ.
Consail, XI, 2, 1936:229 (юго-восточная Аляска; мечение); Hart a. Tester,
liept. Prov. Fish. Dept., Brit. Colombia, (1936), 1937 : 55 (берега Брит. Колумбии;
мочение); Tester, Journ. Biol. Board Canada, III, 2, 1937 : 145 (там же; возраст-
ной состав, половое созревание); Aikawa, Bull. Japan. Soc. Sci. Fish. Tokyo,
VI, 2, 1937 : 59 (о. Хоккайдо; возрастной состав уловов, запасы); Schaefer,
Copeia, 1937, 1 : 57 (процесс нереста); Андрияшев, Исслед. морей СССР, 25,
1937 : 295 (Авачинский зал.); Tester, Journ. Conseil, XIII, 1, 1938 : 71 (зависи-
мость количества позвонков от температуры воды в период ранних стадий развития
личинок); Писарев, Рыбн. хоз., 1938, 8 : 25 (содержание жира); Каганов-
с к и й, Изв. Тихоокеанск. научно-исслед. инет. рыбн. хоз. и океаногр., 14, 1938 : 19
(Японское' м.; возрастной состав); Агапов, Тр. Научно-исслед. инет, полярн.
зомлед., животн. и промысл, хоз., сер. промысл, хоз., 15, 1941 : 101 (Анадырский
лим.; нерест, возрастной состав, измерения); Полутов, Костюченко
и Панин, Рыбн. хоз., 1941, 3 : 3 (берега Камчатки; подходы, питание, уловы);
К и з е в е т т е р, Изв. Тихоокеанск. научно-исслед. инет. рыбн. хоз. и океаногр.,
21, 1942:58 (химический состав, содержание жира); М с Н u р h, Journ. Fish.
Res. Board Canada, V, 4, 1942 : 347 (ненормальности строения позвонков); Cle-
mens a. Wilby, Bull. Fish. Res. Board. Canada, LXVIII, 1946 : 79 (берега
Канады); Панин, Рыбн. хоз., 1946, 8 : 31 (северо-восточные берега Камчатки;'
условия подходов, состав уловов); Зоолог, журн., XXV, 5, 1946 : 459; Природа,
1947, 1 : 68 (там же; связь подходов с приливами);- Варварин, .Изв. Тихоокеанск.
научно-исслед. инет. рыбн. хоз. и океаногр., 22, 1946 : 3 (Татарский прол.; жирую-
щая сельдь, биология); Пирожников, Рыбн. хоз., 1946, 10—11 : 59; Докл.
АН СССР, н. с., LVI, 4, 1947 : 441 (м. Мастах у юго-восточной оконечности Быков-
ского п-ова в бухте Тикси, 3, 21 и 26 VIII 1945, 3 экз.); А ю ш и н, Изв. Тихооке-
анск. научно-исслед. инет. рыбн. хоз. и океаногр., 25, 1947 : 3 (северо-западная часть
Охотского м.; подходы, нерест, возраст); Пискунов, там же : 230 (зал.
Де-Кастри; возраст, рост); Пирожников, Задачи научно-исслед. организаций
в четв. пятилетке в обл. развит, рыбн. хоз. Сибири, изд. Главсибрыбпром, Новоси-
бирск, 1948 : 9 ’(Оленёкский зал.; дважды в 1946 г.); Пискунов, Изв. Тихо-
океанск. научно-исслед. инет. рыбн. хоз. и океаногр., 29, 1949 : 182 (западное побе-
режье южной части Сахалина; возрастной состав); Кун, там же : 164 (северная
часть Татарского прол, у берегов Сахалина; питание); Городничий, Рыбн.
хоз., 1949, 1 : 36 (колебание уловов в связи с потеплением); Голенченко,
там же, 1949, 2 : 18, рис. 1 (западное побережье Сахалина; летнее и осеннее распре-
деление); Пискунов, там же, 1949, 5 : 37 (западное побережье южной части
Сахалина; ход на нерест, возрастной состав); там же, 1949, 7 : 27 (лов на свет);
Веденский, там же : 36 (южные Курильские о-ва); Фридлянд, там же,
1949, 11 : 35 (западное побережье южной части Сахалина; половое созревание, пло-
довитость, развитие икры); Tester, Journ. Fish. Res. Board Canada, VII, 7, 1949 :
43 (западный берег о. Ванкувер; число позвонков из ряда пунктов за 1927—1938 гг.);
Фридлянд, Изв. Тихоокеанск. научно-исслед. инет. рыбн. хоз. и океаногр.,
31, 1949 : 193 (западное побережье южной части Сахалина у Антоново; личинки
с начала мая по половину июня); Кун, там же : 198 (Амурский лиман; зимнее пи-
тание молоди); Панин, там же, 32, 1950 : 3 (северо-восточное побережье Кам-
чатки; биология, промысел); Каганове кий -и Полутов, там же : 37
(Пенжинский зал.; биология); Веденский, там же : 55 (восточное побережье
Сахалина; биология); Богаевский, там же : 155 (о. Монерон; промысел);
Фридлянд, там же : 157 (западное побережье южной части Сахалина; личинки);1
Пробатов, Рыбн. хоз., 1950, 2 : 24 (западное побережье южной части Сахалина;
возрастной состав); Леванидов, там же : 37 (химический состав); Богаев-
ский, там же, 1950, 3 : 43 (о. Монерон; преднерестовые и нагульные подходы,
нерест вокруг почти всего острова до 1926 г.); Козлов, Фролов и Шнель,
там же, 1950, 6 : 45 (восточное побережье северной части Сахалина; возможность
увеличения уловов); Богаевский, там же, 1950, 9 : 14 (район о. Монерон;
1 Нижеследующие статьи, опубликованные после окончания работы, использо-
ваны в тексте* не полностью.
10*
148
CLUPEIDAE
лов нагульной сельди); там же, 195'1, 3 : 25, рис. (западное побережье южной части
Сахалина; летнее распределение); Изв, Тихоокеанск. научно-исслед. инет. рыбн.
хоз. и океаногр., 34, 1951 : 5, рис. 1—6 (юго-западные берега Сахалина; летнее
и осеннее распределение); Пробатов и Варварин, там же : 25, рис. 1—5
(зал. Анива; подходы молоди); Грищенко, там же : 4'1 (влияние электриче-
ского света); Панин, там же : 257, рис. 1 (восточное побережье Камчатки; рас
пределение нагульной сельди); Пробатов и Шелегова, Докл. АН СССР,
LXXVIII, 3, 1951 : 601, рис. 1 (зал. Анива; причины осенних подходов к берегам);
Пробатов, там же, LXXX, 5, 1951 : 825, рис. 1 (южная часть Сахалина; при-
чины изменения уловов); А ю ш и н, Изв. Тихоокеанск. научно-исслед. инет,
рыбн. хоз. и океаногр., 35, 1951 : 81 (северная часть Охотского м.; нагульная
сельдь); Кун, там же: 87, рис. 1—4 (северная часть Охотского м.; питание);
Пробатов и Фролов, там же: 97, рис. 1 (оз. Тоннай; отличие от морской
сельди, нерест, плодовитость, размеры, возраст, рост); Фридлянд, там же: 105,
рис. 1—11 (юго-западное побережье Сахалина; нерест, плодовитость, развитие икры,
личинки и мальки); Пискунов, Зоолог, журн., XXXI, 1, 1925 : 115 (запад-
ный берег Сахалина; плодовитость).
D (III) IV (V) 13—15 (14.6), общим числом 17—20 (18.7), A III (IV)
12—16 (14.1), общим числом 15—19 (17.1), sp. br. 63—73 (67.0), килевых
чешуй позади основания брюшных плавников И—13 (11.8), vert. S. 53—55
(54.1), caud. vert. 27—32 (29.7). Брюшные килевые чешуи более или менее
развиты лишь позади основания брюшных плавников, впереди от них
развиты слабо или отсутствуют. Зубы на сошнике менее развитые, чем
у предыдущего подвида. Голова небольшая и широкая, длина ее 19.0—
20.8 (19.8)% длины тела; межглазничный промежуток 15.7—18.6 (17.2)96
длины головы. Глаза небольшие, 19.7—22.6 (21.2)% длины головы. Осно-
вание анального плавника сравнительно короткое, 9.2—11.2 (10.2)%
длины тела. Размеры до 50 см, у берегов Камчатки в уловах от 24 до 38 см,
средние размеры нерестовой сельди в ряде промысловых районов Кам-
чатки от 29.1 до 34.1 см, в Пенжинском зал. — 24 см, в зал. Петра Вели-
кого — 24 см. Описание дано по 50 экз. длиной от 31.8 до 36.1, в среднем
34.0 см, собранным 12 III 1949 у западных берегов южной части Сахалина
в районе Антоново. У экземпляров от азиатских берегов позвонков 49—57,
средние колеблются от 52.78 до 54.67; у экземпляров от американских
берегов позвонков (45) 47—57, средние колеблются от 51.68 до 54.79.
Морская форма, живущая в воде с океанической соленостью, но раз-
множающаяся как в морской, так и в солоноватой воде.
Распадается на ряд еще слабо изученных форм. Наиболее существенно
делится на две группы — морских или береговых сельдей, размножаю-
щихся в море у берегов, и озерных, живущих в море, но для икрометания
заходящих в осолоненные озера и в заливы и бухты с пониженной соле-
ностью. Морские сельди у берегов Камчатки, по исследованиям К. И. Па-
нина, характеризуются низким, прогонистым и округлым телом,
спинным и отчасти анальным плавниками, отнесенными далее назад,
быстрым темпом роста. У озерных сельдей тело более высокое и плоское,
спинной и отчасти анальный плавники расположены ближе к концу
рыла, темп роста замедленный. Сходным образом от морских сельдей
отличается сельдь и оз. Тоннай (Пробатов и Фролов, 1951). В пределах
каждой из этих групп имеется ряд локальных форм или стад, характе-
ризующихся обособленностью нерестилищ, некоторыми морфологическими
особенностями, различным возрастным составом в уловах и темпом
роста. В восточной части Тихого океана по направлению с юга на
север у западных берегов Японского моря, по исследованиям Амброза
(1931), Фуджита и Кокубо (Fujita a. Kokubo, 1927), среди морских
сельдей в настоящее время различают следующие локальные формы,
3. CLUPEA
149
или расы, с обособленными нерестилищами, отличающиеся глав-
ным образом особенностями роста: 1) корейская сельдь,
нерестящаяся у восточных берегов Кореи (Хоко, Пусан); 2) сельдь
зал. Петра Великого, с наиболее быстрым ростом из всех
форм, встречающихся в наших водах; 3) пластунско-нельмин-
ская сельдь, с более медленным ростом, размножающаяся в зал.
Пластун — б. Нельма; 4) декастринская сельдь, с самым
медленным ростом из всех япономорских сельдей (см. ниже), основные
нерестилища которой по материковому берегу Татарского прол, распо-
ложены в зал. Де-Кастри, бухтах Сущева и Чихачева и далее на север
до м. Лазарева; по сахалинскому побережью эта сельдь размножается
у открытого берега в районе Черной речки, в полузащищенных бухтах
в районе Александровска — Половинки, м. Танги — м. Хоэ и далее
до м. Погиби. Эта сельдь, по некоторым указаниям (Фролов, 1949), в нере-
стовый период заходит и южнее Черной речки — до Широкой Пади и
Углегорска. Декастринская сельдь близка к сельди Охотского моря.
Остается неясным вопрос, является ли самостоятельной формой сельдь
от западных берегов Хондо. У берегов Хоккайдо и южной части Сахалина
установлена 5)южносахалинско-хоккайдская сельдь
(называемая также у нас западносахалинской, у японцев — хоккайдской),
куда относятся сельди, размножающиеся у западных и отчасти восточных
берегов Хоккайдо и у западных и отчасти южных (западное побережье
зал. Анива) Сахалина. Ареал этой, наиболее многочисленной из всех форм
тихоокеанской сельди у западного побережья Сахалина уточнен исследо-
ваниями Тихоокеанского научно-исследовательского института морского
рыбного хозяйства и океанографии (Пискунов, Фролов и др.). Основные
места размножения здесь расположены от м. Кузнецова до м. Усу и
в западной части зал. Анива (в апреле); в годы больших подходов
к южной части западного побережья Сахалина она распространяется
и далее к северу — до Углегорска и Широкой Пади. У восточных берегов
Сахалина и северных Хоккайдо, по Фуджита и Кокубо, встречается
смешанная группа этой сельди и охотской, так называемая охотско-
хоккайдская сельдь (см., однако, ниже, 7). У тихоокеанских берегов Япо-
нии локализована: 6)тохокуккайская сельдь, размножаю-
щаяся у восточного побережья Хондо (Тасиродзима, пров. Мияги). Наи-
менее изучены сельди Охотского моря. У восточных берегов Сахалина ука-
зывается: 7) восточносахалинская сельдь, свойственная
зал. Терпения и северной части зал. Анива, но изученная на материале
лишь из последнего (Фролов, 1949). В зал. Анива эта сельдь нерестует в мае,
после нереста южносахалинско-хоккайдской сельди. Южносахалинско-
хоккайдская сельдь, судя по ряду указаний, проникает и к восточному
берегу южной части Сахалина. Сельди от Шантарских о-вов и охотского
побережья далее к северу изучены мало. По размерам, возрастному составу
и темпу роста к ним близка декастринская сельдь. В северной части
Охотского моря указывается: 8) Пенжинская сельдь,
с более медленным ростом и менее крупными размерами, чем южноса-
халинско-хоккайдская сельдь; эта сельдь встречается и размножается
в Пенжинском зал.1 В Беринговом море у восточных берегов Камчатки,
1 По исследованиям Кагановского и Полутова (1949), сельдь Пенжинского зал.
разделяется на два стада — пенжинское и гижигинское. Гижигинская сельдь нере-
стует раньше (со второй половины мая до второй половины июня) и при более высо-
кой температуре воды (3—10°, массовый ход при 4—7°), чем пенжинская (с середины
150
CLUPEID 4E
по исследованиям К. И. Панина, изучавшего меристические признаки
и биологические особенности, и Р. А. Костюченко, исследовавшего рост,
различаются две локальные формы или стада: 9) южнокамчатская
сельдь, с медленным ростом, размножающаяся в Авачинской губе,
в бухтах юго-восточного побережья до м. Лопатка, а также, возможно,
у юго-западного побережья в районе зал. Камбального на север до устья
р. Озерной; 10) северокамчатская сельдь, с более быстрым
ростом, чем предыдущая, нерестящаяся в зал. Олюторском, Корфа и в
бухтах северной части прол. Литке (Анапка, Уала). Сельди более север-
ных районов Берингова моря не изучены. У берегов Сев. Америки конста-
тированы отдельные формы сельди у Калифорнии, южной части Брит.
Колумбии, ряд форм у юго-восточной Аляски, в зал. Вильяма, в зал.
Качмак — прол. Чуяк, в бухте Чигник, у Шумагинских о-вов, Уналашки
и в зал. Головина. В западной половине Тихого океана сельди южных
частей ареала имеют меньшее число позвонков, чем из северных. Так,
например, в Японском море корейская сельдь имеет в среднем 53.80 по-
звонков, сельдь зал. Петра Великого 54.21—54.67.1 У сельди Охотского
моря в южной части ареала позвонков также меньше: у восточносахалин-
ской (зал. Анива) позвонков в среднем 53.85, в северной части моря у Пен-
жинской сельди 54.11 (в Кичигинском зал. 54.82). В Беринговом
море, наоборот, количество позвонков больше у сельдей из южных частей
его: у южнокамчатской сельди позвонков в среднем 54.18—54.35, у севе-
рокамчатской 53.28—53.98. У берегов Сев. Америки среднее число
позвонков увеличивается с юга на север: от 50.68 (Сан-Диего) до 53.22
(Уналашка). В аналогичной зависимости находится и рост, более быстрый
у сельдей из южных частей ареала, чем из северных (см. ниже).
Среди озерных сельдей различаются (Fujita a. Kokubo, 1927): 1) хи-
ну м с к а я сельдь, на восточном побережье Хондо (нерест в оз.
Хинума); с этой сельдью по всем признакам идентична сельдь, заходящая
для нереста в оз. Обучи (Obuchi, пров. Аомори) на о. Хондо (Kokubo а.
Tezuka, 1938); 2) сельдь лимана Аккеси, на восточном по-
бережье Хоккайдо (нерест в лимане Аккеси, находящемся в глубине
залива того же названия); 3)тоннайская сельдь, на восточном
побережье южной части Сахалина (нерест в оз. Тоннай, относительно
этой сельди см. Пробатов и Фролов, 1951). По восточному побережью
Сахалина озерного типа сельди есть и в северной его части, в зал. Ныйво
и Чайво. У восточных берегов Камчатки озерные сельди, заходящие
с осени в осолоненные и связанные с морем протоками прибрежные озера,
известны из оз. Халыгер и Нерпичье.
Некоторые из перечисленных форм, изученных, как указывалось,
еще недостаточно, в дальнейшем, подобно атлантическим, несомненно
будут объединены. Так, судя по всему, следует рассматривать южно-
и северокамчатскую сельдь, подобно тому как рассматривают норвежскую
и мурманскую сельдей атлантическо-скандинавской сельди.
Распространение. Северная часть Тихого океана и при-
легающие моря. У берегов Сев. Америки на юг до Калифорнии (Сан-
июня, при температуре от 7—8°, массовый ход после повышения температуры воды
до 10—12°). Нерестовая Пенжинская сельдь мельче (в среднем 23.8 см) и более моло-
дого состава, чем гижигинская сельдь (в среднем 26.2 см).
1 У южносахалинско-хоккайдской сельди позвонков в среднем 54.20—54.62
(Хоккайдо; по Фуджито и Кокубо); у экземпляров от западных берегов южной
части Сахалина," по Фролову, 54.16.
3. CLUPEA
151
Диего), на север до Порт-Кларенс на Аляске.1 У азиатских берегов
ла юг до западного побережья Кореи в Желтом море.1 2 В Японском море
вдоль всего западного побережья, вдоль восточного побережья на юг
до зал. Тояма на о. Хондо. У тихоокеанских берегов Японии на юг до
Хинумы (пров. Хитати) на о. Хондо, далее к северу вдоль Курильских
и возможно Алеутских о-вов. По всему побережью Охотского моря, в Бе-
ринговом море вдоль восточных берегов Камчатки и далее к северу до
Анадырского зал. В последние годы отмечена у северных берегов Сибири
в бухте Тикси близ дельты Лены и в Оленёкском зал.3 Нерест происходит
в ряде мест почти по всему ареалу. У северных берегов Сибири нерестует,
невидимому, в бухте Тикси (Пирожников, 1946). У берегов восточной
Азии нерест отмечен в Анадырском лимане (Агапов, 1941), в б. Уала,
Анапка, зал. Корфа, южнее — в районе Авачинской губы и в бухтах к югу
от нее (Жировая, Ахомтэн) у восточных берегов Камчатки, в районе р. Озер-
ной по западному берегу (по И. А. Полутову и Р. А. Костюченко), вдоль
берегов Гижигинской и Пенжинской губ (Кагановский и Полутон, 1950),
в заливах Ныйский, Даги, Чайво, Пильтун по восточному берегу север-
ной части Сахалина, в заливах Терпения и Анива и по западному побе-
режью Сахалина, в- ряде мест (зал. Петра Великого и др.) у берегов
Приморья (Амброз, 1931), у западных и отчасти восточных берегов Хок-
кайдо. У берегов Сев. Америки нерест происходит в зал. Сан-Диего,
Сан-Франциско, а также в ряде мелких заливов севернее — у берегов
США, Брит. Колумбии и юго-восточной Аляски. Среди последних
наибольшее нерестилище расположено в зал. Ситка с наружной стороны
о. Баранова, меньшее — в зал. Сан-Альберта на о. Принца Уэльского
(у входа в проливчик Клауок), небольшое — в прол. Стефенса (у Juneau),
непостоянное и уменьшающееся — в проливчике Kootznahoo. Севернее,
у берегов Аляски, места нереста отмечены в зал. Принца Вильяма, Кука,
у о. Кодьяка и в Беринговом море у Уналашки. Для нереста заходит
также в солоноватые озера, стоящие в связи с морем, или в изолирован-
ные части заливов, бухт и пр. Камчатки, Сахалина и японских островов.
Для берегов Сев. Америки нереста в озерах не указано.
Биология. Время нереста находится в зависимости от географи-
ческого положения нерестилищ и длится в общем с декабря по июль
включительно. В Анадырском лимане нерест, судя по нахождению сельди
с текучими половыми продуктами в конце июля, происходит в июле.
Южнее, в бухтах Анапка и Уала у восточных берегов Камчатки, нерест
начинается с середины мая и заканчивается в конце его (Панин, 1950).
У северо-западных берегов Охотского моря нерест начинается с середины
мая—начала июня и заканчивается в начале июля (Аюшин,- 1947).
У берегов Приморья нерест происходит раньше — в зал. Де-Кастри
1 В более ранних работах сельдь у берегов Сев. Америки указывалась и далее
к северу: в 80 милях к западу от устья р. Мекензи (Scofield. List fishes Arctic
Alaska, 1899 : 494, co слов местных жителей) и еще далее — из зал. Батурст
i(Bathurst inlet, 67° с. ш., 109° в. д.; Richardson. Fauna Boreali-Americana,
1836 : 230).
2 Согласно Базилевскому, есть и далее, в Чжилийском зал.
3 В бухте Тикси сельдь была обнаружена в 1940 (Берг, 1948 : 154) и в 1945 гг.
<Пирожников, 1947). Один из 3 экз. Пирожникова хранится в коллекциях Зоологи-
ческого института АН СССР (№ 31143). В 1946 г. сельдь дважды была поймана
в южной части Оленёкского зал. (Пирожников, 1948). Один из этих экземпляров также
хранится в коллекциях Зоологического института СССР (№ 31154, п. Станнах-Хочо,
'2/ VII 1946). Указание наше (1944) на нахождение сельди в Чаунской губе и у о. Ляхов-
ского недостоверно и основано на недоразумении. По сообщению Ф. Н. Кириллова,
она есть также, повидимому, близ дельты Индигирки.
152
CLUPEIDAE
начинается co второй половины мая—начала июня (Аюшин, 1947) и закан-
чивается в конце июня; южнее, в зал. Посьета, — с первой половины марта
по конец апреля—начало мая. У восточных берегов Сахалина икроме-
тание начинается с конца мая—начала июня, местами вследствие плаваю-
щих льдов — позднее — в конце июня и начале июля (Амброз, 1931),
у западных берегов южной части Сахалина — с начала—середины апреля
по середину мая. У берегов Сев. Америки икрометание происходит значи-
тельно раньше, чем в соответствующих широтах у берегов Азии. В южных
частях ареала, у Сан-Диего, нерест отмечен в середине декабря, в зал.
Сан-Франциско — со второй половины декабря по середину апреля.
В северных частях ареала нерест происходит позднее — у берегов юго-
восточной Аляски с середины по конец марта, в зал. Кука в середине
мая, у о. Кодьяка с конца мая по начало июня (Rounsefell, 1930). Общая
продолжительность нереста составляет около 12—15 суток (Панин,
1950). У берегов Брит. Колумбии продолжительность нереста
меньше — на каждом нерестилище всего лишь несколько (2—3) суток
(Hart a. Teater, 1934). Икра выметывается на мелководьях, на глубине
3—4 м, максимально, повидимому, до 10—15 м, у западных берегов юж-
ной части Сахалина не дальше глубин 6—9 м, иногда почти у самого
уреза воды на глубине 0.5—1.5 м, обычно в укрытых от действия
ветра местах: в заливах, бухтах, часто в предустьевых пространствах
рек или у открытого берега, на подводную растительность — зостеру,
фукус и др., с каменистым или илисто-песчаным дном, покрытым мелкими
камнями, галькой и пр. (Амброз, 1931), в исключительных случаях при
отсутствии подводной растительности икра в небольшом количестве
откладывается на камень и гальку (Аюшин, 1947; Фридлянд, 1951).
Икра, как и у других форм вида, клейкая. Температурные условия не-
реста, как и у других малопозвонковых подвидов океанической сельди,
довольно низкие, иногда нерест начинается еще подо льдом. У восточных
берегов Камчатки (б. Уала) нерестовые подходы начинаются при темпе-
ратуре воды от 2.2 до 7° и заканчивается при повышении среднесуточной
температуры до 8°, основные подходы и нерест происходят при темпера-
туре от 3 до 6° (Панин, 1950). В зал. Петра Великого нерестовые под-
ходы начинаются даже при отрицательной температуре, но основной
ход происходит при 4—9° (Амброз, 1931). У западных берегов южной
части Сахалина подходы к берегам для нереста начинаются при 2° (иногда
ниже, даже при отрицательных температурах, или выше, до 4.9°), закан-
чиваются при 10°, основная масса подходит обычно при 3—6° (Пискунов,
1949; Фридлянд, 1951). У северо-западных берегов Охотского моря нере-
стовая сельдь подходит при температуре воды от 0.5 до 10.7° (Аюшин,
1947). Подобно другим малопозвонковым подвидам, выносит значитель-
ные опреснения, заходя в устья рек и с приливом подымаясь высоко вверх
по течению (в р. Тумень-ула в низовья, в р. Суйфун на 15 км от устья;
Павленко, 1914; Берг, 1915), но полного опреснения не переносит и,
попав в пресную воду, погибает, как это отмечено в р. Пятибратной
(Слюнин, 1900). Еще большую склонность к опреснениям обнаруживают
озерные сельди, размножающиеся в осолоненных озерах или частях за-
ливов и бухт с пониженной соленостью. В озера Камчатки эти сельди
заходят с осени и, перезимовав, весной после нереста уходят в море.
Плодовитость у сельди из зал. Петра Великого колеблется (длина рыб
21—37 см) от 10.8 до 134.1, в среднем 72.2 тыс. икринок (Амброз, 1931),
от западных берегов южной части Сахалина — от 25.1 до 85.2 тыс. икри-
нок (Фридлянд, 1949), по другим указаниям (Пискунов, 1952; длина
3. CLUPEA
153
рыб 23—37 см) — от 17.6 до 106.4, в среднем 50.6 тыс. икринок, от запад-
ных берегов северной части Сахалина у Широкой Пади (1940 г., длина
рыб 23—-34 см) — от 20.8 до 95.5, в среднем 44.9 тыс. икринок, там же
(1941 г., длина рыб 20—32 см) — от 13.9 до 77.8, в среднем 38.4 тыс. икри-
нок, там же (1946 г., длина рыб 21—32 см) — от 13.8 до 117.8, в среднем
49.8 тыс. икринок, у Александровска (1940 г., длина сельдей 18—30 см) —
от 8.7 до 46.5, в среднем 27.3 тыс. икринок (Пискунов, 1952), от берегов
Камчатки (северная часть прол. Литке, длина рыб 27—38 см) — от 12.6 до
122.8, в среднем 65.9 тыс. икринок (Панин, 1950), от берегов Брит.
Колумбии — от 18.2 до 29.5, в среднем около 20 тыс. икринок
(Hart a. Tester, 1934), по другим указаниям (Fraser, 1922) — от 12 до
35 тыс. икринок, из оз. Тоннай — от 7.5 до 29.0, в среднем 17.0 тыс.
икринок (Пробатов и Фролов, 1951). Диаметр оплодотворенных икринок:
1.3—1.6 мм (Амброз, 1931). Икра выметывается, судя по указаниям ряда
авторов, одновременно. Продолжительность развития икры при средних
температурах воды около 9.2° равна 15 суткам, при 8.1° — 24 суткам,
при 5.8° — 23 суткам, при 3.7° — 38 суткам, при 2.7° — 50 суткам (Амб-
роз, 1931; Панин, 1950). В естественных условиях при средней темпера-
туре воды 6° развитие икры длится около 26 суток, при 2.9° — 30 суток.
Температура 17—18° и выше для развивающейся икры гибельна. Разви-
тие икры может происходить при довольно широких пределах колебания
солености — от 10.66 до 33.33%о. Плотность засева икрой субстрата
крайне густа, у западных берегов южной части Сахалина обычно состав-
ляет 2—6 млн. икринок на 1 м2, максимально достигает до 17.5 млн. икри--
нок, у северной части в 2—3 раза меньше. Среди развивающихся икри-
нок у западных берегов южной части Сахалина мертвых обнаружено
в зависимости от субстрата от 2 до 48% (Фридлянд, 1949, 1951),.
у берегов Брит. Колумбии от 1.4 до 10.5% (Hart a. Tester, 1934).
Личинки по выходе из икринок имеют в длину около 6.0—6.2 мм.
Подросшие мальки озерных сельдей выходят из озер в море,
не отходя далеко от этих мест. Личинки морских сельдей первоначально
держатся на местах нереста, постепенно отходя от берегов и из заливов
и бухт (Амброз, 1931). У западных берегов южной части Сахалина личинки
ко времени рассасывания желточного мешка отходят от берегов до зоны
глубин 28—30 м; отход личинок от берегов заканчивается к концу мая
(1949 г.) или середине июня (1948 г.). Позднее, до конца ноября сформи-
ровавшиеся мальки держатся повсюду вдоль западного побережья
южной части Сахалина ’к северу от м. Лопатина (Фридлянд, 1949).
К северо-восточному побережью Хоккайдо (пров. Китами) и в зал. Анива
молодь, выведшаяся, судя по всему, у западных берегов Хоккайдо, под-
ходит с середины июня. Взрослые больших миграций, меридиональных
и вдоль берегов, такой протяженности, как у атлантической сельди,
не совершают; все передвижения имеют местное значение в пределах
ограниченного пространства, преимущественно к берегам из открытого
моря и от берегов. Лишь местами, например, у западных берегов южной
части Сахалина, какая-то часть половозрелой сельди отходит вдоль бере-
гов южнее. Зимний период жизни не изучен. Судя по имеющимся наблю-
дениям и опытам мечения у берегов Сев. Америки (Dahlgren, 1936), дер-,
жится вблизи мест икрометания, иногда даже в тех же заливах, где раз-
множается, например в зал. Петра Великого. По наблюдениям Н. И. Кули-
ченко, у западных берегов южной части Сахалина, судя по нахождениям
в желудках трески, пойманной в октябре, ноябре, феврале и марте на глу-
бине 100—150 м, какая то часть сельди держится в открытом море против.
154
clupeidae
мест икрометания на глубинах. Во второй половине марта сельдь появ-
ляется в районе о. Монерон и затем образует преднерестовые скопления
в 10—12 милях от Сахалина. Преднерестовая сельдь во второй половине
марта держится на глубине 40—50 м, затем по мере прогревания воды
поднимается в поверхностные горизонты и подходит к берегам (Писку-
нов, 1949). Подходы имеют обычно фронтальный характер — из открытых
частей моря к берегам и лишь в узко прибрежной области вдоль берегов.
Весенние подходы сельди к берегам начинаются в южных районах, раньше
,чем в северных. В разных пунктах Приморья по направлению с севера
на юг начало весенних подходов приходится на следующие сроки: зал.
Петра Великого — 17—20 марта, зал. Пластун — 20—22 апреля, бухта
Нельма — 1—10 мая, зал. Де-Кастри — 17—24 мая (Амброз, 1931)’.
У западных берегов южной части Сахалина начало нерестовых подходов
наступает с 5 по 22 апреля (Богаевский, 1951). У восточных берегов Кам-
чатки в Авачинской губе весенние подходы сельди начинаются с середины
•апреля; севернее, в бухтах Уала, Анапка и зал. Корфа в середине или во
второй половине мая. Продолжительность весенних подходов обычно
не превышает 20 дней, в отдельных случаях (бухты Уала, Анапка) они
заканчиваются в 5—6 дней (Панин, 1950). На подходы сельди к берегам
для размножения существенное влияние имеют приливо-отливные течения,
•особенно в сизигийные фазы — ко времени полнолуния или новолуния.
В частности, в бухтах Анапка и Уала у восточных берегов Камчатки под-
ходы сельди происходят в сизигийные фазы больших колебаний уровней
в начале или в середине мая от первой четверти луны через полнолуние до
последней четверти (Панин, 1946). Подходам сельди к берегам благоприят-
ствуют береговые ветра, выносящие прогретые прибрежные воды в откры-
тое море и тем способствующие подходам. Сильные и длительные
береговые ветра, вызывающие выход на поверхность холодных вод нижеле-
жащих горизонтов, по наблюдениям К. И. Панина, на подходы дейст-
вуют отрицательно. Весенние подходы к берегам происходят в несколько
'(2—-3—4) последовательных волн: в первых подходах преобладают круп-
ные сельди старших возрастов, в конце — более мелкие младших воз-
растов (Амброз, 1931; Панин, 1950 и др.). Крупные сельди начала весенних
подходов идут на нерест, мелкие и более жирные сельди конца подходов
для питания. Сельди более старших возрастов начинают подходить даже
при отрицательных температурах воды, трехгодовалые — при 3—4°,
двухгодовалые — в массовом количестве при 5—9°. По окончании нереста
-сельдь из прибрежных областей отходит и начинает усиленно откармли-
ваться. После весенних нерестовых подходов летом подходит к берегам
для питания нагульная или жирующая сельдь. К берегам Приморья
жирующая сельдь подходит в первой половине июня (Амброз, 1931).
Против западных берегов южной части Сахалина первые косяки отнере-
стовавшей сельди появляются во второй половине апреля у о. Монерон,
сначала к северо-востоку и в некотором отдалении (3—10 миль) от него,
в конце апреля и начале мая приближаются (до 0.5 мили) и держатся
здесь до конца июня. Вначале сельдь здесь в дневное время в поверх-
ностных слоях воды держится сравнительно редко, чаще всплывая
к поверхности после заката солнца и ночью; в июне всплывание в поверх-
ностные слои воды происходит реже, в начале июля уловы прекращаются.
В течение всего этого периода здесь происходит усиленное питание сельди,
желудки ее у преобладающего большинства до предела наполнены пищей;
<с пустыми желудками встречается сравнительно небольшое количество
<(18°/о в 1948 г. и 28°/0 в 1949 г.). Позднее, в ию е в зависимости
3. clupea
155
от температурных условий в начале или конце этого месяца, жирующая
сельдь появляется у западных берегов южной части Сахалина в районе
м. Слепиковского. В 1946 г. сельдь появилась здесь 28 июня, в 1947 г. —
10 июня, в наиболее теплом 1948 г. — 4 июня. Большая часть сельди
вначале держится преимущественно в верхних слоях на глубине 3—4 м
от поверхности и подходит близко к берегам в зону ставных неводов.
В этот период сравнительно хорошо упитанная сельдь питается менее
интенсивно; с пустыми желудками встречаются большее количество ее
(54% в 1948 г. и 52% в 1949 г.), чем у о. Монерон. Исчезновение сельди
у о. Монерон по времени совпадает с появлением ее у м. Слепиковского и,
судя также по размерам, возрастному составу, упитанности и жирности,
это одна и та же сельдь, переместившаяся из одного района в другой.
В зависимости от температуры воды, в середине или конце июля, с образо-
ванием сильно прогретого поверхностного слоя воды и избегая температуры
воды выше 10°, сельдь от берегов отходит. Осенью, со второй половины сен-
тября до начала октября, с похолоданием сельдь вновь держится в этом
районе. В период от июля до половины сентября местопребывание сельди
остается'невыясненным (Богаевский, 1951). У западных берегов Камчатки
нагульная сельдь подходит с июня по сентябрь, у восточных — в течение
всего теплого сезона. Подходы отмечены во всех заливах — от Авачинского
до Олюторского, вдоль побережья от Олюторки до Анадыря, у юго-восточ-
ных берегов от м. Лопатки до м. Поворотного. В нагульный период сельдь
держится здесь в относительна прогретых водах с колебаниями темпера-
туры от 6 до 14°, наичаще в верхних слоях воды (до 20 м) при температуре
от 4.5 до 7.5° (Панин, 1951). Озерные сельди, по наблюдениям К. И. Па-
нина, в озера заходят с осени, держатся здесь всю зиму и после нереста
выходят в море (см. также: Крашенинников, 1755, и Пробатов и Фролов,
1951). В промысловых уловах встречаются экземпляры от двух- до три-
надцати- и пятнадцатигодовалых. Возрастной состав уловов и размеры
сельди вследствие обособленности стад значительно различаются даже
и в близлежащих районах. В северных районах восточного побережья
Камчатки в весенних подходах с середины мая в 1938—1943 гг. преобла-
дали семи-, восьми- и девятигодовалые; во втором подходе (конец мая—
•начало июня) преобладали младшие возрастные группы, в основном
четырех- и пятигодовалые. Урожайными поколениями в уловах этих
лет было поколение 1935 г., появившееся впервые в промысле в 1939 г.
и составлявшее основную массу уловов до 1943 г. У западных берегов
Камчатки (Кихчик—Кольский район) в 1934 г. основную массу уловов
крупных сельдей составляли восьми- и девятигодовалые, среди мелких
сельдей — четырех- и пятигодовалые (Панин, 1946). В зал. Петра Вели-
кого в 1926 г. в уловах преобладали трех- и четырехгодовалые сельди,
в бухте Нельма — семи- и восьмигодовалые, в зал. Де-Кастри в 1929 г. —
восьми- и девятигодовалые (Амброз, 1930), в 1938—1946 гг. —• более
младшие возрастные группы (Пискунов, 1947). У западных берегов юж-
ной части Сахалина и у Хоккайдо преобладающими в уловах в последние,
годы были урожайные поколения 1939 и 1940 гг., которые составляли
основную или значительную массу уловов, начиная с 1942—1943 гг.
до 1951 г. включительно в возрасте от трех-четырех- до одиннадцати-
двенадцатигодовалых. Половой зрелости у северных берегов Приморья
достигает в трех-, отчасти в двухгодовалом возрасте и мечет икру, пови-
димому, до предельного возраста, судя по имеющимся данным, ежегодно
(Амброз, 1931). У северо-восточных берегов Камчатки впервые начинает
метать икру в трехгодовалом, как правило в четырехгодовалом возрасте.
156
CLUPEIDAE
В Авачинской губе встречаются половозрелые в двухгодовалом возрасте;
возможно, что это озерные сельди, зимующие в оз. Вилюй. В Пенжин-
ском зал., по наблюдениям К. И. Панина, среди мелкой нерестовой
сельди встречаются половозрелые и в двухгодовалом возрасте. У запад-
ных берегов южной части Сахалина впервые начинает метать икру в трех-
годовалом, в основном в четырехгодовалом возрасте; судя по нарастаю-
щему количеству поколения одного и того же года в более старших воз-
растных группах, часть сельди достигает половой зрелости и в более
старшем возрасте — в пяти-, шести- и, возможно, как у мурманской
сельди, в семигодовалом. У берегов Брит. Колумбии впервые начи-
нает метать икру также в трех- и отчасти двухгодовалом, некоторые
в четырехгодовалом возрасте (Tester, 1937). У берегов юго-восточной
Аляски (прол. Стефенса) зрелые среди трехгодовалых составляют 84%,
четырех- и пятигодовалые зрелые все; севернее, у берегов центральной
Аляски (зал. Качмак), среди трехгодовалых зрелых 52%, среди четырех-
годовалых— 83%, пятигодовалые зрелые все (Rounsefell, 1931). Сельдь,
нерестующая в оз. Обучи (о. Хондо), в 1936 г. состояла из трех-и четырех-
годовалых (Kokubo a. Tezuka, 1938), в оз. Тоннай — от двух- до десяти-
годовалых (Пробатов и Фролов, 1951). По темпу роста сельди разных
локальных форм, как указывалось выше, существенно различаются,
причем в восточной половине Тихого океана в северных частях ареала
рост более замедленный, чем в южных. В Японском море в наших водах
наилучший рост имеет сельдь зал. Петра великого, более замедленный —
пластунско-нельминская сельдь, затем сельдь от западного берега южной
части Сахалина и самым медленным — декастринская сельдь [по Амброзу
(1930, 1931) и Фролову; см]:
Возраст . . . .
Зал. Петра Вел.
Зал. Пластун .
Бухта Нельма .
Зап. Сахалин ,
Зал. Де-Кастри
. 3 4 5
. 29.0 31.0 32.7
. 27.3 26.1 29.8
. 26.3 29.6 29.6
. 24.3 26.5 28.0
. 20.8 22.3 24.1
6 7 8
32.7 35.0 35.7
31.5 33.2 33.8
31.2 32.7 33.7
29.6 29.7 31.0
26.6 27.5 28.5
9 10 11
36.4 35.5 36.2
34.6 36.0 37.3
35.1 35.1 36.5
31.3 31.7 —
30.0 31.3 31.8
12 13 14 15
37.3 37.3 — —
38.6 37.0 38.0 —
36.0 37.7 34.6 38.1
32.5 34.7 — —
У берегов Камчатки рост сельди еще более замедлен, причем здесь,
наоборот, сельдь северной части прол. Литке (северокамчатская) имеет
более быстрый рост, чем сельдь из Авачинской губы (южнокамчатская);
сельдь Пенжинского зал. имеет еще более медленный рост (1940 г., по
Р. А. Костюченко; см):
11 Ь 1з Ц Ц le I? 1s к ho
Северная часть прол. Литке 7.4 14.8 21.3 25.5 28.3 30.1 31.2 32.1 33.0 33.6.
— (7.4) (6.5) (4.2) (2.8) (1.8) (1.1) (0.9) (0.9) (0.6>
Авачинская губа.............. 6.2 12.9 18.3 22.7 25.8 27.9 29.4 30.5 31.6 32.5
- (6.7) (5.4) (4.4) (3.1) (2.1) (1.5) (1.1) (1.1) (0.9>
Пенжинский зал............... 6.0 13.6 18.2 22.0 23.7 25.3 25.8 26.6 27.4 29.0'
Годичные приросты у северокамчатской сельди (цифры в скобках))
в первые годы выше, чем у южнокамчатской; с четвертого года жизни
наоборот — южнокамчатские имеют больший прирост. Более быстрым:
ростом, как и у берегов Камчатки, обладают сельди из северных частей
ареала, чем из южных, а также от берегов Сев. Америки. Так, например,
шестигодовалые сельди от Уналашки на 6.5 см больше сельдей того же:
возраста от юго-восточной Аляски (прол. Стефенса). Озерные сельди
при одном и том же возрасте имеют значительно меньшие размеры,
3. CLUPEA
157
чем морские из близких мест, как это видно из нижеследующих данных
(по К. И. Панину; см):
1, 1. 14 15 1» 1, 1s 1,
(Алюторский зал. . . . . . 8.6 16.5 24.0 29.0 32.7 34.7 36.1 38.0 40.7
Нерпичье оз . . . 8.0 15.6 21.0 24.1 26.4 27.8 29.1 30.1 31.0
Питание тихоокеанской сельди в северной части Татарского прол,
у западного побережья Сахалина на протяжении года по интенсивности
распадается на следующие периоды: 1) весеннего или преднерестового
откорма (апрель—май), 2) нерестового голодания (май—июнь), 3) интен-
сивного посленерестового летнего откорма (с конца июня по август вклю-
чительно), 4) осеннего ослабления питания и 5) мало изученный зимний
период, когда сельдь или не питается совершенно, или питается слабо.
Основу питания здесь составляют Euphausiidae Thysanoessa inermis, Th.
raschii (82.1% по весу), Calanus finmarchicus (5.12%) и Sagitta elegans
(9.04%). Весной, частично осенью и иногда летом в пище обычно преоб-
ладают Euphausiidae-, С. finmarchicus наичаще встречается в желудках
в июле, августе, иногда в сентябре (Кун, 1949). У западных берегов
южной части Сахалина в период нагула сельди различают периоды:
1) усиленного питания после нереста, накопления жировых отложений
и восстановления гонад после нереста (апрель—июнь); 2) уменьшения
интенсивности питания, продолжения накопления жировых отложений
и начала роста тела и развития гонад (июнь—август); 3) повышения интен-
сивности питания, замедления и окончания роста тела, продолжения
развития гонад (август—октябрь) (Богаевский, 1951). В зал. Петра
Великого взрослые поедают Copepoda, Mysidae, Amphipoda, реже икру
рыб. Сеголетки и годовалые питаются также ракообразными, но более
мелкими — мелкие формы Copepoda, zoea крабов, 2 раза в желудках
были находимы личинки сельди (Амброз, 1931). В зимнее время здесь же
(Амурский зал.) молодь в основном питается ракообразными и пр. —
Calanus cristatus (47.9%),’ Stylomysis sp. (32.4%), Sagitta sp. (14.9%).
У восточных берегов Камчатки, по исследованиям К. И. Панина, основной
пищей служат веслоногие ракообразные; в Авачинском зал. основу питания
составляют Eucalanus elongatus (61.2%), несколько меньшее С. cristatus
(31.6%) и ничтожное С. tonsus (1.8%) и Thysanoessa sp. (4.3%); в Кро-
ноцком зал. большое значение имеет С. cristatus(64.6%), значительно мень-
шее Е. elongatus (22.9%) и незначительное С. tonsus (1.3%) и Thysanoessa
sp. (7.5%); в Петропавловском ковше сельдь питается, помимо Copepoda,
донными организмами (Polychaeta, Amphipoda, случайно моллюск Tel-^
Una calcarea, молодь рыб). В северной части Охотского моря поедает наи-
более массовые формы планктона — Metridia sp. (40—50% по весу),
Themisto libelulla (местами до 90%), Calanus finmarchicus (10—15%),
Pseudocalanus elongatus и Acartia longiremus (25—30%) (Кун, 1951). В Пен-
жинском зал. по исследованиям И. А. Полутона, поедает в основном
Thysanoessa sp. У берегов Брит. Колумбии основную пищу взрос-
лых составляют Copepoda, Euphausia pacifica и случайно икра сельди:
весной глав:ое значение имеет Calanus tonsus, в другие времена
года большую роль в питании играет Euphausia pacifica (Wailes, 1935).
Конкурентами в питании тихоокеанской сельди являются горбуша,
скумбрия, колючая акула, навага и некоторые другие рыбы, а также
в некоторые годы в августе медузы и, как у атлантической сельди, греб-
невики. В местах большого скопления гребневиков, а также и медуз
158
CLUPEIDAE
в период летнего откорма, подобно атлантической сельди, встречается
в меньшем количестве. Массовое развитие фитопланктона в период лет-
него откорма оказывает отрицательное влияние на распределение тихо-
океанской сельди; весной, во время нереста, скопления фитопланктона
не оказывают на нее влияния, и она проходит их (Кун, 1949). Нерестовая
сельдь значительно менее жирна, чем более мелкая, не нерестующая..
У западных берегов Камчатки, по данным К. И. Панина, нерестовая
сельдь длиной 32—36 см имеет в теле 18.6—18.7% жира (на сухой вес),,
мелкие сельди, не нерестующие, длиной 24—26 см — от23.7 до 32.4% жира.
У берегов Приморья наибольшее количество жира содержит в теле летняя
сельдь — 14.4—17.9% в мае—июле, нерестовая сельдь содержит жира
значительно меньше — 7.4% в марте (Кизеветтер, 1942). Наибольшей жир-
ностью отличаются крупные (34—42 см длиной) сельди, вылавливаемые
в летнее время (июль—август) в Кроноцком зал. и Авачинской губе у во-
сточных берегов Камчатки, а также в Олюторском зал. осенью (сентябрь—
октябрь) (жупановская сельдь), содержание жира в теле которых колеб-
лется от 20.2 до 33.2% (Писарев, 1938; Панин). Значительно большим:
содержанием жира отличается нагульная летняя сельдь (до 25.7%) по
сравнению с нерестовой (1.1—:9.1%) и у западного побережья Сахалина
(Леванидов, 1950).
Хозяйственное значение очень велико. Общий улов
в 1936—1939 гг. колебался от 4 до 6.4 млн ц. Основная масса его
добыта у южных берегов Сахалина (0.7—2.4 млн ц, около 3.7 млн ц
в 1934 г.), у о. Хоккайдо (0.13—1.29 млн ц, 3.7 млн ц в 1934 г.), у берегов
Кореи (0.3—0.5 млн ц), Сев. Америки (1.4—1.8 млн ц). В водах СССР
в 1936—1940 гг. уловы составляли 425—523 тыс. ц (без южного Сахалина),
из них в Японском море добыто 221—250 тыс. ц, в Охотском море —
147—195, в Беринговом море — 75—97 тыс. ц. Уловы в связи с колеба-
ниями численности претерпевают большие изменения. В частности, у бере-
гов южной части Сахалина уловы в 1931 г. достигли наибольшей величи-
ны — 5.3 млн. ц, в 1937—1938 гг. снизились до 0.7 млн ц, к 1940—1941 гг.
возросли до 1.6—1.9 млн ц, к 1945 г. вновь уменьшились до 1.4 млн. ц.
У берегов Хоккайдо наибольший улов до 9.7 млнц был в 1897 г.; в дальней-
шем уловы держались в среднем на несколько меньшем уровне. В двадца-
тых годах уловы резко снизились, в 1930 г. достигли всего лишь 2.8 млн ц,
а к 1938 г. снизились до 0.13 млн ц, после чего вновь увеличились, не
достигнув, однако, размеров высоких уловов предыдущих лет. Уловы
в ряде промысловых районов могут быть увеличены путем освоения новых
промысловых участков и лова в другое время года кроме весны, в част-
ности жирующей летней сельди. Ловится во время нереста, в Приморье
в марте—мае, в Амурском лимане в июне, у охотского побережья и запад-
ного Камчатки — в июне—июле, у" восточных берегов Камчатки в мае—
июне. Нагульную (жирующую) сельдь ловят в Приморье в июле и в сен-
тябре—январе, у Сахалина и Камчатки — в июне—августе.
*ld. Clupea harengus pallasi n. maris-albi Berg — Беломорская
сельдь,1 малопозвонковая сельдь (табл. IV).
Clupea harengus membras (non Linne) Pallas, Zoogr. rosso-asiat., Ill, 18'1'1 :
211 (частью: Белое м.: Сорока, Кемь). — Clupea harengus Данилевский,
Исслед. сост. рыбол. России, VI, 1862 : 14 (Белое м.; две расы: мелкая — Сорокская
1 В Кандалакшском зал. «егорьевской» называют мелкую сельдь, подходящую
для нереста с половины апреля, «ивановской» — крупную сельдь, нерестящуюся
в первой половине лета.
3. CLUPEA
159
губа, Онежский зал., отчасти Летний берег; крупная — Кандалакшский зал., Понь-
гома, Соловецкие о-ва); Н е i n с k е, Naturgesch. d. Herings, I, 1898 : LXV,
Tab. LXVI—LXIX (частью: Белое и.: Архангельск, Соловецкие о-ва; измерения рыб
и черепов). — Clupea harengus pallasi maris-albi Берг, Рыбы пресных вод России,
1923 : 50'1 (Соловецкие о-ва, по Гейнке). — Clupea harengus pallasi maris-albi var. a
Рабинерсон, Изв. Отд. прикл. ихт., Ill, 1, 1925 : 80; Тр. Инет. изуч. Севера,
25, 1925 : 50 (крупная сельдь: центральная часть Белого м.; Кандалакшский зал., Соло-
вецкие о-ва, отчасти у Умбы и в Онежском зал.). — Clupea harengus pallasi maris-albi
var. 6 Рабинерсон, там же (мелкая сельдь: Кандалакшский и Онежский зал.). —
Мелкая раса Кандалакшского зал., мелкая раса Онежского зал., мелкая раса Двинского
зал., крупная раса Кандалакшского зал., крупная раса Двинского зал. Аверин-
ц е в, Тр. Научи, инет. рыбн. хоз., II, 1, 1927 : 57—65; там же, III, 4, 1928 : 73
(Белое м.; расы). — Clupea harengus pallasi n. maris-albi Дмитриев, Биол:
и пром, сельди в Белом м., изд. Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз.
и океаногр., 1946 : 41 (сводка по биологии и промыслу, литература 2); Берг, Рыбы
пресных вод, I, 1948 : 151; Дмитриев, в: Промысловые рыбы СССР, 1949 : 131,
табл. 33.
Распространение, биология. Якобсон, Мат. позн. русск.
рыбол., IV, 8, 1915 : 59 (заход в устье Сев. Двины); Солдатов, Тр. Плов, морск.
паучн. инет., 3, 1923 : 9, 66 (в устьях Сев. Двины вместе с плотвой, ершом, сайкой,,
бельдюгой); Рабинерсон, Изв. Отд. прикл. ихт., VIII, 1928 : 99 (Кандалакш-
ская и онежская мелкие сельди, биометрика); Антипова, там же : 112 (Онеж-
ский зал.; возраст, рост, вес); Телегин, там же : 136 (Онежский зал.; весенние
подходы, нерест, уловы); Антипова, Изв. Гос. инет, опытн. агроном., VI, 3—4,
1928 : 113 (плодовитость); Шапиро, Тр. Научн. инет. рыбн. хоз., Ill, 1, 1928 :
177 (жирность); Бородатова, там же, III, 2, 1928 : 35 (мелкая сельдь Онеж-
ского зал.; возраст, рост); Скворцов, там же, III, 4, 1928 : 5—7 (биология,
карта мест лова); Мейснер, там же, V, 2, 1930 : 63 (зимой заходит с приливом
в устья Сев. Двины); Болховитянов, Тр. Астраханок, ихт. паб., VII, 3,
1930 : 17 (Онежский зал.; рост); Телегин, Изд. Ленингр. научно-исслед. ихт..
инет., XI, 2, 1931 : 3 (Сорокская губа; возраст, рост, вес); Антипова, там же :
24 (крупная и мелкая сельдь из Кандалакши и Поньгомы; возраст, рост); Гера-
симов, там же : 42 (мелкая Кандалакшская сельдь; возраст, рост); Петру-
шевский, там же : 51 (места нереста, диаметр икринок, возраст, уловы); О с а д-
ч и х, За рыбн. индустр. Севера, 1934, 8 : 35 (условия развития икры); Алтухов,
Рыбн. хоз. СССР, 1936, 4 : 53 (нерест и условия развития икринок и личинок);
М а к у ш о к, Рыбн. хоз., 1937, 9 : 17 (Летний берег; возрастной состав крупной,
и мелкой сельди); Кари некий, Тр. Моск, технич. инет. рыбн. хоз. и пром., 1,
1938 : 147 (условия нереста, развитие икринок и личинок); Рыбн. хоз., 1938, 9 : 29-
(выживаемость икры, отложенной на неводах); Безрукова, Зоолог, журн.,
XVII, 1, 1938 : 175 (плодовитость, диаметр икринок); Чаянова, Сб., посвящ.
деят. Книповича, 1939 : 279 (питание); Алтухов, Природа, 1943, 3 : 71 (Кан-
далакшский зал., места нереста); Т амбовцев, Рыбн. хоз., 1947, 6 : 30 (колеба-
ние численности и его причины); Бюлл. рыбн. хоз. Карело-Финск. ССР, 1948, 3 : 9
(уловы); Д р я г и н, Вести. Ленингр. унив., 8, 1950 : 27 (уловы, уменьшение запа-
сов в последние годы и его причины).
D (III) IV 14—16 (14.9), общим числом 18—20 (18.9), А (II) III
13—16 (14.0), общим числом 16—19 (17.0), sp. br. 58—70 (63.4), килевых
чешуй позади основания брюшных плавников 10—14 (11.5), vert. S. 52—
55 (53.2), caud. vert. 27—31 (29.0). Брюшные килевые чешуи более
или менее развиты лишь позади основания брюшных плавников,
впереди от них развиты слабо или отсутствуют. Зубы на сошнике
1 ВЬем формам беломорской сельди, установленным Рабинерсоном и Аверинце-
вым, Дмитриев дает латинские наименования, а именно: Cl. harengus pallasi n. maris-
albi f. major (=var. a Rabinerson); f. minor (=var. Rabinerson); f. minor biotyp.
jegorjevka (Кандалакшский зал., центральная часть Белого м.); f. minor biotyp. опе-
gensis (Онежский зал., центральная часть Белого м.); f. minor biotyp. doinensis (Двин-
ский зал., центральная часть Белого м.). Кроме того, без описаний им даны латинские
названия сельдям, свойственным кутовой части Онежского зал. (f. minor biotyp.
pokrooka, nomen nudum) и предустьевого пространства Сев. Двины и кутовой части
Двинского зал. (f. minor biotyp. ustyanka, nomen nudum).
160
CLUPEIDAE
развиты слабо. Голова крупнее, чем у предыдущей формы, длина ее
22.5—24.6 (23.7)% длины тела; межглазничный промежуток уже, 15.3—
17.8 (16.5)% длины головы. Глаза крупнее, 23.0—27.0 (25.4)% длины
головы. Основание анального плавника длиннее, 10.3—12.0 (10.9)%
длины тела. Размеры крупной формы до 34, обычно 20—30 см, мелкой
до 20, обычно 12—13 см. Описание дано по 50 экз. размерами от 13.7
до 17.8, в среднем 15.8 см, пойманным 29 V 1929 в Онежском зал. у Бело-
морска. По Аверинцеву (1927), позвонков 50—56, килевых чешуй 8—14;
средние числа позвонков у форм подвида колеблются от 53.14 до 53.76,
килевых чешуй — от 11.36 до 12.23.
Морская форма, живущая в воде с несколько пониженной соленостью.
Образует несколько, еще не в достаточной степени изученных форм.
Рабинерсон (1925) установил 2 формы — крупную (var. а) и мел-
кую (var. р), отличающихся не столько морфологическими признаками,
сколько размерами, темпом роста, локализацией в разных частях моря,
биологическими особенностями. Аверинцев (1927, 1928) среди круп-
ных и мелких сельдей установил 5 форм (рас): 1) мелкая раса
К а ндалакшского зал.; среднее число позвонков 53.76, туло-
вищных позвонков 24.36, килевых чешуй 11.62; 2) мелкая раса
Онежского зал.; среднее число позвонков 53.13, туловищных
позвонков 23.31, килевых чешуй 11.36; 3) мелкая . раса Двин-
ского зал.; среднее число позвонков 53.25, туловищных позвонков
24.05, килевых чешуй 11.74; 4) крупная раса Кандалакш-
ского зал.; среднее число позвонков 54.05, туловищных позвонков
24.27, килевых чешуй 12.23; 5) крупная раса Двинского
зал.; среднее число позвонков 53.50, туловищных позвонков 24.17,
килевых чешуй 11.54. В Онежском зал. различают 2 формы сельди —
сорокскую (район Беломорска, мелкая раса Онежского зал. Аверинцева)
и покровскую (район г. Онеги и с. Покровского), более мелкую, чем
сорокская, и созревающую при меньших размерах. Сорокская сельдь
встречается в Онежском зал. и центральной части моря, покровская дер-
жится в кутовой части Онежского зал. в предустьевом пространстве
р. Онеги. Подобным же образом и в Двинском зал., помимо сельди,
описанной С. В. Аверинцевым (мелкая раса Двинского зал.) и распро-
страненной в этом заливе и центральной части моря, есть более мелкая
сельдь (так называемая устьянка), свойственная кутовой части залива
в предустьевом пространстве р. Сев. Двины. По исследованиям последних
лет (Дмитриев, 1946), беломорская сельдь разделяется на 2, установленные
А. И. Рабинерсоном формы (расы) — мелкую и крупную, по отношению
к которым формы С. В. Аверинцева рассматриваются как стада. Относи-
тельно латинских наименований всех этих стад (biotipus Дмитриева) сле-
дует сказать то же, что и о подвидах атлантической сельди Шнакенбека
и natio murmanica Тихонова этой же сельди. Что касается его f. major
и f. minor, то они уже обозначены Рабинерсоном как var. а и var. р.
Типичной формой беломорской сельди следует считать, судя по всему,
крупную сельдь, так как описание n. maris-albi Л. С. Берга основано на
табл. LXVII Гейнке крупных сельдей (176—292, в среднем 218 мм) от
Соловецких о-вов. Мелкая форма, таким образом, является систематически
более низкой.
Распространение. Белое море и преимущественно его за-
.ливы — Кандалакшский, Онежский и отчасти Двинский. Крупная форма
распространена главным образом в центральной части моря (у Понь-
гомы, Шуерецкого, Соловецких о-вов) и в Кандалакшском зал., заходит
3. CLUPEA 101
Ч'пкже в Двинский и Онежский заливы. Мелкая форма встречается по всему
Морю, держась преимущественно в прибрежных и кутовых частях зали-
Non; заходит в устья рек — в Сев. Двину в сильно опресненную воду.
Моста нереста известны мало. В Кандалакшском зал. мелкая сельдь
монет икру вдоль юго-западных берегов, а также в губах и бухтах (конец
лпроля—начало июня). В Онежском зал. основные места нереста мелкой
сельди расположены в восточной части в предустьевом пространстве
р. Онеги — близ с. Ворзогоры и Покровского, губ Пушлахотской и
Конюховой и у Беломорска (май—начало июня). В Двинском зал. икро-
метание мелкой сельди происходит в низовье дельты Сев. Двины, главным
образом у о. Ягры в Яндовской губе и далее к востоку в предустьевых:
частях рек Летнего берега — Солзы, Сгозьмы и рек, впадающих в У некую
губу (май). Нерест происходит также вдоль Терского берега. Крупная
сельдь нерестится в Кандалакшском зал. в районе Кибринского берега
(середина июня), в центральной части моря в районе Поньгомы (июнь),-
н Двинском зал. (май).
Биология. Время нереста приходится на весну и начало лета.1
Мелкие сельди выметывают икру раньше, в апреле—мае, в Кандалакш-
ском зал. еще подо льдом; крупные сельди нерестуют несколько позднее,
в июне и мае, после освобождения нерестилищ от ледяного покрова.
По указанию ряда авторов, как среди нерестующей мелкой сельди встре-
чаются крупные, так и среди крупных попадаются мелкие. Икра откла-
дывается на небольшой глубине — 2—5, наичаще 2—3 м, в прибрежной
зоне, обычно на подводную растительность, чаще всего на зостеру, реже
на фукус, кладофору и филлофору. Температурные условия нереста до-
вольно низкие. В Кандалакшском зал., где икрометание происходит
ранее, в начале его температура воды близка к 0°, в конце — около 5—6°.
В Сорокской губе Онежского зал. нерест начинается при более высокой
температуре, в 1927 г. — при 6.5° (Телегин, 1928). Нерест крупной сельди
в Кандалакшском зал. наблюдался при температуре воды от 4 до 6°.
Содержание солей на нерестилищах крупной сельди в Кандалакшском
зал. на глубине от 0.05 до 7.5 м колебалось от 22 до 24 %о (Алтухов, 1936).
Плодовитость по сравнению с другими подвидами океанической сельди
не велика. Мелкая Кандалакшская сельдь имеет от 4.0 до 13.1, в среднем
7.6 тыс. икринок, мелкая онежская сельдь — от 2.3 до.21.4, в среднем
6.9 тыс. икринок. У крупных сельдей количество икринок больше: у круп-
ной сельди из Кандалакшского зал. от 9.2 до 62, в среднем 27.4 тыс. икри-
нок, у крупной сельди от Шуерецкого из Онежского зал. — от 17.0 до
45.3, в среднем 30.5 тыс. икринок. Указаний на порционность созревания
икры нет. Диаметр икринок мелкой Кандалакшской сельди колеблется
от 0.99 до 1.18 мм; у крупных сельдей икринки мельче: у крупной Кан-
далакшской сельди от 0.83 до 1.04 мм, у крупной сельди от Шуерецкого
от 0.70 до 0.95 мм1 2 (Безрукова, 1938). Продолжительность развития
икры в аквариуме при средней температуре воды около 12° (от 5 до 20.5°)
равнялась 10 дням, в естественных условиях при средней температуре
воды около 7° — 21 дню (Алтухов, 1936). Размеры личинок по выходе
из икринок колеблются от 6 до 7.2 мм (Каринский, 1938). Встречается
по всему морю, но основные скопления происходят в заливах и губах —
в основном в Кандалакшском и Онежском заливах и отчасти в других
1 Указание Данилевского (1862 : 19) на икрометание сельди в Сороковом зал.
в начале зимы последующими исследованиями не подтверждено.
2 Цо данным Петрушевского (1931), наоборот — диаметр икринок мелкой сельди
равен 1.6—1.9 мм, крупной — от 2.5 до 3.0 мм.
11 Фауна СССР — 314
162
CLUPEIDAE
частях моря. Летом с июня месяца держится в прибрежной зоне, в ав-
густе и сентябре и отчасти в июле из прибрежных участков уходит и встре-
чается как в открытом море, так и у берегов. В октябре сельдь опять под-
ходит к берегам, в Кандалакшском зал. держится главным образом в куто-
вой части его, в Онежском зал. — у западного берега. Летом и осенью
придерживается поверхностных слоев воды глубиной до 5 м, что обуслов-
лено наибольшей прогреваемостью их. В августе, сентябре и октябре
количество сельди в нижележащих горизонтах (5—10 и 10—15 м) после-
довательно увеличивается. Зимой в Кандалакшском зал. основные ско-
пления наблюдаются в наиболее теплом слое воды на глубине от 25 до
50 м. В Онежском и Двинском зал. сельдь держится зимой в предустье-
вых пространствах рек (Онега, Выг, Сев. Двина). Весенний подход к бере-
гам для нереста в Кандалакшском зал. обусловлен прогреванием при-
брежных вод. С повышением температуры воды до 0° начинает подходить
мелкая сельдь, при 5° начинается подход крупной сельди (Дмитриев,
1946). Наиболее интенсивно питается летом и отчасти осенью, в сентябре
и октябре индексы наполнения желудков уменьшаются. Особенно интен-
сивно питается сельдь в открытых частях моря. В период нереста интен-
сивность питания не велика. Мелкая сельдь в губах Кандалакшского
зал. в это время поедает главным образом Euphausiidae, Calanus finmar-
chicus, Metridia longa, Mysidae и др. Крупная сельдь в период нереста
поедает в основном Calanus finmarchicus, в небольшом количестве Mysi-
dae. Летом, в' июне в прибрежных частях Кандалакшского зал. наиболь-
шую роль в питании играют мелкие Copepoda — Acartia, отчасти Pseu-
docalanus, Centropages, Temora, Metridia, nauplii Copepoda, также мизид-
ные стадии Decapoda, Mysidae, Amphipoda, Sagitta, икра и мальки рыб
и др. В июле состав пищи тот же, но увеличивается значение мальков
рыб. В августе из Copepoda преобладает Acartia. В открытых частях
Кандалакшского зал. в августе наибольшее значение в питании имеют
Metridia longa и Calanus finmarchicus и из крупных — Themisto litellu.a
и Т. abyssorum, отчасти Sagitta', в сентябре — Themisto и Metridia, в ок-
тябре — Themisto, Mysidae и в меньшей степени Calanus, Metridia, Sagitta.
В Онежском зал. в питании крупной сельди в мае основную роль играют
Amphipoda и из Copepoda Pseudocalanus, Acartia и др. Мелкая сельдь
Онежского зал. в июне поедала мальков сельди и отчасти мелких Cope-
poda — Temora, Acartia, Pseudocalanus, Centropages и др. Половой зре-
лости мелкие сельди достигают на втором и третьем году жизни, круп-
ные — на четвертом и пятом. По характеру роста мелкие и крупные сельди
существенно различаются. Значительно различается рост мелких и круп-
ных сельдей и в различных частях моря, как
щего (по Дмитриеву, 1946; см):
/ Кандалакшский зал........
Мелкая сельдь < Онежский » .........
( Двинский » .........
Крупная сельдь { Дви“ский - » .........
В уловах мелкой сельди в Кандалакшском зал. весной во время нереста
преобладающей возрастной группой обычно являются трехгодовалые
(около 60% в 1940 и 1941 гг., иногда свыше 96% — в .1933 г.), реже
в некоторые годы четырех- (88.5% в 1931 г.) или пятигодовалые (80.4%
в 1932 г.), иногда в значительном количестве встречаются двухгодовалые
это видно из нижеследую-
ll 12 1з 1, h
6.4 11.1 13.4 14.8 16.5
5.3 10.2 12.9 14.3 16.0
4.4 9.0 11.7 — —
4.9 11.5 17.0 21.8 24.7
5.2 11.2 16.0 19.2 20.8
3. CLUPEA
163
(24.2% в 1940 г. Численность поколений отдельных лет обусловлена
температурными условиями. В годы с более высокой температурой воды
поколения отличаются малой численностью, усилением роста и более
ранним наступлением половой зрелости, как, например, у поколений
1938 и 1939 гг. Кандалакшской мелкой сельди, отличавшихся малой чис-
ленностью, быстрым ростом и вступавших в промысел в основной массе
в двухгодовалом возрасте. Поколение 1942 г., года, характерного резким
похолоданием, отличалось большей численностью, медленным ростом
и более поздним наступлением половой зрелости, в результате чего в двух-
годовалом возрасте нерестовала лишь часть его, а основная масса созрела
в трех- и четырехгодовалом возрасте, вызвав увеличение уловов в 1945
и 1946 гг. (Тамбовцев, 1947, 1948). Приблизительно таков же возрастной
состав мелкой сельди и в уловах в Онежском зал. В кутовой части этого
залива преобладают также трехгодовалые, но процент двухгодовалых
значительно больше, чем в открытой части залива. В Двинском зал. перед
устьями Сев. Двины в уловах преобладают двухгодовалые (65.6%), трех-
годовалых— 22.2%, более старших — еще меньше. В уловах крупной
сельди в Кандалакшском зал. преобладают пятигодовалые (46.9%), зна-
чительно количество четырехгодовалых (27.5%) и шестигодовалых
(16.6%), более старших — единицы процентов (Дмитриев, 1946). Наи-
более жирной бывает осенью — в среднем свыше 14% жира у мелкой
сельди Кандалакшского зал. в октябре. Сельдь с неразвитыми половыми
продуктами (двухгодовалые) в это время содержит несколько больше
жира (свыше 13%), чем сельдь более старшего возраста с созревающими
половыми продуктами (свыше 11%). Весной перед нерестом содержание
жира меньше — 4.3—4.5% у мелкой сельди Онежского зал. в конце мая
(Шапиро, 1928).
Хозяйственное значение. Важнейшая промысловая
рыба Белого моря, уловы которой в некоторых промысловых районах
(Кандалакшский зал.) составляли свыше 80% общего улова. Общий удов
в 1933—1946 гг. составлял 13—36 тыс. ц, из него в Кандалакшском
зал. добывалось 2.2—18.5 тыс. ц, на Терском побережье 0.8—5.7 тыс. ц,
в Онежском зал. и центральной части моря 3.5—13.8 тыс. ц, в Двинском
зал. 2.5—7.1 тыс. ц. Главную часть улова составляют мелкие сельди.
Уловы могут быть увеличены. Ловится весной и осенью у берегов, в откры-
том море лов развит мало. В Кандалакшском зал. в 1945—1946 гг. произ-
водился зимний промысел, улов которого оказался выше весеннего; вес-
ной 1946 г. успешно проходил лов ставными неводами, а в некоторых
губах эфективно применялись запоры.
*le. Clupea harengus pallasi n. suworowi Rabinerson — Чёшско-печор-
ская сельдь, малопозвонковая сельдь (табл. IV).
Clupea harengus pallasi suworowi Рабинерсон, Тр. Инет. изуч. Севера,
34, 1927 : 66 (Чешская губа: устья рр. Пеши, Индиги; устье Камбальницы; измере-
ния, рост). — Clupea pallasi probatowi Макушок, За рыбн. индустр. Севера,
1935, 1 : 23 (Югорский Шар, Карская губа). — Clupea harengus pallasi и. suworowi
Есипов, Тр. Полярн. научно-исслед. инет, морск. рыбн. хоз. и океаногр., 1, 1938 :
157 (Чешская губа: низовья р. Индиги, устье р. Пеши; низовье р. Камбальницы). —
Clupea harengus pallasi n. probatowi Есипов, там же (Баренцовом. в районе о. Кол-
гуева, Печорский зал., Югорский Шар; Карское м., Карская губа, Обская губа). —
Clupea harengus pallasi n. tambowcewi Дмитриев, Биол. и пром, сельди
в Белом м., изд. Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океаногр.,
1946 : 41 (Мензенский зал.; nomen nudum); Т амбовцев, Малопозв. сельдь
Мезенск. зал., изд. Северн, отд. Геогр. общ. АН СССР, Архангельск, 1947 : 3—8
(описание, близость с сельдью Чешской губы). — Clupea harengus pallasi n. suworowi
11*
164
CLUPEIDAE
Ю дкин, Докл. АН СССР, LVIII, 9, 1947 : 2085 (сравнение сельдей Чешской губы,
Карского м. и Карской губы); Берг, Рыбы пресн. вод, I, 1948 : 153; Васильев,
в: Промысловые рыбы СССР, 1949 : 134.
Распространение, биология. Суворов, Тр. Инет. изуч. Се-
вера, 34, 1927 : 42 (Чешская губа и восточнее); Васильев и Бородатова,
Бюлл. Рыбн. хоз., 1930, 7—8 : 42 (Печорский зал., нерест в июне под Русским Заво-
ротом); М а к у ш о к, За рыбн. индустр. Севера, 1933, 8 : 19 (низовья рек запад-
ного побережья п-ова Канина: Кии, Шойны и Торны); там же, 193,4, 8 : 32 (Печорский
зал.; возраст); Аверинцев, Природа, 1934, 10:67 (Териб рка, по Бородато-
вой, 1930); Пробатов, Мат. научно^промысл. обслед. Карской губы и р. Кары,
изд. Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океаногр., 1934 : 91 (Кар-
ская губа; 1932 г., нерест); Макушок, Зоолог, журн., XVII, 4, 1938 : 678
(Югорский Шар, Карская губа; размеры, возраст); Р ы ж е н к о, Рыбн. хоз., 1938,
4—5 : 22; там же, 1939, 4 : 20 (Чешская губа и прилегающие участки моря; весенние
подходы, нерест, развитие икры, половозрелость, возрастной состав); Галкин,
Тр. Научно-исслед. инет, полярн. землед., животн. и пром, хоз., сер. пром, хоз.,
10, 1940 : 87 (северная часть Обской губы под 72°26 с. ш.; измерения, размеры, воз-
раст, рост, плодовитость); Болдовский, Тр. Полярн. научно-исслед. инет,
морск. рыбн. хоз. и океаногр., 7, 1941 : 272 (питание в Колгуевском районе);
Ю дкин, Рыбн: хоз., 1948, 5 : 41 (Югорский Шар, Байдарацкая и Карская губы;
нерест).
D IV 14—16 (14.8), общим числом 18—20 (18.8), А III 14—16 (14.6),
общим числом 17—19 (17.6), sp. br. 60—70 (65.1), vert. S. 53—55 (53.5),
caud. vert. 29—32 (30.7). Брюшные килевые чешуи более или менее раз-
виты лишь позади основания брюшных плавников, впереди них развиты
слабо или отсутствуют. Зубы на сошнике развиты слабо. Голова крупнее,
чем у Cl. harengus harengus, длина ее 21.1—23.2 (21.2)% длины тела;
межглазничный промежуток уже, 14.3—18.7 (16.6)% длины головы.
Глаза крупнее, 23.2—26.8 (25.1)% длины головы. Основание анального
плавника сравнительно короткое, 9.3—11.0 (10.4)% длины тела. Размеры
до 32 см, средние размеры в Мезенском зал. 21.4 см. Описание дано по
26 экз. длиной 17.0— 21.4, в среднем 20.0 см, собранным в Мезенском
зал. (Щекино) в мае 1948 г. Позвонков 50—57, средние числа колеб-
лются от 53.12 до 53.91.
Морская форма, живущая в воде как с океанической, так и с понижен-
ной соленостью.
В пределах довольно обширного ареала распадается на несколько
форм, повидимому стад, незначительно различающихся некоторыми
признаками. Макушок (1935) обнаружил некоторые различия в зна-
чительном количестве признаков (число позвонков, лучей в спинном,
анальном и грудном плавниках, жаберных тычинок и ряд меристических
признаков) между сельдью Печорского и Карского морей, выделив послед-
нюю в п. probatowi. Есиповым (1938) 'произведено сравнение между
сельдью Чешской губы и от о. Колгуева, с одной стороны, и сельдью
от о. Колгуева и из Карского моря, с другой, и предложено разделение
этой сельди на две формы (nationes), незначительно различающиеся
количеством лучей в анальном плавнике, жаберных тычинок и отчасти
позвонков. Дмитриевым (1946) на основании неопубликованных
исследований Б. М. Тамбовцева выделена без описания как n. tambow-
zewi (nomen nudum) сельдь Мезенского зал., которая, судя по всему,
относится к этому подвиду, а не к предыдущему. Близость мезенской
сельди к чешской как по признакам меристическим, так и по биологи-
ческим особенностям подтверждает и Тамбовцев (1947). Все эти nationes
имеют незначительные различия, не более различий между группами
атлантической сельди или формами (стадами) беломорской сельди
и поэтому давать им латинские наименования совершенно не целе-
3. CLUPEA
765
сообразно. Что касается указываемой В. К. Есиповым локализации чеш-
ской сельди только в Чёшской губе, то следует отметить, что исследова-
ния Рыженко (1938) свидетельствуют об отсутствии локальных форм
как в Чёшской губе, так и в Печорском зал., а также и о широком распро-
странении сельди в прилегающих частях моря.
Распространение. Юго-восточная часть Варенцова и юж-
ная часть Карского морей. На запад до Мезенского зал., восточное и
отчасти западное побережье п-ова Канина, Чёшская губа, юго-восточ-
ная часть Варенцова моря к востоку от п-ова Канина, в районе о. Кол-
гуева и к востоку от него до Югорского Шара, Печорская губа, южная
часть Карского моря (Байдарацкая и Карская губы), северная часть
Обской губы. Заходит в низовья рек (Индиги, Пеши, Камбальницы).
Нерест в Мезенском зал., отчасти у восточных берегов п-ова Канина,
в ряде мест, главным образом в предустьевых пространствах рек Чёш-
ской губы и к востоку от нее (м. Русский Заворот), в Югорском Шаре,
в Карской губе и северной части Обской.
Биология. Нерест в Чёшской губе и прилегающей части побе-
режья к востоку происходит с мая по середину июля с максимумом в июне
(Рыженко, 1938), у м. Русский Заворот — в июне (Васильев и Борода-
това, 1930), в Югорском Шаре и Карской губе — в начале и во второй
половине июля, в первой половине августа 1 и в начале и даже середине
сентября (Макушок, 1935; Юдкин, 1948), в северной части Обской губы —
во второй половине августа (Галкин, 1940), в Мезенском зал. — с конца
апреля до середины июля, разгар с конца мая до середины июня (Там-
бовцев, 1947). Нерест довольно продолжителен — в Чёшской губе длится
около 3 месяцев, в 1938 г. с конца апреля почти до конца июля. Икромета-
ние происходит в зоне приливов и отливов, на каменистых песчаных грунтах
с подводной растительностью при температуре 7.4° в начале и до 15“
в конце июня в восточной части Чёшской губы (Рыженко, 1938, 1939);
в Мезенском зал. от 3 до 15°, разгар — от 6 до 12°, на глубине от 8—15 см
до 2—3 м (Тамбовцев, 1947). Плодовитость обской сельди от 10 до 23,
в среднем 16.5 тыс. икринок (Галкин, 1940), чёшской — от 13 до 50 тыс.,
у шестигодовалых сельдей Мезенского зал. — от 14.9 до 33.7 тыс., у
семигодовалых — от 19.7 до 53.6, в среднем 28.5 тыс. икринок (Тамбов-
цев, 1947). В естественных условиях при температуре от 3.8 до 12.6“
личинки выходят из икры через 14 суток после оплодотворения. Личинки
держатся в прибрежной области, подрастающие личинки ловились в от-
крытых частях Чёшской губы и прилегающих участков моря. В Чёшской
губе и прилегающих частях побережья к востоку весной с распалением
льда в конце апреля или начале мая происходит одновременный подход
к берегам для нереста. В 1938 г. в начале нерестовых подходов подошла
крупная, шести-семигодовалая сельдь с незначительной примесью более
мелкой, количество которой в дальнейшем увеличилось, и со второй
половины мая до конца икрометания составляло основную массу нере-
стующей сельди. После нереста сельдь от берегов отходит и широко рас-
пространяется в открытых частях моря даже за пределами Чёшской
губы, где держится в разреженном состоянии на довольно большом про-
странстве, встречаясь в то же время летом и осенью в устьях рек и в губах.
В открытых частях моря в августе и сентябре сельдь усиленно откармли-
вается, причем желудки неоднократно оказывались набитыми песчанкой
1 В Карской губе сельдь с текучими половыми продуктами обнаружена в конце
августа (Пробатов, 1934).
166
CLUPEIDAE
(Рыженко, 1938, 1939). В 1932 г. с первой декады июля по середину ав-
густа вместе с неполовозрелой атлантической сельдью с приливами захо-
дила в низовья рек (Кия, Шойна, Торна) западного побережья п-ова
Канина, составляя незначительную часть в уловах (Макушок, 1933).
Питается ракообразными и молодью рыб. В Колгуевском районе в ав-
густе—начале сентября 1935 г. основной пищей являлись Euphausiidae
(74.6%) и отчасти Temora longicornis (10.9%), Calanus finmarchicus (7.3%)
и мальки рыб (4.2%). В сентябре 1936 г. основной пищей были мальки
рыб и отчасти Temora, в сентябре 1938 г. — почти исключительно
ракообразные {Т. longicornis, Mysis mixta и М. oculata). В октябре 1933 г.
основу питания составляла Temora с примесью М. mixta (Болдовский,
1941). Половой зрелости в Чешской губе и в прилегающих частях побе-
режья к востоку достигает на четвертом году жизни (Рыженко, 1938),
в северной части Обской губы — повидимому, в возрасте около 5 лет
(Галкин, 1940). Рост в разных частях ареала происходит следующим
образом (Макушок, 1938; Тамбовцев, 1947; средние размеры возрастных
групп, см):
Возраст..........1 2 3 4 5 6 7 8 9 10 11 12
Мезенские .... — — 14.0 18.9 20.5 21.4 22.7 23.8 25.3 _ _ —
Чёшские.......... 8.6 12.5 16.4 18.2 20.4 21.9 23.8 24.1 25.7 26.5 27.1 —
Печорские .... 7.8 12.1 16.0 19.8 21.3 22.8 24.2 25.5 26.8 27.7 28.5 —
Карские.......... 10.3 12.4 16.8 19.2 21.0 23.1 25.2 26.1 26.9 28.1 28.4 28.6
Сельди из восточных частей ареала растут несколько быстрее, чем
из западных. В Чешской губе и в районе о. Колгуева в уловах встре-
чаются сельди в возрасте от 0 до 11-годовалых. Нерестующая сельдь
в 1937 г. состояла из рыб в возрасте от 3+ до 8+ лет, причем преобладали
шестигодовалые (5+) (Рыженко, 1938, 1939). В Югорском Шаре и Кар-
ской губе преобладали пяти-девятигодовалые, причем встречались
сельди до 12-годовалого возраста включительно (Макушок, 1935). В север-
ной части Обской губы в наибольшем количестве ловились пяти- и шести-
годовалые (4+ и 5-}-), встречались от трех- до семигодовалых (Галкин,
1940). В Мезенской губе, по наблюдениям за 5 лет, возрастной состав
был таков: трехгодовалые — 0.02%, четырехгодовалые — 11.30%,
пятигодовалые — 24.97%, шестигодовалые — 30.10%, семигодовалые —
27.30%, восьмигодовалые — 3.71%, девятигодовалые—1.70%, десяти-
годовалые— 0.88%, 11-годовалые — 0.02% (Тамбовцев, 1947).
Хозяйственное значение небольшое. В Чешской губе
в 1937—1939 гг. добывалось 1.5—5.6 тыс. ц. Уловы могут быть увеличены,
так как запасы недоиспользуются. Ловится в период нерестовых скопле-
ний у берегов весной в апреле—июне и -во время летних подходов для
нагула в губы и предустьевые пространства в июле—сентябре.
4. Род HARENGULA VALENCIENNES
Harengula Valenciennes, in: Cuvier et Valenciennes, Hist,
nat. poiss., XX, 1847 : 277 (тип: H. latulus 1 Vai. 1847=CZu/>e<z macrophthalma Ran-
zani, 1842 =H. clupeola Cuv. 1829). — Clupeonia Valanciennes, 1. c. : 345
(тип: C. iussieui Val.=C. vittata Vai.=77. vittata).— Harengula Regan, Ann.
Mag. Nat. Hist. (8), XIX, 1917 : 386 (обзор видов). — Wilkesina Fowler a. Bean,
Proc. U. S. Nat., Mus., 63, 1923 : 3 (подрод, тип: H. fijiense Fowler et Bean,
1923). — Herkotsella Fowler, Proc. Acad. Nat. Sci. Phila., LXXXV, 1930:246
1 H. latulus указана Валенсьеном от берегов Европы. См. об этом у Ригэна
(Regan, 1917с : 388) и Сторей (Storey, 1938 : 36).
4. HARENGULA
167
(подрод, тип: Н. displonotus Bleeker, 1852). —Harengula S t о r e y, Stanf. Ichth. Bull.,
I, 1, 1938 : 15 (обзор вест-индских видов).1
По отсутствию медиальной вырезки в верхней челюсти, удлиненных
чешуй (ala) при основании лопастей хвостового плавника и радиальных
бороздок на крышечной кости близок к Sprattus и Clupea. Глаза спереди
и особенно сзади прикрыты сравнительно хорошо развитыми веками.
Последние два луча анального плавника слегка удлинены, не образуя
значительно выдающейся лопасти (рис. 15). На вертикальной части клю-
чицы выдающийся в жаберную полость кожистый вырост с двумя закруг-
ленными лопастями, разделенными углублением (рис. 16). Брюшные
килевые чешуи сравнительно хорошо развитые на всем протяжении от
горла до начала анального плавника, брюхо сжатое с боков, с хорошо
выраженным килем. Рот небольшой: сочленение нижней челюсти с чере-
пом впереди вертикали заднего края глаза, задний конец верхнечелюст-
ной кости простирается за вертикаль переднего
достигает вертикали середины его, нижняя че-
люсть чаще слегка выдается вперед. Сошник без
зубов, слабые зубы есть на нижнечелюстных,
межчелюстных, нёбных костях, мезоптеригоиде
и на языке, верхнечелюстные кости иногда асо
края глаза, или почти
Рис. 16. Кожи-
стый вырост на
вертикальной
части ключицы
у Harengula zu-
nasi.
Рис. 15. Анальный плавник Haren-
gula zunasi.
слабым зубовидным нижним краем, как у Clupea. Жаберные ты-
чинки верхней части жаберной дуги почти не налегают на ты-
чинки нижней части дуги, тычинки довольно длинные и тонкие, 27—
70 на нижней части дуги. Отростки плавательного пузыря помещаются
в'ргооНсиш и pteroticum. Брюшные плавники позади начала спинного,
иногда под задней частью его. Основание спинного плавника в бороздке
из увеличенных чешуй, удлиненных у заднего конца плавника и налегаю-
щих на большую часть последних лучей. Бороздки на чешуях имеют
поперечное направление, сплошные, не прерванные посредине. Позвон-
ков 40—44. Пятен на боках тела у большинства видов нет, у некоторых
есть по темному пятну за жаберной крышкой и у немногих по ряду не-
ясных пятен на боках тела. Небольшие рыбы, размерами до 200 мм.
Скелет.2 Bulla pterotica значительно крупнее, чем b. prootica.
В. prootica образует на черепе сбоку (табл. XXXII, А) сравнительно
1 В качестве синонима этого же рода следует, повидимому, рассматривать Escua-
losa Whitley (Austr. Zool., v. 9, 4, 1940 : 402, f. 8—9; тип: Clupea macrolepis
Steind). Поперечные бороздки на чешуях у этого вида, как у видов Harengula, не
прерванные иос. редине. К сожалению, в диагнозе не указано, есть ли на вертикаль-
ной части ключицы кожистый вырост.
g * Фотографии черепа Н. punctata (=Cl. mizun) см. у Кишинуйе (Kishinouye,
168
CLUPEIDAE
большое выпуклое вздутие; вздутие b. pterotica сбоку черепа небольшое,
значительно большее, почти такое же, как на prooticum, сверху у осно-
вания fossa praeepiotica. Каждый отросток плавательного пузыря входит
в череп через отверстие в передней части occipitale laterale между отвер-
стиями n. vagus и fenestra auditiva, часть occipitale laterale, расположен-
ная между этими отверстиями, узкая, с продольным углублением для
отростка плавательного пузыря. Fenestra auditiva большая, продолгова-
тая, овальной формы, более широкая спереди, передний конец ее почти
соприкасается с bulla prootica, задний отделен от отверстия n. vagus не-
большим промежутком. Fossa praeepiotica небольшая, сравнительно
высокая, с прямым нижним краем и более или менее закругленными
боковыми и верхними. Foramen temporale большое, длина его значительно
превосходит длину fossa praeepiotica, наиболее высокое в задней части.
Сочленовная поверхность дляЬуотапй1Ьи1аге на sphenoticum и pteroticum
продолговатая, не разделенная на две обособленные части, передний край
ее простирается на отросток переднего конца sphenoticum, отходящий
перпендикулярно продольной оси черепа. Парасфеноид изогнут под сере-
диной черепа, более высокий и сжатый с боков над изгибом, задние крылья
его не выдаются вниз под мио домом, постепенно суживается позади черепа.
Нисходящего отростка базисфеноида нет.1 Задний край supraoccipitale
и epioticum с каждой стороны на черепе сверху (5) расходятся под тупым
углом. Pteroticum оканчивается сзади небольшим, загнутым слегка вниз
шипом. Передний конец каждого sphenoticum отходит в стороны в виде
треугольника. Оба крыла ethmoidalia lateralia выдаются из-под перед-
него конца лобных костей в стороны, слегка направлены вперед. Попереч-
ные отростки, мезэтмоида отходят в стороны, не суживаются и не заост-
рены на концах. Череп широкий, наибольшая ширина его между краями
каждого pteroticum около двух раз, ширина лобных костей впереди
sphenoticum около трех раз в его длине. Сошник на черепе снизу (В)
слегка выпуклый, с продолговатым, невысоким и сравнительно широким,
закругленным гребнем, передняя часть парасфеноида плоская, тонкая,
крылья парасфеноида разделяются под передней частью prooticum.
Opisthoticum сзади с коротким тупым отростком. Углубление fossa tem-
poralis posterior с каждой стороны на черепе сзади (Г) едва развитое,
расположено в месте соединения epioticum и occipitale laterale. Fossa
sudtemporalis над отростком opisthoticum не развита. Hyomandibulare
сверху с одной головкой для сочленения с черепом, не разделенной на
две обособленных. Quadratum треугольной формы, без выемки в верхнем
крае. Нижнечелюстная кость короткая и высокая, сочленовная много
шире нижнечелюстной, высокая. Предкрышечная и крышечная кости
довольно узкие, одинаковой ширины. Описание сделано по одному ске-
лету Н. zunasi и фотографии черепа Н. punctata.
Морские рыбы, один вид пресноводный.
Около 19 видов 1 2 в тропических частях Тихого, Индийского океанов
и в западной части Атлантического океана. Род в основном индо-паци-
фический, значительное количество видов свойственно прилегающим частям
Тихого и Индийского океанов, 4 вида в западной части Атлантического
океана (у берегов Америки) и 2 вида в восточной части Тихого (у берегов
Америки), 1 тихоокеанский встречается в западной части Индийского
1 Если он не обломан.
2 Обзор видов рода см. у Ригэна (1917с), вест-индских — у Сторей (1938), индо-
малайских — у Фаулера (1941).
4. HARENGULA
169-
океана (у берегов Африки); в восточной части Атлантического океана'
(у берегов Европы и Африки) отсутствует. В наших водах один вид.
*1. Harengula zunasi Bleeker — Зунаси (табл. V).
Clupea kowal (non Riipp.) Schlegel, in: Temminck et Schlegel,.
Fauna Jap., Pisces, 1846 : 235 (nomen praeoccup.). — Harengula zunasi Bleeker,.
Verb. Bat. Gen., XXVI, 1854 : 117 (Нагасаки). — Clupea kowal (non Rupp.) G u n-
t h e r, Cat. fish., VII, 1868:450 (частью: Китай). — Clupea zunasi Gunther,
1. c. : 451 (Япония); Heincke, Naturgesch. d. Herings, I, 1898 : 194, Tab. CXCII
(измерения 30 экз.). — Sardinella zunasi Jordan a. Snyder, Proc. U. S. Nat.
Mus., XXIII, 1900 : 349 (Токио). — Harengula zunasi Jordan a. Herre, ibid.,
XXXI, 1906 : 634 (Токио, Ономичи, Томакомай, Вак ноура, Нагасаки, Цуруга);:
Regan, Ann. Mag. Nat. Mus. (8), XIX, 1917 : 392 (Япония,‘Амой); Fowler,.
U. b. Nat. Mus., Bull. 100, v. 13, 1941 : 597 (Филл.(пинские о-ва, Китай, Япония,
Корея).
Распространение, биология. Martens, Preuss. Exped. Ost-
Asien, I, 1876 : 405 (Иокогама, Манила, Сингапур, о-ва Батджан); Jordan а,
S ,t a r k s, Proc. U. S. Nat. Mus., XXVIII, 1905 : 193 (Вонсан); ibid., XXXI, 1906 :
5'15 (Порт-Артур); Kishinouye, Journ. Imp. Fish. Bureau, Tokyo, XIV, 1907 :
98, t. XX, f. 4 (берега Японии и Кореи); Franz, Abh. math.-phys. KI. Bayer. Akad.
Wiss., IV, Suppl.-Bd. 1, 1910 : 5 (зал. Сагами); Jordan, Tanaka a. Sny-
der, Cat. fish. Japan, 1913 : 30 (южная Япония, Корея); Jordan a. Metz,
Mem. Carnegie Mus., VI, 1, (1913), 1914: (Нампхо, Пусан); Павленко,
Мат. позн. русск. рыбол., III, 10, 1914 : 145; Берг, Ежегодн. Зоолог, муз. Акад.
Наук, XIX, 4 (1914), 1915:554 (зал. Петра Вел., 27 VI 1913); Jordan
а. Н u b b s, Mem. Carnegie Mus., X, 2, 1925 : 121 (Токио, Сидзуока, Кагосима,
Микава, Фукуока, Фукуи, Мисак ); Солдатов и Линдберг, Обзор рыб'
дальневост, морей, 1930 : 40 (зал. Петра Вел.); Шмидт и Линдберг, Изв.
АН СССР, отд. мат. и ест. наук, 1930 : 1137 (Цуруга); Шмидт, Тр. Тихо-
океанск. комит. АН СССР, II, 1931 : 19 (Нагасаки); Mori a. Uchida, Journ.
Chosen Nat. Hist. Soc., 19, 1934 : 4 (Вонсан, Пусан); Fowler, List fish. Malaya,
1938 : 27 (Сингапур); Румянцев, Зоолог, журн., XXVI, 1, 1947 : 47 (зал. Петра
Великого); Chen, Quart. Journ. Taiwan Mus., 1, 2, 1948:2 (о-ва Пескадорес).-
D III—IV 13—16 (14.4), общим числом 17—20 (18.4), A III—IV 14—
18 (15.4), общим числом 17—21 (18.7), V I 7, sp. br. 68—80 (75.8), на ниж-
ней половине жаберной дуги 47—59 (51.5), vert. S. 43—45 (43.94), caud.
vert. 28—31 (29.76). Килевых чешуй 17—18+12—14 (17.8+13.9), общим,
числом 30—32 (31.1). Голова сравнительно небольшая и широкая, длина
ее 18.0—19.8 (19.3)% длины тела, межглазничный промежуток 21.0—
25.1 (23.5)% длины головы. Глаза небольшие, 25.6—30.9 (27.5)% длины,
головы. Тело сравнительно невысокое, наибольшая высота 20.9—23.1
(22.4)%, высота головы у затылка 17.0—19.1 (17.8)% длины его. Спина
темнозеленая, бока серебристые. Концы лопасти хвостового плавника
не черноватые, одной окраски с основанием. Пятен на боках тела и пятна
за жаберной крышкой сверху нет. Длина до 160 мм и более, обычно
меньше. Описание дано по 15 экз. длиной от 106 до 161, в среднем:
135.4 мм, из зал. Петра Великого, от берегов Японии и Китая. По иссле-
дованиям Гейнке (Heincke, 1898), позвонков 43—45 (43.5), килевых чешуй.
(15) 17—19+12—15 (18.0+13.2).
Распространение. Западная часть Тихого океана и приле-
гающие моря у берегов южной Японии, южного Приморья, Кореи, Китая,.
Индокитая, Филиппинских о-вов и Индо-малайского архипелага. На
север вдоль восточных берегов Японии до Хоккайдо (Томакомай), в Япон-
ском море до Фукуи и зал. Петра Великого. Желтое море (Порт-Артур,.
Нампхо), Восточно-китайское (Нагасаки) и Южно-китайское (Амой,
Сингапур) и моря Индо-малайского архипелага (о-ва Батджан) Филип-
пинских о-вов (Манила).
170
CLUPEIDAE
Биология не изучена. В наших водах (зал. Петра Великого)
впервые констатирована в 1913 г. и встречалась до 1938 г., после чего
в период времени до 1945 г. в связи с похолоданием, наряду с некоторыми
другими теплолюбивыми рыбами, исчезла (Румянцев, 1947). Обычна
у южных берегов Японии и Кореи, особенно в заливах и внутренних
морях.
Хозяйственное значение небольшое и статистикой про-
мысла обычно не учитывается. У берегов Кореи в 1935—1942 гг. уловы
колебались от 1380 до 6240 ц. В наших водах промыслового значения не
имеет.
5. Род SARDINELLA VALENCIENNES
Sardinella Valenciennes, in: Cuvier et Valenciennes, Hist,
nat. poiss., XX, 1847 : 263 (тип: A. aurita Vai.). — Ambligaster Bleeker, Journ. Ind.
Arch., Ill, 1849 : 70 (тип: A. clupeoides В1кг.=«5. clupeoides). —Sardinia1 P о e y,
Mem. hist. nat. Cuba, II, i860 : 31'1 (тип: A. pseudo~h.ispa.nica Poey). — Sardinella
Regan, Ann. Mag. Nat. Hist. (8), XIX, 1917 : 377 (обзор видов).—Fiscina
Whitley, Austr. Zool., v. 9, 4, 1940 : 400 (тип: A. posterus Whitley = A. poste-
rus). —Fimbriclupea Whitley, 1. c. : 399 (тип: F. dactylolepis Whitley).
Верхняя челюсть без заметной медиальной вырезки. На глазах срав-
нительно хорошо развитые жировые веки. При
плавника на обоих лопастях по удлиненной
чешуе (ala, рис. 12). Последние два луча аналь-
ного плавника сильно удлиненные, образуют
выдающуюся лопасть (рис. 17). На вертикаль-
ной части ключицы как у Harengula выдаю-
основании хвостового
Рис. 18. Кожи-
стый вырост на
вертикальной
части ключицы
у Sardinella
aurita.
Рис. 17. Анальный плавник Sardinella
aurita.
щийся в жаберную полость кожистый вырост с двумя закруглен-
ными лопастями и углублением между ними (рис. 18). На крышечной
кости радиальных бороздок нет. Брюшные килевые чешуи сравнительно
хорошо развитые, брюхо сжатое с боков, с хорошо выраженным килем
или слегка закругленное. Рот конечный, небольшой: сочленение нижней
челюсти с черепом не далее вертикали середины глаза или под передним
краем его, задний конец верхнечелюстной кости заходит за вертикаль
переднего края глаза, иногда почти достигая вертикали середины его,
реже не доходит до вертикали переднего края глаза. Сошник без зубов,
на нижнечелюстных, межчелюстных и верхнечелюстных костях также
нет, слабые зубы есть на нёбных костях и на языке. Жаберные тычинки
верхней части дуги не налегают снаружи на тычинки нижней части ее,
1 Тип Sardinia есть синоним A. aurita. Следовательно, и Sardinia предположи-
тельно следует считать синонимом Sardinella.
5. SARDINELLA
171
тычинки тонкие, удлиненные, от 38 до 250 на нижней части дуги (рис. 19).
Отростки плавательного пузыря помещаются в prooticum и pteroticum.
Брюшные плавники позади начала спинного. Основание спинного плав-
ника в бороздке из увеличенных чешуй, удлиненных у заднего конца
плавника и почти прикрывающих последние лучи. Поперечные бороздки
на чешуях с боков тела посредине прерваны. Позвонков 44—49. Пятен
на теле обычно нет, за исключением темного пятна у некоторых за жабер-
ной крышкой. Рыбы небольших и средних размеров, до 300 мм, наичаще
100—200 мм.
Скелет.1 Bulla pterotica значительно меньше, чем b. prootica.
В. prootica снаружи с каждой стороны на черепе сбоку (табл. XXXIII, А)
образует едва заметное вздутие, слегка лишь возвышающееся над
Рис. 19. 1-я жаберная дуга Sardinella aurita. Длина тела 216 мм.
поверхностью этой кости; b. pterotica имеет вздутие лишь сверху черепа
под передней частью fossa praeepiotica. Каждый отросток плаватель-
ного пузыря помещается в продольном углублении на occipitale laterale,
идущем вдоль переднего края от основания этой кости вверх, проходит
в череп через отверстие, расположенное в верхнем конце углубления
на 1/з от границы с opisthoticum; далее расположен в костном канале.
Fenestra auditiva довольно значительных размеров, неправильной оваль-
ной формы, передний край ее далеко отстоит от вздутия на prooticum,
задний — от отверстия n. vagus. Fossa praeepiotica небольшая, невы-
сокая, неправильной овальной формы. Foramen temporale большое,
значительно больше в длину, чем fossa praeepiotica, более высокое в зад-
ней части. Поверхность для причленения hyomandibulare на sphenoticum
и pteroticum не разделена на две части, немного лишь сужена на границе
обеих костей. Сошник плоский, его нижний край и передняя часть пара-
1 Фотографии черепов б”, aurita (=Cl. immaculata) и S. clupeoides (=01. okina-
wensis) см. у Китаинуйе (Kishinouye, 1907, pl. XXII, f. 4—5).
172
CLUPEIDAE
сфеноида образуют равномерно изогнутую линию, с изгибом у начала
крыльев парасфеноида, которые слегка выдаются вниз под миодомом
и менее изогнутые, у некоторых (S. clupeoides') прямые; задний конец
крыльев парасфеноида менее широкий, заостренный, передняя часть
парасфеноида сжатая с боков, более высокая посредине. Нисходящий
отросток базисфеноида тонкий и длинный, почти достигает снизу пара-
сфеноид. Задний край supraoccipitale и каждого epioticum на черепе
сверху (Б) расходится от середины под тупым углом. Pteroticum окан-
чивается длинным, слегка изогнутым, широким при основании шипом.
Передний конец каждого sphenoticum отходит в сторону в форме треуголь-
ника. Из-под переднего конца лобных костей с каждой стороны выдается
заднее крыло ethmoidale laterale. Поперечные отростки мезэтмоида за-
кругленные, заостренные на концах, направлены немного вперед. Череп
широкий, наибольшая ширина его между наружным краем каждого
pteroticum около двух раз, ширина лобных костей впереди отростка
sphenoticum около ЗЙ> раз в длине черепа. Сошник на черепе снизу (В)
плоский, без гребня на головке, передняя часть парасфеноида вогнутая,
суживающаяся назад, наиболее широкая впереди заднего конца сош-
ника; крылья парасфеноида расходятся под серединой prooticum, тесно
прилегают друг к другу спереди. Opisthoticum сзади удлинено в виде
довольно длинного тупого на конце отростка, видного с каждой стороны
черепа сзади при взгляде на него и сверху внутри от шипа pteroticum.
В нижней части epioticum и верхней части occipitale laterale с каждой
стороны сзади черепа (Г) по глубокой ямке fossa temporalis posterior,
кнаружи и несколько ниже нее над каждым отростком opisthoticum
небольшая и глубокая ямка fossa subtemporalis. На hyomandibulare
одна продолговатая сочленовная головка, не разделенная на две, слегка
лишь суженная посредине. Quadratum треугольной формы, без выемки
в верхнем крае. Нижнечелюстная кость высокая, сочленовная — удли-
ненная и низкая, немного длиннее нижнечелюстной. Крышечная кость
узкая, почти одинаковая в наиболее широкой верхней части с широкой
предкрышечной. Описание сделано по одному скелету A. aurita и фото-
графии черепа S. clupeoides.
Морские рыбы.
Около 16 видов 1 в тропических, реже в субтропических частях Индий-
ского, Атлантического океанов и в западной части Тихого и в смежных
с ними морях. Род в основном индо-пацифический, большинство'
видов свойственно Индийскому океану и прилегающим частям Тихого,
несколько видов встречается в восточной части Атлантического океана
(у берегов Африки и южной Европы), в восточной части Тихого океана
(у берегов Америки) отсутствуют, в западной части Атлантического
океана у берегов Америки один вид (S. aurita, встречающийся по всему
ареалу рода, за исключением Индийского океана, где отсутствует).
В наших водах один вид.
*1. Sardinella aurita Valenciennes (табл. V).
? Clupea caeruleo-vittata Richardson, Rept. ichth. China Japan, 1846 : 305
(Кантон). — Sardinella aurita Valenciennes, in: Cuvier et Valenci-
ennes, Hist. nat. poiss., XX, 1847 : 263, pl. 594 (Средиземное м. у Мессины, Гре-
ции). — Sardinella anchovia Valenciennes, 1. с. : 269 (Рио де Жанейро). —
1 Обзор видов рода см. у Ригэна (1917с); описание двух новых видов см. у Роксаса
(Roxas, Philipp. Journ. Sci., 55, 1934 : 275) и Уайтли (Whitley, Rec. Austr. Mus.,
XVIII, 4, 1931 : 144).
5. SARDINELLA
173
Meletta mediterranea Valenciennes, 1. c. : 369 (Средиземное м. у Тулона,
Марселя). — Sardinella, lemuru В 1 е е к е г, Nat. Tijdschr. Ned. Ind., IV, 1853 : 500
<Б .тавия). — Sardinia pseudo-hispanica P о e у, Mem. hist. nat. Cuba, II, i860 : 311
(Куба).1 — Clupea aurita Gunther, Cat. fish., VII, 1868 : 420 (Средиземное м.). —
Clupea anchovia G ii n t h e'r, 1. c. : 421 (атлантические берега тропической Аме-
рики).— Clupea melanosticta (non Schl.) Gunther, 1. c. : 430 (частью: Китай;
2 экз.). — Clupea brasiliensis Steindachner, Sitzungsber. Akad. Wiss Wien,
math.-naturw. Cl., LXXX, 1880 : 182 (Рио де Жанейро). — Clupanodon pseu ohlspani-
cus Jordan a. Everman n, Fish. N. a. M. Amer., I, 1896 : 423 (Мексиканский
зал., на север до м. Код). — S ardinella anchovia Jordan a. Everman n, 1. с. :
429 (от о. Мартиника до Бразилии). — Sardinella euxina A n t i р a. Denkschr. Akad.
Wiss. Wien, math.-naturw. KI., LXXVIII, (1905), 1906 : 46, t. L, t. Ill, f. 12 (Черноем.
у Констанцы). — Clupea immaculata Kishinouye, Journ. Imp. Fish. Bureau,
Tokyo, XIV, 3,1907 : 96, t. XIX, f. 1 (Кю-сю: Сага; Китай: Амой, Сватоу). — Clupea
longiceps Weber a. Beaufort, Fish. Indo-Austr. Archipel., II, 1913 : 82 (Ява,
прол. Бали, Брит. Индия). — Sardinella aurita Regan, Ann. Mag. Hist. (8), XIX,
1917 : 378 (Гавана, Тринидад, Рио де Жанейро, Алжир, Ява, Китай); Fowler,
Mar. fish. West Africa, I, 1936 : 163 (Бразилия, Адриатическое м., Средиземное м.,
описание). — Sardinella allecia Fowler, U. S. Nat. Mus., Bull. 100, v. 13,
1941 : 602.1 2
Распространение, биология. Vinciguerra, Atti Soc. Ital.
Sci. Nat., XXXIV, 1892 : 331 (Гран Канария); Pellegrin, Act. Soc. Linn. Bor-
deau, LXII, 1907 : 80, f. 2 (Дакар); Bull. Soc. Zool. France, XXXVII, 1912 : 291
(Ангола); 1. с., XXXVIII, 1913 : 116 (западные берега Африки); Ann. Inst, oceanogr.,
VI, 4, 1914 : 13 (Дакар, Ангола); Fowler, Proc. U. S. Nat. Mus., LVI,
1919 : 208 (Зеленый Мыс, Ангола: Лоанда); Fage, Rept. Danish Oceanogr. Exped.
1908—1910, 6, II (Biology), A. 9, 1920 : 117 (Средиземное м.; нерест, личинки);
Fowler, Proc. Acad. Nat. Sci. Phila., LXXV, 1923 : 33 (Мадейра: зал. Фуншаль);
De В u e n, Cat. peces Iberico, 1935 : 43, f. 12 (Средиземное м. у берегов Пиреней-
ского п-ова, Атлантический о. у входа в Гибралтарский прол.); Н е г г е, Copeia,
1945, 3 : 146 (Филиппинские о-ва); Майорова, Природа, 1951, 5 : 67 (Батум-
ская б.; октябрь 1937 г., 10 экз.).
D III—IV 14—16 (15.1), общим числом 17—20 (18.5), А III 13—15
(14.1), общим числом 16—18 (17.1), V I 8, sp. br. 201—228 (211.1), на
нижней половине жаберной дуги 115—133 (125.2), килевых чешуй 17—
20+14—16 (18.8+15.1), vert. S. 46—49 (48.30), caud. vert. 31—32 (31.75).
Жаберные тычинки тонкие и нежные, слегка превосходят длину жабер-
ных лепестков. Килевые чешуйки заостренные. Голова сравнительно
небольшая и широкая, длина ее 18.5—19.6 (19.0)% длины тела, межглаз-
ничный промежуток 18.3—21.0 (20.0)% длины головы. Грудные плав-
ники 12.6—13.9 (13.3)% длины тела. Тело низкое, наибольшая высота
17.0—18.6 (17.9)% длины его, высота головы у затылка 13.0—13.9 (13.6)%
той же длины. Верхняя челюсть не достигает середины глаза, оканчи-
вается под его передней третью. Брюшные плавники расположены под
серединой или позади середины спинного. За жаберной крышкой сверху
темное пятно. Длина до 280 и даже 300 мм, обычно меньше, 200—220 мм.
Описание дано по 10 экз. длиной от 208 до 259, в среднем 227.6 мм, пой-
манным 24—25 X 1937 (10 экз.) в Батумской бухте. По исследованиям
1 Хубс (Hubbs, Proc. Calif. Acad. Sci., XVIII, 11, 1929 : 263) установил,
что экземпляр Sardinia pseudo-hispanica Poey (хранится в США, Mus. Comp.
Zool.), предположительно принимаемый за тип этого вида, на самом деле не соот-
ветствует описанию (он меньше, число позвонков у него 51, по описанию 46). Хубс
полагает, что этот экземпляр есть калифорнийская сардина с неверной этикеткой
или по меньшей мере относится к одному роду. Что касается A. pseudo-hispanica Роеу,
то он полагает, судя по описанию, что это есть Sardinella anchovia Уа1.=А. aurita.
То же самое он считает и относительно Clupanodon pseudohispanicus Jord. a. Everm.
2 Фаулер восстанавливает название этого вида, данное ему Рафинеском (Clupea
allecia Rafinesque, Garatteri etc., 1810), чего ни в коем случае нельзя допускать.
Замена общеизвестного названия другим, хотя бы и согласно правилам приоритета,
ничего кроме неудобства и затруднений дать не может.
174
CLUPEIDAE
' 90
Фажа (Fage, 1920), у
экземпляров из Сре-
диземного моря поз-
вонков 47—49 (48.2).
Распростра-
нение. Атлантиче-
ский океан по обе
стороны и западная
часть Тихого океана
и прилегающие моря.
У берегов Америки
от м. Код до Рио де
Жанейро, у берегов
Европы к югу от Гиб-
ралтарского прол, до
Анголы у берегов.
Африки. Средиземное
море у берегов Ев-
ропы, у берегов Аф-
§ рики до Ливии, *се-
е верная часть Крас-
? ного моря (29°22г—
29°25' с. in., 32°38'
е в. д.), Адриатическое,
Эгейское моря и юж-
g ная часть Черного
g моря (у Батуми [и
а Констанцы). В Тихом
g океане к югу от о.
g< Кю-сю (Сага, Амой,
Й Сватоу) до Явы. Вво-
04 сточной части Тихого
о океана отсутствует,
в Индийском океане
н близкий вид.1 Нерест
в Средиземном море
наблюдался у берегов
Алжира, Пиреней-
ского п-ова, Сици-
лии, южной части
Апеннинского и Бал-
1 5. longiceps Vai.,
отличающийся большим
количеством жаберных
тычинок (180—250 на
нижней половине жабер-
ной дуги), меньшими
размерами глаз. Биоло-
гия этого вида — см. :
J. Hornell a. N а-
у u d i, Madras Fish.
Dept., 17, 1924 : 129—
187).
6. SARDINOPS
176-
канского п-овов и Малой Азии и, вероятно, происходит у берегов Ли-
вии (рис. 20).
Биология изучена слабо.. В Средиземном море икрометание
происходит летом, с середины июня по конец сентября. Нерест и разви-
тие икринок и личинок происходит в поверхностных слоях воды, до 25 м
при высокой температуре воды, в среднем около 22°, и высокой соле-
ности, в среднем около 38%о. Половой зрелости достигает при длине
12 (<5)—13.5 (j) см в возрасте, повидимому, около двух лет (Fage, 1920).
В Черном море был пойман 1 экз. длиной 161 мм в июле 1905 г. у Кон-
станцы (Antipa, 1906), 10 экз. в Батумской бухте в октябре 1937 г., раз-
меры их 192—232, в среднем 238 мм, стадия зрелости II (Майорова, 1951).
Нерест в Черном море не констатирован 1 и, повидимому, вследствие
низкой температуры воды и слабой солености происходить не может.2
Хозяйственного значения в наших водах не имеет,
так как встречается единичными экземплярами. У берегов Алжира
местами ловится круглый год, уловы на протяжении 1895—1914 гг,.
колебались от 3 до 14, в среднем около 6 тыс. ц, составляя основную массу
общего улова. У берегов Туниса ловится также почти круглый год, уловы
в 1892—1906 гг. колебались от 0.34 до 9, в среднем составляли около'
1 тыс. ц; в настоящее время уловы здесь достигают 13—15 тыс. ц. Имеет
существенное значение в уловах у берегов Греции.
6. Род SARDINOPS HUBBS
Sardinops Hubbs, Proc. Calif. Acad. Sci., XVIII, 11, 1929 : 264 (тип: Meletta cae-
rulea Girard = S. sagax caerulea).
По отсутствию заметной медиальной вырезки в верхней челюсти и
по наличию удлиненных чешуй (ala) при основании хвостового плавника
и удлиненных последних лучей анального плавника (рис. 21) близок,
к Sardinella. Жировые веки обычно одинаково хорошо развиты сзади
и спереди глаз. На вертикальной части ключицы кожистого выроста нет.
На крышечной кости есть радиальные бороздки. Брюшные килевые че-
шуи сравнительно хорошо развитые, образуют явственный киль, брюхо
слегка закругленное. Рот конечный, нижняя челюсть не выдается вперед,
сравнительно большой: сочленение нижней челюсти с черепом за верти-
калью середины глаза, у крупных — под вертикалью заднего края его,
задний конец верхнечелюстной кости достигает или почти достигает ДО'
вертикали середины глаза, у крупных простирается несколько далее.
Сошник без зубов, челюстные и нёбные кости также без зубов, лишь
в задней части по нижнему. краю верхнечелюстной кости есть мелкие
зубчики. Жаберные тычинки нижней части жаберной дуги укорачиваются
к /углу дуги (рис. 22), тычинки верхней части дуги сильно налегают сна-
ружи на тычинки нижней части дуги, тычинки тонкие и длинные, до
100 на нижней части дуги. Отростки плавательного пузыря помещаются
в prooticum и pteroticum. Брюшные плавники позади начала спинного.
Основание спинного плавника в бороздке из чешуй, более крупных и
удлиненных в задней части плавника и прикрывающих последние лучи
его до вершины их. Чешуи на боках тела одинакового размера. Попереч-
ные бороздки на чешуях с боков тела немногочисленные, неясно выра-
1 В о д я н и ц к и й, Тр. Севастоп. биолог, ст., V, 1936 : 36.
* Однако в более ранней статье (Раб. Новоросс. биол. ст., I, 4, 1930 : 100,
рис. 1) описываются икринки, относимые В. А. Водяницким к роду Sardinella.
176
CLUPEIDAE
женные, прерванные посредине. На боках тела за жаберной крышкой
сверху по темному пятну и по ряду пятен позади него, ниже которого
у некоторых бывает еще 1—2 ряда из меньшего числа пятен. Икринки
пелагические, с жировой каплей и с большим околожелтковым про-
странством. Рыбы средних размеров, до 300 мм, иногда немного более.
Скелет.1 Bulla prootica меньше, чем b. pterotica. В. prootica сна-
ружи на черепе сбоку (табл. XXXIV, И) образует слабую, едва выдаю-
Рис. 21. Анальный плавник Sardinops sagax melano-
sticta.
щуюся над поверхно-
стью выпуклость; Ь.
pterotica имеет заметное
вздутие лишь сверху
под передней половиной
fossa praeepiotica, сбоку
на этой кости вздутие
едва заметно, иногда
отсутствует. Оба отро-
стка плавательного пу-
зыря с каждой стороны
расположены в продольном углублении вдоль переднего края occipi-
tale laterale и отчасти прикрыты сверху гребнем, отделяющим это
углубление от отверстия n. vagus; выше каждый отросток помещается
в костном канале, отверстие в который лежит впереди отверстия
п. vagus значительно ниже opisthoticum. Fenestra auditiva значитель-
ных размеров, узкая и длинная, спереди близко подходит к bulla proo-
tica, сзади к каналу, в
пузыря. Fossa praeepio-
tica небольшая, низкая.
Foramen temporale боль-
шое, более высокое и
длинное, чем fossa prae-
epiotica, наиболее высо-
кое сзади. Поверхность
для причленения hyo-
mandibulare сплошная,
не разделена на две ча-
сти на sphenoticum и
pteroticum. Нижний
край сошника и перед-
ней части парасфеноида
почти прямые, слегка
изогнутый лишь под
котором расположен отросток плавательного
Рис. 22. 1-я жаберная дуга б1 ardinops sagax melanosticta.
Длина тела 180 мм.
ethmoidalia lateralia, передняя часть парасфеноида сверху закруглен-
ная, крылья парасфеноида выдаются вниз под миодомом, прямые
снизу, суженные сзади черепа и заостренные на конце. Нисходя-
щий отросток базисфеноида тонкий и длинный, снизу почти достигает
парасфеноида. Задний край supraoccipitale и каждого epioticum на черепе
сверху (2>) образует тупой угол, близкий к прямому. От заднего конца
pteroticum отходит длинный и тонкий, слегка изогнутый шип, длина
которого значительно варьирует; сверху под ним второй шип, более ко-
роткий, с отверстием у основания сверху. Передний конец каждого
f.
1 Описание и рисунки скелета головы см. у Филипса (Phillips, 1942 : 463—500,
6. SABDINOPS ITt
sphenoticum в виде отростка, почти равного по ширине на всем протя-
жении и тупого на конце, направленного в стороны и немного вперед.
Передние и задние крылья ethmoidalia lateralia слегка выдаются в сто-
роны из-под переднего конца лобных костей, задние крылья суживаются
к концу, направлены в стороны, передние крылья обращены концами
в стороны. Поперечные отростки мезэтмоида направлены немного вперед,
не заостренные на концах. Череп довольно широкий, наибольшая ширина
его немного более двух раз, ширина лобных костей впереди sphenoticum
около 3 Уг—4 раз в его длине. Сошник и передняя часть парасфеноида
на черепе снизу (5) плоские, сошник с коротким и небольшим гребнем
на головке, закругленным сверху, парасфеноид сзади от сошника сужи-
вается, крылья парасфеноида разделяются под передней третью. pro-
oticum, тесно сближены впереди. Задний конец opisthoticum слегка удли-
нен в виде короткого, тупого на конце отростка. С каждой стороны на
черепе сзади (Г) в нижней части epioticum и верхней части occipitale
laterale располагаются fossae temporales posteriores, между основанием
отростка каждого opisthoticum и шипом каждого pteroticum распола-
гаются fossae subtemporales. Сочленовная головка на hyomandibulare
сверху одна, не обособлена на две части, расширенная спереди. Quad-
ratum с небольшой выемкой в верхней части, передний угол вытянут.
Нижнечелюстная кость невысокая, сочленовная кость удлиненная и
низкая, немного короче нижнечелюстной. Предкрышечная и крышеч-
ная кости широкие, последняя шире первой. Описание сделано по несколь-
ким скелетам Sardinops sagax melanosticta.
Морские рыбы.
Один1 вид в субтропических частях Тихого, Индийского и отчасти
Атлантического океанов у берегов Сев. и Южн. Америки, восточной
Азии, Новой Зеландии, южных берегов Австралии и южной оконечности
Африки (рис. 23).
*1. Sardinops sagax (Jenyns).
Clupea sagax J e n у n s, Zool. «Beagle», Fish., 1842 : 134 (Лима, о. Сан-Ло-
ренцо, Перу).
В отдельных изолированных частях обширного ареала распадается
на ряд подвидов: S. sagax sagax (Jenyns, 1842; тихоокеанские берега
Южн. Америки), S. sagax melanosticta (Schlegel, 1846; берега восточной
Азии), S. sagax ocellata (Poppe, 1853; берега южной Африки), 5. sagax
caerulea (Girard, 1854; тихоокеанские берега Сев. Америки), 5. sagax
neopilchardus (Steindachner, 1879; вокруг Новой Зеландии, у южных,
восточных и западных берегов Австралии и северных Тасмании). Все
эти формы рядом авторов признаются идентичными, за исключением
последней, или самостоятельными видами. Сравнительно-морфометри-
ческим изучением S. sagax melanosticta и S. sagax caerulea обнаружено
(Таранец, 1938), что между этими двумя формами имеются различия,
1 б1. dakini Whitley (Mem. Queensl. Mus., XI, 1937 : 114; известно 3 экз. от бере-
гов северной части Квинслэнда, Австралия), выделяемая позднее в подрод (Fusci-
clupea Whitley, Austr. Zool., v. 9, 4, 1940 : 401, f. 7), судя по всему, относится к роду
Sardinella, так как жаберные тычинки нижней части дуги у этого вида не налегают
на тычинки нижней части дуги, радиальные бороздки на крышечной кости отсутствуют
(они, как полагает автор описания, атрофированы или редуцированы до одной).
12 Фауна СССР —314
178
CLUPEIDAE
но незначительные, и поэтому их следует правильнее считать подвидами.
Приблизительно таковы же, судя по всему, различия и между осталь-
ными формами. Несколько более отличается лишь S. sagax neopilchar-
dus,1 но, судя по имеющимся данным, и эта форма, подобно другим, рез-
ких отличий от остальных не имеет. Поэтому все формы провизорно, до
детального сравнительного изучения их на большом материале, правиль-
нее всего считать подвидами.
Распространение. Тихий океан по обе стороны в северном
и южном полушариях, Индийский океан. У берегов восточной Азии от
Кантона, вокруг Японии, по обе стороны почти до северной оконечности
Сахалина, у берегов Сев. Америки от Калифорнии до м. Омманей (юго-
восточная Аляска), у берегов Южн. Америки, вокруг Новой Зеландии,
у Тасмании и южных берегов Австралии от Квинслэнда до западных бере-
гов, у южной оконечности Африки от бухты Столовой и Фольс до Наталя
(рис. 23).
В наших водах один подвид.
*la. Sardinops sagax melanosticta (Schlegel) — Япономорская сар-
дина, дальневосточная сардина, иваси (табл. VI).
Clupea melanosticta Schlegel, in: Temminck et Schlegel, Fauna
Jap., Pisces, 1846 : 237, t. CVII, f. 3 (берега Японии); G ii n t h e r, Cat. fish., VII,
1868 : 430 (Китай, Япония). — Clupea sagax (non Jenyns) G ii n t h e г, 1. c. : 430
(частью: Япония). — Clupanodon melanostictus Jordan a. Snyder, Proc.
U. S. Nat. Mus., XXIII, 1900 : 349 (Токио). — Clupea melanosticta Kishinouye,
Journ. Imp. Fish. Bureau, Tokyo, XIV, 3, 1907 : 71, 94, 97, t. XVlI, f. 1—2, t. XXI,
f. 1 (описание черепа, второй ряд пятен на теле). — Sardinella melanosticta J о г d a n
а. Н е г г е, Proc. U. S. Nat. Mus., XXXI, 1907 : 632 (Хакодате, Токио, Иокогама,
Цуруга, Аомори, Мисаки, Саме, Татейяма, зал. Матцусима, Ваканоура, Кобе, Оно-
мичи, Хаката, Нагасаки). — Ambligaster melanostictum Jordan, Tanaka
a. Snyder, Cat. fish. Japan, 1913:37 (берега Китая, Кореи, Японии, Отару,
Мисаки, Сагами). — Sardina sagax (non Jenyns) Regan, Ann. Mag. Hist. (8),
XVIII, 1916 : 13 (частью: Япония). — Sardinia melanosticta Jordan a. Hubbs,
Mem. Carnegie Mus., X, 2, 1925 : 121 (Мисаки, Микава, Нагоя, Токио, Тоба, Кусиро,
Такасима). — Ambligaster melanostictus Fowler, Proc. Acad. Nat. Sci. Phila.,
LXXXI, (1929), 1930 : 590 (Токио). — Sardinops melanosticta К а г а и о века я,
Рыбн. хоз. Дальн. Вост., XIII, I, 1935 :'38 (систематическая характеристика); Т а-
ранец, там же : 40 (сравнение с калифорнийской сардиной); К агановская,
Изв. Тихоокеанск. научно-исслед. инет. рыбн. хоз. и океаногр., XIV, 1938 : 45 (си-
стематическая характеристика). — Sardinops melanosticta melanosticta Таранец,
там же : 69 (сравнение с калифорнийской сардиной). — Arengus sagax (non Jenyns)
Fowler, U. S. Nat. Mus., Bull. 100, v. 13, 1941 : 622 (частью: Китай, Тайван,
Корея, Япония). — Sardinops sagax melanosticta Кагановский, в: Промысло-
вые рыбы СССР, 1949 : 79, табл. 19.
Распространение, биология. Сноу, Зап. Общ. изуч. Амурского
края, VIII, 1, 1902 : 50 (о. Кунашир — южный остров Курильской гряды); Franz,
Abh. Bayer. Akad. Wiss., IV, Suppl.-Bd. 1, 1910 : 5 (зал. Сагами, Абуратсубо,
Фукуура); Snyder, Proc. U. S. Nat. Mus., XLII, 1912 : 402 (Отару, Мороран,
Томакомай, Хакодате, Мисаки); Павленко, Мат. позн. русск. рыбол,, III, 10,
1914 : 145 (устье р. Тумень-ула); Берг, Ежегодн. Зоолог, муз. Акад. Наук, XIX,
4, (1914), 1915 : 555 (там же, 24 и 26 IX 1913); Jordan a. Hubbs, Mem. Car-
negie Mus., X, 2, 1915 : 121 (Мисаки, Микава, Нагоя, Токио, Тоба, Кусиро, Така-
сима); Солдатов и Линдберг, Обзор рыб дальневосточн. морей,М1930 : 38,
1 Regan, Ann. Mag. Nat. Hist. (8), XVIII, 1916 : 11—14; Thompson,
Fish. a. Game Comm. Calif., Fish. Bull. 11, 1926 : 8—17. Сведения по биологии, глав-,
ным образом по возрасту и росту, этой формы см.: Blackburn М. Age, rate
of growth, and general life-history of the Australian pilchard (Sardinops neopilchardus)
in New South Wales waters. Commonwealth Sci., Ind. Res. Org., Australia, Melb., Bull.
242, 1949 : 1—86, 8 pls.
Рис. 23. Распространение Sardinops sagax и Saraina pilchardus.
sagax sagax; 2 -r- §. sagax neopilchardus; 3 — S. sagax ocellata; 4 — S. sagax casrulca; 5 — S. sagax melanosticta; в — 8. pilchardus pilchardus;
7 — S. pilchardus sardina. •
180
CLUPEIDAE
табл. 3; Амброз, Рыбн. хоз. Дальн. Вост., 1930, 3—4 : 33 (причины появления
. в наших водах); Инясевский, там же : 5 (промысел); Шмидт, Изв. АН
СССР, отд. мат. и ест. наук, 1931 : 103 (Обама); Тр. Тихоок. комит. АН СССР, II,
1931 : 19 (Н псаки, Кагосима); С h u, Index pise. Sinens., 1931 : 14 (Кантон, Китай,
Корея, берега южн. Японии); Mori a. Uchida, Journ. Chosen Nat. Hist. Soc.
19, 1934 : 4 (Вонсан, Пусан); К а г а н о в с к и й, Рыбн. хоз. Дальн. Вост., 1934,
1—2 : И (наблюдения над ходом); Кагановская, там же : 34 (биология);
Гайд, там же : 52 (питание); Линдберг, Природа, 1935, 5 : 47 (появление
у берегов Камчатки в 1933 и 1934 гг., Командорские о-ва в 1934 г., Приморье '
в 1923 г.); К а г а н о в с к и й, Рыбн. хоз. Дальн. Вост., XIII, I, 1935 : 35 (био-
логия); Ан дрияшев, Исслед. морей СССР, 22, 1935 : 141 (Авачинская губа,
Кроноцкий зал., Командорские о-ва); Берг, Пробл. физич. геогр., II, 1935 : 77
(причины появления у берегов Камчатки); Бродский и Янковская,
Вести. Дальневост. фил. Акад. Наук, 13, 1935:103 (питание); Бродский, i
тамже, 18, 1936 : 159 (питание); Янковская, тамже : 63 (питание); Панин, '
. Докл. АН СССР, III (XII), 1 (96), 1936 : 41 (восточные берега Камчатки: Кроноцкий
зал., 1933 г.; Кроноцкий зал., бухта Моржовая, Авачинский зал. и Авачинская губа,
1934 г.); Panin, Zool. Anz., 115, 5 6, 1936 : 149 (там же); Amemiya, Japan. ;
Journ. Zool., VI, 4, 1936 : 79 (изменение количества позвонков у берегов Японии); <
Uda a. Okamoto, Journ. Imp. Fish. Exp. St., 7, 1936 : 47 (связь с температу-
рой); Kimura, Bull. Jap. Soc. Sci. Fish. Tokyo, v. 6, 2, 1937 : 69 (сезонные изме-
нения коэффициента упитанности); Оу a, Usui a. Sukegawa, ibid., v. 5, 5,
1937 : 308 (сезонные изменения жирности); Т а р а н е ц, Изв. Тихоокеан'-к. научно-
исслед. инет. рыбн. хоз. и океаногр., 12, 1937 : 33 (Охотское м. у восточных берегов
Сахалина: зал. Ныйво и Чайво); Кагановская, там же : 115 (расчисление
роста); Евстафьев, Лямин и Маконогова, Учен. зап. Ленингр.
. Гос. унив., III, 15, 1937 : 302 (Приморье; уловы, размеры, возраст, возрастной
состав, рост); Андрияшев, Исслед. морей СССР, 25, 1937 : 294 (восточные
берега Камчатки); Кагановский, Дальневост, сардина, изд. Тихоокеанск.
научно-исслед. инет. рыбн. хоз. и океаногр., 1939 : 3—39; Промысл, разведка
иваси, там же, 1939 : 9 и сл. (биология, промысел); Румянцев и Голубев,
Рыбн. хоз., 1940, 3 : 24 (ход в Приморье в 1939 г.); A i k a w a, Bull. Jap. Soc. Sci.
Fish. Tokyo, v. 8, 5, 1940 : 227 (возраст, количество позвонков, миграции, места не-
реста); Rec. oceanogr. works Jap., XI, 2, 1940 : 81 (возраст); Кизеветтер, Изв.
Тихоокеанск. научно-исслед. инет. рыбн. хоз. и океаногр., 21, 1942 : 98 и сл. (содер-
жание жира); Шмидт, Рыбн. промышл., 1, 1945 :3 (причины исчезновения
в 1941 г. и следующих годах); Кагановский, там же, 3, 1945 : 8 (причины
исчезновения в те же годы); Clemens a. Wilby, Fish. Res. Board Canada, I
Bull. LXVIII, 1946:77 (берега Сев. Америки); Румянцев, Зоолог, журн., >
XXVIj 1, 1947 : 47 (время появления в наших водах); Городничий, Рыбн.
хоз., 1949, 1 : 36 (колебание уловов в связи с изменением температурного режима
моря); Кизеветтер, Изв. Тихоокеанск. научно-исслед. инет. рыбн. хоз. и океа-
ногр., 31, 1949 : 209 (содержание жира); Пробатов, Докл. АН СССР, LXXVII,
.. 1, 1951 : 147 (западный берег южной части Сахалина в районе Яблочное, 1 экз.,
1 X1949).
D III—IV 14—16 (15.4), общим числом 18—20 (19.3), А II—IV 15—
- 18 (15.8), общим числом 17—21 (18.7), sp. br. 97—140 (122.0), на ниж-
ней половине жаберной дуги 58—93 (78.4), vert. S. 50—52 (50.73), caud.
vert. 30—33 (31.13). Голова удлиненная и узкая, длина ее 19.9—
22.5(21.1)% длины тела, межглазничный промежуток 15.6—18.6(17.2)%
длины головы. Грудные плавники 12.3—14.3 (13.3)% длины тела. Тело
удлиненное, наибольшая высота его 15.6—18.9 (17.1)%, высота головы
у затылка 12.5—14.2 (13.3)% длины тела. Спина зеленовато-оливковая,
бока серебристо-белые, конец рыла и задняя часть хвостового плавника
. черные, на боках тела с каждой стороны по ряду темных пятен числом
Г от нескольких до 15, ниже которого иногда имеется второй и изредка
третий ряд 1 из меньшего числа более светлых пятен. Размеры до
292 мм, наименьшая длина в наших водах за ряд последних лет 158 мм,
1 Сардин с тремя рядами пятен встречал также А. Г. Кагановский.
6. SARDlNO”S
181
наичаще 155—240 мм. Описание дано по 50 экз. длиной от 199 до 263
в среднем 220.1 мм, собранным в июне—июле 1947 г. в Японском море
против северной части Корейского зал. По исследованиям Каганов-
ской (1938), у 158—233 экз. длиной 190—290, в среднем 228.1 мм (до
конца хвостового плавника, до конца средних лучей его в среднем
208.3 мм) из б. Троица D III—IV 14—17 (15.2), A III—IV 14—17
(15.8), жаберных тычинок 126—174 (144.6), килевых чешуй 16—19+13—
16 (17.9+14.1), рядов чешуй 50—57 (52.3), позвонков 48—53 (50.5),
пилорических придатков 75—120 (99.0); по исследованиям Таранца
(1938), у 61—76 экз. длиной 180—240, в среднем 205.1 мм (до конца сред-
них лучей хвостового плавника) из зал. Ольги и бухты Преображения
жаберных тычинок 120—170 (142.4), поперечных рядов чешуй 52-—57
(54.0), позвонков 50—51 (50.6); по данным К. И. Панина (Андрияшев,
1937), у 223 экз. длиной от 140 до 200 мм (какой не указано) от восточ-
ных берегов Камчатки жаберных тычинок 1С8—139 (123.5); по Ригэну
(Regan, 1916), жаберных тычинок на нижней половине жаберной дуги
70—100.
На протяжении вытянутого в меридиональном направлении ареала
не однородна: у сардины, локализованной в северной части ареала, по-
звонков несколько больше, чем у сардин из южной части ареала. Так,
например, вдоль обоих берегов Японии ловится сардина с количеством
позвонков от 50.72 (о. Хоккайдо) до 50.48 (о. Кю-сю) (Ашеппуа, 1936).
Равным образом и в наших водах у берегов Приморья ввачале ловится
сардина с большим количеством позвонков — в среднем 49.73, по наблю-
дениям в 1932 г. в бухтах Преображения и Троица (Кагановская, 1938),
которую в дальнейшем на протяжении хода сменяет сардина с меньшим
количеством позвонков — в среднем 49.66, причем параллельно наблю-
дается изменение -и величины антедорсального расстояния в среднем от
43.88% в начале хода до 42.86% длины тела (до конца средних лучей
хвостового цлацника) в конце. (Об изменении длины тела и пр. см. ниже
в разделе «Биология»). Обусловлено это тем, что при летних миграциях
происходит смещение ареала с юга на север, и поэтому в наших водах
сперва появляется сардина, локализованная в северной части ареала,
которую в дальнейшем сменяет сардина более южной части ареала.
Изменение количества позвонков и пр. происходит в общем постепенно
и довольно закономерно, но каких-либо обособленных группировок
не обнаружено. Сходным образом с севера на юг изменяется количество
позвонков и у S. sagax caerulea, что особенно наглядно видно у сеголе-
ток: север Калифорнии (к северу от 35° с. ш.) 51.77, юг Калифорнии,
(к северу от 32°50' с. ш.) 51.75, север Нижней Калифорнии (к северу
от 27® с. ш.) 51.62, юг Нижней Калифорнии (к северу от 24°30') —
51.30, м. Сан-Лукас и Калифорнийский зал. 51.05 (Clark, Fish. Bull.,
65, 1947). V
Распространение. Западная часть Тихого океана и приле-
гающие моря. На юг у берегов Китая до Тайвана и Кантона. Восточно-
китайское (Нагасаки) и Японское моря. В Японском море вдоль обоих
берегов до самого севера, вдоль западных от Кореи (Пусан, Вонсан) до
м. Лазарева.в Татарском прол., иногда до южной части Амурского ли-
мана. Вдоль восточных берегов Японии до Курильских о-вов, единично
встречалась в Охотском море у восточных берегов Сахалина (зал. Ныйво
и Чайво), в Беринговом море до берегов Камчатки (Авачинская губа,
Кроноцкий зал.) и Командорских о-вов. В северных частях ареала
(к северу от южной части о. Хондо) в зимнее время отсутствует. Икро-
182
CLUPEIDAE
метание в Японском море от южной оконечности о. Кю-сю до зал. Тояма
на о. Хондо, вдоль тихоокеанских берегов Японии к югу от зал. Сагами
(о. Хондо); по материковому берегу Японского моря в наших водах,
как правило, нереста нет, но единично зрелые и текучие встречались
в южном Приморье.’
Биология. Нерест с декабря по начало мая, в южных частях
ареала раньше, чем в северных: у южной оконечности о. Кю-сю (Каго-
сима) — в конце декабря—начале января, у о. Хондо (у берегов пров.
Фукуи) — в феврале, в районе зал. Тояма — в марте—начале апреля,
на восточном побережье Японии несколько раньше, чем на западном
(Aikawa, 1940). В годы с низкой температурой в январе—марте на юге
Японского моря зрелые и недавно отнерестовавшие, по наблюдениям
А. Г. Кагановского, встречались до августа месяца у берегов северной
части Приморья. Икрометание происходит в бухтах и заливах, по некото-
рым указаниям (Uda a. Okamoto, 1936), в прибрежных областях открытого
моря (против о. Хондо), при температуре воды 13—15°, но наблюдалось
и при более низкой, 11—12°, точно так же, как и при более высокой, до
20°. Плодовитость от 27 до 84, в среднем 45 тыс. икринок. Диаметр икри-
нок неодинаковый, что указывает на возможность порционного икрометания
(это отмечено и yS. sagax caerulea). Развитие икры при 18° длится 2—4 дня.
Молодь в течение первого года совершает, судя по всему, ограниченные
миграции, но в некоторые годы заходит даже в Приморье. Взрослые
в зимнее время держатся в южных частях Японского моря и в прилегаю-
щих Восточно-китайского. Миграции на север начинаются с марта, от-
части с февраля, когда температура воды подымается до 8° и выше. Мас-
совые подходы к берегам происходят при температуре воды от 10°, при
прогревании воды до 19—20° отходит, в водах Приморья встречалась
при 23—24°, а в южной части Японского моря и при 25°, так же как
при похолодани i встречается при 6° и даже 4°. При быстром похолода-
нии погибает уже при 6°, при постепенном понижении температуры воды
выживает и при 4°, но становится вялой, малоподвижной. В зал. Петра
Великого обнаружена в декабре при 2°. Молодые, неполовозрелые более
теплолюбивы, температурные условия миграции и подходов для них выше,
невидимому 15—26°. Массовый отход при обратных миграциях в южном
Приморье начинается при 9—10°, в северном при 10—11°. По отношению
к колебаниям солености гораздо более чувствительна. Обычно держится
при 29.9—35.0° оо содержания солей, но в Амурском зал., по указанию
А. Г. Кагановского, в дождливое время, когда соленость значительно
снижается, встречалась и при 20 % о; известны случаи захода в устья рек,
вероятно с приливами. В Японском море из Цусимского прол,
на север' продвигается по обе стороны его: вдоль берегов Кореи
и далее Приморья, с одной стороны, и Японии и Сахалина, с другой,
причем часть сардины через проливы Сангарский и Лаперуза уходит
в Тихий океан. Обратные миграции на юг происходят теми же путями,
причем значительная или большая часть сардины от восточного берега
Японского моря, от Сахалина, переходит к западному и двигается
к местам зимнего пребывания вдоль берегов Приморья. С тихоокеанской
стороны Японии одна часть сардины продвигается вдоль берегов (нере-
тический путь), другая — в открытых частях океана (океанический путь)
в струях Куро-сиво (Aikawa, 1940). В начале миграций идет с юга на
север с водами теплого течения и при установлении благоприятных темпе-
ратурных условий устремляется к берегам из прилегающих участков
моря, где держится вблизи берегов, а не по всей ширине моря, так как
г
6. SABDINOPS
183
в открытых частях его вода, невидимому, менее богата планктоном, чем
воды прибрежные. Это подтверждается наблюдениями в районе зал.
Петра Великого и к югу от него и с самолета, причем сардина здесь наблю-
далась на расстоянии не далее 20—30 миль от берега. В восточной поло-
вине Японского моря в начале хода идет не далее 8 миль от берега и лишь
К северу, у северной части о. Хондо (против Акита) до 30 миль и у бере-
гов Кореи иногда на 80—90 миль от берега (Uda a. Okamoto, 1936); в север-
ной части Приморья (к северу от бухты Нельма) и у южной оконечности
Сахалина идет, судя по всему, несколько в большем отдалении от них.
Обратные миграции на юг, по указанию А. Г. Кагановского, происходят на
большем расстоянии от берегов, так как осенью у берегов после штормов
наступает резкое похолодание воды, между тем как вдали от берегов нахо-
дится более теплая вода. При этом в годы с ослабленным холодным тече-
нием и близким прохождением к берегу теплого течения миграции начи-
наются раньше и рыба идет ближе к берегу. В годы усиленной деятельности
холодного течения, отжимающего теплое течение к востоку, в начале хода
держится вдали от берегов. Скорость движения по мере продвижения
на север увеличивается, что обусловлено более быстрым прогреванием
воды в северных районах. У западных берегов Японского моря вдоль
Кореи (от Кейхоку до Конхоку), по указанию А. Г. Кагановского, идет
со скоростью около 15.2 км (от 11.0 до 18.5 км), вдоль берегов Приморья
(от зал. Посьета до бухты Светлой) — со скоростью 26 км. У восточных
берегов Японского моря (Uda a. Okamoto, 1936) вдоль о. Хондо (от Фукуи
до Аомори) идет со скоростью 13.6 км (от 9.0 до 18.0 км), вдоль о. Хок-
кайдо (от Осима до Китами) — со скоростью 23.9 км (от 13.0 до 26.0 км).
Массовые подходы в южной части Приморья (Хасанский район) на про-
тяжении 10 лет (1929—1938 гг.) начинались от 19 мая по 24 июня, в се-
верной части (Советский район) — от 1 июля по 15 августа. При обрат-
ных миграциях на юг массовые подходы на протяжении тех же 10 лет
в северной части Приморья (Советский район) заканчивались от 18 октября
по 5 декабря, в южной части (Хасанский район) — от 31 октября по
19 ноября. Таким образом, продолжительность периода массовых под-
ходов в южной части Приморья значительно больше, чем в северной:
в Хасанском районе, по данным А. Г. Кагановского, период массовых
подходов на протяжении того же десятилетия колебался от- 132 до 178
дней, между тем как на севере, в Советском районе, продолжительность
его колебалась от 65 до 126 дней. Вертикальное распределение на про-
тяжении хода неодинаково. В начале лета (в июне), когда нагрет лишь
сравнительно небольшой поверхностный слой воды, держится на неболь-
шой глубине (от 5 до 12 м). При дальнейшем прогревании воды на боль-
шие глубины занимает большую толщу воды. Глубокая гомотермия с тем-
пературой воды выше 20° вызывает отход в более холодные участки
моря. В начале хода (июнь—июль) обычно идет рыба более крупных раз-
меров и большего веса, более старшего возраста и более быстрого темпа
роста, затем более мелкая, имеющая минимальные размеры в сентябре.
Параллельно с изменением размеров, веса и пр. изменяется и коэффициент
упитанности. Такая же последовательность хода наблюдается и у бере-
гов Японии (Uda a. Okamoto, 1936). В конце хода (октябрь—ноябрь),
при обратных миграциях на юг, мелкую рыбу сменяет опять более круп-
ная, но не достигающая размеров, которые наблюдались в начале хода,
причем в некоторые годы, вследствие того что во время обратного хода
рыба идет дальше от берегов, крупная сардина в конце хода не ловится,
что видно из следующих данных А. Г. Кагановского:
Р84
CLUPEIDAE
И юнь Июль Август Сентябрь Октябрь
1930 г f Длина (мм) . . . . . . 213.9 210.3 206.8 205.0 201.6
I Вес (г)- . . . 101.4 103.6 92.4 81.3 85.3
1935 J2. ( Длина (мм) . . . . . . 205.6 204.0 198.8 196.4 200.0
( Вес (г) . . . 103.4 101.4 92.6 86.5 87.8
1 •р ( Длина (мм) . . . . . . 199.7 196.5 191.4 193.2 197.2
1 • [ Вес (г) . . . 85.4 86.6 72.9 75.4 81 1
Таким образом, в северном Приморье, куда не доходит мелкая cap”
дина, зимующая и размножающаяся в самых южных частях ареала п
идущая в конце, средние размеры ее крупнее, чем в южном. Сардина
из южных частей ареала при одинаковом возрасте имеет меньшие раз-
меры и при одинаковых размерах меньший вес, чем из северных (Кага-
новский, 1939). Основной пищей является зоопланктон, в частности
Copepoda, которые составляют главную массу содержимого желудков
в период усиленного кормления. Значительную роль в питании играет
фитопланктон, но, повидимому, в качестве вынужденного корма. Боль-
шое количество растительных организмов встречается в желудках обычно
в период менее интенсивного кормления, когда желудки бывают слабо
наполнены или пусты. Постоянными компонентами пищи из Copepoda
являются: Oithona similis, Paracalanus parvus, Microstella noroegica,
nauplii и juv. Copepoda, встречаемые в течение почти всего периода вре-
мени с июня по октябрь. Из растительных организмов таковыми
являются: Coscinodiscus sp., Chaetoceras sp., Thalassionema nitzschoides,
Skeletonema costatum, Bacteriastrum sp., Dinophysis acuta. В период
усиленного кормления в сильно наполненных желудках в массе встре-
чались Centropages mcmurrichi, Calanus finmarchicus, Pseudocalanus elon-
gatus. Наиболее интенсивно, по наблюдениям, питается осенью (сентябрь,
октябрь), летом (июль, август) желудки наполнены мало (Бродский и
Янковская, 1935; Бродский, 1936; Янковская, 1936). Показателем от-
сутствия сардины является наличие гребневиков, медуз, а также и
сельди, которые держатся в более холодной воде (Кагановский, 1939).
Половой зрелости достигает в основной массе в двухгодовалом возрасте,
после чего мечет икру ежегодно. Семи- и восьмигодовалые самки часто
оказываются стерильными.' У годовалых и мелких двухгодовалых в на-
чале хода пол невооруженным глазом почти не различим. Взрослые
летом в наших водах имеют половые продукты во II стадии зрелости,
единичные — во II—III; изредка в июне, июле и даже в августе
попадается еще не отнерестовавшие, со зрелыми половыми продуктами.
В исключительных случаях, иногда в значительном количестве, рыба со
зрелыми половыми продуктами встречается в июне и июле в Сангарском
прол. (Aikawa, 1940). У двухгодовалых количество самцов и самок при-
близительно равно, затем у более взрослых количество самок возрастает,
у старших возрастных групп количество самок всегда больше количества
самцов. В уловах сетей количество самок в среднем несколько больше
количества самцов (в среднем 63.5% первых и 56.5% вторых), в уловах
неводов ловятся в большом количестве самцы. В уловах преобладают
трех- и четырехгодовалые, последние в начале хода, первые в конце,
двухгодовалые встречаются редко, но в некоторые годы заходят в зна-
чительном количестве, одногодовалые встречаются единицами процентов,
пятигодовалые — в значительном количестве, в некоторые годы в боль-
шом, шести- и семигодовалые — в небольшом количестве, последние не
6. SARDINOPS
185
каждый год, совсем редко встречаются восьмигодовалые. Возрастной
состав в уловах различных орудий лова таков (в процентах):
Возраст . .................1+
Плавные сети...............—
Ставные сети..............1.5
Кошельковые невода . . . .1.1
2-j- 4+ 5-|~ 6+ 7+
2.5 22.1 42.5 25.2 7.0 0.7
9.4 37.8 32.3 16.9 3.1
9.8 40.2 38.0 9.2 1.7 —
Неводами ловится более мелкая рыба размерами наичаще 15.5—19.0
(14—17.5 до конца средних лучей хвостового плавника) и весом 30—
75 г, в сети попадает более крупная рыба длиной наичаще 19.5—24 см
(18—22 до конца средних лучей хвостового плавника) и весом 70—120 г.
Размеры ловимой сардины из года в год меняются: наиболее крупная
рыба ловилась в 1928—1930 гг., в 1931 г. — менее крупная, к 1933 г.
более крупная, с 1935 по 1938 гг. наблюдалось уменьшение средних
размеров и веса ловимой сардины с сопутствующим увеличением сред-
него возраста. Рост, по исследованиям А. Г. Вагановского, происходит
следующим образом (зал. Посьета; см, длина до конца средних лучей
хвостового плавника):
Возраст . . 4-|- 5+ 6-|-
1930 г. . . . . . 18.7 20.0 21.0 21.6 22.3
1933 г. . . . . . 17.6 19.4 20.9 22.2 22.8
1934 г. . . . ; . 18.1 19.4 20.6 21.7 23.3
1935 г. . . . . . 18.1 18.9 19.7 20.4 21.8
1936 г. . . . . . 18.5 19.1 19.6 —
1937 г. . . . . . 18.0 18.7 19.5 20.4 20.7
1938 г. . . . . . 1.8.2 19.2 20.2 21.0 21.9
По содержанию жира стоит на одном из первых мест среди представи-
телей семейства, уступая в этом отношении лишь немногим видам. Содер-
жание жира в теле сардины из различных районов наших вод за период
времени с 1929 по 1940 г. колебалось от 11.32 до 28.27%, среднее —
19.16%. Крупные сардины содержат жировых отложений больше, чем
мелкие, как это можно видеть из нижеследующего: длина тела 20.5 см—
содержание жира 17.53%, 21.5 см—18.93%, 22.5 см — 19.45%,
23.5 см — 19.98%, выше 24 см — 20.49% (Кизеветтер, 1942).
Появление сардины в наших водах ставилось в связь с общим по-
теплением (Берг, 1935), с землетрясением 1923 г., колебанием запасов
сельди (Амброз, 1930) или полагалось (Линдберг, 1935; Кагановский,
1939), что она встречалась постоянно и ранее, и нормальной северной
границей ее ареала следует считать южные воды восточного побережья
Камчатки, где она была обнаружена в сентябре 1933 г. в Кроноцком зал..
и в августе, сентябре, октябре и начале ноября 1934 г. в Кроноцком.
зал., бухте Моржовой и в Авачинском зал. и Авачинской губе (Панин,
1936), а также у Командорских о-вов (Андрияшев, 1937), где она указы-
валась и ранее (Сноу, 1902). В Приморье сардина была находима в зал-
Петра Великого в 1910 г., в устье р. Тумень-ула — в 1913 г. (Павленко,
1914; Берг, 1915), в прол. Стрелок ловилась в 1912 г., в ставные невода
попадалась с 1919 г., в 1922 г., поданным А. Г. Вагановского, в Хасан-
ском районе был организован небольшой лов ее, а в 1923 г. в бочонке,
полученном для исследования сельди, оказалась сардина (Линд-
берг, 1935). Отсутствие более частых и больших по размерам уло-
вов объяснялось тем, что ко времени появления в наших водах сардины
промысловый лов уже заканчивался и орудия лова снимались (Каганов-
ский, 1939). Все эти факты свидетельствуют о том, что сардина несом.-
186
CLUPEIDAE
денно встречалась в наших водах и ранее 1925 г., когда начался промы-
словый лов ее, однако вряд ли в значительных количествах. Несомненно
также, что возникновение промысла сардины в какой-то мере было свя-
зано с изменением температурного режима моря, так как в 1941 г., при
менее благоприятных температурных условиях прибрежных вод Япон
ского моря, чем в предыдущие годы, сардина пришла в наши воды в зна-
чительно меньшем количестве, и улов ее в этом и следующем году был
ничтожным, а в 1943 и 1944 гг. ловились лишь единичные экземпляры
{Шмидт, 1945). Падению уловов сардины в наших водах сопутствовало
снижение уловов ее в 1942 г. и у берегов Японии, у о. Хондо в 3 раза,
севернее — у о. Хоккайдо во много раз большее (Кагановский, 1945),
причем тенденция к снижению уловов у берегов Кореи и Японии обна-
ружилась еще в 1936—1937 гг. (Ясугава Macao, 1944; цит. по Шмидту,
1945). С изменением температурного режима моря так или иначе связы-
вается падение уловов и согласно всем трем взглядам, высказанным в объяс-
нение причин этого падения (Шмидт, 1945, Кагановский, 1945; Ясугава
Macao, цит. по Шмидту, 1945 и Кагановскому, 1945). Следует также
отметить, что увеличение численности сардины сопровождалось пониже-
нием уловов нерестовой сельди у берегов Приморья (Городничий, 1949)
и у Хоккайдо и южной части Сахалина. Падение уловов отмечается и
у калифорнийской сардины, но несколько позднее. Первые признаки
сокращения уловов ее были отмечены после 1944 г., а к 1947 г. снизились
в 5 раз.
Хозяйственное значение. Важнейшая промысловая
рыба, стоявшая по уловам мирового промысла на первом месте. Общий
улов рассматриваемого подвида в 1936—1939 гг. составлял 21.7—
27.9 млн ц, если же принять во внимание уловы других подвидов, то об-
щий улов вида в те же годы достигал 27.3—34.8 млн ц, из них 5.5—
7.3 млн ц добыто у берегов Сев. Америки (S. sagax caerulea). В наших
водах промысел возник в 1925 г., в 1931—1940 гг. уловы составляли от
0.959 до 1.397 млн ц. У берегов Японии, где возникновение промысла
•относится к 1854—1859 гг., с 1911—1912 гг. промысел начал быстро воз-
растать, в 1936—1939 гг. поймано от 10.9 до 16.3 млн ц, у берегов
Кореи — от 9.8 до 13.9, у южной части Сахалина — от 0.5 до 4.89 млн ц.
Лов происходил у восточных берегов Кореи, вдоль берегов Приморья
и по обе стороны Японии. Ловят как в открытом море, так и у берегов.
7. Род SARDINA ANTIPA
Sardina 1 A n t i р a, Denkschr. Akad. Wiss. Wien, math.-naturw. KI., LXXVIII,
(1905), 1906 : 54 (тип: Clupea pilchardus = S. pilchardus pilchardus).
По отсутствию заметной медиальной вырезки в верхней челюсти и по
наличию удлиненных последних двух лучей анального плавника
<(рис. 24) и удлиненных чешуй при основании лопастей хвостового плав-
ника (ala) подобен Sardinella и Sardinops. К последнему роду близок
отсутствием кожистого выроста на вертикальной части ключицы и нали-
чием радиальных бороздок на крышечной кости. Жировые веки сравни-
тельно хорошо прикрывают глаза сзади, спереди менее развитые. Брюш-
1 Взамен этого, уже общепринятого и очень удачного родового названия Дебуен
((De Buen, 1935 : 43) восстанавливает Arengus Cornide 1788. По закону приоритета,
это безусловно правильно, но менять уже укоренившееся название на другое, хотя бы
и согласно этим правилам, вряд ли целесообразно.
7. SABDflVA
187
.ные килевые чешуи довольно хорошо развитые, образуют заметный киль
на всем протяжении от горла до анальног* плавника, брюхо не сжатое
« боков. Рот конечный, небольшой: сочленение нижней челюсти с чере-
пом впереди вертикали середины глаза, задний конец верхнечелюстной
кости слегка заходит за вертикаль переднего края глаза, не достигая
середины его. Сошник, челюстные и нёбные кости без зубов, мелкие зуб
чики есть лишь по задней половине верхнечелюстной кости снизу. Жабер-
ные тычинки нижней части жаберной дуги в углу ее одинаковой длины"
« тычинками верхней части дуги (рис. 25), не укороченные, не налегают
на тычинки верхней части дуги. Отростки плавательного пузыря поме-
щаются в prooticum и pteroticum. Брюшные плавники позади начала
спинного. Основание спинного плавника в бороздке из чешуй, удлинен-
ных у заднего конца плавника и налегающих на последние лучи до вер-
шины их. Чешуи неодинакового размера — крупные и более мелкие,
скрытые под крупными,1 поперечные бороздки на крупных чешуях много-
численные, прерванные посредине. На теле сбоку пятно за жаберной
крышкой и ряд темных пятен позади него, иногда незаметных. Икринки
пелагические, с жировой каплей и
большим околожелтковым простран-
ством. Сравнительно небольшие рыбы
ддиной менее 200 мм.
Рис. 24. Анальный плавник Sardina Рис. 25. 1-я жаберная дуга Sardina
pilchardus sardina. pilchardus sardina. Длина тела 159 мм.
Скелет.1 2 Bulla pterotica немного крупнее, чем b. prootica. В. pro-
otica образует сбоку черепа (табл. XXXV, Л) довольно большое выпук-
лое вздутие; вздутие b. pterotica сбоку значительных размеров и еще
более крупное, почти такое же, как на prooticum, сверху под серединой
fossa praeepiotica. Каждый отросток плавательного пузыря расположен
в углублении вдоль переднего края occipitale laterale, отделенном от
отверстия п. vagus небольшим гребнем, отчасти прикрывающим отро-
сток и сверху, входит в череп через отверстие, расположенное на поло-
вине расстояния между нижним краем этой кости и границей ее с opis-
thoticum, далее помещается в костном канале. Fenestra auditiva
значительных размеров, суживающаяся впереди, близко подходит к bulla
prootica спереди, но широко отделена от отверстия n. vagus. Fossa prae-
epiotica небольшая, низкая, закругленная спереди и сзади. Foramen
temporale большое, в длину и высоту несколько большее, чем fossa prae-
epiotica, более высокое сзади. Поверхность для причленения hyomandi-
х bulare одна, сплошная, не разделенная на две обособленные части. Сош-
ник почти прямой, передняя часть парасфеноида слегка изогнутая, более
1 Поэтому при просчете поперечных рядов чешуй просчитываются только круп-
ные чешуи, числом около 30. У рыб с опавшей чешуей по кармашкам просчитываются
все чешуи, т. е. вдвое больше.
2 Описание и рисунки черепа см. у Мэтьюза (Matthews, 1887 : 289—292) я Воль-
фарта (Wohlfahrt, 1936, figs. 1—2).
188
CLUPEIDAE
высокая и сжатая с боков посредине, крылья парасфеноида изогнутые,,
заостренные сзади, слегка выдаются вниз под миодомом, суженные иг
заостренные на конце сзади черепа. Нисходящий отросток базисфеноида.
отсутствует. Задний край occipitale laterale и каждого epioticum на че-
репе сверху (Б) расходится от середины под тупым углом. Шип на заднем,
конце pteroticum совсем короткий. Передний конец каждого sphenoticum
отходит в стороны и немного вперед, более тонкий на конце, чем у осно-
• вания. Передние и задние крылья ethmoidalia lateralia короткие, едва
выдаются из-под переднего края лобных костей. Поперечные отростки,
мезэтмоида закругленные, направлены немного вперед. Череп довольна
широкий, ширина его в задней части около 2 раз в длине, наибольшая
ширина лобных костей около З’/г раз в длине его. Сошник на черепе снизу
(В) слегка закругленный, с небольшим, едва заметным продельным греб-
нем, передняя часть парасфеноида с продольной вогнутостью, сзади
суженная, крылья парасфеноида разделяются немного позади переднего
края prooticum. Задний конец opisthoticum без отростка. С каждой сто-
роны черепа сзади (Г) в epioticum и occipitale laterale.no обширной fossa,
temporalis posterior. Сочленовная головка на hyomandibulare одна, лишь,
немного суженная и вогнутая посредине. Quadratum без выемки в верх-
нем крае. Верхние отростки нижнечелюстной кости высокие, сочленовная
кость значительно короче нижнечелюстной, высокая. Подкрышечная
кость широкая, крышечная узкая, одной ширины с предкрышечной.
Описание дано по одному скелету S. pilchardus sardina.
Морские рыбы.
Один вид преимущественно в субтропических частях Атлантического
океана у берегов Европы и северной Африки, в Средиземном море, и при-
легающих к нему морях (рис. 23).
*1. Sardina pilchardus (Walbaum) — Сардина.
Clupea pilchardus Walbaum, in: Ar ted i, Gen. pise., 1792?:|38 (secundtnn
Pennant, Brit, zool., HI, 177'1 : 353, t. LXVIII, Cornwall).
Разделяется на 2 подвида, которые, в свою очередь, распадаются на
более низкие систематические формы, по взглядам Фажа (Fage, 1920),
расы. По исследованиям Ригэна (Regan, 1916), у S. pilchardus pilchar-
dus не менее 60 жаберных тычинок на нижней половине 1-й жаберной
дуги, у S. pilchardus sardina — не более 60. Из 51 исследованного нами
экземпляра S. pilchardus sardina 10 имели более 60 (до 68) жаберных
тычинок на нижней половине 1-й дуги. Таким образом, этот отличитель-
ный признак трансгрессивен.
Распространение. Атлантический океан у берегов южной
Европы и северной Африки, на север до южных берегов Ирландии и юж-
ной части Северного моря, на юг до м. Бланко. Средиземное и прилегаю-
щие к нему моря (рис. 23).
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА ПОДВИДОВ
Г (2). Жаберных тычинок на нижней половине 1-й жаберной дуги
у взрослых не менее 60.1 Голова большая, 20—23% длины тела..
Атлантический океан у берегов Европы...........................
............ . . . S. pilchardus pilchardus (Walb.)
1 У 8 крупных экземпляров (165—192 мм) от атлантических берегов Испании
(Виго) жаберных тычинок ИЗ—133, на нижней половине жаберной дуги 75—83;
у мелких экземпляров из Северного моря менее 60.
7. SARDINA
189
2 (1).. Жаберных тычинок на нижней половине 1-й жаберной дуги 44—
68. Голова меньше, 18.5—21% длины тела. Средиземное м. и при-
легающие к нему моря, Атлантический океан у берегов Африки
............................... *la. S. pilchardus sardina (Risso)
*la. Sardina pilchardus sardina (Risso) .— Средиземноморская сар-
дина (табл. VI).
Clupea sprattus (нон Linne) В r ii n n i c h, Ichth. Massil., 1768 : 82 (Марсель),
Risso, Ichth. Nice, 1810 : 352 (Ницца). — Clupanodon sardina 1 Risso, Hist,
nat. Europ. merid., Ill, 1826 : 451 (Ницца). — Alosa senegalensis 1 2 Bennett, Proc.
Zool. Soc. London, 1831 : 147 (атлантическое побережье северной Африки). — Clupea
sardina Lowe, Trans. Zool. Soc. London, II, 1841 : 189 (Мадейра). — Clupea lati-
costa Lowe, Proc. Zool. Soc. London, 1843 : 90 (Мадейра). — Clupea pilchardus
var. a. sardina Gunther, Cat. fish., VII, 1868:440 (Далмация, Ницца, Ма-
дейра). — Alausa pilchardus Steindachner, Sitzungsber. Akad. Wiss. Wien,
math.-naturw. CL, LVII, 1, 1868 : 738 (частью: восточные берега Пиренейского п-ова,
Канарские о-ва).—Sardina dobrogica Antipa, Denkschr. Akad. Wiss. Wien, math.-
naturw. KI., LXXVIII, (1905), 1906 : 42, t. I, t. Ill, f. 7—11 (Чернеем, у Констанцы).—
Sardina pilchardus sardina Regan, Ann. Mag. Nat. Mus. (8), XVIII, 1916 : 13 (юго-
западная часть Черного.м., Средиземное м., атлантическое побережье Марокко, Ма-
дейра, Канарские о-Ва). — Arengus pilchardus f. sardina De В u e n, Cat. peces
Iberico, 1935 : 43 (Средиземное м. у Пиренейского п-ова).
Распространение, биология. Baade г, Вег. Senckenberg.
Naturf. Ges., (1873—1874), 1875 : 182 (Могадор); Vinciguerra, Atti Soc. Ital.
Sci. Nat., XXXIV, 1892 : 331 (Канарские о-ва); Pi etschmann, Ann. К. K.
Naturhist. Hofmus. Wien, XXI, 1906 : 101 (атлантические берега Марокко); M u r-
г а у а. Н j о г t, Deapth of ocean, 1912 : 611 (у м. Бланко); F a g е, Arch. Zool.
Exper. Gener., 52, 1913 : 305 (Средиземное м.; размножение, биология); Rept.
Danish Oceanogr. Exped. 1908—1910, 6, II (Biology), A. 9, 1920 : 34—93 (Сре-
диземное m. ; размножение, развитие, биология); Дренски, Спис. Българ.
Акад. Наук , XXV, 1923 : 73 (берега Болгарии: Бургас, Созополь); Водяниц-
к и й, Раб. Новоросс. биолог, ст., I, 4, 1930 : 100, рис. 2 (у входа в Новороссийскую
бухту; икринки); Тр. Севастоп. биолог, ст., V, 1936 : 36 (там же; время нереста);
Майорова, Природа, 1951, 5 : 66 (берега Грузии от Пицунды до Батуми; с ав-
густа по июнь, размеры 90—164 мм). •
D III—IV 13—16 (14.5), общим числом 17—19 (18.4), А III 13—
17 (15.3), общим числом 16—20 (18.3), sp. br. 70—98 (84.9), на нижней
половине жаберной дуги 44—68 (57.5), vert. S. 50—52 (51.23), caud. vert.
30—32 (31.31). Голова короткая и широкая, длина ее 18.6—-20.9 (19.9)%
длина тела, межглазничный промежуток 16.7—21.4 (18.7)% длины го
ловы. Глаза 23.1—29.7 (26.0)% длины головы. Грудные плавники 12.5—
15.1 (13.9)% длины тела. Тело удлиненное, наибольшая высота 14.2—
18.3 (16.5)% длины его, высота головы у затылка 12.6—14.8 (13.6)%
той же длины. Окраска серебристая, спина зеленоватая или синеватая.
За жаберной крышкой сверху с каждой стороны по небольшому темному
пятну, сзади которого по ряду таких же пятен, заметных обычно по уда-
лении чешуй. Размеры в Черном море 90—170 мм, в среднем около 120 мм,
в Средиземном море до 180-мм. Описание дано по 51 экз. длиной от 130
до 170, в среднем 146.6 мм, собранным 20 I 1934 (21 экз.) и 2 XI 1938
(30 экз.) в Батумской бухте. По исследованиям А. А. Майоровш
у 100 экз. длиной от 111 до 146, в среднем 126.9 мм, D общим числом
15—18, А общим числом 15—-18, килевых чешуй 33—35 (33.5), sp. br..
74—87 (79.7), позвонков 50—52; по исследованиям Фажа (Fage, 1920),
у экземпляров от северных берегов Средиземного моря D общим числом
1 Дебуен (De Buen, Anal. Ciencias Nat., IV, 10, 1801) упоминает Clupea sardina
Asso. Это издание оказалось автору недоступно.
2 Предположительно, см.: Regan, Ann. Mag. Nat. Hist. (8), XIX, 1917 : 380.
190
CLUPEIDAE
17—19 (18.0), позвонков 50—53 (51.6), у экземпляров из южной части
моря D общим числом 17—19 (17.9), позвонков 50—52 (51.3).
Распространение. Средиземное и прилегающие к нему
моря, южная часть Черного моря.1 Восточная часть Атлантического1
океана от м. Бланко у берегов Африки до Гибралтарского прол., о. Ма-
дейра,1 2 Канарские о-ва. Нерест почти по всему ареалу, в Средиземном
море вдоль европейских и африканских берегов, несомненно и в восточ-
ной части, в Черном море икринки были найдены у входа в Новороссий-
скую бухту.
Биология. Икрометание в Средиземном море у африканских
берегов происходит с ноября по июнь, наиболее интенсивно в декабре-
феврале, у европейских берегов — с сентября по май, наиболее интен-
сивно также в декабре—феврале (у S. pilchardus pilchardus у берегов-
Пиренейского п-ова нерест происходит в феврале—марте, в северных
частях ареала, в Северном море — в июне, июле и августе). В более хо-
лодном Черном море, подобно атлантической сардине в Северном море,
мечет-икру позднее, в июле—августе. Нерест и развитие икринок и личи-
нок в Средиземном море происходит, в основном вблизи берегов и отчасти
в открытом море на расстоянии до 70 миль от берегов, в поверхностных
слоях воды на глубине около 20—25 м, при температуре воды в северной
части моря от 12.5 до 14.1, в среднем около 13.3° и солености от 37.38
до 38.24, в среднем около 37.94°/00, в южной части моря — при темпе-
ратуре от 13.4 до 14.5, в среднем около 14.1° и солености от 36.55 до
37.04°/оо (у S. pilchardus pilchardus у берегов Пиренейского п-ова в сред-
нем при 14.3° и солености 36.14°/г0, в Ламанше при той же температуре
и солености в среднем около 35.27°/00). Еще неофо рмившиеся личинки
в северной части Средиземного моря с февраля подходят в прибрежную
область и в массе держатся здесь большую часть их первого года жизни
у берегов, в глубинах заливов (Лионском, Неаполитанском и др., заходят
в устья рек, например, Роны), где заканчивается превращение во вполне
оформившегося малька. У берегов молодь держится до наступления пер-
вых холодов и затем в возрасте около года или более, при длине около
8—11 см, уходит в открытое море, где зимой временами наблюдается на
поверхности. С марта молодь опять подходит в прибрежную область,
где держится в течение лета, ведя активный образ жизни и усиленно
питаясь, достигает к осени длины около 13 см и становится половозре-
лой; с наступлением зимы половозрелые от берегов несколько отходят
и впервые нерестуют. По окончании нереста подходят вновь в богатые
планктоном прибрежные области, держатся здесь до осени, становятся
опять зрелыми, с наступлением холодов отходят от берегов и нерестуют
вновь. Повидимому, в прибрежной области заканчивается метаморфоз
личинок и в южной части Средиземного моря. Молодь здесь к зиме дости-
гает длины в среднем около 9 см и после этого у берегов изобилует только
временами, в течение короткого времени. Взрослые в прибреж-
ной области встречаются в общем в течение всего года и поэтому ловятся
круглый год, но в наибольшем количестве с апреля по октябрь (по окон-
чании нереста до начала его); Зимой, встречаясь в прибрежной области
реже, держится в открытом" море из-за непогоды на несколько большей
глубине, появляясь на поверхности при хорошей погоде (Fage, 1920).
В Черном море к берегам Грузии (от Пицунды до Батуми) подход наблю-
1 В сентябре 1950 г. обнаружена автором у Карадага и Севастополя.
2 По исследованиям Ригэна (Regan, 1916), экземпляры от Мадейры длиной 175—
180 мм имели от 54 до 57 жаберных тычинок на нижней половине дуги.
8. CLUPEONELLA
191
дается ежегодно с августа по июнь, наибольшие уловы с февраля—марта
по июнь включительно и с сентября по декабрь, т.. е. в самое жаркое
время года и зимой к берегам не подходит. По наблюдениям А. А. Майо-
ровой, ловится преимущественно рыба длиной 11—14 см, в одно-
двухгодовалом возрасте, в мае — со II и II—III стадиями зрелости.
К берегам Румынии у Констанцы подходит с середины июля по сентябрь
и затем с середины октября при миграциях к северу и обратно (Antipa, 1906).
Половой зрелости в Средиземном море достигает к концу второго года.
Большинство нерестует, повидимому, не более, четырех раз и до шестиго-
довалого возраста не доживает (5. pilchardus pilchardus достигает половой
зрелости к концу второго или третьего года при длине в среднем около
15.5—16 см; продолжительность жизни больше, у берегов Ламанша встре-
чаются 14-годовалые, в Бискайском зал. — девятигодовалые, у Пиреней-
ского п-ова—шестигодовалые). Основную массу уловов составляют рыбы
в возрасте 2Уг—4% лет. К концу второго года жизни достигает длины
в среднем 12—13 см, к концу третьего — в среднем около 14 см, четвер-
того — около 15 см, пятого — около 16 см. Самки растут несколько быстрее
самцов. Молодь в прибрежной области питается ракообразными (Cope-
poda, zoea Brachyura) и фитопланктоном. Наиболее упитанными взрос-
лые бывают осенью, перед нерестом (в среднем 9.23—9.27% жира), на-
именее упитанной после нереста (в среднем З.С6% жира) (Fage, 1920).
Хозяйственное значение. В Черном море у берегов
Грузии в 1933 г. в Батумской бухте было выловлено около 10 ц, в 1936 г.—
8.66 ц, в 1937 г. — 32.31 ц, в 1938 г. — 39.57 ц. В 1936 г. у берегов Абха-
зии в Пицундской и Сухумской бухтах было поймано 40 ц. В Средизем-
ном море в 1930—1938 гг. уловы составляли 320—350 тыс. ц. Улов
типичной; формы (S. pilchardus pilchardus) в 1936 г. исчислялся
в 2260 тыс. ц (улов Испании взят по 1934 г.)..
8. Род CLUPEONELLA KESSLER — ТЮЛЬКИ И САРДЕЛЬКИ
Clupeonella Кесслер, Рыбы Арало-касп.-понт. обл., 1877 : 187, табл. VI,
фиг. 24 (тип: личинки Cl. grimmi Kessler). — Harengula (non Valenciennes, 1847)
Берг, Мат. к позн. русск. рыбол., II, 3, 1913 : 42; там же, IV, 6, 1915 : 4; Рыбы
пресных вод, 1923 : 28. — Clupeonella Regan,. Ann. Mag. Nat. Hist. (8), XIX,
1917 : 377; Берг, Рыбы пресных вод, I, 1932 : 101.
Верхняя челюсть без медиальной вырезки. Последние два луча аналь-
ного плавника, как у Sardinella, Sardinops и Sardina, удлиненные и обра-
зуют лопасть (рис. 26), но удлиненные чешуи (ala) при основании лопа-
стей хвостового плавника отсутствуют. Кожистого выроста на верти-
кальной части ключицы, как у Sardinops и Sardina, нет, но радиальные
бороздки на крышечной кости в отличие от них отсутствуют. Жировые
веки зачаточные или почти отсутствуют. Задние концы мочеточников
с пучком многочисленных (до 10) выростов, свободно свисающих у личи-
нок, у взрослых скрыты в стенке тела между половым сосочком и аналь-
ным плавником.1 Брюхо сжатое с боков или слегка закругленное, брюш-
ные килевые чешуи хорошо развитые, на всем протяжении от горла до
начала анального плавника образуют явственный киль. Рот небольшой:
сочленение нижней челюсти с черепом позади вертикали переднего края
глаза, не достигая вертикали середины его, задний конец верхнече-
люстной кости едва заходит на вертикаль переднего края глаза.
1 См.: Владимиров, Докл. АН СССР, LVIII, 6, 1948 : 761—763.
192
CLUPEIDAE
Нижняя челюсть выдается вперед. Зубов на челюстных 1 и нёбных
костях и на сошнике нет. Жаберные тычинки верхней части жабер-
ной дуги не налегают на тычинки нижней части дуги, тычинки удлинен-
ные, тонкие, 39—67. Отростки плавательного пузыря
помещаются только в prooticum, в pteroticum
их нет. Пятен на теле нет. Икринки пелагические, с очень большой
жировой каплей и большим околожелтковым пространством. Небольшие
рыбы длиной менее 200 мм.
Скелет. Bulla prootica образует сбоку черепа (табл. XXXVI—
XXXIX, И) большое и выпуклое вздутие, занимающее большую часть
поверхности этой кости. Каждый отросток плавательного пузыря на ос-
cipitale laterale расположен в бороздке у переднего края этой кости,
вдоль заднего края ее короткий гребень; отверстие, ведущее в череп,
расположено в верхней части, под opisthoticum. Fenestra auditiva зна-
чительных размеров, близко расположена к bulla prootica, не сопри-
касается с ней, широко отделена от отверстия n. vagus. Fossa prae-
epiotica большая и высокая, широким краем обращена кверху, по длине
равная или слегка большая или меньшая, чем foramen temporale, по-
следнее наиболее высокое посредине. Поверхность для причленения
Jiyomandibulare состоит из двух разобщенных частей на sphenoticum
и pteroticum. Сошник почти прямой, передняя часть парасфеноида изо-
_____________ гнутая, тонкая, с закругленным верх-
ним кРаем> крылья парасфеноида тон-
“ff кие и длинные, заостренные на конце.
Нисходящего отростка базисфеноида
нет. Задний край supraoccipitale и каж-
Рис. 26. Анальный плавник С1и- Дого epioticum на черепе сверху (Б)
peonella delicatula. расходится в обе стороны под тупым
углом. Задний конец pteroticum без
шипа на конце. Передний конец sphenoticum в виде удлиненного
и тонкого отростка, направленного в сторону и слегка вперед.
Из-под переднего конца лобных костей слегка выдаются в стороны зад-
ние крылья ethmoidalia lateralia. Поперечные отростки мезэтмоида на-
правлены в стороны и немного вперед, одинаковой ширины на всем про-
тяжении, тупые и закругленные на концах. Череп узкий, более широкий
у Cl. delicatula, наиболее узкий у Cl. grimmi, наибольшая ширина его
около 2% раз у первого и 234 у второго в длине его, наибольшая ширина
лобных костей около 3V1 у первого и около 5 раз у второго. Сошник на
черепе снизу (В) слегка закругленный, головка его с небольшим про-
дольным закругленным гребнем, передняя часть парасфеноида слегка
вдоль вогнутая, более широкая спереди, крылья парасфеноида разде-
ляются под передним концом bulla prootica или немного позади. Зад-
ний конец opisthoticum без отростка. С каждой стороны на черепе сзади
(Г) неглубокие fossae temporales posteriores. Верхняя часть hyomandi-
bulare разделена на две совершенно обособленные головки для сочле-
нения с черепом, с большой выемкой между ними. Quadratum без выемки
в верхнем крае. Нижнечелюстная и сочленовная кости высокие, сочленов-
ная короче нижнечелюстной. Предкрышечная довольно широкая, немного
уже крышечной. Описание дано по многим скелетам Cl. delicatula deli-
1 Владимиров (1949 : 20) указывает немногочисленные зубы на нижней
челюсти, встречаемые не у всех экз. Cl. delicatula delicatula. На костях таких
зубов я не обнаружил. Повидимому, это не зубы, а зазубренный край нижней
>челюсти.
8. CLUPEONELLA
193
catula и Cl. delicatula caspia, нескольким скелетам Cl. engrauliformis и
Cl. grimmi и одному Cl. abrau.
Солоноватоводные или пресноводные рыбы, некоторые из солоновато-
водных заходят в лиманы и реки.
4 вида с 1, возможно, 2 подвидами в Каспийском, Азовском и опрес-
ненных частях Черного морей и их бассейне, в оз. Абрау и Абулионд
(басе. Мраморного моря).
Судя по размерам (до 45 мм), а также времени (зимой) и глубине на-
хождения — 146—457 м (80—250 саж.), личинки, описанные Кесслером
под названием Clupeonella grimmi, могли относиться только к этому виду.
Систематическое положение и распространение Cl. abrau весьма своеоб-
разно. Краниологически и по ряду других особенностей этот вид, живу-
щий в озерах, расположенных близ Черного и Мраморного морей, ближе
к каспийским видам Cl. engrauliformis и Cl. grimmi, а не к встречающе-
муся также и в Черном море Cl. delicatula. Более узкий череп и более
низкое тело, чему Cl. delicatula, исключают вероятность общности происхо-
ждения Cl. abrau с этим видом, у которого при переходе к пресноводному
образу жизни (Cl. delicatula caspia m. tscharchalensis) тело становится зна-
чительно более высоким, а череп, хотя и незначительно, более широким.
ОПРЕДЕЛИТЕЛЕЙ АЯ ТАБЛИЦА ВИДОВ
1 (6). Грудные плавники на конце заостренные. Голова короткая и
широкая, межглазничный промежуток не менее 16% длины головы.
2 (5). Тело и в особенности брюшко сжатые с боков, брюшко заострен-
ное, брюшные шипы хорошо заметные.
3 (4). Голова широкая, межглазничный промежуток не менее 17)4%
длины головы. Черное, Азовское и Каспийское моря и их бассейн
........................................*1. Cl. delicatula (Nordmann)
4 (3). Голова узкая, межглазничный промежуток не более 17)4 % длины
головы. Озера Абрау и Абулионд . . . *3. Cl. abrau (Maljatskij)
5 (2). Тело валъковатое, низкое, брюшко закругленное, брюшные шипы
слабо заметные...............................*2. Cl. engrauliformis (Borodin)
6 (1). Грудные плавники на конце закругленные. Голова большая и
суженная, межглазничный промежуток не более 15)4% длины
головы.......................................*4. Cl. grimmi Kessler
*1. Clupeonella delicatula (Nordmann) — Тюлька, сарделька, на
Каспийском море килька (неправ.).
Литературу см. при подвидах.
Жаберных тычинок 49—62, у каспийских несколько больше, чем
у черноморско-азовских. Тело и в особенности брюшко сильно сжатые
с боков, брюшко снизу заостренное, с хорошо развитыми килевыми
чешуйками. Голова широкая, межглазничный промежуток не менее
17)4 % длины головы. Грудные плавники заостренные на конце, у черно-
морско-азовских значительно длиннее, чем в каспийских. Размеры чер-
номорско-азовских до 90 мм, каспийских до 145 мм. Евригалинная рыба,'
встречается и размножается как в море, так и в опресненных частях
его и в реках, некоторые формы пресноводные.
Широко евригалинный, в основном солоноватоводный вид, имеющий
солоноватоводные, полупроходные и пресноводные формы.
Распадаетсц на 2 подвида, причем каспийский образует озерную вы-
сокотелую морфу. Впервые на различие между каспийской и черноморско-
азовской тюлькой было указано Суворовым (1908 : 37, 38). Однако
13 Фауна СССР —314
194
CLUPEIDAE-
сравнения между ними до сих пор произведено не было. По нашим иссле-
дованиям, различия между обоими подвидами заключаются в длине пар-
ных плавников, высоте тела, высоте головы, размерах глаз и др.
Распространение. Опресненные части Черного моря, Азов-
ское и Каспийское моря, оз. Чархал, затоны Волги, оз. Палиастоми,
заходит в реки.
ОПРЕДЕЛИТЕЛЬН АН ТАБЛИЦА ПОДВИДОВ
1 (2). Грудные и брюшные плавники длинные, грудные 17J4—21% %,
брюшные 11%—14% длины тела. Азовское и опресненные части
Черного моря..............*1а. Cl. delicatula delicatiila (Nordmann)
2 (1). Грудные и брюшные плавники короче, грудные 15%—19%, брюш-
ные 8%—12%% длины тела. Каспийское море и его бассейн.
3 (4). Наибольшая высота тела составляет 18—24%%, наименьшая —
5%—8% длины его. Жаберных тычинок 51—62. Каспийское море,
Волга, Урал...................*lb. Cl. delicatula caspia Svetovidov
4 (3).. Тело выше, наибольшая высота 21%—29%, наименьшая высота
8%—9% длины его. Жаберных тычинок 41—50. Оз. Чархал, за-
тоны и ильмени Волги ...........................................
.........*1Ь1. С1. delicatula caspia ш, tscharchalensis (Borodin)
*la. Clupeonella delicatula delicatula (Nordmann) — Черноморско-
азовская тюлька, или сарделька (табл. VIII).
Clupea delicatula Nordmann, Faune pontique, III, 1840 : 524 (Одесса,1
рынок). — Clupea cultriventris Nordmann, 1. c.: 522 (северный берег Чер-
ного м.1 2); Кесслер, Тр. СПб. общ. ест., V, 1874 : 307 (Черное море у устьев рек,
Буг до Вознесенска). — Clupea delicatula Кесслер, там же : 309 (Черное м.);
Рыбы Арало-касп.-понт. обл., 1877 : 276 (частью: северная часть Черного м.). —
Clupea cultriventris Кесслер, там же : 276 (северная часть Черного м., лиманы
Днестра, Буга и Днепра); Antipa, Denkschr. Akad. Wiss. Wien., math.-naturw.
KI., LXXVIII, (1905), 1906 : 32 t. F, t. II, f. 15—18 (устье Дуная, Разельмский
лиман). — Clupea delicatula Antipa, 1. c. : 35, t. G, t. II, f. 11—14 (Дунай
до Браилова; икрометание); Браунер, Тр. Бессарабск. общ. ест., II, 2, 1912 :
125 (Севастополь, Днепровско-Бугский лиман, устье Днестра). — Clupea cultriventris
Браунер, там же : 125 (Днестровский лиман и устье Днестра, Днепровско-Буг-
ский лиман). — Harengula delicatula Берг, Мат. позн. русск. рыбол., II, 3, 1913 :
45 (частью: Черное м.); Рыбы пресных вод, 1916 : 31 (частью). —Harengula cultri-
ventris Берг, там же : 105; Pietschmann, Arch. f. Hydrob., 33, 1938 : 706
(устье Дуная, сравнение Cl. delicatula и Cl. cultriventris). — Clupeonella delicatula
delicatula Световидов, Докл. АН СССР, XXXI, 8, 1941 : 806 (отличие
от каспийской формы); Зоолог, журн., XXII, 4, 1943 : 231; Докл. АН СССР,
XLVI, 5, 1945 : 277 (описание); в: Промысловые рыбы СССР, 1949 : 82, табл. 20;
Владимиров, Тр. Инет, гидробиолог. АН Укр. ССР, 25, 1949:1 (Днестров-
ский лиман, низовья Днестра, Кучуганский лиман; измерения, биология); Докл. АН
СССР, LXX, 1, 1950 : 125 (Днестровский лиман). — Clupeonella delicatula azovi
Владимиров, там же : 125 (Азовское м. у Бердянской косы).3 — Clupeonella
delicatula delicatula Владимиров, Зоолог, журн., XXX, 6, 1951 : 578 (бассейн
Днестра; различия между тюльками Днестра, Днестровского и Кучурганского лимана).
Распространение, биология. Остроумов, Изв. Акад. Наук,
VII, 1897 : 259 (Таганрогский зал., устье Дона, западная часть Азовского м.; икринки
и личинки); Кесслер, Путеш. к сев. берегу Черного м., 1860 : 9 (Буг у Возне-
1 Тип не указан, но сохранились экземпляры Нордманна. За тип следует считать
один из этих экземпляров длиной 74 мм, Черное море, 1838 г., № 2254 коллекций
Зоологического института Академии Наук СССР.
2 Котипы (3 экз. длиной 70'—80 мм, Одесса) Cl. cultriventris имеются в Museum
National d’Histoire Naturelle в Париже [см.: Berlin, Bull. Mus. Nat. Hist. Nat. (2),
XII, 1940 : 282].
3 Выше не упомянута работа, опубликованная в недоступном для автора издании
(Вогсеа I., С. R. Acad. Sci. Roumanie, I, 1936 : 217 и 219).
8. clupeonella
195
сенска), 106 (Днепр у Бериславы); Antipa, Fauna ichtiol. Romaniei, 1909 : 230,
табл. XVI, фиг. 88 (дельта Дуная; нерест); Клер, Рыбопромышл. жизнь, I, 1912 :
55 (оз. Сафьянино у Измаила); Максимов, Мат. позн. русск. рыбол., II, 10,
1913 : 63 (лиманы северо-западной части Черного м.); там же, III, 8, 1914 : 25, 50
(Днепровско-Бугский лиман; биология, промысел); Никольский, Билл. Всеукр.
Гос. черном.-азовск. научно-пром, опытн. ст., 6—7, 1923 : 4 (Очаков; описание, био-
логия, промысел); Д р е н с к и, Спис. Българск. Акад. Наук.,, XXV, 1923:72
(у берегов Болгарии); Белинг, Тр. Всеукр. Гос. черном.-азовск. научно-пром,
опытн. ст., I, 1925 : 57 (Днепр у Бериславы и Никополя); Е г е р м а н, там же,
II, 1, 1926 : 16 (Кучурганский лиман; нерест, промысел); Бюлл. Всеукр. Гос. чер-
ном.-азовск. научно-пром, опытн. ст., 17—18, 1926 : 53 (Днепр в 126 км от устья);
Шептицкий, там же, 19—20, 1927 : 36 (промысел); Тихонов, там же : 59
(северный берег Азовского м.); Б е л i н г, 36ipH. праць Дшпр. бюлог. ст., 2, 1927 :
338 (Бугский лиман, Буг в 30 верстах от Николаева); Недошивин, Тр. Азовско-
черном. научно-пром, эксп., IV, 1929:36 (низовья Дона; нерест); Телегин,
там же : 211 (Таганрогск. зал.; ход, нерест); Тихонов, Тр. Азовско-черном,
научн. рыбохоз. ст., 5, 1930 : 22 (промысловое значение); Есипов, там же, 7,
1930 : 48 (дельта Кубани); Родин, там же, 8, 1930 : 3 (содержание жира);
Д р е н с к и, Свед. землед., XII, 7—8, 1931 :8 (у берегов Болгарии); Сыро-
ва т с к а я, Рыбн. хоз. СССР, 1936, 7 : 34 (вылов молоди других рыб); М а йс к и й,-
Тр. Азовско-черном, научно-исслед. инет. рыбн. хоз. и океаногр., 11, 1938 : 190,
рис. 4 (Азовское м.; биология); Зоолог, журн., XVIII, 2, 1939 : 143 (роль в питании
хищных рыб); Троицкий, Природа, 1939, 10 : 71 (Вербенское гирло дельты'
Кубани); Майский, Тр. Азовско-черном, научно-исслед. инет. рыбн. хоз. и океа-
ногр., 12, ч. 1, 1940 : 25 (распространение, миграции, биология, промысел); Скул,
там же. ч. 2, 1940 : 114 (питание); Зоолог, журн., XX, 4—5, 1941 : 587 (питание); Кро-
тов, Докл. АН СССР, XXXIII, 2, 1941 : 162 (плодовитость); Борисов, Рыбн.
хоз., 1949, 1 : 40 (Феодосийский зал.); Сафонов, Тр. Рыбоводно-биолог. лабор.
Азчеррыбвода, 1, 1949:132—136 (Азовско-кубанский район; промысел); Май-
ский, Миндер, Дорменко, Тюлька Азовского м., Пищепромиздат, 1950 :
3—19, рис. 1—3 (Азовское м.; биология, промысел); Майский, Тр. Азовско-
черном. научно-исслед. инет, морск. рыбн. хоз. и океаногр., 15, 1951 : 6, рис. 1 (Азов-
ское м.; распределение и численность); Костюченко, там же : 63, рис. 1—5
(Азовское м.; весенние миграции); Майский, там же : 81, рис. 1—4 (Азов-
ское м.; возрастной состав, рост); Логвинович, там же : 235 (Азовское м.;
питание взрослых); Логвинович и Фельдман, там же : 251, рис. 1—9
(Азовское м.; питание личинок).
D III—IV 11—13 (12.0), общим числом 14—17 (15.4), А III 14—Д8 (15.4),
общим числом 17—21 (18.3), sp. br. 49—62 (54.0), килевых чешуй
24—29 (27.0), vert. S. 41—43 (41.92), caud. vert. 23—26 (24.92). Тело и
в особенности брюшко сильно сжатые с боков, брюшко снизу заостренное,
килевые чешуи хорошо развитые. Голова удлиненная и широкая, длина,
ее 22.4—25.0 (23.7)% длины тела,1 межглазничный промежуток 17.6—21.7
(19.4)% длины головы. Глаза значительных размеров, 24.1—30.8 (26.5)%
длины головы, заглазничный отдел довольно удлиненный, 26.3—
42.4 (39.3)%, рыло довольно укороченное, 29.3—36.1 (32.4)% той же
длины. Грудные и брюшные плавники длинные, грудные плавники со-
ставляют 17.7—21.2 (19.0)% длины тела или 60.0—72.0 (68.6)% рас-
стояния между их основанием и основанием брюшных плавников, брюш-
ные плавники 11.7—13.8 (12.7)% длины тела. Тело высокое, наибольшая
высота 21.3—27.0 (24.4)% длины его, наименьшая высота 7.6—9.3(8.1)%,
высота головы 16.5—19.6 (17’9)% той же длины. Спина и верхняя часть,
головы от серо-зеленоватой до синевато-зеленой окраски, брюшко сере-
бристо-белое или золотисто-желтое. Длина до 90 мм, наичаще в Азовском
море 40—70 мм. Описание дано по 50 экз. длиной от 59.3 до 79.5, в сре-
1 В процентах длины тела до конца хвостового плавника: длина головы 19.4—
22.3 (21.1), длина грудного плавника 15.8—18.9 (16.9), длина брюшного плавника
10.4—12.3 (11.3), наибольшая высота тела 18.9—24.0 (21.7), наименьшая высота
.тела 6.8—8.3 (7.2), высота головы у затылка 14.7—17.4 (15.9).
13*
196
CLUPEIDAE
днем 68.2 мм, собранным 2 XI 1940 у западного побережья Азовского моря
между о. Бирючьими Кирилловкой. По исследованиям Владимирова (1949),
у тюльки из северо-западной части Черного моря D II—V И—14 (11.6—
11.9), А II—IV 13—20 (15.9—16.1), килевых чешуй впереди брюшных
плавников 16—20 (17.7—17.8), позади брюшных плавников 7—11 (9.2—
9.4), жаберных- тычинок 42—55 (48.1—50.6), позвонков 40—43 (41.9—
42.0), пилорических придатков 6—13 (8.5—9.3).
Евригалинная форма, живущая и размножающаяся как в пресной,
так и в солоноватой воде с содержанием солей до 13°/оо С1.
Тюлька северо-западной части Черного моря выделяется Владими-
ровым (1950) в особый подвид Cl. delicatula azovi. Отличия этой формы,
как это видно из табл. 3 Владимирова, значительно меньше различий
между Cl. delicatula delicatula и Cl. delicatula caspia и притом наблюдаются
в признаках, зависящих от размеров (жаберные тычинки, диаметр глаз),
упитанности и зрелости половых продуктов (высота тела наибольшая,
наименьшая и у затылка), и обусловлены отчасти размерами сравни-
ваемых рыб (азовская 62.7, днестровская 59.8 мм). Наиболее существенны
различия в плодовитости, значительно более высокой у днестровской
тюльки. Что касается разницы в диаметре оплодотворенных икринок,
то она обусловлена различиями в условиях развития их, что общеиз-
вестно для ряда и других сельдевых — икринки азовской тюльки раз-
виваются в солоноватой воде, икринки днестровской — в пресной, вслед-
ствие чего они и более крупные. Несомненно тюлька Азовского моря и
северо-западной части Черного, так же как, вероятно, и оз. Палиастоми,
различаются, но различия эти будут внутриподвидового порядка и счи-
тать их можно самое большее за nationes. Во всяком случае различать
их по этим признакам затруднительно, и тем более не следует давать
особых латинских наименований. Такие различия несомненно наблю-
даются и у каспийской тюльки, размножающейся как в море, так и
в пресной воде. Подобные формы имеются внутри почти каждого подвида.
У таких форм безусловно необходимо отмечать биологические особен-
ности, если они имеются, но выделение их в особые систематические кате-
гории с латинскими наименованиями в большинстве случаев не имеет
ни научного, ни практического значения. Владимировым (1951) обна-
ружены также различия между тюльками бассейна Днестра — Днест-
ровского лимана, Днестра и Кучурганского лимана. Сопоставление
Cl. delicatula delicatula и Cl. czzZ^rzpen^rzs произвел Питчман (Pietschmann,
1938) и еще в более убедительной форме Владимиров (1950), показав-
ший нереальность выделения последней даже в качестве морфы.
Распространение. Азовское море и опресненные части
Черного моря, главным образом в северо-западной части его, есть в оз.
Палиастоми, у берегов Болгарии, в Феодосийском зал., входят в низовья
почти всех рек, иногда подымаясь высоко вверх по течению — по Днепру
до Никополя, в Буг до порогов, в Днестр до Тирасполя и выше, по Дунаю
до Браилова и выше (оз. Калараш), по Дону на 50—60 км (выше Ростова
н/Д.). Наиболее многочисленная и распространенная рыба Азовского
моря, в осолоненных частях Черного моря не встречается, придерживаясь
опресненных предустьевых участков лиманов и устьев рек. В Азовском
море нерест происходит, главным образом, в Таганрогском зал., частично
в дельте Дона, в лиманах Ейском и Миусском, в кубанских опресненных
лиманах — Ахтанизовском, Ахтарском, Бейсугском и др., изредка
в рукавах дельты Кубани — Ачуевском и Темрюкском и др., в низовьях
Дона на 50—60 км от устья, в северо-восточной части моря, прилегающей
8. CLUPEONELLA
197
к Таганрогскому зал., в незначительных размерах по всему морю. В се-
веро-западной части Черного моря размножается в лиманах и устьях рек.
Биология. В отличие от каспийской формы местами заходит
в пресную воду с осени, в массе ловится подо льдом (Днестровский лиман).
В некоторых пресноводных лиманах (Кучурганский) встречается, здесь
же и размножаясь, круглый год, не изменяя в такой степени своего внеш-
него вида, как каспийская форма. Главный потребитель планктона Азов-
ского моря и вместе с тем основная пища хищных промысловых рыб.
В зимнее время, в январе—марте, основная масса взрослых и молоди
держится вдали от берегов в центральной части Азовского моря с глу-
бинами 10—13.4 м, с температурой глубинных слоев воды 1.3—1.5°,
понижающейся временами до 0.2—0.3°. В апреле начинает заходить
в Таганрогский зал., где, так же как в меньшей степени и на других
местах нереста, держится основная масса в мае—июне. При весенних
миграциях в массе подходит к более прогретым, чем открытые части моря,
берегам, преимущественно у входа в Таганрогский зал. Подходы начи-
наются при температуре воды 5—6°, массовые — при 10—18°. В июле—
августе основная масса находится в центральной части Азовского моря,
в лиманах и в прибрежной области держится мало. В сентябре и октябре
распределение остается приблизительно тем же, в декабре принимает
зимний характер. Осенью нередко наблюдается в значительном коли-
честве вблизи Керченского прол., Темрюка, Ачуева, Ахтари, Осипенко,
Обиточной косы и Геническа. В северо-западной части Черного моря
в массе встречается в Днепровско-Бугском лимане, где происходит и
нерест ее. Из моря в реки наблюдаются два хода: осенний и весенний
для нереста. Ловится в массе и у берегов Болгарии. Икрометание в Азов-
ском море начинается в апреле при 5—6° в Таганрогском зал., затем,
по мере прогревания воды, распространяется на прилегающую часть
моря и в незначительной степени и на западную и центральную части его.
Нерест происходит при температуре воды от 5 до 24° и солености от 0
до 8°/г0 С1, разгар нереста в мае при 13—20° при содержании солей обычно
ниже 5.5°/00 С1, наичаще от 0 до 4°/00 С1. Заканчивается нерест в середине
июля. Нерест происходит преимущественно вечером. В северо-западной
части Черного моря в Днестровский лиман для нереста заходит с конца
марта по начало апреля; размножение происходит в пресной воде в вер-
шине лимана и в нижнем течении Днестра, с начала мая по начало июня,
при температуре 15—24°. После нереста из Днепровского лимана на лето
уходит в море, возвращаясь обратно с конца августа по ноябрь. Мальки
покидают лиман в конце июня—начале июля, частично выносятся тече-
нием в море в стадии личинки. В Кучурганском лимане тюлька живет
круглый год, здесь же и размещается. Половой состав на протяжении
года неодинаков. В начале хода и периода нереста несколько преобла-
дают самки, затем — самцы и с начала мая до конца нереста количество
самок значительно больше количества самцов. В остальное время года
половой состав изменчив, но в общем количестве самцов и самок одина-
ково. В Азовском море количество самок в начале весны меньше коли-
чества самцов, в мае—июне самки количественно преобладают над сам-
цами. Плодовитость от 5 220 до 20110, в среднем 10 620 икринок. Икра
выметывается несколькими порциями с промежутками в несколько дней.
Развитие икры при 10° длится 98 час., при 14° — 62 часа, при 18° —
35 час. и при 22° — 25 час. Сеголетки распространены по всему Азовскому
морю, но в основной массе держатся в северо-восточной части моря про-
тив входа в Таганрогский зал., а также в центральной части. Питается
198
CLUPEIDAE
в основном зоопланктоном, причем главным компонентом пищи в Азов-
ском море являются Copepoda (до 86% содержимого желудков), Clado-
сега (до 2%), коловратки (около 3%), мизиды (около 1%), личинки мол-
люсков (до 3%) и рыб (около 1%). Наиболее интенсивно питается в июле,
августе и сентябре; хотя и слабо, питается и в период нереста; в конце
осени, зимой и весной питается слабо. Наиболее интенсивно питается
между 16 и 17 часами (Окул, 1941). По другим исследованиям (Логви-
нович, 1951), основу питания в центральной части Азовского моря (между
Керченским прол, и Осипенко) и в Таганрогском зал. составляли также
Copepoda (82—94% содержимого желудков) — Acartia clausi, Calani-
peda aque-dulcis, nauplii. Личинки переходят на активное питание еще
с нерассосавшимся желточным мешком. Основной пищей личинок длиной
до 7.3 мм являются личинки моллюсков, меньшее значение имеют nauplii
Copepoda и коловратки. По мере роста личинки переходят на питание
науплисовыми и копеподитными стадиями и затем взрослыми Copepoda;
меньшее значение имеют Cladocera, поедаемые в большем количестве
более крупными личинками. Значение личинок моллюсков и коловраток
по мере роста у личинок тюльки уменьшается (Логвинович, 1951). Поло-
возрелой становится на втором—третьем году и по достижении половой
зрелости мечет икру ежегодно. Урожайность, возрастной состав стада
и размеры рыб из года в год меняются, но весной в главное время лова
в основных стаях в Азовском море преобладают сеголетки, двухгодова-
лые и трехгодовалые; четырехгодовалые встречаются мало, пятигодова-
лые —•. как исключение. В промысловых уловах преобладают двухгодо-
валые и трех- или одногодовалые. Возрастной состав уловов в Азовском
море, по данным Майского (1930—1940 гг.) и Костюченко (1946—1950гг.),
таков (в процентах):
Сеголетки 0-|-' Двух- годовалые Трех- годовалые 2+ Четырех- гоцовалые 3+
1930 г. . . . . 61.0 36.7 2.3 0.01 '
1931 г. . . . . 34.5 55.8 9.5 0.2
1932 г. . . . . 19.8 64.7 15.2 0.3
1933 г. . . . . 41.8 31.2 24.1 2.9
1934 г. . . . . 43.9 42.8 12.8 0.5
1935 г. . . . . 42.2 55.4 2.3 0.1
1936 г. . . . . 35.0 32.0 30.8 2.2
1937 г. . . . . 25.4 30.2 37.3 7.1
1938 г. . . . . 51.3 36.4 8.7 3.6
1939 г. . . . . 67.5 17.7 10.8 3.0
1940 г. . . . . 36.3 52.4 10.4 0.9
1946 г. . . . . 34.4 19.9 40.3 5.4
1947 г. . . . . 44.5 27.2 20.9 7;4
1948 г. . . . . 47.5 44.5 7.7 0.3
1949 г. . . . . 35.7 45.4 18.4 0.5
1950 г. . . . . 29.8 53.2 16.0 1.0
Основную массу в уловах составляют рыбы длиной 40—70 мм. Самки
крупнее самцов и обладают более быстрым темпом роста. Растет значи-
тельно медленнее, чем каспийская форма (по данным обратного рас-
кисления) :
Возраст..................... 1
Азовское море (мм)........49.6
Днестровский лиман (мм) . . 54.7
2 3 4
63.2 72.6 86.5
66.9 — —
По сравнению с каспийской формой, судя по имеющимся неполным
данным для последней, обладает большим содержанием жиров. Наи-
8. CLUPEONELLA
199
более жирной и упитанной бывает осенью, в октябре—ноябре (от 16.96
до 18.45% жира), менее жирна весной до начала нереста (16.12%), наи-
менее жирной бывает в период икрометания и по окончании его, в мае—
июне (4.48—8.07%-).
Хозяйственное значение очень большое. В Азовском
море одна из самых основных промысловых рыб, стоящая по улову на
первом месте. Общий улов в 1936—1938 гг. составлял 749—832 тыс. ц;
из них главная масса вылавливалась в Азовском море, меньшее коли-
чество (22.5—34.4 тыс. ц) — в северо-западной части Черного моря
в украинских водах; у кавказских и крымских берегов уловы.незначи-
тельны. В Азовском море лов производится почти по всему побережью,
но главным образом у входа в Таганрогский зал. Ловится ставными нево-
дами и аломанами, весной во время хода на нерест и осенью на местах
нагула. В Азовском море в небольшом количестве стала ловиться с на-
чала этого века, причем до 1930 г. запасы почти не использовались.
*lb. Clupeonella delicatula caspia Svetovidov — Каспийская тюлька,
или сарделька, обыкновенная килька (неправ.) (табл. VIII).
Clupea delicatula Кесслер, Рыбы Арало-касп.-понт. обл., 1877 : 276 (частью:
Каспийское м. у берегов Мангышлака); Суворов, Тр. Касп. эксп. 1904 г., II,
1908 : 48, 60 (по всему Каспийскому м.; устья рек, описание, биология). —Нагеп-
gula delicatula Берг, Мат. позн. русск. рыбол., II, 3, 1913 : 45, табл. I, фиг. 2
(частью: Каспийское м., дельта Волги и Урала); Рыбы пресных вод, 1916 : 31 (частью);
Сергеева и Ганешина, БюантГВ’еекасп. научн. рыбохоз. эксп., 5—6, 1932 :
43 (количества лучей в плавниках, жаберных тычинок, позвонков). — Clupeonella
delicatula Берг, Рыбы пресных- вод, I, 1932 : 102 (частью). — Clupeonella delica-
tula caspia Световидов, Докл. АН СССР, XXXI; 8, 1941 : 806 (отличие от ти-
пичной формы вида1); Зоолог, журн., XXII, 4, 1943 : 231; Докл. АН СССР, XLVI, 5,
1945 : 227 (описание); Чугунова, в: Промысловые рыбы СССР, 1949 : 85, табл. 21.
Распространение, биология. Бородин, Ежег. Зоолог, муз.
Акад. Наук, I, 1—2, 1896 : 89, фиг. 1 (устье Урала, дельта Волги); Lonnberg,
Bihag. К. Svensk. Vet.-Akad. Handl., XXVI, afd. IV, 8, 1900 : 28 (Петровой, Ман-
гышлак); Суворов, Мат. позн. русск. рыбол., III, 3, 1914 : 3 (распространение,
размеры, нерест, промысловое значение); Киселевич, Промысловые рыбы
Волго-каспийского района Астрах., 1926:26 (биология); Белоусов, Бюлл.
рыбн. хоз., 1926, 6 : 12 (дельта Волги, ход, промысел); Киселевич, «Наш
край», 1927, 9—10:11 (дельта Волги; биология, промысел); Недошивин,
Сборн. в честь Книповича, 1927 : 290 (искусственное оплодотворение, развитие);
Тр. Астраханск. научн. рыбохоз. ст., VI, 4, 1928 : 92 (дельта Волги; рост молоди);
Дмитриев, Бюлл. рыбн. хоз., 1928, 7 : 17 (у берегов Дагестана; промысел);
Изв. Дагестанск. ихт. лаб., I, 1929 : 21 (у берегов Дагестана; биология, промысел);
Бюлл. рыбн. хоз., 1930, 7—8 : 13 (у берегов Дагестана; промысел); Беляев,
Бюлл. Всекасп. научн. рыбохоз. эксп., 1—2, 1932 : 62 (у берегов Азербайджана;
промысел, нерест в зимнее время); Леванидов, там же, 5—6, 1932 : 56 (жир-
ность); Подсевало в, Изв. Астраханск. отд. Научно-исслед. инет. рыбн. про-
Мышл., II, 1935 : 256 (иранское побережье; жирность, уловы); Дмитриев, Рыбн.
хоз. СССР, 1935, 10 : 16 (у берегов Дагестана; прилов молоди других рыб);
Шульман, Рыбн. хоз. СССР, 1936, 3 : 42 (жирность, химический состав жира);
Чаянова, Тр. I Всекасп. научн. рыбохоз. конфер., I, 1936 : 51 (питание); К и-
с е л е в и ч, Сельди северного Каспия, Сталингр., 1937 : 37 (биология); Клы-
ков, Тр. Касп. ком. АН СССР, II, 1938 : 80 (в громадном количестве заходит в за-
падную часть зал. Мертвый Култук одновременно с долганкой и немного ранее);
Перцева, Рыбн. хоз., 1938, 7 : 32, рис. 3—5 (северная часть Каспийского м.;
места и время нереста); Расс иХалдинова, Сборн., посвящ. деят. Книпо-
вича, 1939 : 307 (развитие и распространение икринок и личинок); Л е в о н и к,
Рыбн. хоз., 1939,'5 : 9 (биология, промысел); С. Пробатов, Изв. Азербайджанок,
научно-исслед. рыбохоз. ст., 4, 1939 : 3 (биология, промысел); Пожалуева,
Рыбн. хоз., 1940, 1 : 26 (у берегов Туркмении, распределение, промысел); Ловец-
1 Тип — экземпляр длиной 152 мм, дельта Волги, Оранжерейный промысел,
1885 г., Гримм, № 15883 коллекций Зоологического института Академии Наук СССР.
200
CLUPEIDAE
кая, там же : 27 (средняя и южная часть Каспийского м.; распределение, промы-
сел); там же, 1941, 3 : 20 (зрелость, нерест); Каспийские кильки, изд. Азербайджанок,
научно-исслед. рыбохоз. ст., 1941 : 4, 15, рис. 1, карты 1—4 (биология, распределе-
ние, промысел); Казанчеев, Рыбн. хоз., 1941, 4 : 20 (восточное побережье
средней части моря; лов летом и осенью); Ш о р ы г и н, Рыбн. промышл. СССР,
1—2, 1944 : 3 (промысел); Борисов, там же, 3, 1945 : 55; Рыбн. хоз., 1946,
2—3 : 32; 10—11 : 38; 1947, 10 : 23 (лов на свет, размеры); Краснова, Докл.
Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океаногр., 8, 1947 : 15 (северная
часть моря; условия нереста); Казанчеев, Тр. Волго-каспийск. научн. рыбо-
хоз. ст., IX, 1, 1947 : 38 (северная часть моря; биология); Приходько, там же :
63 (восточное побережье средней части моря; летние подходы); Ловецкая, Докл.
Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океаногр., 9, 1947 : 9 (прилов
молоди рыб в ставных килечных неводах); Радаков и Токарев, Рыбн.
хоз., 1948, 5 : 13 (лов на свет); Демин, Тр. Дагестанок, сельскохоз. инет., IV, 1,
1949 : 159 (берега Дагестана; миграции); Приходько, Рыбн. хоз., 1951, 8 : 43
(по обе стороны южной части моря, с 25 февраля по 19 марта; лов на свет); Ловец-
к а я, Каспийские кильки и их промысел, Пищеиромиздат, 1951 : 5, 6, 15 и сл.,
рис. 1, 4—10 (распределение, миграции, размножение, размеры, возраст, рост, про-
мысел); Н. Танасийчук, Промысл, рыбы Волго-Каспия, Пищеиромиздат,
1951 :.,47 (размеры, вес); В. Танасийчук, Тр. Всесоюзн. Научно-исслед. инет,
морск. рыбн. хоз. й океаногр., XVIII, 1951 : 21 (северная часть моря; учет молоди,
размеры мальков); Перцева-Остроумова, там же: 106, рис. 2 (описание
икрппок и личинок); Халдинова, там же : 106 (зал. Мертвый Култук и Кайдак
и прилегающие районы; нерест, распределение икринок и личинок); Чаянова,
там же : 245, рис. 1—3 (северная часть моря; питание).
D III—IV 11—13 (11.9), общим числом 14—16 (15.4), А III 14—18
(16.2), общим числом 17—21 (19.1), sp. br. 51—62 (56.6), килевых чешуй
26—30 (27.9), vert. S. 41—44 (42.65), caud. vert. 24—27 (25.70). Тело и
в особенности брюшко сжатые с боков, брюшко снизу заостренное, брюш-
ные шипы хорошо развитые. Голова укороченная и широкая, длина ее
20.9—24.2 (22.5)% длины тела,1 межглазничный промежуток 17.7—21.5
(18.8)% длины головы. Глаза не особенно большие, 22.8—29.1 (25.9)%
длины головы, заглазничный отдел удлиненный, 38.2—44.6 (41.8)%,
рыло укороченное, 29.2—35.3 (31.9)% той же длины. Грудные и брюш-
ные плавники укороченные, грудные плавники 15.6—18.7 (16.9)% длины
тела или 52.3—65.2 (57.8)% расстояния между их основанием и основа-
нием брюшных плавников, брюшные плавники-8.6—10.5 (9.5)% длины
тела. Тело довольно высокое, наибольшая высота 18.0—24.2 (20.6)%
длины его, наименьшая 5.6—7.8 (7.0)%, высота головы 14.8—17.4 (16.0)%
той же длины. Спина и верхняя часть головы у экземпляров, пойманных
в море, светлозеленые. Все плавники бесцветные, за исключением хво-
стового, обычно темноватого при основании, и спинного с неясной, слабой
темной поперечной полосой посредине. Длина до 145 мм, наичаще 80—
100 мм, вес до 19 г, наичаще 10—13 г. Описание дано по 50 экз. длиной
от 76.0 до 119.5, в среднем 93.4 мм, пойманным 26 II—30IV 1911 (30 экз.)
и в мае 1885 г. (20 экз.) в дельте Волги (Оранжерейный промысел). У 39
экз. длиной от 80.7 до 134.5, в среднем 114.6 мм, собранных 8—9 XI 1939
в южной части Каспийского моря против Апшеронского п-ова, D III
11—14 (12.1), А III 15—19 (16.5), sp. br. 50—63 (57.8), позвонков 42—44
(43.1). По данным Сергеевой и Ганешиной (1932), у экземпляров из южной
части моря А 14—17 (15),1 2 жаберных тычинок 52—64 (58). По сообщению
1 В процентах длины тела до конца хвостового плавника: длина головы 18.4—
21.3 (19.8). длина грудного плавника 13.7^16.5 (14.9), длина брюшного плавника
7.6—9.2 (8.4), наибольшая высота тела 15.8—21.3 (18.1), наименьшая высота тела
4.9—6.9 (6.2), высота головы у затылка 13.0—15.3 (14.1).
2 Количество лучей в анальном плавнике здесь преуменьшено, невидимому.,
вследствие ошибки в разграничении разветвленных лучей от неразветвленных.
8. CLUPEONELLA
201
E. В. Пожалуевой, у исследованных ею экземпляров от берегов Турк-
мении позвонков 41—45 (43.1).
В высокой степени евригалинная форма, встречающаяся, как в воде
с соленостью до 15!l/0fl CI, так и в совершенно пресной.
Биологически крайне изменчивая форма. Часть каспийской тюльки
проводит всю жизнь в море (например в южной части Каспийского моря),
здесь же и размножается, другая часть является в сущности проход-
ной рыбой, идущей на нерест в Волгу. Возможно, что обе эти группы,
тюльки представляют самостоятельные формы.
Распространение. Каспийское море, где встречается почти
повсеместно, от сильно осолоненных частей (до 34.150/00 в зал. Кайдак).
(Халдинова, 1951), до совершенно опресненных, заходит в низовья рек
Волги и Урала, иногда подымаясь высоко по течению: по Волге до.
Вольска и выше, в притоки среднего течения ее (Еруслан, Б. Иргиз).
Икрометание почти повсеместно, как в море, так и в пресной воде пред-
устьевых пространств и низовий рек (Волга, Урал, Терек). В сильно осо-
лоненных частях (например зал. Кайдак) нерест не происходит. В север-
ной части моря нерестует главным образом в юго-западном и западном
районах моря (от о. Чечень до Лагани), в предустьевом районе Волги
(вдоль свала до Белинской банки), у Забурунья, перед устьем Урала,,
у берегов пол. Бузачи—Мангышлак. В средней и южной частях мора
икрометание происходит вдоль западного и восточного побережий,,
в заливах (Туркменском, Кирова).
Биология. Держится как в открытом море, так и у берегов,
куда в массе подваливает весной. В зимнее время держится вдоль запад-
ных берегов в южной части моря в районах с глубинами 35—100 м
(от банки Макарова до Куринской) и несколько южнее (Норд-остов-
Култук—Астара), где встречается в промысловом количестве даже в ме-
стах с глубинами 10—20 м; часть зимует на юге южной части моря. В цен--
тральной части моря и над глубинами свыше 100—200 м встречается,
редко. В средней части моря зимой обнаружена в районе Дивичи, есть,,
повидимому, и в других местах, возможно, и в северной части подо льдом
(Ловецкая, 1941, 1951). Зимой в южной части моря держится главным
образом при температуре 7—10°, но иногда встречается при 3—4° и даже-
2.6°. Весной одни косяки подходят к западным, другие к восточным бере-
гам южной части, третьи вдоль западных берегов направляются в сред-
нюю и далее в северную часть моря, где также подходят к берегам, и.
в Волгу. Массовые миграции происходят с середины—конца марта,
вдоль западного побережья средней чавти моря в зоне свала над глуби-
нами 35—100 м. Первые подходы к берегам происходят при температуре
около 4.5—5.5°, массовые подходы при температуре около 10°, при 13°
и выше отходит, предельная температура 23—25° (Казанчеев, 1947). При-
летних подходах у восточных берегов средней части моря наибольшие-
скопления образуются при 10—17° (Приходько, 1947). Подходы у бере-
гов Азербайджана начинаются с февраля, массовые подходы в южной,
и средней частях моря — в марте—апреле. Подходы у берегов Даге-
стана усиливаются при ветрах восточной четверти, дующих со стороны-
моря, наиболее благоприятен восточный ветер (Демин, 1949). В северной-
части моря появляется в начале апреля вместе с долгинской сельдью,,
главная масса появляется при температуре 10—-12°. В Волгу ход начи-
нается в половине апреля, во второй половине апреля при температуре-
около 10° массовый ход, разгар хода в начале мая; ход очень дружный,
продолжается дней 7—10, за 2—-3 дня до хода сельди или одновременно?
202
CLUPEIDAE
с ним. В отличие от сельди идет не серединой протока с наибольшей глу-
биной, а ближе к берегу, по мелякам, преимущественно утром и в пер-
вой половине дня (с 7—8 до 15 час.), затем ход ослабевает, а ночью пре-
кращается совсем. Основная масса заходит в самую нижнюю часть дельты
и не подымается вверх. В 1925—1927 гг. ловилась на тоне Первомай-
ской, находившейся в то время в нижней части дельты; в 1942 г. лов
на этой тоне был безуспешен ввиду того, что тоня вследствие понижения
уровня моря отстояла от выхода реки в море уже на 20—25 км (Казан-
чеев, 1947). Летом держится у западных и восточных берегов средней
и южной частей моря (Махачкала—Каякент, Худат—Дивичи, Апше-
рон—Астара, зал. Александер-бай, Казахский и др.), в отдалении от бере-
гов, на глубинах от 20—40 до 100 м; у восточных берегов средней части
моря временами в зависимости от сгонных ветров и распределения планк-
тона подходит в прибрежную зону. Миграции на зиму в южную часть
моря происходят в ноябре. Из северной части моря взрослые уходят
сразу после окончания нереста, из Волги и ее дельты — вскоре после
нереста или остаются до осени, иногда, будучи запертыми в ильменях
и затонах, остаются на зиму, причем молодь превращается в морфу
tscharchal nsis. После отхода из северной части моря летом и отчасти
осенью в массе подходит к восточным берегам от п-ова Мангышлак до зал.
Кендырли, где усиленно откармливается (Приходько, 1947). Зимой
и в начале весны в большинстве случаев в массе держится на глубине
ниже 8 м, в апреле и мае в связи с прогреванием воды в прибрежной
области подходит на мелководья до глубин 1—2 м. Летом в наиболее
жаркое время (июнь—август) при прогревании поверхностных слоев
воды до 25—28° в массе держится ниже этих слоев. В начале осени (в сен-
тябре) с охлаждением поверхностных слоев воды поднимается в верхние
горизонты и до мере дальнейшего охлаждения держится на глубине
ниже 8 м от поверхности (Ловецкая, 1951). В 1951 г. с конца февраля
по середину марта по обе стороны южной части моря в наибольшем коли-
честве при лове на свет обнаружена на глубине от 20 до 40 м, в двух слу-
чаях наибольшее количество было на глубине 60 м (Приходько, 1951).
Время нереста зависит от температуры воды. В северной части моря
перед дельтой Волги в 1940—1941 гг. икрометание происходило со 2—
3-й декады апреля, разгар в мае, продолжаясь единично в июле, при тем-
пературе воды от 11 до 20°, солености от 0 до 15°/00, на глубине от 1
до 9 м. При повышении температуры выше 20° нерест незначителен,
при 25° и выше прекращается (Краснова, 1947). На мелководье перед
входом в Мертвый Култук и в Прилегающих ко входу частях залива
икринки встречались при более высокой солености, при. 20°, 00 и выше
икринки отмирают (Халдинова, 1951). В южной части моря нерест сильно
растянут, происходит с января—февраля; наиболее развитые половые
продукты бывают здесь в феврале—марте и вплоть до лета. В промысло-
вых уловах круглый год обычно преобладают более крупные по разме-
рам самки, среди мелких — самцы, которые созревают раньше (Казан-
чеев, 1947). Плодовитость тюльки от берегов Дагестана исчисляется
от 9.5 до 60 тыс., в среднем 31.2 тыс. икринок, в дельте Волги, где тюлька
мельче, несколько меньше, от 9.2 до 17.4 тыс., в среднем 14 тыс. икри-
нок. Относительная плодовитость (количество икринок на 1 г веса тела)
значительно выше, от 4 до 13 раз, чем у сельдей из рода Alosa (Дмитриев,
1929). Благодаря быстрому созреванию и высокой относительной пло-
довитости обладает большой способностью к восстановлению своих
запасов. Икра выметывается не вся сразу, а несколькими порциями.
8. CLUPEONELLA
2)3
Развитие икры при 8—9° длится 92 часа, при средней температуре
17.6° — 27—30 часов (Ловецкая, 1951). Состав пищи в основном зави-
сит от состава зоопланктона. В северной части моря пища состоит глав-
ным образом из Copepoda (56%) — Calanipeda aquae-dulcis и Heterocope,
caspia, Cladocera (20%) —Evadne trigone, E. camptonyx, E. hircus, Cer-
copages gracillina, временами планктоно-бентические ракообразные —
Mysidae, Amphipoda, Cumacea, на местах икрометания икра этого же
вида. Питается в течение всего светлого времени суток, ночью не питается
или питается в незначительной степени. Питается и в период икроме-
тания, но в незначительной степени (Чаянова, 1951). Половой зрелости
особи, нерестящиеся в Волге и в северной и средней частях моря, дости-
гают на втором году жизни, в южной части частично в возрасте даже
менее одного года. Это, повидимому, будут рыбы, выведшиеся из икры
поздней осенью и зимой и поэтому не имеющие на чешуе первого зимнего
кольца. Тюльки из северной и средней частей моря (от берегов Дагестана)
отличаются от тюлек из южной части, главным образом, меньшими при-
ростами за первый год, достигая большего возраста. Кривая прироста,
за первый год у килек из южной части моря двухвершинна, первый ма-
ксимум (около 7 мм) соответствует приросту особей от весеннего нереста,
второй (около 10 мм) — приросту особей от осеннего нереста. Нересто-
вые косяки в северной части моря в 1941 г. состояли из рыб от одно-
до шестигодовалого возраста, преобладали одногодовалые и четырех-
и трехгодовалые, что, повидимому, было обусловлено различной уро-
жайностью отдельных поколений (Казанчеев, 1947). В средней части
моря в уловах преобладают двух- и трехгодовалые особи, встречаются
одно-, четырех- и пятигодовалые. В дельте Волги преобладают двух-
и трехгодовалые, четырехгодовалых мало, пятигодовалых нет, есть годо-
вики. В южной части моря в уловах преобладают двух- и трехгодовалые,
шестигодовалые не встречаются (Ловецкая, 1951). Самки немного круп-
нее самцов, самки от берегов Азербайджана имеют в среднем длину 102—
107 мм, вес 8.5—-10.0 г, самцы длину 93—101 мм, вес 6.5—8.5 г.
В дельте Волги ловится несколько меньшего размера, что обусловлено,
повидимому, отбирающим влиянием орудий лова. Растет значительно
быстрее, чем черноморско-азовская форма (по данным обратного расчис-
ления Киселевича, 1926 и Дмитриева, 1929):
тт / / дельта Волги.... 57.0 79.6 94.8 110.0 —
Длина (мм) дагестан..........49.7 82.5 99.9 110.9 116.0
Менее .жирна, чем черноморско-азовская форма. В апреле у берегов
Дагестана количество жира довольно значительно (10.84%), к началу
мая в северной части моря значительно уменьшается (до 4.27—6.37%;
Леванидов, 1932), у берегов Ирана (Ашур-аде) — 5.86% (Подсевалов,
1935).
Хозяйственное значение довольно существенное. Уловы
за последние 15 лет возросли с 25 тыс. ц в 1929 г. до 169 тыс. ц.1 Основ-
ная масса улова добывается у берегов Дагестана, Казахстана и в южном
районе Азербайджана; в дельте Волги и у берегов Туркмении промысел
развития не получил. Уловы могут быть значительно увеличены, так как
запасы велики. Лов производится весной во время массовых подходов
1 В Горганском районе в 193'1—1932 г. поймано 240 ц, т. е; 0.2% всего улова
(Подсевалов, 1935).
204
CLUPEIDAE
к берегам, главным образом в марте—апреле; в дельте Волги лов про-
изводился во время хода, в начале мая. К концу массовых подходов
к берегам вместе с тюлькой начинает ловиться молодь сельдей, вследствие-
чего по существующим правилам лов должен прекращаться с 16 апреля
и ранее, если в улове более двух дней подряд будет свыше 5% молоди
других рыб. Главное орудие лова у берегов скипасти, в море также ало-
маны, в южной части моря ставные сети, в дельте Волги ловилась воло-
кушами. Лов с помощью сильных источников света оказался также
эффективным.
*lbi. Clupeonella delicatula caspia m. tscharchalensis (Borodin) —
Чархальская тюлька, чархальская селедочка (табл. VIII).
Clupea cultriventris var. tscharchalensis Бородин, Ежег. Зоолог, муз. Акад..
Наук, I, 2, 1896 : 82, 88, фиг. 1—2 (оз. Чархал в басе. р. Урала). — Clupea cullrivent-
ris var. tscharchaliensis (sic!) Бородин, Вести, рыбопр., XX, 5, 1905 : 282 (в за-
тоне Волги в 84 верстах выше Саратова против с. Воскресенского х); Диксон,
Рыбол. в басе. Волги выше Саратова, VIII, 1909 : 30 (затон Криуша ниже Саратова
и у с. Синеньких). — Harengula tscharchalensis Берг, Мат. позн. русск. рыбол.,
II, 3, 1913 : 45; Рыбы пресных вод России, 1916 : 32, фиг. 50. — Clupeonella delica-
tula m. tscharchalensis Берг, Рыбы пресных вод, I, 1932 : 104, фиг. 105 и 106.
D III—IV 11—13 (11.9), А III 15—19 (16.9), sp. Ъг. 41—50 (47.4),
килевых чешуй 24—29 (26.0). Тело сильно сжатое с боков. Высокотелая
форма, образуемая в замкнутых водоемах от Cl. delicatula caspia. От кас-
пийской формы отличается меньшим количеством жаберных тычинок,
немного меньшим количеством килевых чешуек, менее изогнутым, пря-
мым или почти прямым профилем спины и более высоким телом, наи-
большая высота его 21.5—28.8 (27.4)%, наименьшая высота 8.4—8.9
(8.7)%, высота головы 18.2—19.2 (18.7)% длины тела. Грудные и брюш-
ные плавники несколько длиннее, грудные плавники 15.6—16.9 (16.7)%,
длины тела или 53.9—61.8 (58.4)% расстояния между их основанием,
и основанием брюшных плавников, брюшные плавники 10.4—12.4 (11.6)%,
длины тела. Голова немного длиннее и шире, рыло короче, длина головы
22.2—23.6 (22.9)% длины тела; межглазничный промежуток 17.9—20.0
(19.1)% длины головы, рыло 27.0—29.8 (28.1)% той же длины. В осталь-
ном от типичной формы существенных отличий нет. Окраска яркосере-
бристо-белая, лишь слегка темнее на спине. Длина до НО мм. Описание
дано по 13 экз. длиной 61—102, в среднем 81.9 мм, из оз. Чархал и из.
затонов Волги у Саратова.
Пресноводная форма.
Несмотря на столь резкие отличия внешние и в количестве жаберных
тычинок и пр. это будет только морфа, образуемая в пресных водах про-
ходной тюлькой, подобная морфам Sabno trutta и Osmerus eperlanus.
Распространение. Озеро Чархал в бассейне р. Урала,
в затонах Волги (у с. Воскресенского в 90 км выше Саратова, затон
Криуша в 20 км -ниже Саратова), в ильменях дельты ее.1 2
Биология изучена мало. Представляет несомненно пресновод-
ную, замкнутую в озерах, ильменях и пр. форму от типичной.
Хозяйственного значения не имеет.
1 Этих рыб под названием Clupea kessleri описывает Гримм на стр. 117—Г19>
того же тома «Вести, рыбопр.».
2 Киселевич. Промысловые рыбы Волго-Каспийского района, Астрах.,
1926 : 26.
8. CLUPEONELLA
205
*2. Clupeonella engrauliformis (Borodin) —• Анчоусовидная тюлька, или
сарделька, анчоусовидная килька (неправ.), у берегов Туркмении сар-
динка (неправ.) (табл. VII).
Clupea engrauliformis Бородин, Вести, рыбопр., XIX, 6, 1904 : 335 (Буй-
нак,1 средняя часть Каспийского м.); там же, XXI, 4, 1906 : 197—203, фиг. 1
на стр. 199 (против Буйнак, а и f табл, измер., против Апшеронского п-ова, b—е табл,
измер.); Суворов, Тр. Касп. эксп. 1904 г., II, 1908 : 50, 60, фиг. на стр. 51 (сред-
няя и южная части Каспийского и., по Бородину). — Harengula engrauliformis
Берг, Мат. позн. русск. рыбол., II, 3, 1913 : 46, табл. I, фиг. 3 (средняя часть
Каспийского м. от о. Тюленьего до Апглеронского п-ова); Суворов, там же,
III, 3, 1914 : 1 (количества позвонков, распространение, биология). — Harengula
grimmi (non Kessler) Берг, Рыбы пресных вод, 1923 : 29; Малятский, Тр.
Азовско-черном, научн. рыбохоз. ст., 6, 1930 : 67 (измерения). — Harengula engrau-
liformis Сергеева и Ганешина, Бюлл. Всекасп. научн. рыбохоз. эксп.,
5—6, 1932 : 43 (количества лучей в плавниках, жаберных тычинок, позвонков). —
Clupeonella engrauliformis Берг, Рыбы пресных вод, I, 1932 : 107; Светови-
дов, Докл. АН СССР, XXXI, 8, 1941 : 806; Зоолог, журн., XXII, 4, 1943 : 231;
Докл. АН СССР, XLVI, 5, 1945 : 226; Чугунова, в: Промысловые рыбы
СССР, 1949 : 89.
Распространение, биология. Недошивин, Сборн. в честь
Книповича, 1927 : 296 (искусственное оплодотворение, развитие); Расс и Хал-
fl и н о в а, Сборн., посвящ. деят. Книповича, 1939 : 302 (развитие и распространение
икринок и личинок); С. Пробатов, Изв. Азербайджанск. научно-исслед. рыбо-
хоз. ст., 4, 1939 : 3, 32 (размеры, вес, миграция, биология); Пожалуева, Рыбн.
хоз., 1940, 1 : 26 (распространение, биология); Ловецкая, там же : 27 (рас-
пространение, биология); там же, 1941, 3 : 20 (зрелость, нерест); Каспийские кильки,
изд. Азербайджанск. научно-исслед. рыбохоз. ст., 1941 : 6, 13, рис. 2, карта 1—4
(биология, распределение, промысел); Приходько, Тр. Волго-каспийск. научн.
рыбохоз. ст., IX, 1947 : 65 (восточные берега средней части моря, летом); Р а д а-
ков и Токарев, Рыбн. хоз., 1948, 5 : 13 (лов на свет); Токарев, там
же, 1949, 6 : 33 (восточное и западное побережья моря, лов на свет); Ловецкая,
там же, 1951, 1 : 36 (западное побережье южной части моря; с 4 по 18 июля и с 17
но 22 сентября 1950 г.; лов на свет); Приходько, там же, 1951, 8 : 43 (по обе
стороны южной части моря, с 25 февраля по 19 марта 1951; лов на свет); Бори-
сов, там же, 1951, 11 : 9 (северо-восточное побережье средней части моря,
с 15 июня по 25 сентября 1951 г.; лов на свет); Ловецкая, Каспийские кильки
и их промысел, ’Пищепромиздат, 1951 : 5, 6, 7, 8 и сл., рис. 2, 4—10 (распреде-
ление, миграции, размножение, размеры, возраст, рост, промысел); Н. Тана-
си й ч у к, Промысл, рыбы Волго-Каспия, Пищепромиздат, 1951 : 50 (раз-
меры, вес).
D III 12—14 (12.8), общим числом 15—17 (15.7), А III 15—19 (16.8),
общим числом 18—22(19.8), sp. br. 56—67 (61.3), килевых чешуй 23—31
(27.6), vert: S. 44—47 (46.07), caud. vert. 25—28 (26.52). Тело валькова-
тое, брюшко снизу закругленное, килевые чешуи слабые. Голова корот-
кая и широкая, длина ее 20.4—23.1 (21.4)% длины тела,1 2 межглазничный
промежуток 16.2—18.7 (17.5)% длины головы. Глаза небольшие, 21.6—
27.3 (24.9)% длины головы, заглазничный отдел удлиненный, 39.2—
44.8 (42.0)%, рыло довольно укороченное, 30.4—34.8 (32.7)% той же
длины. Челюсти короткие, верхняя челюсть 35.8—41.5 (39.0)% длины
головы, нижняя челюсть 47.5—53.0 (49.5)% той же длины. Парные плав-
ники короткие, грудные плавники на конце заостренные, составляют
1 Тип не указан, но экземпляры, по которым дано первоописание, сохранились.
За тип следует считать один из этих экземпляров длиной 124 мм, Каспийское м. про-
тив Буйнак, 11 IV 1904, № 13860 коллекции Зоологического института Академии
Наук СССР.
2 В процентах длины тела до конца хвостового плавника: длина головы 18.5—
21.0 (19.5), длина грудного плавника 12.0—14.7 (13.5), длина брюшного плавника
7.4—9.4 (8.4), наибольшая высота тела 14.6—17.5 (16.2), наименьшая высота тела
5.6—6.9 (6.1), высота головы у затылка 10.9—13.1 (12.2).
206
CLUPEIDAE
13.2—16.2 (14.9)% длины тела или 40.4—-54.1 (48.8)% расстояния между
их основанием и основанием брюшных плавников, брюшные плавники
8.1—10.3 (9.2)% длины тела. Тело низкое, наибольшая высота 16.0—
19.2 (17.8)?4 длины его, наименьшая высота 6.2—7.6 (6.7)%, высота
головы 12.0—14.4 (13.4)% той же длины. Спина и верхняя часть головы
у живых темносиние, с зеленым или оливковым оттенком, у мертвых
светлеют или иногда темнеют, становясь почти черными, в особенности
в местах соприкосновения с нитями сетей. Все плавники бесцветные,
за исключением хвостового, почти черного у основания, и спинного
с неясной темной поперечной полосой посредине. Длина до 155, наичаще
115—125 мм, вес до 26.4 г, наичаще 10.5—16.5 г. Описание дано по 64
экз. длиной от ИЗ до 150, в среднем 122.3 мм, собранным 8—9 XI 1938.
в южной части Каспийского моря против Апшеронского п-ова. По дан-
ным Сергеевой и Ганешиной (1932), А 15—16 (15.4), жаберных тычинок 57—
63 (60), позвонков 44—47 (46). По сообщению Е. В. Пожалуевой, у иссле-
дованных ею рыб от берегов Туркмении позвонков 44—48 (46.0).
Со.лоноватоводная рыба, в пресные воды и в сильно опресненные
части моря не заходит.
Распространение. Средняя и южная части Каспийского'
моря, в северной части встречается не далее границы опреснения. Нерест
главным образом в средней и южной частях моря вдоль западных и
восточных берегов как в открытом море, так и в прибрежной области,
а также и на мелководье в северных районах средней и южных районах
северной частей.
Биология. Встречается главным образом в открытом море,
но иногда подходит и к берегам. В зимнее время держится в южной части
моря, преимущественно над глубинами от 40 до 750 м при температуре
воды 8.5—9° и выше, до 13.5°. В средней части моря встречается в незна-
чительных количествах, преимущественно в южной половине. В теплые
зимы держится как в западной, так и в восточной половине южной части
моря, в холодные отходит в его южные, юго-восточные и восточные райо-
ны. Весной, с апреля или мая одни стада начинают мигрировать в сред-
нюю и частично в северную часть моря, подходя к берегам лишь в очень
редких случаях, изредка довольно в большом количестве, и придержи-
вается обычно свала и струи постоянного течения вдоль западного и в мень-
шей степени восточного побережья. В 1946 и 1947 гг. в большом коли-
честве обнаружена летом у восточных берегов. от п-ова Мангышлака
до зал. Кендырли, где в 1946 г. составляла 32% (8.5 тыс. ц) в уловах
обыкновенной тюльки. Держится и здесь на некотором отдалении (1—
10 миль) от берегов, в более открытых частях моря (в 10—20 милях от
берега) встречались косяки, состоявшие исключительно из этого вида
(Приходько, 1947). В северную часть моря дальше границы опреснения
не идет. Другие стада остаются в южной части моря, концентрируясь
у западного и восточного побережий, точно также не подходя к берегам,
за исключением немногих более или менее приглублых районов (над
глубинами более 25 м) у берегов северной части Туркмении, где под-
ходит летом и осенью — в 1935 г. в мае—июне и в октябре; в последние
годы подходы к берегам здесь незначительны. С конца сентября
начинается отход из северной половины средней части моря, но в ее
южной половине, преимущественно у западных берегов, держится
в массе в течение всей осени и ловится в наибольших количествах над
небольшими глубинами (25—100 м), богатыми в это время планктоном.
Миграции, как и весной, происходят в области гидрологического течения
8. CLUPEONELLA
207
вдоль западного и отчасти восточного побережий. С охлаждением поверх-
ностных слоев воды до 5—6° опускается в нижние горизонты и держится
в более глубоких слоях воды, наичаще от 8 до 32 м; в самых поверхност-
ных слоях воды скопления наблюдаются редко, ниже 32 м, хотя и встре-
чается, но в незначительном количестве. Весной, с началом прогревания
воды до 11—15° и выше подымается к поверхности, где преимущественно
и держится летом при температуре воды около 16—17°. В июле—сен-
тябре при прогревании воды до 26—28° и выше отходит дальше от бере-
гов и вновь опускается в нижние слои, в октябре — ноябре подымается
опять к поверхности (Ловецкая, 1951). Однако ловом на электросвет
установлено, что по обе стороны южной части моря с конца февраля
по середину марта 1951 г. держалась главным образом на глубине от 30
до 60 м, встречалась также до глубины 78 м (Приходько, 1951). В пер-
вой половине июля и во второй половине сентября 1950 г. у западных
берегов южной части моря тем же способом лова обнаружено, что в наи-
большем количестве держалась в зоне температурного скачка, па глу-
бине 35—-42 м. В зависимости от глубины расположения слоя темпера-
турного скачка, летом и осенью в наибольшем количестве может дер-
жаться даже на глубине и более 40 м (Ловецкая, 1951). В период икро-
метания в большинстве случаев преобладают самцы (73.5%), которые,
невидимому, держатся на нерестилищах более долгое время, в то время
как самки уходят сразу же после выметывания икры. По окончании
нереста при переходе к интенсивному питанию в уловах преобладают
самки. Самцы во время нереста, как правило, держатся преимущественно
на глубине 10—20 м, самки — на глубине 20—25 м. Самки немного
крупнее самцов: средние размеры самок 116 мм, самцов — около 112 мм,
средний вес самок 11 г, средний вес самцов — около 10 г. Нерест про-
исходит с конца апреля—начала мая по ноябрь, наиболее интенсивно
в июле, при температуре воды 13—24° и солености 8—13 % о, в открытом
море с глубинами от 10—20 м и выше, в массе над глубинами от 50-
до 200 м. Икрометание порционное. Развитие икринок при температуре
17.9° происходит в 30—34 часа. В открытом море, как и Cl. delicatula
caspia, планктоноядна (Copepoda, пелагические Mysidae и Gammaridae),
причем нередко поедает мальков Cl. grimmi (?) и даже личинок сельдей..
У берегов питается тем же, чем и Cl. delicatula caspia (Copepoda, Сшпа-
сеа, Schizopoda и Amphipoda). Половой зрелости достигает в трехгодо-
валом возрасте, частично и в двухгодовалом. У берегов Туркмении зимой
и весной в уловах дрифтерных сетей преобладают четырех- и трехгодо-
валые, наибольший возраст — семигодовалый (Ловецкая, 1941, 1951).
Обладает наилучшим ростом по сравнению с другими видами рода,
(по данным Ловецкой, 1951):
Возраст................... 1 2 3 4 5
Средняя длина (мм)....... 60—69 85—110 105—125 120—128 135—140
Хозяйственное значение несмотря на большие запасы
до последнего времени было ничтожно. Уловы могут быть значительно-
увеличены путем организации промысла в открытом море, в частности
весьма перспективен лов на свет. Ловится прибрежным промыслом и
учитывается вместе с Cl. delicatula caspia. У восточных берегов средней
части моря уловы ее выше последней. Благодаря применению лова
на электросвет, уловы в 1951 г. превысили уловы обыкновенной тюльки.
Повидимому, большую роль играет в питании хищных сельдей и некото-
рых других рыб. •
208
CLUPEIDAE
*3. Clupeonella abrau (Maljatskij) — Абрауская тюлька, или сар-
делька (табл. VII).
Harengula abrau Малятский, Тр. Азовско-черном, рыбохоз. ст., 6, 1930 :
•65 (оз. Абрау близ Новороссийска1); Водяниц кий, Раб. Новоросс. биолог,
ст., I, 4, 1930 : 154, фиг. 2 (икринки и личинки, биология). — Clupeonella abrau
Берг, Рыбы пресных вод, I, 1932 : 106, рис. 107 и 108. — Clupeonella muhlisi
Neu, Intern. Rev. ges. Hydrob. u. Hydrogr., XXX, 1934 : 446, f. 1—4 (оз. Абу-
.лионд, басе. Мраморного м.).—Clupeonella abrau Световидов, Докл. АН
СССР, XXXI, 8, 1941 : 801; Зоолог, жури. XXII, 4, 1943 : 231; Докл. АН СССР,
XLVI, 5, 1945 : 226.
D III 10—12 (11.7), общим числом 13—15 (14.7), А III 15—17 (16.1),
•общим числом 18—20 (19.1), sp. br. 39—50 (44.8); килевых чешуй 23—26
(23.3), caud. vert. 23—25 (23.77), vert. S. 41—42 (41.51). Тело сжатое
с боков, брюшко снизу заостренное, килевые чешуи довольно хорошо
выраженные. Голова довольно удлиненная и узкая, длина ее 22.0—23.2
{23.0)% длины тела,1 2 межглазничный промежуток 16.2—17.5 (16.7)%
длины головы. Глаза довольно большие, 25.0—29.0(28.1)% длины головы,
заглазничный отдел укороченный, 36.8—41.0 (38.7)%, рыло укорочен-
ное, 28.6—33.5 (31.9)% той же длины. Челюсти не особенно длинные,
верхняя челюсть 39.4—45.5 (42.8)% длины головы, нижняя челюсть
50.2—55.4 (53.2)% той же длины. Грудные и брюшные плавники корот-
кие, грудные плавники на конце заостренные, составляют 14.6—17.6
(15.8)% длины тела или 45.8—57.6 (51.9).% расстояния между их осно-
ванием и основанием брюшных плавников, брюшные плавники 9.4—
10.6 (10.0)% длины тела. Тело довольно высокое, наибольшая высота
18.7—23.2 (20.5)% длины его, наименьшая высота 5.9—6.8 (6.4)%, высота
головы 16.1—18.1 (16.6)% той же длины. Спина и верхняя часть головы
слабо пигментирована, оливково-зеленого цвета, бока и брюхо серебри-
•сто-белые. Длина до 95 мм, в оз. Абулионд до 60 мм. Описание дано
по 10 экз. длиной от 72 до 95, в среднем 73.9 мм, собранным в мае—июне
1937 г. По данным Малятского (1930), D III И—12, А III 17—19,
жаберных тычинок 42—52, килевых чешуй 24—27; по данным Неу,
D 14—15, А 16—-18, килевых чешуй 26—28.
Пресноводная рыба.
Cl. muhlisi Neu несомненно идентична этому виду, являясь, вероятно,
особой формой (С7. abrau muhlisi).
Распространение. Пресноводное замкнутое оз. Абрау, рас-
положенное недалеко от Новороссийска на высоте около 70 м над ур. м.,
и оз. Абулионд (Abuliond, Турция), стоящее в связи с Мраморным морем.
Биология. Период размножения сильно растянут, продолжается
с мая по октябрь. Нерест происходит по всему озеру, ночью, непосред-
ственно после захода солнца. Икра пелагическая, развитие ее происходит
очень быстро, личинки при температуре поверхностных слоев воды
22° выклевываются часов через 10—12 после выметывания, к утру,
днем икринки уже не встречаются. Личинки тотчас же после выклевы-
вания опускаются ко дну, откуда к поверхностным слоям воды поды-
маются вновь после всасывания желточного пузыря. Крайне быстрое
1 Тип не указан. За тип следует считать экземпляр длиной 82 мм, оз. Абрау,
V—VI 1937, № 28351 коллекций Зоологического института Академии Наук СССР.
2 В процентах длины тела до конца хвостового плавника; длина головы 20.0—
21.1 (20.9), длина грудного плавника 13.3—16.0 (14.4), длина брюшного плавника
8.5—9.6 (9.1), наибольшая высота тела 17.0—21.1 (18.6), наименьшая высота тела
5.4—6.2 (5.8), высота головы у затылка 14.6—16.5 (15.1).
8. CLU РГ.ОУ I'.LLA
209
развитие икринок и опускание из поверхностных слоев личинок является
приспособлением против выбрасывания их на берег из поверхностных
слоев небольшого, но довольно бурного озера. Половая зрелость насту-
пает через год при длине 35—45 мм, двухгодовалые имеют длину 70—
80 мм. Наиболее активный образ жизни ведет ночью. Взрослые питаются
ракообразными (Mesomysis и Heterocope}, годовалые поедают Copepoda,
яйца коловраток и растительные организмы. Образ жизни в оз. Абу-
лионд^ не изучен, питается здесь водорослями, коловратками.
Хозяйственного значения не имеет.
*4. Clupeonella grimmi Kessler — Большеглазая тюлька, или сар-
делька, большеглазая килька (неправ.) (табл. VII).
Clupeonella grimmi Кесслер, Рыбы Арало-касп.-понт. обл., 1877 : 187,
। табл. VI, фиг. 24 (личинки из средней части Каспийского моря; 1 48—49 позвонков).—
Harengula macrophthahna К н и п о в и ч, Тр. Касн. экси. 1914—1915 г., 1921 : 719,
727; Сергеева и Ганеши на, Бюлл. Всекасп. научн. рыбохоз. эксп., 5—6,
1932 : 43 (количества лучей в плавниках, жаберных тычинок, позвонков). — Clupeo-
nella grimmi Берг, Рыбы пресных вод, I, 19.32 : 101; Световидов, Докл.
АН СССР, XXXI, 8, 1941 : 801; Зоолог, журн., XXII, 4, 1943 : 231; Докл. АН СССР,
XLVI, 5, 1945 : 226 (описание).
Распространение, биология. С. Пробатов, Изв. Азербай-
I джанск. научно-исслед. рыбохоз. ст., 4, 1939 : 3, '32 (размеры, вес, биология);
Ловецкая, Рыбн. хоз., 1940, 1 : 30 (распределение); там же, 1941, 3 : 20 (зре-
лость, нерест); Каспийские кильки, изд. Азербайджанок, научно-исслед. рыбохоз.
ст., 1941 : 7, 17, рис. 3, карты 1—4 (биология, распределение, промысел); П р и-
х о д ь к о, Рыбн. хоз., 1951, 8 : 43 (по обе стороны южной части моря, с 25 февраля
по 15 марта; лов на свет); Ловецкая, Каспийские кильки и их промысел, Пище-
промиздат, 1951 : 5, 6, 7, 8,.19 и сл., 22, 31, 35, 37, рис. 3—10 (распределение, мигра-
ции, размножение, размеры, возраст, рост, промысел); Н. Танасийчук, Про-
мысл. рыбы Волго-Каспия, Пищепромиздат, 1951 : 51 (размеры, вес).
D III (IV) 13—15 (14.2), общим числом 16—18 (17.2), А III 18—21
(19.1), общид^ числом 19—24 (22.1), sp. br. 42—51 (47.5), килевых чешуй
26—32 (28.8), vert. 8. 46—48 (46.4). Тело и в особенности брюшко сильно
сжатые с боков. Брюшко снизу заостренное, килевые чешуйки хорошо
развитые. Голова удлиненная и узкая, длина ее 23.5—26.7 (25.0)%
длины тела,1 2 межглазничный промежуток 13.0—15.3 (14.1)% длины
головы. Глаза довольно крупные, 25.8—31.5 (28.6)% длины головы,
j заглазничный отдел сильно укороченный, 32.6—39.5 (36.0)%, рыло
। удлиненное, 33.4—39.0 (35.4)% той же длины. Челюсти удлиненные,
верхняя челюсть 43.0—49.5 (46.7)%, нижняя — 54.6—61.8 (57.9)% длины
головы. Грудные и брюшные плавники удлиненные, грудные плавники
на конце закругленные, составляют 16.1—19.8 (18.0)% длины тела или
58.0—74.6 (64.1)% расстояния между их основанием и основанием брюш-
ных плавников, брюшные плавники 9.7—13.2 (11.2)% длины тела. Тело
довольно высокое, наибольшая высота его 17.5—22.6 (20.3)%. длины его,
наименьшая высота 6.1—7.7 (6.6)%, высота головы 15.5—18.2 (16.7)%
той же длины. Спина и верхняя часть головы темные. Длина до 145 мм,
1 Тип не указан, но личинки, по которым сделано описание, сохранились в кол-
лекциях Зоологического института Академии Наук СССР и Лаборатории гидробио-
логии и ихтиологии Ленинградского Государственного университета. За тип следует
считать личинку длиной 31.5 мм, Каспийское море, 41°6 с. ш., 0°26' в. д., 90 саж.,
1876 г., Гримм, № 10934 коллекции Зоологического института Академии Наук СССР.
2 В процентах длины тела до конца хвостового плавника: длина головы 21.2—
24.0 (22.5), длина грудного плавника 14.5—17.8 (16.2), длина брюшного плавника
8.7—11.9 (10.1), наибольшая высота тела 15.7—20.3 (18.3), наименьшая — 5.5—6.9
15.9), высота головы у затылка 13.9—16.4 (15.0).
14 Фауна СССР — 314
210
CLUPEIDAE
наичаще 105—110 мм (до конца средних лучей хвостового плавника),,
вес до 20 г, наичаще 7—11 г. Описание дано по 50 экз. длиной от 91
до 141 мм, в среднем 106.2 мм, собранным 8—9 XI 1938 в южной части
Каспийского м. против Апшеронского п-ова (11 экз.) и 20 XII 1914
к северу от Пехлевийского зал. (39 экз.). По данным Сергеевой и Гане-
шиной (1932), А 14—20 (17.4),1 жаберных тычинок 43—50 (46), позвонков
44—49 (47).
Солоноватоводная рыба, в пресные и сильно опресненные воды не
заходит.
Распространение. Каспийское море, главным образом
в южной части, в меньшем количестве в средней части, в северной части
не найдена. Держится в открытом море, к берегам не подходит. Нерест,
повидимому, в центральных областях южной и против западных бере-
гов в средней части моря.
Биология. Держится исключительно в открытой, галистати-
ческой области моря, к берегам не подходит. Зиму проводит в южной
и отчасти средней части моря, где ловится над большими глубинами,
400—600 м, держась, повидимому, в основном не в поверхностных слоях
воды, а на некоторой глубине, более 32 м от поверхности,1 2 при темпера-
туре 9—11°, ниже 5° обнаружена не была. Весной, в середине марта,
начинает мигрировать в среднюю часть моря, преимущественно в его
более прогретую восточную половину, распространяясь не далее райо-
нов с глубиной 50 м. Летом держится в средней и южной частях моря,
в среднюю часть севернее линии Махачкала—Мангышлак не идет, но и
в этих миграциях участвует незначительная часть. В первой половине
лета (в июне—июле) ловится над глубинами больше 40 м. Во второй
половине лета отходит в более глубокие районы моря, так как в боль-
шинстве случаев ловится над глубинами 100 м и более. В ноябре—дека-
бре большая часть уходит из средней части моря в южную. В марте—
апреле держится в верхних слоях воды. В июле—сентябре с прогрева-
нием воды опускается в более глубокие слои воды и летом и осенью кон-
центрируется на глубине 16—32 м. Нижняя граница распространения
точно не установлена, в 1932 и 1935 гг. ловилась на глубине 90—100 м..
На местах икрометания в большинстве случаев преобладают самцы
(94.4%), которые, повидимому, дольше здесь задерживаются, а самки
уходят тотчас после окончания нереста. Самцы в период нереста, как
правило, держатся преимущественно на глубине 10—20 м, самки —
с глубины 20—25 м. Нерест отмечен в средней и южной частях моря
с января по сентябрь, в местах с большими глубинами, чем у двух дру-
гих видов, при температуре воды от 6—13° и выше и солености 12.6—
13J/oo- Икрометание порционное. Плодовитость от 6.5 до 28.3, в среднем
15.9 тыс. икринок. Развитие икры при температуре воды 17.8° длится
25—28 часов (С. Пробатов, 1939; Ловецкая, 1941, 1951). Личинки, по ука-
занию Книповича, были найдены Гриммом на глубине от 80.5 до 732 м
(44—400 саж.),3 что Книпович считает мало вероятным. По его мнению,
нахождение личинок даже на глубине 467 м (250 саж.) и тем более 732 м
1 Количество лучей в анальном плавнике здесь указано несомненно ошибочно..
Наши просчеты были проверены под бинокуляром.
2 Зимой 1951 г. (с 25 февраля по 15 марта) по обе стороны южной части моря
в поверхностном 40-метровом слое совершенно отсутствовала, держась в основном,
на глубине от 60 до 80 м и, вероятно, значительно глубже (Приходько, 1951).
3 По указанию Кесслера, эти личинки были пойманы на меньшей глубине —
от 146.4 до 457.5 м (80—250 саж.).
0. ALOSA
211
невозможно. Личинки, повидимому, этого вида Каспийской экспеди-
цией 1904 г. были пойманы на глубинах 100—150 м в средней и 86.5 —
130 м и 138—186 м в южной частях моря. Наибольшая глубина нахо-
ждения личинок экспедицией 1914—1915 гг. была от 300 до 450 м в сред-
ней части моря в конце января. Годовалые встречались начиная от
50-метровой изобаты; количество их увеличивалось к глубине 100м (Ловец-
кая, 1951). Исключительно планктоноядная; основной пищей являются
Copepoda, более крупные формы — пелагические Mysidae и мальки рыб
имеют большее значение, чем в питании обоих других видов. Половой
зрелости достигает в двухгодовалом возрасте, в уловах дрифтерных
сетей встречается в двух-шестигодовалом возрасте, преимущественно
в четырех- и трехгодовапом. Самки несколько крупнее самцов, в среднем
имеют длину около 110 мм, самцы — около 107 мм; средний вес самок
около 7.1 г, самцов — около 6.9 г. Растет несколько медленнее анчо-
усовидной тюльки (по данным Ловецкой, 1951):
Возраст............. 1 2 3 4
Длина (мм).......... 46—54 78—90 до 96 до 109 .
Хозяйственного значения в настоящее время не имеет,,
так как существующим прибрежным промыслом не используется. Более
перспективен лов на свет. Хищными рыбами используется в пищу меньше,
чем обыкновенная тюлька.
9. Ргд ALOSA CUVIER
Alosa Cuvier, Regne --'jimal, ed. II, II, 1829 : 319 (тип:Л. alosa). — Alausa
Valenciennes, in: Cuvier et Valenciennes, Hist. nat. poiss.,
XX, 1847 : 389 (тип: A. Ugaris =A. alosa).— Clupeonella (non Kessler) Берг,
Мат. позн. русск. рыбол., .1, 3, 1913 : 10 (тип:С7. caspia — A. caspia caspia). — Cas-
pialosa Берг, там же, IV, 6, 1915 : 4 (тип: С. caspia=A. caspia caspia). —Alosa
Regan, Ann. Mag. Nat. Hist. (8), XVIII, 1916 : 6 (обзор видов и близких родов). —
Paralosa Route, Poiss. eau douces France, 1925 : 73 (тип: A. fallax-, non Paralosa.
Regan, 1916).-
Верхняя челюсть с заметной медиальной вырезкой в межчелюстных
костях. На глазах сильно развитые жировые веки, прикрывающие сзади
и спереди большую часть их. При основании хвостового плавника на обеих
лопастях по удлиненной чешуе (ala, рис. 12). Удлиненных последних
двух лучей анального плавника и кожистой лопасти на вертикальной
части ключицы нет. На крышечной кости ясные радиальные бороздки.
Брюхо сжатое с боков, на всем протяжении от горла до начала аваль-
ного плавника покрыто хорошо развитыми брюшными килевыми чешуями,
образующими острый киль как позади, так и впереди брюшных плавни-
ков. Рот конечный, иногда нижняя или верхняя челюсть слегка выдаются
вперед, большой: сочленение нижней челюсти с черепом позади верти-
кали заднего края глаза, задний конец верхнечелюстной кости прости-
рается до вертикали середины глаза или почти достигает вертикали
заднего края его. Зубы на межчелюстных, верхнечелюстных и нижне-
челюстной костях и на нёбных и на языке есть (у Л. kessleri kessleri, A. brash-
nikovi, A. saposhnikovi, A. sphaerocephala') или отсутствуют (у A. fallax
и др., у A. fallax и A. caspia иногда отсутствуют на нижнечелюстных,
у A. kessleri volgensis на нижнечелюстных слабые или отсутствуют), зубы
на сошнике, расположенные на продольном гребне головки его, есть
или отсутствуют (у A. fallax й близких видов, иногда у A. kessleri ool-
14*
222
CLUPEIDAE
gensis). Жаберные тычинки короткие и толстые или тонкие и длинные,
числом от 18 до 180, у видов с большим количеством их тычинки верхней
части жаберной дуги налегают на тычинки нижней части дуги. Отростки
плавательного пузыря помещаются в prooticum и pteroticum. Начало
спинного плавника над началом брюшных или последние расположены
под передней третью спинного. Основание спинного плавника лежит
в бороздке, образованной расширенными чешуями, более крупными
у начала его. Позвонков 43—59. С каждой стороны тела по темному пятну
за жаберной крышкой сверху, иногда за ними ряд из нескольких пятен,
у некоторых, кроме того, под этим рядом есть второй и изредка третий
из меньшего числа пятен. Икринки полупелагические, держатся во взве-
шенном состоянии в природных слоях воды, с большим околожелтковым
пространством. Размеры в половозрелом состоянии 160—520 мм.
Сколе т.1 Bulla prootica крупнее по размерам, чем b. pterotica.
В. prootica на черепе сбоку (табл. XL—LII, Л) образует большое и вы-
пуклое вздутие; вздутие b. pterotica снаружи ни сбоку, ни сверху не вы-
ражено. Каждый отросток плавательного пузыря расположен в углуб-
лении вдоль переднего края occipitale laterale, сзади и отчасти сверху
ограниченном гребнем; отверстие, через которое отросток входит в череп,
расположено сверху, под opisthoticum. Fenestra auditiva небольшая,
обычно овальной формы, далеко отстоит от bulla prootica /Спереди и от
гребня вдоль отростка плавательного пузыря сзади. Fossa praeepiotica
большая, несколько большая по размерам, чем foramen temporale, имеет
форму треугольника, обращенного вершиной вниз, высота ее меньше
длины. Foramen temporale сравнительно небольшое, длина его немного
меньше длины fossa praeepiotica, наиболее высоко посередине. Сочленовная
поверхность hyomandibulare разделена па две обособленные части па
sphenoticum и pteroticum. Сошник и передняя часть парасфеноида почти
прямые, передняя часть парасфеноида посередине сверху закругленная,
крылья парасфеноида выдаются вниз под миодомом, нижний край их
прямой или слегка изогнутый, заостренные на концах. Нисходящий
отросток базисфеноида длинный, часто почти достигает парасфеноида.
Задний край supraoccipitale и каждого epioticum на черепе сверху (В)
расходится под прямым углом. Pteroticum сзади оканчивается небольшим
шипом. Передний конец каждого sphenoticum отходит в стороны, иногда
немного направлен вперед или назад, на конце закругленный или с неболь-
шим крючкообразным отростком сзади, короткий или более длинный,
варьируя во всех этих отношениях в зависимости от формы и индиви-
дуально. Поперечные отростки ethmoidalia lateralia выдаются из-под
переднего конца лобных костей, значительно варьируют по форме и направ-
лению. Передние отростки мезэтмоида направлены в стороны и немного
вперед, прямые, немного закругленные на концах. Ширина черепа варьи-
рует у разных видов, наибольшая ширина его содержится от 2V1 до 1% раз
в длине, ширина лобных костей от 4% до Зх/5 раз, наиболее широк череп
у A. fallax. Сошник снизу черепа (В) закругленный, головка его с широ-
ким и высоким гребнем, несущим зубы, у некоторых (Л. fallax и близкие
виды, иногда у A. kessleri volgensis), у которых зубы на сошнике отсут-
ствуют, гребень развит очень слабо, узкий и закругленный; передняя часть
парасфеноида плоская, обычно более узкая сзади, крылья парасфеноида
1 Описание и рисунки черепа A. fallax ал. у Мэтьюза (Matthews, 1887 : 274—
292), Райдвуда (Ridewood, 1904а : 453—459, f., 122—124), A. sapidissima у Трэси
<Тгасу, 1920 : 439—474, pl. 1—3).
9. ALOSA
213
разделяются и сразу
широко расходятся под
серединой prooticum.
Сзади на черепе (Z1) fos-
sae temporales posterio-
res отсутствуют, с каж-
дой стороны между отро-
стком opisthoticum и
шипом pteroticum рас-
положена fossa subtem-
poralis. На hyomandi-
bulare сверху две отчет-
ливо обособленные го-
ловки для сочленения с
черепом. Quadratum с
глубокой выемкой в
верхнем крае, передний
угол ее вытянут. Ниж-
нечелюстная и сочле-
новная кости удли-
ненные и низкие, пер-
вая длиннее последней.
Предкрышечная кость
значительно уже широ-
кой крышечной. Описа-
ние дано по многим ске-
летам почти всех видов
и форм, встречающихся
в наших водах, и по
одному скелету A .fallax.
С олонов атов одные
или проходные рыбы,
последние образуют ряд
пресноводных форм, р
5 или, возможно,' 6
видов с рядом подви-
дов в Каспийском, Чер-
ном и Азовском морях
и 2—4 вида с несколь-
кими подвидами у ев-
ропейских и американ-
ских берегов Атлантиче-
ского океана, в Бал-
тийском, Средиземном
и отчасти в Черном мо-
рях и впадающих в
них реках (рис. 27).
Относящиеся к этому
роду виды разделялись
на два рода — Alosa и
Caspialosa по отсутст-
вию зубов на сошнике
и нёбных костях у пер-
Рис. 27. Распространение рода Alosa.
каспийско-черноморские виды и их формы (подрод Caspialosa): 2 — A. fallax и его формы; 3— A. alosa и его формы; 4 — A. sapidissima
(в Мексиканском_зал. близкая форма).
214
CLUPEIDAE
вого и наличию их у второго. Однако у A. caspia и A. kessleri volgensis эти зу-
бы развиты слабо, иногда почти не заметны, а у A. kessleri volgensis зубы
на сошнике иногда могут отсутствовать совершенно, причем гребень вдоль
головки сошника у таких рыб бывает даже менее развит, чем у А. /allax
Такой же переходный характер имеют и другие признаки отличия (зубы
на челюстных костях) между Alosa и Caspialosa. Вообще степень развития
зубов на одних и тех же костях у разных видов, как указывалось выше,
варьирует в широкой степени — от сильно развитых до слабых, едва
заметных, или совершенно отсутствующих, как и у видов Sprattus. Разли-
чия в окраске тем более не могут быть признаны достаточными для разде-
ления обоих родов, так как ряд темных пятен на теле, постоянно имею-
щийся у видов Alosa, имеют и некоторые формы Caspialosa. Самым суще-
ственным является то, что по строению черепа оба рода не имеют таких
отличий, по каким различаются другие роды семейства (например Sardina,
Sardinops и др. из подсем. Clupeinae). По всем признакам виды обоих родов
представляют близко родственную группу, в которой виды, относимые
к Alosa, по комплексу признаков, положенных в основу системы, являются
более прогрессивными по сравнению с видами, относимыми к Caspialosa
(см. «Система семейства и принципы классификации», стр. 22 и сл.).
Череп видов, относимых к Alosa, лишь несколько более широк, чем у
видов, относимых к Caspialosa. Это наблюдается и у ряда других родов,
в частности Clupeonella, у более прогрессивного вида которого Cl. de-
licatula череп значительно шире, чем у менее прогрессивного Cl. grimmi.
Таким образом, имеющиеся морфологические различия не дают оснований
для разделения обоих родов. Особенности распространения, история раз-
вития (см. «Географическое распространение», стр. 55 и сл.) и имеющиеся не-
большие различия дают возможность считать их самое большее за подроды.
Все виды рода по характерному внешнему виду делятся на две группы:
1) пузанков с более высоким, сжатым с боков и укороченным в хвостовой
части телом, большой и высокой, клиновидно сжатой с боков головой
и длинными грудными плавниками и 2) сельдей с низким, не сжатым
с боков и не укороченным в хвостовой части телом, более короткой, низ-
кой и не сжатой клиновидно с боков головой и короткими грудными
плавниками. По ряду морфологических особенностей пузанки являются
более примитивными видами, чем сельди (см. об этом стр. 25 и сл.); экологи-
чески эти группы различаются тем, что виды и формы сельдей являются
более реофильными, пузанков — стагнофильными. Среди последних нет
настоящих проходных видов и форм, те же формы, которые заходят для
размножения в реки, нерестуют в отличие от проходных сельдей не в основ-
ном русле, а в ильменях, на полоях и т. п.
Кесслер был первым, если не считать неопределенных высказываний
Палласа (Zoogr. rosso-asiatica, III, 1811 : 205), Бэра (Bull. Cl. phys.-
math., XVI, 1858 : 327, 332) и некоторых других, кто сопоставил каспий-
ских и черноморско-азовских сельдей и указал на близость их. Впервые
им была отмечена (Тр. СПб. общ. ест., I, 1870 : 76) близость к каспийским
проходным черноморско-азовской проходной сельди (С. pontica auct.),
причем затруднительно сказать, какую из каспийских проходных сельдей
он имеет в виду под названиями Clupea caspio-pontica и Clupea rossica (nom-
ina nuda). Под именем Clupea pontica и Alosa caspia им, несомненно, смешаны
(цит. раб. : 281, 282) A. kessleri kessleri и A. kessleri roZgezzsis, а с послед-
ним, кроме того, и A. caspia.1 Несколько позднее Кесслер (там же, V, 1,
1 Один из экземпляров, пойманных в сентябре 1809 г. у Ярославля относится
к A. caspia caspia (см. об этом ниже, стр. 245).
9. ALOSA
21.5
1874 : 301) еще в более определенной форме указывает на близость каспий-
ских и черноморско-азовских форм A. caspia, причем совершенно правильно
•отмечает и признаки отличия черноморской разности, как он ее называет
(более сильно развитые зубы, меньшее количество жаберных тычинок
и др.). Что касается Cl. pontica, то под этим названием он, повидимому
смешивает, судя по числу жаберных тычинок (35—55), из черноморско-
азовских сельдей A. kessleri pontica и A. brashnikovi maeotica, а из каспий-
ских, для которых он приводит еще меньшее число жаберных тычинок
(25—£8), по мнению Гримма (Астраханская селедка, СПб., 1887 : 5),
исследовавшего экземпляры, определенные Кесслером, «3 различных
формы — 2 самостоятельных вида и продолговатую разность предыду-
щего вида» (Cl. caspia), т. е. современные A. brashnikovi brashnikovi, A. kessle-
ri kessleri и A. kessleri volgensis. После Кесслера сельди обоих бассейнов
были сопоставлены Бородиным (Ежегодн. Зоолог, муз. Акад. Наук,
1, 1896 : 82—84), которым было указано (Вести, рыболр., XIX, 3, 1904 ;
176) на близость каспийских морских сельдей к черноморско-азовской
и установлен общий для них вид Clupea caspio-pontica, в качестве разно-
видностей которого он рассматривает A. saposhnikovi, A. brashnikovi trashni-
kovi, A. brashnikovi grimmi и A. brashnikovi maeotica. Самое название
caspio-pontica Borodin является, как это отмечено Бергом (Мат. позн.
русск. рыбол., II, 3, 1913 : 19), синонимом saposhnikovi Grimm 1887.
Кроме того, это название есть nomen praeoccupatum (см. выше caspio-
pontica Kessler). Несколькими годами ранее последней из упомянутых
работ Бородина, Гримм (Вести, рыбопр., XVI, 2, 1901 : 57), описывая
новые формы сельдей из Азовского моря, сделал также некоторое сопостав-
ление их с каспийскими. Позднее сельди обоих бассейнов изучались друг
от друга отдельно [каспийские Бергом (Мат. позн. русск: рыбол., II,
3, 1913), Киселевичем (Каспийско-волжские сельди, I, 1923), Мейснером
и Михайловской и некоторыми другими; черноморско-азовских изучали
Antipa (Denkschr. Akad. Wiss. Wien, math.-naturw. KI., LXXVIII, 1905,
1906), Браунер (Тр. Бессарабск. общ. ест., II, 2, 1912), Исаченко (Тр.
Всеукр. Гос. черном.-азовск. научно-промысл. оп. ст., I, 1925), Алексан-
дров (Тр. Керченск,- ихт. лаб., I, 1, 1926), Borcea (Ann. Sci. Univ. Jassy,
XIX, 1934; XXII, 1936; XXV, 1939), Майорова (Тр. Научн. рыбо-
хоз. биолог, ст. Грузии, II, 1939)] и лишь некоторые сравнительные
замечания о каспийских и черноморско-азовских сельдях были сделаны
Киселевичем (Изв. Отд. рыбол. и научно-промысл. исслед., I, 1, 1918 :
21), отметившим, что последние отличаются от каспийских меньшими
размерами. При этом из каспийских сельдей изучались преимущественно
встречающиеся в северной части этого моря (Киселевич, цит. раб.; Аве-
ринцев и Сыч, Тр. Астрах, научн. рыбохоз. ст., VII, 3, 1930), а встречаю-
щиеся в западной части Черного моря (Antipa, 1. с.; Исаченко, цит. раб.;
Borcea, 1. с.) — независимо от встречающихся в восточной части его ив Азов-
ском море. Изучение каспийских сельдей по всему бассейну после работы
Берга (1913) было предпринято в сравнительно недавнее время Мейсне-
ром и Михайловской (Михайловская, Докл. АН СССР, XXX, 6, 1941),
исследовавшими обширные материалы и описавшими ряд новых форм,
главным образом из южной части моря, причем система и систематиче-
ские обозначения каспийских сельдей как Мейснером и Михайловской,
так и большинством других авторов (Морозов, Тр. Научн. инет. рыбн.
хоз., II, 4, 1928), в том числе и Киселевичем (Промысловые рыбы Волго-
каспийского района, Астрах., 1926; Сельди северного Каспия, Сталингр.,
.1937), предложившим ранее (цит. раб., 1923) считать всех каспийских
216
CLUPEIDAE
сельдей формами одного вида (С. caspia), были приняты, согласно Бергу
(цит. раб., 1913; Рыбы пресных вод, 1923; там же, I, 1932). Несколькими
годами позднее Майоровой (цит. раб.) были изучены сельди из восточной
части Черного моря, Керченского прол, и низовьев Дона и произведено
сравнение их с сельдями западной части моря по литературным данным
(Исаченко, 1925), что дало, однако, возможность сделать правильные
выводы относительно некоторых форм и систематических отношений,
черноморско-азовских сельдей. Вследствие отсутствия сравнительного
изучения каспийских и черноморско-азовских сельдей после упомянутых
выше работ Кесслера и др. система и систематические обозначения сель-
девых, общих обоим бассейнам (роды Clupeonella и Caspialosa), оставались
до сего времени крайне противоречивыми, находясь в противоречии с систе-
матическими отношениями многих и других рыб, общих обоим бассейнам.
Черноморско-азовских пузанков (С. tanaica auct. и считаемых до насто-
ящего времени формами этого вида С. tana.ica nordmanni иС. tanaica palaeo-
stomi) и морскую (C. maeotica auct.) и проходную (C. pontica auct.) сельдей
принято считать за отдельные виды от соответствующих им морфологи-
чески и биологически каспийских пузанков (формы С. caspia auct.) и мор-
ских (формы С. brashnikovi auct.) и проходных (С. kessleri auct. и близкая к
ней С. volgensis auct.) сельдей, в то время как черноморско-азовскую и кас-
пийскую тюльку принято считать идентичными формами (Clupeonella
delicatula). Между тем ряд других рыб, общих Черному, Азовскому
и Каспийскому морям, представлен в каждом из бассейнов подвидами.
Таковы: Gobius melanostcrnus Pall., Gobius fluviatilis Pall., Proterorhinus
marmoratus (Kessl.), Benthophilus macrocephalus magistri lljin, Syngnathus
nigrolineatus Eichw., Atherina mochon pontica Eichw. в Черном и Азовском
морях и Gobius melanostomus affinis Eichw., Gobius fluviatilis pallasi Bergz
Proterorhinus marmoratus nasalis (Filippi), Behtophilus macrocephalus (Pall.),
Syngnathus nigrolineatus caspius Eichw., Atherina mochon pontica n. caspia
Eichw. в Каспийском море. Самостоятельными подвидами представлена,
в каждом из бассейнов и тюлька (Clupeonella delicatula delicatula и Cl.
delicatula caspia, см. стр. 193).
Сравнительное изучение каспийских и соответствующих близких
им морфологически и биологически черноморско-азовских сельдей дало
возможность установить, что последние не являются самостоятельными
видами, а лишь подвидами общих обоим бассейнам видов. Черноморско-
азовские пузанки (С. tanaica tanaica, С. tanaica nordmanni и С. tanaica
palaeostomi) отличаются от каспийских (форм A. caspia) не более, чем
некоторые из последних между собой. Так, например, A. caspia knipo-
wilschi отличается внешне и количеством жаберных тычинок, которых
у него не менее 120, от некоторых других форм вида (у A. caspia
salina жаберных тычинок не более 117, у A. caspia persica не более
102—104) значительно больше, чем черноморско-азовские пузанки
от большинства каспийских. Еще меньше отличается от каспий-
ских проходных сельдей (A. kessleri kessleri и A. kessleri volgensis)
черноморско-азовская проходная сельдь (С. pontica auct.), имеющая,
подобно черноморско-азовским пузанкам, наименьшее количество
жаберных тычинок, a hiatus в числе их лишь с A. kessleri volgensis.
Отличие черноморско-азовской проходной сельди от остальных каспий-
ских проходных сельдей значительно меньше различий между A. kes-
sleri kessleri и A. kessleri volgensis (подробнее см. об этом стр. 281).
Следует отметить, что упомянутая выше наиболее обособленная форма
каспийских пузанков (A. caspia knipowitschi) имеет близкие формы,.
9. .\I,OS.\
217'
промежуточные по своим признакам (например A. caspia caspia) как
между другими каспийскими формами, так и между наиболее резко
отличающимися от них из черноморско-азовских пузанков (например А. ca-
spia palaeostomi и др.). Черноморско-азовская морская сельдь (С. maeotica
auct.) отличается от большинства каспийских морских сельдей (форм
A. brashnikovi), в частности от типичной формы вида (A. brashnikovi
brashnikovi) значительно меньше, чем некоторые из последних между
собой. Так, например, A. brashnikovi grimmi имеет не более 27 жаберных
тычинок, в то время как у A. brashnikovi kisselevitshi их не менее 29. Обе
формы, что самое существенное, резко различаются строением жаберных
тычинок (см. рис. 44, 46) и внешне — формой тела, окраской. Кроме того,.
A. brashnikovi grimmi резко отличается от большинства форм вида нали-
чием мозолистого утолщения на нижней челюсти, имеющегося в менее
развитой степени еще лишь у A. brashnikovi nirchi (см. табл. XIX, XX).
Однако нет никаких оснований считать одну из этих двух форм, в част-
ности наиболее уклоняющуюся — A. brashnikovi grimmi, за самостоятель- .
ный вид, так как обе эти формы вместе с остальными формами вида, про-
межуточными по своим признакам между ними, представляют одну
группу, связанную сходством в основных морфологических и биоло-
гических особенностях и принимаемую в настоящее время всеми с пол-
ным основанием, подобно формам A. caspia, за единый вид. Различия
между формами A. brashnikovi не более различий между многими локаль-
ными формами Zoarces viviparus L., некоторые из которых резко отли-
чаются количеством позвонков. Так, например, форма из Роскильде-
фиорд имеет не более ИЗ позвонков, а форма из восточной части Балтий-
ского моря (Клайпеда) имеет не менее 116 позвонков (Johs. Schmidt,
C.-R. Trav. Lab. Carlsberg, XIII, 3, 1917 : 363, 366). Резко различаются
отдельные формы Zoarces viviparus и внешне, в особенности в строении
выемки между спинным и хвостовым плавниками, у некоторых форм
совершенно отсутствующей (Johs. Schmidt, 1. с., fig. 16, 17, 18), так что,
не зная промежуточных форм, наиболее уклоняющиеся по этой особенности
формы следовало бы считать разными видами. Однако несмотря на резкие
различия между некоторыми из этих локальных форм, все они вследствие
наличия между ними переходных по своим признакам форм рассматри-
ваются совершенно справедливо как составляющие единый вид. Формаль-
ная точка зрения в вопросах систематики, как видно из этих приме-
ров, не всегда приемлема, так как, следуя ей, некоторые формы каспий-
ских сельдей следовало бы считать отдельными видами, а морских и проход-
ных сельдей черноморско-азовских и каспийских соединить в один вид,
потому что нет достаточно резких различий между черноморско-азов-
кими морской и проходной формами сельдей (см. стр. 58). Несом-
ненно, что при разграничении видов сельдей этого рода необходимо
принимать во внимание помимо признаков морфологических и эколого-
биологические особенности их и условия формообразования. Следова-
тельно, считая вполне основательно формы А. brashnikovi единым видом,
несмотря на резкие различия между некоторыми из них, черноморско-
азовскую морскую сельдь (С. maeotica auct.) следует тем более признать
за форму этого вида (A. brashnikovi maeotica). Принимая за единый вид
формы A. caspia, различающиеся между собой менее, чем формы A. brashni-
kovi, мы должны считать и черноморско-азовских пузанков формами этого
вида (Л. caspia tanaica, A. caspia nordmanni, A. caspia palaeostomi). Волж-
ская сельдь (С. volgensis auct.) и черноспинка (С. kessleri auct.), прини-
маемые всеми в настоящее время за отдельные виды, отличаются друг
:2J8
CLUPEIDAE
от друга не более, чем A. caspia knipowltschi от A. caspia salina и А. caspia
persica, и значительно менее, чем A. brashnikovi grimmi от A. brashnikovi
kisselevitshi. Рассматривая как единые виды каспийские и черноморско-
азовские формы пузанка (Л. caspia s. 1.) и каспийские и черноморско-
азовскую формы морской сельди (Л. brashnikovi s. 1.), мы должны признать
за единый вид всех и проходных сельдей как каспийских (Л. kessleri
kessleri и A. kessleri volgensis *), так и черноморско-азовскую (Л. kessleri
pontica). Таким образом, среди сельдей подрода Caspialosa следует раз-
личать комплекс форм морских, непроходных, составляющих вид A. bra-
shnikovi s. 1., комплекс форм проходных, составляющих вид A. kessleri
s. I.,1 2 и комплекс широко евригалииных форм, составляющих вид A. caspia
s. L, одни из форм которого являются морскими, непроходными, размно-
жающимися в море, другие — полупроходными, эстуарными. Кроме
того, самостоятельными видами следует считать резко отличающиеся
друг от друга и от других видов A. saposhnikovi и A. sphaerocephala, сле-
дуя в отношении этих двух видов Л. С. Бергу и принявшим его систему
сельдей этого рода ряду других авторов. За самостоятельный вид, однако,
провизорно, до более детального изучения этой малоизвестной сельди,
следует признать и A. curensis. Ниже приведены замечания о некото-
рых сельдях, принимаемых рядом авторов за самостоятельные виды или
формы некоторых видов.
Caspialosa nigra Kisselevitsh — Пузанок черный.
Clupeonella curensis (non Suw.) К и с e л e в и ч, Мат. позн. русск. рыбол., III, 6,1914:
20—22, 42—43; Тр. Астрах, ихт. лаб., III, 5, 1914 : 76, 90. — Caspialosa caspia nigra
Киселевич, Каспийско-волжские сельди, I, 1923 : 115, 139—140. — Caspialosa
nigra Берг, Рыбы пресных вод, I, 1932 :73; Киселевич, Сельди северного
Каспия, Сталингр., 1937 : 35; Световидов, Зоолог, журн., XXII, 4, 1943 : 232.
Жаберных тычинок по Киселевичу 26—56 (38). Зубы хорошо развитые.
Бугорок на нижней челюсти развит слабо. Длина головы 23.8—26.6
(25.1)%, высота 19.0—21.0 (20.1)% длины тела. Диаметр глаза 18.9 —
24.9 (22.9)% длины головы. Высота тела 23.0—28.2 (25.7)% длины его.
Верхняя часть головы, спина и бока тела, грудные, спинной и хвостовой
плавники черные. Как показало исследование сохранившихся экзем-
пляров, послуживших для установления вида, под этим названием были
описаны экземпляры A. saposhnikovi (№ 15938 коллекций Зоологического
института Академии Наук). Сельди из.зал. Мертвый Култук, опреде-
ленные Киселевичем первоначально как Clupeonella curensis (1914 :
76, 90), а позднее как Caspialosa caspia nigra (1923 :115), судя по коли-
честву жаберных тычинок, описанию и измерениям (1914 : 90), есть
темноокрашенные A. brashnikovi brashnikovi, которые нередко были нахо-
димы нами (Тр. Касп. ком. АН СССР, I, 1937 : 190) наряду с такими же
темноокрашенными A. caspia salina в этом заливе и в прилегающих к нему
1 О С. volgensis kisselevitshi auct. (=С. volgensis imitans) см. стр. 305.
2 По правилам номенклатуры, формам морских сельдей следовало бы присвоить
видовое название A. maeotica, а не A. brashnikovi, формам же проходных сельдей —
A. pontica, а не A. kessleri, так как черноморско-азовские формы их описаны раньше
каспийских. Однако поступить таким образом в угоду этим правилам было бы крайне
неблагоразумно, так как за более изученными и более многочисленными каспийскими
формами этих видов, в частности за морскими сельдями, уже прочно укоренились
принятые нами названия и перемена их на другие причинит много неудобств. Необ-
ходимо сказать, как совершенно справедливо отмечено Л. С. Бергом (цит. раб.,
1932 : 17), что «никакого непреложного „закона" приоритета нет, а есть правило, ко-
торым надлежит в разумных пределах пользоваться», не доводя его до абсурда.
9. ALOSA
219
районах, где обе последние формы мечут икру и где, по указанию Ки-
селевича (1923 : 119), нерестует и С. nigra. Сельди от северных берегов
Каспийского моря (к востоку от Синего Морца), определенные Кисе-
левичем (1924 : 20—22, 42—-43) как Clupeonella curensis, а позднее как
Caspialosa caspia nigra (1923 : 115), судя по таблицам измерений (1914 :
42—43), есть A. brashnikovi brashnikovi й A. saposhnikovi. Сельди, относи-
мые Бергом (Мат. позн. русск. рыбол., II, 3, 1913 : 22, табл. XIII)
к Clupenoella curensis, а Киселевичем (1923 : 115) к Caspialosa caspia
nigra, повидимому, есть A. saposhnikovi и, возможно, частью A. curensis.1
Сельди из зал. Кендырли и от островов Кулалы и Долгого, определенные
Бергом (Мат. позн. русск. рыбол., IV, 6, 1915 : 5) как Caspialosa
curensis, есть, повидимому, A. brashnikovi brashnikovi. Вообще к Caspia-
losa nigra относились сельди с сильно пигментированными, почти черными
верхней частью головы, спиной, боками и спинными, хвостовыми и груд-
ными плавниками, причем такое предположение высказывалось уже
и ранее (Берг, 1932 : 73; Световидов, Тр. Касп. ком. Акад. Наук, I,
1937 : 197). Такие сельди встречаются в пределах почти каждого вида
и формы, известны даже у одной из наиболее белесых сельдей — A. brash-
nikovi grimmi (Киселевич, 1923 : 135). Рисунки таких экземпляров
A. brashnikovi brashnikovi и A. caspia salina см. табл. XIV и XVI.
Caspialosa suworowi Berg — Суворовский пузанок.
Clupea sp. Суворов, Тр. Касп. эксп. 1904 г., I, 1907 : 161. — Clupeonella
suworowi Берг, Мат. позн. русск. рыбол., II, 3, 1913 : 28, табл. XII, фиг. 2;
Киселевич, там же, III, 6, 1914 : 24. — Caspialosa suworowi Берг, там же,
IV, 6, 1915 : 6. — Caspialosa caspia suvorovi Киселевич, Изв. Отд. научно-
промысл. исслед., I, 1, 1918:17, 18, 29; Киселевич, Каспийско-волжские
«сльди, I, 1923 : 112, 128—139. — Caspialosa suworowi Берг, Рыбы пресных вод,
1923 : 498; Киселевич, Промысловые рыбы Волго-каспийского района,
Астрах., 1926:26. — Caspialosa caspia suvorovi Аверинцев и Сыч, Тр.
Астрах, научн,. рыбохоз. ст., VII, 3, 1930 : 9. — Caspialosa suvorovi Киселевич,
Сельди северного Каспия, Сталингр., 1937 : 34. — Caspialosa suworowi Светови-
дов, Тр. Касп. ком. АН СССР, I, 1937 : 191, табл. I, фиг. 2; Берг, Рыбы прес-
ных вод, I, 1932 : 77; Световидов, Зоолог, журн., XXII, 4, 1943 : 231.
По внешности сходен с A. caspia и A. saposhnikovi. Жаберных тычи-
нок по Киселевичу 32—76 (55.3), по Бергу 32—68 (55). Зубы развиты
слабо или сильно. На нижней челюсти небольшой бугорок, иногда слабо
развитый или отсутствующий. Длина головы 22.7—28.0 (25.5)% длины
тела, высота головы 17.9—22.0 (19.8)% той же длины. Диаметр глаза
20.0—28.2 (23.4)% длины головы. Высота тела 22.0—29.9 (25.9)% длины
его. Длина от 12.9 до 26.8, в среднем 19.1 см. Под этим названием, как
показало исследование типа и других экземпляров, хранящихся в кол-
лекциях Зоологического института Академии Наук и определенных
К. А. Киселевичем как С. caspia suvorovi, был описан экземпляр и при-
нимались в дальнейшем помеси между разными видами каспийских
сельдей. Экземпляр (№ 15927 коллекций Зоологического института Ака-
демии Наук), послуживший Л. С. Бергу для описания этого вида с целью
обратить на эту форму внимание будущих исследователей, был перво-
начально принят Е. К. Суворовым (1907) за помесь, причем им было
указано на сходство его с С. caspia, с одной стороны, и с С. brashnikovi,
с другой. Берг (1913 : 28) сближал С. suworowi с С. kessleri auct.
1 Относительно двух экземпляров, с 53 и 58 жаберными тычинками, сказать
что-либо определенное затруднительно.
220
CLUPEIDAE
а позднее (1915 : 6) с C. saposhnikovi. Киселевич (1923 : 11) считал
этот вид промежуточной формой между С. caspia и С. saposhnikovi.
К этому же виду отнес К. А. Киселевич и описанную Бергом
(1915 : 6) помесь между С. caspia (вернее одной из ее южнокаспий-
ских форм) и С. brashnikovi leucocephala (=А. brashnikovi grimmi), а также
и ряд экземпляров из коллекций Зоологического института Академии
Наук (№№ их перечислены в работе Киселевича, 1923 : 112), отнесен-
ных предыдущими исследователями к разным видам (С. kessleri,.
С. saposhnikovi, С. brashnikovi). Позднее, как мог установить автор,
принимая участие в работах Всекаспийской научной рыбохозяйствен-
ной экспедиции весной 1931 г. и из бесед с лицами, участвовавшими
в сборах и обработке материалов по сельдям этой экспедиции, к С. suwo-
rowi обычно относились такие сельди, в определении которых встречались
затруднения. Чаше всего это были экземпляры, промежуточные но своим
признакам между обычными видами и формами каспийских сельдей.
Условия, благоприятные для образования помесей между видами и фор-
мами каспийских сельдей, весьма нередкое явление. Так, например,
в конце нереста A. brashnikovi brashnikovi на тех же местах начинает
метать икру A. caspia salina и встречаемые иногда здесь сельди, по внеш-
ности напоминающие первую форму, но с большим количеством жабер-
ных тычинок и, наоборот, сельди, внешне напоминающие вторую, но
с меньшим количеством тычинок, являются, повидимому, помесями между
формами этих двух видов (см. табл. XV и рис. 37). Точно так же на местах
икрометания A. brashnikovi kisselevilshi в самый разгар нереста бывали
находимы единичные самки и самцы A. brashnikovi grimmi с еще не вполне
выметанными икрой и молоками. (О помесях между формами A. kessleri
s. 1. см. стр. ЗС5). Возможности для образования помесей, принимаемых
за С. suworowi, имеются, несомненно, и у других видов и форм сельдей,
например у A. caspia caspia, A. caspia salina и A. saposhnikovi. Следует
также отметить, что сельди, принимаемые за С. suworowi, встречаются
почти по всему Каспийскому морю, но, как и помесь между A. kessleri
kessleri и A. kessleri volgensis (см. об этом стр. 305), в небольшом коли-
честве и, что самое существенное, мы до сего времени не располагаем
достоверными сведениями об образе жизни этой сельди. В настоящее
время достаточно хорошо известны места и условия нереста и строение
икринок и личинок в сущности всех сельдей, размножающихся в север-
ной части Каспийского моря, даже таких редко встречаемых, как, напри-
мер, A. sphaerocephala. Мы не располагаем такими сведениями лишь
о С. suworowi, относительно которой имеются крайне неопределенные
данные лишь у Киселевича [1923 : 115 — «Икрометание происходит
во второй половине апреля и в мае в море у устья Волги» и в такой же
неопределенной форме позднее (1937 : 35): «Мечет икру в тех же местах,
где и пузанки большеглазый и каспийский, главным образом у устьев
Волги и Урала, в одинаковой мере перенося и полное опреснение и сла-
бое осолонение»], без каких-либо указаний, кем и когда наблюдался не-
рест. Никаких других сведений относительно этого нет, несмотря на то
что в отмеченных К. А. Киселевичем местах в последние годы были про-
изведены довольно детальные исследования.
Большинство форм основных каспийско-черноморских видов рода,
рассматриваемых в нижеследующем как подвиды, не имеют резко обо-
собленных ареалов, так как в зимнее время встречаются в одних и тех же
местах. Так, например, A. caspia caspia и A. caspia salina, размножаю-
щиеся в северной части Каспийского моря, зимой держатся в южной
9. ALOSA
221
части моря, где постоянно живут и размножаются A. caspia knipowitschi
и A. caspia persica. A. caspia knipowitschi, нерестующий у западных бере-
гов южной части Каспийского моря, осенью н зимой в небольшом коли-
честве заходит на восток до Астрабадского зал., где весной нерестует
A. caspia persica, повидимому, заходящий, в свою очередь, на восток
до Пехлевийского зал. Равным образом и A. brashnikovi brashnikovi
и A. brashnikovi agrachanica, размножающиеся в северной части Каспий-
ского моря, зимуют в южной части моря, где живут и размножаются
остальные 6 подвидов этого вида. Это ясе можно сказать и о Л. kessleri
kessleri и A. kessleri volgensis, встречаемых в море совместно, но для икро-
метания идущих раздельно и размножающихся в разных местах по тече-
нию Волги. Таким образом, все эти подвиды, не имея резко обособлен-
ных ареалов в течение главным образом зимнего времени, в период раз-
множения достаточно обособлены, так как места икрометания их довольно
строго локализованы. Каспийские формы A. kessleri Бергом в последнем
издании «Рыб пресных вод» (1948) обозначены как infraspecies (например
С. kessleri isp. volgensis), черноморская — как subspecies (С. kessleri
pontica). Как каспийские, так и черноморские формы двух других упо-
мянутых выше видов приняты им за подвиды. Учитывая отсутствие
резкой обособленности ареалов не только у каспийских форм A. kes-
sleri, но в такой же или у некоторых форм даже в большей мере и
других упомянутых видов, за infraspecies следовало бы считать
формы всех трех видов. Однако каспийские формы A. caspia и А.
brashnikovi всеми авторами приняты за подвиды, обозначение их как
subspecies или как infraspecies имеет лишь то различие, что в послед-
нем случае между видовым и подвидовым названием ставится isp.
Поэтому в нижеследующем формы всех упомянутых видов приняты
за подвиды, хотя это обозначение в известной мере условно. Это тем более
допустимо, что подобные же ареалы свойственны ряду подвидов и птиц.
Так, в Закавказье (Азербайджанская ССР) на ареале местного подвида
скворца Starnas vulgaris caucasicus Lorenz зимует совместно с ним 5. vul-
garis vulgaris L., населяющий большую часть восточной Европы. В тех же
местах зимуют совместно подвиды белой трясогузки Motacilla alba alba
(L.), населяющей Европейскую часть СССР и Зап. Европу, и М. alba
dukhunensis Sykes, гнездящихся в Сибири на восток до басе. Лены и к югу
до прикаспийских степей и Кавказа. В Закавказье же и в Таджикистане
зимуют совместно подвиды полевого жаворонка Alauda arvensis canta-
rella Bp., гнездящегося в южной части СССР, и A. arvensis dulcivox
Brooks, гнездящегося в западной Сибири. Из примеров, которых можно
было бы привести и больше, видно, что все эти подвиды не являются,
строго говоря, подвидами, однако считаются таковыми.
Некоторые авторы (Smitt 1895; Otterstr0m 1 и др.) рассматривают
A. fallax, A. alosa и A. sapidissima как формы одного вида. Однако A. jal-
lax резко отличается от всех видов как внешне, так и количеством жабер-
ных тычинок. Крайне сходные внешне A. alosa и A. sapidissima, с одина-
ково клиновидно сжатой с боков и высокой головой, напоминающей
по форме голову A. caspia, не .различаются резко и по количеству жабер-
ных тычинок (A. alosa от 90 до 130, у A. sapidissima от 93 до 120), являясь,
повидимому, формами одного вида.
1 Damn. Fauna, Fisk, II, 1914 : 218 (Clupea alosa forma finta, f. alosa, i. sapi-
dissima).
222
CLUPEID. IE
Видовая принадлежность сельдей рода Alosa определяется обычно-
без особых затруднений, хотя иногда и встречаются экземпляры как
промежуточные по своим признакам, так, повидимому, и гибридного
происхождения, отнесение которых к тому или иному виду бывает затруд-
нительно. Что же касается подвидов, в особенности A. brashnikovi, то-
здесь такие особи, относительно которых бывает затруднительно сказать,
к какой форме данного вида их отнести, довольно нередки.
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА ВИДОВ
1 (10). Зубы на нёбных костях есть, у некоторых очень слабые, почти
незаметные. За жаберной крышкой сверху обычно темное пятно,
у некоторых сзади него па боках тела по ряду темных пятен. Кас-
пийское, Черное и Азовское моря и впадающие в них реки (подрод
Caspialosa).
2 (7). Тело пузанковое, высокое и сжатое с боков, с укороченным хво-
стовым стеблем и длинными грудными плавниками. Голова большая
и высокая, клиновидно сжатая в нижней части с боков.
3 (6). Жаберных тычинок на первой дуге не более 45. Тычинки толстые
и короткие, равны или длиннее жаберных лепестков. Зубы хорошо
развитые.
4 (5). Верхний и нижний профили головы прямые. Нижняя челюсть-
выдается вперед, верхний край нижней челюсти прямой.................
................................*1. A. saposhnikovi (Grimm)
5 (4). Верхний и нижний профили головы закругленные, в особенности
впереди глаз. Челюсти одинаковой длины, верхний край нижней че-
люсти характерной полулунной формы *2. A. sphaerocephala (Berg)
6 (3). Жаберных тычинок на первой дуге не менее 5Q. Тычинки тонкие
и длинные, значительно длиннее жаберных лепестков, с необломан-
ными концами, образующими на нижней половине дуги выпуклую
линию. Зубы развиты очень слабо, на нижней челюсти иногда со-
вершенно незаметные на ощупь . . . *3. A. caspia (Eichw.) s. 1.
7 (2). Тело сельдеобразное, низкое и не укороченное в хвостовой
области, не сжатое с боков, с короткими грудными плавниками.
Голова низкая, не клиновидная, не особенно большая.
8 (9). Жаберных тычинок не более 47. Тычинки толстые и грубые,
короче, равны или немного длиннее жаберных лепестков. Зубы
хорошо развитые. Морские сельди *4. A. brashnikovi (Borodin) s. I.1
9 (8). Жаберных тычинок не менее 47, у каспийских от 59. Тычинки
тонкие и длинные, длиннее жаберных лепестков или более толстый
и короткие, с обломанными или целыми концами. Зубы более или
менее развитые, иногда на нижней челюсти слабо заметные. Про-
ходные сельди...........................*6. A. kessleri (Grimm) s. 1.
10 (1). Зубы на нёбных костях отсутствуют. Кроме темного пятна за жа-
берной крышкой сверху есть всегда ряд таких же пятен на боках
тела, ниже которого иногда имеется еще 1 или реже 2 ряда из мень-
шего числа пятен. По обе стороны Северной части Атлантического
океана, Средиземное, Балтийское и отчасти Черное моря и впадаю-
щие в них реки (подрод Alosa s. str.).
1 Слабо изученная A. curensis, которую автор не имел в достаточном количестве,,
в определительную таблицу не включена. Эта сельдь близка к A. brashnikovi, отли-
чаясь более ранним половым созреванием (при 11—14 см).
и. , I/JAS', I
223'
11 (14). Жаберных тычинок не более 80, тычинки короткие, обычно рав-
ные лепесткам. Голова невысокая и не сжатии и нижней части
клиновидно с боков, рыло заостренное, узкое *7. A. fallax (Lacep.)
12 (13). Жаберных тычинок 37—43, в среднем около 40. Спинной плав-
ник расположен ближе к голове, антедорсальное расстояние
в среднем около 43%% длины тела. Атлантические берега Бироны,
Балтийское море ........................*7b. A. fallax fallax (Laccp.)
13 (12). Жаберных тычинок 34—37, в среднем около 35. Спинной плав-
ник отнесен несколько дальше назад, антедорсальное расстояние
в среднем около 45% длины тела. Средиземное'- и Черное
моря..................................*7а. A. fallax nilotica (Geoffr.)
14 (11). Жаберных тычинок не менее 85, тычинки тонкие и длинные,
значительно длиннее жаберных лепестков. Голова высокая, кли-
новидно сжатая в нижней части с боков, рыло широкое................
........................................... *8. A. alosa (Б.).
15 (16). Жаберных тычинок 100—110. Черное море.....................
................................*8а. A. alosa bulgarica Drensky.
16 (15). Жаберных тычинок 90—120. Атлантические и тихоокеанские
берега Сев. Америки, у западных берегов Камчатки . ................
....................................*9. A. sapidissima (Wilson)
*1. Alosa saposhnikovi (Grimm) — Большеглазый или саиожников-
ский пузанок (табл. IX).
Clupea saposchnikowii Гримм, Астраханская селедка, СПб., 1887 : 7, 16
(дельта Волги1); Голынец, О ходе и ловле сельди у берегов Манги-
шлака, Астрах., 1903 : 7 (широкая разновидность с большим глазом; биология). —
Clupea caspio-pontica var. saposchnikowii Бородин, Вестн. рыбопр., XIX, 3,
1904 : 176, 180, 182 (частью: Дербент № 18, Белиджи № 19, 21). — Clupea caspio-
pontica var. bra.schnikowii Бородин, там же : 184 (частью: Красноводск № 27). —
Clupea (Alosa) brashnikowi (non Borodin) Суворов, Тр. Касп. эксп. 1904 г., I,
1907 : 155, 189—)91, фиг. 2 (большеглазая разность, № 157—176); там же, II, 1908 :
44, 53, 58 (описание, распространение). — Clupeonella saposhnikovi Берг,1 2 Мат.
позн. русск. рыбол., II, 3, 1913 : 15, табл. VIII—IX (описание, синонимы); К и се-
ле в и ч, там же, III, 6, 1914 : 38 (северо-восточная часть Каспийского моря; изме-
рения). — Caspialosa saposhnikovi Берг, там же, IV, 6, 1915 : 4. — Caspialosa
caspia saposhnikovi Киселевич, Изв. Отд. рыбол. и научно-промысл. исслед.,
I, 1, 1918 : 17, 30; Каспийско-волжские сельди, I, 1923 : 122, 151—155 (описание,
измерения). — Caspialosa caspia nigra Киселевич, там же : 115 (частью); Тр.
Астрах, ихт. лаб., V, 1, 1923 : 34 (плодовитость). — Caspialosa saposhnikovi Берг,
Рыбы пресных вод, 1923 : 22; Киселевич, Промысловые рыбы Волго-каспий-
ского района, Астрах., 1926 : 24; М о р о з о в, Тр. Научи, инет. рыбн. хоз., II, 4„.
1928 : 47 (биометрическая обработка материалов Киселевича). — Caspialosa caspia
saposhnikovi Аверинцев и Сыч, Тр. Астрах, научн. рыбохоз. ст., VII, 3,
1930:10 (количества позвонков, килевых чешуй, лучей в плавниках); Свето-
видов, Докл. АН СССР, 1932:203 (количество пилорических придатков).—
Caspialosa saposhnikovi Дехтярева, Тр. Всесоюзн. Научно-исслед. инет, морск.
рыбн. хоз. и океаногр., XIV, 1940:47 (описание сеголетков); Световидов,.
Зоолог, журн., XXII, 4, 1943 : 231; в: Промысловые рыбы СССР, 1949 : 91, табл. 22.
Распространение, биология. Вукотич, Мат. позн. русск.
рыбол., IV, 6, 1915:26 (плодовитость); Киселевич, Тр. Астрах, ихт. лаб,,
V, 2, 1922:2 (рост); Булгаков, Бюлл. Средне-азиатск. унив., 14, 1926:28
(близ Кизил-су, 2 экз., 2 и 4 VI); Недошивин, Сборн. в честь Книповича,
1927 : 303 (искусственное оплодотворение); Мейснер, Бюлл. Всекасп. научн.
рыбохоз. эксп., 1—2, 1932 : 51; там же, 5—6, 1932 : 21 (миграции/ места нереста);.
1 Тип установлен Л, С. Бергом Из числа экземпляров О. А. Гримма, № 15921
коллекций Зоологического института Академии Наук СССР, Оранжерейный промы-
сел (дельта Волги), V 1885, длина 173 мм.
2 Некоторые синонимы и литературу более раннего периода см. в этой работе-
и цитируемой ниже работе Киселевича (1923).
-224
CLUPEIDAE
-Леванидов, там же : 55 (содержание жира); Киселевич, Сельди север-
ного Каспия, Сталингр., 1937 : 31 (биология); Беляев, Первая научн. конф,
по изуч. сельдевых рыб Каспийск, м., Астрах., 1937 : 39 (биология); Клыков,
Тр.. Каспийск, ком. АН СССР, I, 1938 : 77 (северо-восточная часть Каспийского м.);
Чугунова, Тр. Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океаногр.
XIV, 1940:21 (метод изучения возраста); Ловецкая, Изв. Азерб. научно-
исслед. рыбохоз. ст., 5, 1940:27 (биология); На-возов-Лавров, Докл.
Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океаногр., 10, 1947 : 11 (биоло-
гия); Остроумов, Тр. Волго-каспийск. научн. рыбохоз. ст., IX, 1, 1947 : 82
(питание); Н а во зо в - Л а вро в, Рыбн. хоз., 1947, 5 : 31, рис. 1 (распределе-
ние зимой); Перцева-Остроумова, Тр. Всесоюзн. Научно-исслед. инет,
морск. рыбн. хоз. и океаногр., XVIII, 1951 : 55, рис. И (описание икринок и личи-
нок); Н. Танасийчук, Промысл, рыбы Волго-Каспия, Пищепромиздат, 1951 :
42, рис. 6 (распространение, места нереста, миграции, хозяйственное значение).
D (III) IV 12—15 (13.4), общим числом 15—19 (17.4), A III (IV) 15—21 •.
(17.9), общим числом 18—24 (20.9), sp. br. 25—41 (30.4), vert. S. 49—51
(50.12), caud. vert. 32—34 (33.24). Жаберные тычинки толстые и короткие,
обычно короче жаберных лепестков, редкие и заостренные на концах.
Зуб'ь! хорошо развитые на обеих челюстях. Нижняя челюсть выдается
вперед, обычно с хорошо развитым бугорком на переднем конце снизу.
Голова сжатая в нижней части с боков, несколько клиновидная, заострен-
ная, высокая и удлиненная, длина ее 26.1—28.4 (27.1)%, высота 19.4—
.20.G (19.7)% длины тела. Глаза очень большие, 22.3—27.7 (25.5)% длины
головы. Грудные плавники длинные, 16.5—19.6 (17.9)% длины тела.
Тело типично пузанковое, высокое и укороченное в хвостовой области,
наибольшая высота его 22.1—29.3 (24.9)%, наименьшая — 6.7—8.2
(7.6)% длины тела. Окраска слабая, за жаберной крышкой с каждой
стороны по темному пятну, на боках тела пятен нет. В южной части Кас-
пийского моря окрашен более интенсивно, чем в северной, спина фиоле-
товая с зеленоватым отливом, по бокам тела 4 темных полосы, сливаю-
щиеся с темной окраской спины. Длина до 32, изредка до 35 см, наичаще
14—28 см. Описание дано по 50 экз. длиной от 14.3 до 31.5, в среднем
18.9 см, собранным в восточной половине северной части Каспийского
моря и в ппжней части дельты Волги (22 из них собраны Гриммом и по-
служили ему для первоописания). По данным В. И. Мейснера, жаберных
тычинок 24—39 (29.4), позвонков 47—53 (50.2); пилорических придатков
(Световидов, 1932) 36—59 (45.9).
Солоноватоводная, непроходная рыба, заходящая лишь в самые ниж-
ние участки дельты.
Характерен высокой головой, пузанковой формой тела, крайне круп-
ными глазами и длинными грудными плавниками. От молодых экземпля-
ров A. brashnikovi autumnalis, с которыми может быть смешан, отли-
чается значительно более-высокой головой и крайне замедленным темпом
роста: шестигодовалые особи этого вида по размерам равны трехгодова-
лым A. brashnikovi autumnalis, а начиная с третьего года, различия в раз-
.мерах становятся резкими.
Экземпляр № 17 в таблице измерений Clupea caspio-pontica var. sa-
poschnikowii Бородина (1904 : 182), отнесенный позднее Бергом (1913 : 15)
к С. saposhnikovi, а К. А. Киселевичем (1923 : 112) к С. caspia suvorovoi,
есть, повидимому, помесь.
Распространение. Каспийское море, где встречается почти
повсеместно, но наиболее обычен на путях к местам нереста у обоих
берегов средней части его и на нерестилищах в северной; в южной части
моря встречается реже, единично заходит в нижнюю часть дельты Волги,
но выше не подымается. Икрометание в двух изолированных местах
9. ALOSA
225
в северной части моря, по обе стороны от дельты Волги, главным образом
в восточной половине его от Забурунья до Прорвы,1 наиболее интенсивно
в районе Пешных о-вов и южнее и, повидимому, в зал. Сарыташ. В запад-
ной половине северной части моря икрометание происходит наиболее
интенсивно в районе о. Тюленьего.
Биология. Икрометание с конца апреля, разгар в середине
мая. Зимой больших скоплений не образует, и поэтому о местах пребы-
вания в этот период времени имеются довольно разноречивые сведения,
но, судя по ним, зимует в средней части моря, повидимому переходя в хо-
лодные зимы в южную часть. В южной части моря в холодные зимы дер-
жится над глубинами от 400 до 600 м, опускаясь в самое холодное время
на глубины, недоступные облову дрифтерными сетями. В умеренные зимы
встречается между Ашперонским п-овом и Куринской косой над глуби-
нами 200—250 м в более высоких слоях воды. Держится зимой в воде
с температурой, близкой 6—7° (Навозов-Лавров, 1947). Одна из наибо-
лее холодолюбивых из каспийских сельдей, весенние миграции на север
начинает одной из первых, одновре-
менно с долгинкой. В средней части
моря идет вдоль обоих берегов, но в
основной массе вдоль западных. Пер-
вые подходы в прибрежную область у
берегов Азербайджана наблюдаются в
середине марта, в массовых количест-
вах подходит с конца марта по сере-
дину апреля. У берегов Дагестана впер-
вые подходит в конце марта, в мас-
совых количествах — с начала по ко-
нец апреля. Первые подходы наблю- Рис. 28. 1-я жаберная дуга Alosa
даются при 4.5—6.0°, массовые — saposhnikowi. Длина тела 173 мм.
приблизительно при 10°. В средней
части весной основная масса держится в узкой прибрежной полосе,
в отдалении от берегов встречается в небольшом количестве. Во
второй половине мая при повышении температуры воды до 15—
20° уловы здесь прекращаются. В северной части моря появляется
во второй половине марта—начале апреля, у о-вов Чечень и Тюленьего
и п-ова Мангышлака почти в одно и то же время при температуре воды
около 7.6°. Наибольшие концентрации в западной половине северной
части моря наблюдаются в апреле, во время миграций к местам нереста,
в восточной половине —: в начале мая на местах икрометания. В начале
хода в средней части моря и вблизи мест нереста в северной идут более
крупные рыбы (самки длиной 20—23 см, самцы — 17—19 см), чем в конце
его (самки — 15—17 см, самцы — 14—16 см). В средней части моря
в начале хода при температуре около 9° преобладают самцы (43—88%),
в конце хода при температуре около 11° — самки (40—92%), а вообще
за весь период хода количество самцов и самок приблизительно одина-
ково (Ловецкая, 1940; Навозов-Лавров, 1947). Ко времени нереста под-
ходит на еще меньшие глубины и мечет икру на глубине 1—6 м, в основ-
ной массе на 3—4 м, с полужесткими грунтами (ил, песок, ракуша), при
температуре воды 14—16° и содержании солей от 0.07 до 11.0°/оо, в основ-
ном при 8—9°/00. В восточной половине северной части моря нерест про-
исходит в более соленой воде (5.8—11.0°/оп), чем в западной (0.07—5.36°/оО).
1 В зал. Мертвый Култук для нереста не заходил (см., однако, Киселевич, 1937 :
33).
15 Фауна СССР —314
226
CLUPEIDAE
Плодовитость от 44 до 163 тыс., в среднем около ИЗ тыс. икринок. Раз-
витие икры, по наблюдениям Т. А. Перцевой-Остроумовой, при темпе-
ратуре воды 14.8° происходит в 96—156 часов. Молодь в летнее время
держится вблизи мест нереста в северной части моря, наибольшие кон-
центрации образует в августе, на юг отсюда мигрирует, повидимому,
вдоль обоих берегов, уходит, судя по всему, не далеко, возможно, оста-
ваясь в небольшом количестве в северной части и на зиму, так как встре-
чается здесь еще в ноябре, а годовалые весной часто ловятся сразу же
после распаления льда, в начале апреля. Молодь, по наблюдениям
А. И. Дехтяревой и В. С. Танасийчук, в восточной половине северной
части моря по размерам крупнее молоди из западной половины. Взрос-
лые, по наблюдениям К. А. Прохоровой, после нереста при дальнейшем
прогревании воды отходят на большие глубины с более низкой темпе-
ратурой воды, температуры воды выше 26° избегают, в конце мая в про-
мысловых скоплениях уже не встречаются и в июне ловятся единично,
держась рассеянно по всей северной части моря (Н. Танасийчук, 1951).
Питается крупными ракообразными, мелкой рыбой (тюлька, атеринка,
бычки, молодь сельди). В' юго-восточных районах северной части моря
в апреле, в преднерестовый период, основной пищей является Corophium
nobile (49.9%). С конца апреля до середины июня преобладающая роль
в питании принадлежит обыкновенной тюльке; С. nobile в это время
встречается в желудках в незначительном количестве (1.6%). В запад-
ных районах моря в апреле главное значение в питании имела обыкно-
венная тюлька (59.2%), отчасти бычки (14.3%). В мае, с переходом поло-
вых продуктов в IV стадию зрелости, интенсивность питания снижается
и за 1—2 суток до начала икрометания сельдь перестает питаться
(Остроумов, 1947). Половой зрелости достигает в двух-трехгодовалом
возрасте, возрастной состав ходового колеблется от двух- до восьмигодо-
валых, преобладают двух- и трехгодовалые. Возрастной состав из года
в год меняется; у берегов Азербайджана за ряд лет, по данным Ловецкой
(1940), он был таков (в процентах):
Возраст . . . . . 1 2 3 4 5 6 7 8
1929 г . 19.6 • 29.5 49.4 16.1 2.9 0.4 — —
1930 г . 1.2 22.8 37.7 13.1 5.5 1.3 — —
1931 г . 9.2 44.5 33.8 10.0 2.1 0.2 0.1 0.02
1932 г . 8.3 54.6 30.0 6.3 0.4 0.4 — —
1933 г . 6.0 73.8 17.5 2.2 0.4 0.1 —
1934 г . 10.8 21.0 51.1 14.5 2.3 0.2 0.001 0.05
1935 г . 5.5 38.0 46.0 7.5 2.0 0.7 0.2 0.1
1936 г . 6.5 56.6 33.4 2.9 0.6 — —
' 1937 г . 8.0 42.6 37.7 10.3 1.2 0.2 —
У берегов Дагестана возрастной состав был таков (в процентах):
Возраст . . . 1 2 3 4 5 6
1933 г. . . — 40.6 47.4 8.7 3.0 0.3
1934 г. . . . . — 12.7 61.1 24.4 1.6 0.2
1935 г. . . — 37.5 47.6 14.1 0.8 —
1936 г. . . 4.4 67.5 24.6 2.8 0.7
1937 г. . . . . 1.0 39.3 42.6 14.6 2.3 0.2
1945 г. . . . . 2.5 32.1 47.2 14.7 3.4 —
1946 г. . . . . 0.7 50.9 37.7 9.2 1.5 0.1
1947 г. . . . . 4.4 38.0 46.7 10.4 0.5
1948 г. . . . . 0.8 42.6 42.8 12.3 1.5 —
1 Годовалые до 1937 г. не учтены, вследствие чего процентные соотношения от-
дельных возрастных групп несколько выше действительных.
9. ALOSA
227
I колеблются из года в год, ио тем же
мой сельди (см):
данным, и средние размеры лови-
1929 1930 1931 1932 1933 1934 1935 1936 1937
Азербайджан . . . . . . . 19.7 18.5 18.0 18.1 17.3 18.2 17.3 17.2 17.1
Дагестан 21.7 18.9 18.5 17.3 19.1 17.1 18.1 18.0
Основную массу в уловах составляют рыбы длиной от 14 до 21 см,
и 1929 г. основные размеры ловимой рыбы были 17—19 см, с 1933
по 1937 гг. — 16—17 см. Самки несколько крупнее самцов и растут не-
много быстрее (Ловецкая, 1940). Темп роста, после значительного при-
роста за первый год жизни, в дальнейшем снижается и отстает от всех
форм A. brashnikovi (по данным В. И. Мейснера):
Возраст........... 1 2 3 4 а 6
Длина (см)..... 11.5 16.5 20.3 22.7 24.8 25.7
По исследованиям Ловецкой (1940), темп роста за отдельные годы
претерпевал незначительные изменения. Одна из наименее жирных сель-
дей Каспийского моря. В начале весенних миграций у берегов Азербай-
джана и Дагестана содержит от 3.21 до 5.77% жира, в северной части моря
содержание жира падает до 3.49—3.92%. К ноябрю содержание жира
увеличивается до 12.50% (Леванидов, 1932).
Хозяйственное значение довольно существенное. Улов
и 1936—1939 гг. составлял от 38 до 88 тыс. ц, из них в северной части
моря добыто от 13.6 до 36.9 тыс. ц, у западных берегов средней части
моря — от 38 до 76 тыс. ц. Лов производится весной на пути к местам
нереста и на нерестилищах.
*2. Alosa sphaerocephala (Berg) — Круглоголовый или аграханский
пузанок (табл. IX).
Clupeonella sphaerocephala Берг, Мат. позн. русск. рыбол., II, 3, 19'13 : 20,
табл. XII, фиг. 1, 1а (Аграханский зал., у о. Тюленьего, Турали 1); Киселе-
|| и ч, там же, III, 6, 1914 : 17, 23, 41 (в районе Забурунья и у северных берегов
сонорной части Каспийского м., зал. Мертвый Култук; измерения, питание). — Cas-
pialosa sphaerocephala Берг, там же, IV, 6, 1915 : 5 (к югу от дельты Волги,
45”35' с. ш., 1°20' з. д., зал. Кендырли). — Caspialosa caspia sphaerocephala К и с е-
л о в и ч, Изв. Отд. рыбов. и научно-промысл. исслед., I, 1, 1918 : 17, 30; Каспийско-
волжские сельди, I, 1923 : 120, 135, 141—147 (Аграханский зал., кавказское побе-
режье, зал. Кендырли, северный берег Каспийского м.; измерения). — Caspialosa
sphaerocephala Морозов, Тр. Научн. инет. рыбн. хоз., II, 4, 1928 : 47 (биометри-
ческая обработка материалов Книповича); Берг, Рыбы пресных вод, I, 1932 : 77;
Дохтярева, Тр. Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океаногр.,
XIV, 1940 : 47 (описание сеголетков); Световидов, - Зоолог, журн., XXII, 4,
1943:231.
Распространение, биология. Вукотич, Мат. позн. русск.
рыбол., IV, 6, 1915 : 26 (плодовитость); Световидов, Тр. Касп. ком. АН СССР,
1, 1937 : 191 (зал. Мертвый Култук); Киселевич, Сельди северного Каспия,
Сталингр., 1937 : 35 (биология).
D (III) IV 13—15 (13.8), общим числом 17—19 (17.8), A III (IV) 17—
20 (18.0), общим числом 20—23 (21.0), sp. br. 26—42 (31.1), vert. S. к!—51
(49.32), caud. vert. 31—24 (32.26). Жаберные тычинки довольно длинные
и тонкие, равны или обычно длиннее жаберных лепестков, довольно
частые. Зубы хорошо развитые, почти такие же, как у предыдущего вида.
Челюсти одинаковой длины, нижняя челюсть сильно развитая, нижний
1 Тип ’№ 15928 коллекции Зоологического института Академии Наук СССР,
северная часть Каспийского моря близ о. Тюленьего, 25—26 V 1912, длина 190 мм.
15*
228
CLUPEIDAE
край ее закругленный или с небольшим бугорком на переднем конце,
верхний, вооруженный зубами край характерной полулунной формы.
Голова весьма характерной формы, верхний и нижний профили ее закруг-
лены, в особенности впереди глаз, довольно большая и высокая, клино-
видная, как у других пузанков, длина ее 24.4—27.0 (25.7)%, высота
19.8—21.9 (20.8)% длины тела. Глаза большие, 21.7—25.9 (23.4)% длины
головы. Грудные плавники длинные, 16.8—19.8 (16.5)% длины тела.
Тело типично пузанковое, с укороченным хвостовым стеблем и высокое,
наибольшая высота его 24.7—30.1 (26.7)%, наименьшая — 7.6—9.2
(8.2)%, хвостовой стебель 5.5—7.7 (6.5)% длины тела. Спина темная,
с оливково-зеленым оттенком, конец рыла иногда черный, грудные плав-
ники темные. За жаберной крышкой обычно черное пятно, изредка на
боках тела сзади него ряд из нескольких таких же пятен. Размеры не-
большие, наибольшие до 24—
25 см, наичаще 16—18 см. Опи-
сание дано по 50 экз. длиной
от 14.9 до 19.9, в среднем 16.8 см,
собранным в западной половине
северной части Каспийского мо-
ря; количество жаберных тычи-
нок — по 106 экз. длиной от
11.4 до 19.9, в среднем 16.1 см,
собранным в тех же местах.
По данным Киселевича (1923),
жаберных тычинок 25—45 (32.5).
Солоноватоводная, непроход-
Рис. 29. 1-я жаберная дуга Alosa sphaero- НаЯ’ Нб ,а10ДЯЩаЯ В °Ресные
cephala. Длина тела 190 мм. воды рыба.
Один из наиболее обособлен-
ных морфологически видов, от-
личающийся и краниологически. Наиболее близок к A. saposhnikovi (вы-
соким телом, крупными глазами, числом жаберных тычинок, неболь-
шими размерами), отличаясь, однако, более короткой, высокой и округ-
лой головой. Следует отметить, что рыбы с наибольшим количеством жа-
берных тычинок имели небольшие размеры, например: 42 тычинки было
у рыбы длиной 12.7 см.
Распространение. Каспийское море. Весной наиболее обы-
чен у восточных берегов северной части моря, а летом вдоль северных.
Единично встречался у западных берегов средней части моря, в заливах
Кендырли и Мертвый Култук. В большом количестве встречался в Агра-
ханском зал., но после опреснения его более не заходит. Нерест в восточ-
ной половине северной части моря от Трехбратинской косы до п-ова Бу-
зачи, наиболее интенсивно в районе Пешных о-вов, Егорычевых шалыг
и свала Гогольской бороздины. Менее интенсивно нерест происходит
от прол. Прорва до Бурунчука и, возможно, южнее, до зал. Сарыташ.
Биология. Икрометание с середины мая до середины или конца
июня при температуре воды от 15° и выше, разгар нереста при 18—20°.
Нерестилища расположены на местах с глубинами до 6, наичаще около 3 м
и соленостью от 1.48 до 11.00, наичаще 8—IO^/qq. Единичные зрелые самки
в начале июня были находимы в зал. Мертвый Култук.1 Плодовитость
1 1 экз. в 5 км к югу от м. Кизил-каир, 6 VI 1935, и 1 экз. у м. Яман-Айраклы,
3 VI 1935, №№ 26456 и 26457 коллекций Зоологического института Академии Наук
СССР.
9. ALOSA
229
около 20 тыс. икринок. Молодь в июне месяце находится еще вблизи
мест нереста, в северной части моря держится до поздней осени, макси-
мальные концентрации образует в сентябре, встречается еще в ноябре,
когда молодь всех видов сельдей, за исключением A. saposhnikovi, отсюда
уже уходит. Отход молоди на юг происходит вдоль западного берега
и частично, повидимому, вдоль восточного. Зимнее местопребывание
точно не известно.
Хозяйственное значение. Самостоятельного промысло-
вого значения не имеет. В небольшом количестве или единично ловится
вместе с основными промысловыми сельдями.
*3. Alosa caspia (Eiclrwald) s. 1. — Каспийско-черноморские пузанки.
Литературу см. при подвидах.1
Жаберных тычинок 50—180, различное количество у разных форм, ты-
чинки у всех форм тонкие и длинные, значительно длиннее жаберных лепе-
стков, с необломанными концами, обычно образующими на нижней половине
жаберной дуги выпуклую линию. Зубы развиты очень слабо, на верхней
челюсти обычно слабо заметные на ощупь, иногда на нижней, реже
и на верхней совершенно не заметные. Челюсти одинаковой длины или
нижняя слегка выдается вперед, реже короче верхней. Г олова клино-
видно сжатая в нижней части с боков, довольно большая и высокая,
высота ее 17%—25% длины тела, значительно различающаяся у разных
форм. Глаза большие, размеры их у разных форм неодинаковые. Тело
типично пузанковое, высокое, укороченное в хвостовой области, с длин-
ными грудными плавниками, высота его у разных форм различная. Темп
роста даже у наиболее быстрорастущей типичной формы вида по сравне-
нию с каспийскими проходными сельдями, крайне замедленный; при
одном и том же возрасте, начиная со второго года, размеры у каспийских
в среднем на ,5 см и более меньше, чем у A. kessleri volgensis. Сравни-
тельно небольшие по размерам рыбы, каспийские до 28 см, наичаще 18—
22 см, черноморско-азовские не свыше 20 см, наичаще 14—16 см.
Широко евригалинный, в основном солоноватоводный вид, черномор-
ские формы которого заходят для нереста в пресную воду, каспийские
размножаются как в пресных водах, так и в солоноватой воде в море.
Распадается на ряд форм. Один из наиболее изменчивых экологиче-
ски видов, занимая в этом отношении промежуточное положение между
морскими и проходными сельдями, так как имеет формы как полупро-
ходные, мечущие икру в пресной или слегка осолоненной воде, так
и почти морские, размножающиеся в солоноватой или даже с океаниче-
ской соленостью воде. Один из наиболее теплолюбивых видов рода, при-
чем некоторые из самых теплолюбивых каспийских форм живут и раз-
множаются в южной части Каспийского моря, другие для нереста идут
в северную часть его. Черноморско-азовские формы несколько менее
теплолюбивы, чем каспийские. Морфологически некоторые формы вида,
в особенности черноморско-азовские, отличаются друг от друга не слиш-
ком сильно, что стоит в связи с тем, что по некоторым биологическим
особенностям, обусловливающим морфологические различия у форм
других видов рода, формы этого вида сходны —> все они планктоноядны
и ведут пелагический образ жизни, между тем как более сильно разли-
1 В числе работ по черноморским подвидам не упомянуты две статьи, опублико-
ванные в недоступном автору издании (Borcea I., С. В. Acad. Sci. Roumanie, I, .1936 :
26—28, 216—217).
230
CLUPEIDAE
чающиеся морфологически формы других видов рода, например А. bra-
shnikovi s. 1., в отношении характера питания и образа жизни сильно
различаются. Однако по ряду особенностей, в частности по количеству
жаберных тычинок и позвонков, длине головы и высоте тела и некото-
рым другим и даже внешне, почти все формы отличимы довольно хорошо,
а некоторые, как, например, A. caspia knipowitschi, от большинства форм
отличаются резко (см. об этом стр. 216). При этом следует отметить, что
черноморско-азовские формы, отличаясь некоторыми особенностями
(меньшие размеры, менее высокое тело, большие размеры глаз) от кас-
пийских, между собой различаются незначительно, гораздо менее, чем
каспийские (подробнее см. об этом стр. 57, 216). О разделении форм этого
вида по антедорсальному и антеанальному расстоянию, длине головы,
количеству позвонков и некоторым другим особенностям на две группы —
северных и южных и по количеству жаберных тычинок на западных
и восточных см. Световидов, 1950.
Распространение. Каспийское, Черное и Азовское моря.
В Каспийском море некоторые формы, нерестящиеся в северной части
его, распространены почти повсеместно, другие почти не выходят из пре-
делов южной части.
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА ПОДВИДОВ 1
1 (8). Глаза не особенно большие, 18—24%%, в среднем около 21% —
22%% длины головы. Довольно крупные рыбы длиной до 28 см,
в половозрелом состоянии от 14—16 см. Каспийское море.
2 (5). Жаберных тычинок 70—180, наичаще 100—160, тычинки длин-
ные, тонкие и густые. Западная половина Каспийского моря.
3 (4). Жаберных тычинок 70—150, наичаще 100—140. Позвонков 47 -
52, наичаще 49—51. Голова сравнительно небольшая, 25%—28%,
в среднем около 26%% длины тела. Высота головы 1872—22'/о,
в среднем около 2О1/3°/о длины тела. Грудные плавники сравнительно
короткие, 15%—18%, в среднем около 16%—17% длины тела.
Тело не особенно высокое. Преимущественно в западной половине
Каспийского моря, зимой в южной части и в восточной половине
моря...........................*3f. A. caspia caspia (Eichwald)
4 (3). Жаберных тычинок 120—180, наичаще 130—160. Позвонков 43—
49, наичаще 47—48. Голова большая, 25—30%, в среднем около
28% длины тела. Высота головы 21—25%, в среднем около 22% —
23% длины тела. Грудные плавники длинные, 16—19%, в среднем
около 17%% длины тела. Тело значительно выше. Южная часть
Каспийского моря, преимущественно в западной половине, осенью
единично вдоль западного берега средней части ..............
.......................*3d. A. caspia knipowitschi (Hjin)
5 (2). Жаберных тычинок 50—120, наичаще 80—100, тычинки короче,
более грубые и редкие. Восточная половина Каспийского моря.
6 (7). Жаберных тычинок 60—120, наичаще 80—100. Позвонков 48—52,
наичаще 49—51. Голова сравнительно небольшая, 24—26%%,
в среднем около 25%% длины тела. Высота головы 17%—21%%,
1 В числе их не упомянута новая форма из пресных вод Турции, описанная в не-
доступном автору издании [(Battalgil F. Tiirkiyenin tatli su baliklari. Les poissons
des eaux donees de la Turquie. (Collection de I’lnstitut de Zoologie de 1’Universite
d’Istambul). Rev. Fac.Sci. Univ. Istambul, VI B, 1941 : 170—186). (Caspialosa tanaica
etemi subsp. nov., оз. Маньяс, басе. Мраморного моря)].
9. ALOSA
231
в среднем около 19% 96 длины тела. Грудные плавники сравнительно
короткие, 15—17% %, в среднем около 16% длины тела. Тело не осо-
бенно высокое. Восточная половина Каспийского моря, весной
и летом в восточной половине северной части моря.............
............................. . *3g. A. caspia salina (Svetovidov)
7 (6). Жаберных тычинок 50—110, наичаще 60—90. Позвонков 45—51,
наичаще 47—49. Голова большая, 25%—27%, в среднем около 27%
длины тела. Высота головы 19%—20%%, в среднем около 20%
длины тела. Грудные плавники длинные, 16% —18%, в среднем
около 17% длины тела. Тело очень высокое. Южная часть Каспий-
ского моря, преимущественно в восточной половине.................
......................................*3е. A. caspia persica (Iljin)
8 (1). Глаза большие, 22—28%%, в среднем около 24%—26% длины-
головы. Небольшие рыбы длиной не более 20 см, в половозрелом
состоянии от 10 см. Черное и Азовское моря.
9 (12). Тело низкое, наибольшая высота его составляет 20%—2796,
в среднем около 24% % длины его.
10 (И). Глаза большие, 24—28%%, в среднем около 26% длины головы.
Жаберных тычинок 62—85, в среднем около 76. Азовское море и
прилегающая часть восточной половины Черного моря.................
................................... *3с. A. caspia tanaica (Grimm)
11 (10). Глаза несколько меньше, 22—2796, в среднем около 24%%
длины головы. Жаберных тычинок 66—88, в среднем около 80.
Западная половина Черного моря .............................
...................................*3b. A. caspia nordmanni Antipa
12 (9). Тело выше, наибольшая высота его 25—31%, в среднем около
27%% длины его. Юго-восточная часть Черного моря, главным
образом у Поти и Анаклии ,*3а. A. caspia palaeostomi (Sadowsky)
*3а. Alosa caspia palaeostomi (Sadowsky) — Палиастомский пузанок
(табл. X).
Clupea caspia ? Кесслер, Тр. СПб. общ. ест., VIII, прил., 1878 : 1'1 (оз. Палео-
стом, «сельдь исключительно только мелкая, называемая пузиньком»), — Clupea caspia
(non Eichw.) Кесслер, там же : 14 (Черное м. перед устьем Риона). — Clu-
peonella pontica (non Eichw.) Берг, Тр. Общ. изуч. черноморск. поб., II, 1913 :
182 (оз. Палеостом, по Кесслеру). — Clupeonella tanaica (non Grimm) Берг, там же:
182 (оз. Палеостом).1 — Caspialosa pontica (non Eichw.) Берг, Рыбы пресных вод,
1916 : 25 (частью: оз. Палеостом). — Caspialosa nordmanni? Тихий, Изв. Отд.
прикл. ихт., IX, 3, 1929 : 326 (оз. Палестом, конец мая 1928 г.). — Caspialosa tanaica
sbsp. Берг, Рыбы пресных вод, II, 1933 : 838 (оз. Палеостом; синонимы). — Cas-
pialosa tanaica palaeostomi Садовский, Тр. Зоолог, сект. Груз. отд. Закавказск.
фил. АН СССР, I, 1934 : 135 (оз. Палеостом, 4 экз.1 2). — Caspialosa palaeostomica
Майорова, Тр. Научн. рыбохоз. биолог, ст. Грузии, I, 1, 1934:21, фиг.
(оз. Палеостом, Черное м. у Поти). — С aspialosa tanaica palaeostomi С л а с те-
нен к о, Тр. Новоросс. биолог, ст., II, 2, 1938 : 111. — Caspialosa tanaica palaeosto-
mica Майорова, Тр. Научн. рыбохоз. биолог, ст. Грузии, II, 1939 : 30
(оз. Палеостом, р. Молтаква, р. Чурья, Черное м. от Батуми до Очемчири). — Cas-
pialosa caspia palaeostomi Световидов, Зоолог, жури., XXII, 4, 1943 : 231;
Берг, Рыбы пресных вод, I, 1948 : 136.
D (III) IV 12—14 (13.4), общим числом 16—18 (17.4), А (II) III 15—19
(17.9), общим числом 18—22 (20.9), sp. Ъг. 73—87 (75.8), vert. S. 47—50
1 По № 15083 коллекций Зоологического института Академии Наук СССР.
2 Сохранился ли тип, выяснить не удалось. Если он не сохранился, то за тип
•следует считать экземпляр длиной 146.5 мм, оз. Палиастоми, 18 IV 1941, № 31740
коллекций Зоологического института АН СССР (рисунок его см. на табл. X).
232
CLUPEIDAE
(48.75), caud. vert. 31—34 (32.23).1 Жаберные тычинки тонкие и нежные,
не слишком частые, длинные, в 1% — 13/а раза длиннее жаберных лепест-
ков, верхний край их выпуклый. Зубы развиты слабо, но сильнее, чем
у других черноморско-азовских форм вида, обычно заметные на ощупь,
как на верхней, так и на нижней челюсти. Голова сравнительно неболь-
шая и низкая, длина ее 24.3—28.4 (25.9)96, высота 18.9—21.4 (20.1)%
длины тела. Глаза большие, 24.4—28.4 (25.1)% длины головы. Грудные
плавники длинные, 16.5—19.8 (17.8)% длины тела. Тело наиболее высо-
кое из всех черноморско-азовских форм вида, наибольшая высота его
25.2—30.8 (27.7)%, наименьшая — 7.6—9.6 (8.6)% длины. Спина и верх-
няя часть головы темные, бока серебристые. За жаберной крышкой
с каждой стороны тела по одному темному пятну и изредка по ряду из не-
скольких (7—8) пятен, иногда слабо развитых или реже отсутствующих
совершенно. Размеры до 19 см, наичаще 12—15 см. Описание дано по
65 экз. длиной от 11.1 до 18.0, в среднем 13.4 см, собранным 18 IV 1941 в
оз. Палиастоми. По данным Майоровой (1939), у 183 экз., длиной от И до 18,
в среднем 13.5 см, жаберных тычинок
61—90 (75.6),1 2 позвонков 46—50 (48.4),
пилорических придатков 21—50 (34.3).
Полупроходная форма, размножается
в пресной воде.
От азовского и дунайского пузанков
отличается, подобно обеим южнокаспий-
ским формам (Л. caspia knipowitschi и
A. caspia persica) от северокаспийских
(A. caspia caspia и A. caspia salina),
Рис. 30. 1-я жаберная дуга Alosa значительно более высоким телом.
caspia palaeostomi. Длина тела Р аспространение. Юго-во-
146.5 мм. сточная часть Черного моря, главным
образом близ Поти и Анаклии, на юг
единично до Батуми, встречается у Синопа,3 на север до Очемчири.
Для икрометания заходит в оз. Палиастоми, р. Молтакву и р. Чурыо.4
Биология изучена мало. Икрометание наблюдалось в июне.
Места зимовок не известны, единично в зимнее время заходит в Батум-
скую бухту. В оз. Палиастоми через р. Молтакву заходит в начале апреля.
В мае и июне в озере ловится в наибольшем количестве, в июле встре-
чается единично. В начале хода в море (в середине апреля 1932 г.) соот-
ношение количеств самцов и самок почти одинаково. В начале хода
в озеро преобладают самки, составляющие в мае до 96% улова; в июле
преобладают самцы, составляя до 71% улова. Во время хода в озеро
в апреле имеет половые железы в стадии главным образом IV, в мае появ-
1 Экземпляры со срощенными позвонками у этой формы встречаются наиболее
часто. Число позвонков у таких рыб было 40, 42 (2 экз.), 44 (2 экз.), 45, 46, 47 (3 экз.),
48 (2 экз.), 49.
2 У 608 экз. без указания длины тела жаберных тычинок, по этим же данным, —
62—93 (76.0).
3 № 21046 коллекций Зоологического института Академии Наук СССР, зал.
Ак-лиман на северо-запад от Синопа, VIII 1911, 7 экз. длиной от 9.7 до 18.7, в сред-
нем 14.5 см, жаберных тычинок от 70 до 83, в среднем 77.7, наибольшая высота
тела от 25.2 до 29.1, в среднем 27.2% длины тела.
4 Повидимому, заходит в р. Супсу. В коллекциях Зоологического института
Академии Наук СССР имеется 3 экз. (№' 15084, 29 VIII 1909), которые ближе всего
к A. caspia palaeostomi.
9. ALOSA
233
ляются особи, с половыми железами в стадии IV—V и даже V (Майо-
рова, 1934).
Хозяйственное значение небольшое, чисто местное.
В 1927 г. улов составлял 75.3 ц, в 1931 г. — 6.635 ц (0.3% улова озера).
*3b. Alosa caspia nordmanni Antipa — Дунайский пузанок, ризовка
(на Дунае) (табл. X).
Alosa nordmanni Antipa, Denkschr. Akad. Wiss. Wien, math.-naturw. KI.,
LXXVIII, (1905), 1906 : 28, t. F, t. II, f. 6—10 (северо-западная часть Черного и.,.
Дунай);1 Б раунер, Тр. Бессарабск. общ. ест., II, 2, 1912 : 122 (низовья Днепра у
Херсона, Днестра у г. Маяки и с. Троицкого). — Clupeonella nordmanni Берг, Мат.
позн. русск. рыбол., II, 3, 1913 : 12. — С as pi alosa nordmanni Берг, Рыбы пресных
вод, 1916 : 26. — Clupea nordmanni Д р е н с к и, Спис. Българск. Акад. Наук.,
XXV, 1923 : 73 (к северу от Бургаса, реже у Созополя). — Clupea tanaica (non
Grimm) Д p e н с к и, Тр. Българск. природоизп. друж., XI, 1924 : 57 (Бургас). —
Caspialosa nordmanni Исаченко, Тр. Всеукр. Гос. черном.-азовск. научно-
промысл. оп. ст., I, 1925 : 122, табл. 6, 7 (Днепровский лиман у Очакова); В о г-
с е a, Ann. Sci. Univ. Jassy, XIX, 1934 : 368 (берега Румынии, Дунай). — Caspialosa
tanaica (non Grimm) В о r c e a, ibid., XXII, 1936 : 327 (частью: северо-западная
часть Черного м., берега Румынии, Дунай). — Сaspialosa tanaica nordmanni G ла-
ст e н e и к о, Тр. Новоросс. биолог, ст., II, 2, 1938 : 111; Slastenenko Ann.
Sci. Univ. Jassy, XXV, 1939 : 16; Майорова, Тр. Научн. рыбохоз. биолог, ст.
Грузии, II, 1939 : 30 (по Исаченко; биометрика). — Caspialosa caspia nordmanni
Световидов, Зоолог, журн., XXII, 4, 1943 : 231-; Берг, Рыбы пресных вод,
I, 1948 : 135.
Распространение, биология. Haeckel и. К n е г, Siisswas-
serf. ostreich. Mon., 1858 : 232 (Alausa vulgaris ?, у Будапешта); Рябков, Рыбо-
ловство в Херсонск. губ., 1896 :96 (биология); Суворов, Вести, рыбопр., XXX, 1,
1915 : 46 (до порожистой части Днепра не доходит); Пузанов, Рыбн. хоз., II,
1923 : 128 (Черное м. против Ялты); Квинтилианов, Бюлл. Всеукр. Гос.
черном.-азовск. научно-промысл. оп. ст., 15—16, 1925 : 46 (Днейровско-Бугский
лиман); Исаченко, там же, 17—18, 1926 : 10 (низовья Днепра; ход); Шеп-
т и ц к и й, там же, 19—20, 1927 : 36 (низовья Днепра; ход); Сыроватский,
Тр. Всеукр. Гос. черном.-азовск. научно-промысл. оп. ст., II, 2, 1927 : 144 (Дне-
провско-Бугский лиман; ход).
D III—IV 13—15 (13.8), общим числом 17—19 (17.8), A III (IV) 16—
20 (17.9), общим числом 19—23 (20.9), sp. br. 66—88 (79.7), vert. S. 48—51
(49.49), caud. vert. 32—34 (32.8).1 2 Жаберные тычинки тонкие и нежные,
не особенно частые, около 1)4 раз длиннее жаберных лепестков. Зубы,
более или менее развитые, на нижней челюсти иногда незаметные на ощупь.
Голова сравнительно небольшая, длина ее 23.8—27.3 (25.3)%, высота
18.3—20.3 (19.3)% длины тела. Глаза большие, 22.0—26.9 (24.6)% длины
головы. Грудные плавники длинные, 16.5—18.8 (17.4)% длины тела.
Тело не особенно высокое, наибольшая высота его 22.3—26.8 (24.4)%,
наименьшая — 7.5—8.9 (8.3)% длины тела. Спина темная, с голубовато-
зеленоватым оттенком, голова темнее. За жаберной крышкой с каждой
стороны сверху обычно по черному пятну,3 сзади которого иногда
на боках еще по 5—8 таких же пятен. Размеры небольшие, до 18 см,
наичаще около 15 см. Описание дано по 44 экз. длиной от 9.5 до 17.4,
1 Тип не указан. За тип следует считать экземпляр длиной 154 мм, Дунай близ-
Вилкова, 7 VIII 1906, № 15497 коллекций Зоологического института Академии Наук
СССР.
2 Со срощенными позвонками среди исследованных экземпляров был один, имев-
ший 47 позвонков.
3 Черное пятно за жаберной крышкой из 52 рыб, исследованных Исаченко (1925),
имелось только у одной. У исследованных нами рыб черное пятно имелось почти
у всех.
234
CLUPEIDAE
в среднем 13.9 см, собранным главным образом в дельте Дуная
(у Измаила) и к югу от нее (28 экз. в дельте Дуная, 4 экз. из Днестра,
8 экз. у Бургаса, 4 экз. у Пендераклии). По данным Исаченко (1925), у
52 экз., длиной от 11.1 до 16.2, в среднем 13.6 см, от Очакова жаберных
тычинок 78—95 (82.8); по данным Borcea (1936), у 21 экз. длиной в среднем
около 16 см (абсолютная длина от 12 до 22, в среднем 17.8 см) из Дуная
и от берегов Румынии жаберных тычинок от 70 до 91 (80).
Полупроходная или отчасти проходная форма, размножающаяся
в низовьях рек, иногда подымается высоко вверх по течению.
Колебания в количестве жаберных тычинок меньше, чем у азовского
пузанка. У дунайского пузанка количество тычинок несколько менее
(78.5), чем у днепровского, и, возможно, что он представляет особую
расу или стадо.
Распространение. Западная половина Черного моря. Есть
у берегов Румынии, где заходит в лиманы и озера, стоящие в связи
с морем. На юг у берегов Болгарии до Бургаса, единично до Созополя
и вдоль берегов Турции до западной части анатолийского побережья.1
На восток у берегов Крыма до Ялты.
Для нереста входит в нижнее течение
Днепра, не доходя, однако, в прежние
годы до порогов, в низовья Днестра,
в Дунай в массе до Тульчи, единично
до Железных Ворот и выше, возможно
до Будапешта.
Биология. Икрометание с кон-
ца апреля, в мае, по начало июня.
Места зимовок не известны. Осенью в
течение двух-трех недель ловится у юж-
ных берегов Крыма против Ялты, дер-
жась здесь, пока температура воды не
снизится с 12 до 10°. В 1921 г. ло-
вился здесь в течение первой поло-
У берегов Румынии ловится единично
в январе, в начале весны подходит к берегам при температуре воды
около 6°, в апреле при 9—12° ловится уже в значительных количествах,
а вообще встречается при температуре воды от 4 до 24°, в наибольших же
количествах — при 9—18° (Borcea, 1936). В дельте Днепра начинает
ловиться с начала или середины апреля, в некоторые годы единично
с начала марта (в 1925 г. 5 марта; Исаченко, 1926) и продолжает итти
до конца мая. Высоко вверх по течению здесь не подымается, в прежние
годы, насколько известно, до порогов не подымался (Суворов, 1915).
Перед устьями Дуная появляется в конце марта—начале апреля,
в дельту входит в начале апреля, недели через две спустя после крупных
сельдей (Antipa, 1906). Следует отметить, что, по указанию ряда авторов,
в Днепре наблюдается обратное. Как указывалось выше, в 1925 г. пуза-
нок здесь начал ловиться 5 марта, сельдь же была поймана только
8 апреля (Исаченко, 1926). Основная масса остается в дельтовой части
Дуная ниже Тульчи, меньшая часть подымается до Браилова, единично
заходит и значительно далее — до Железных Ворот и выше. Для икро-
Рис. 31.,1-я жаберная дуга Alosa
caspia nordmanni. Длина тела 154 мм.
вины ноября (Пузанов, 1923).
1 В коллекциях Зоологического института Академии Наук СССР есть 4 экз.,
пойманных в сентябре 1912 г. в р. Кулюг и в море у Пендераклии (Эрегли) (№ 21048).
По всем признакам они ближе всего к A. caspia nordmanni.
9. ALOHA
235
метания заходит также в старицы и в поемные и стоящие в связи с Дунаем
озера, причем некоторые остаются здесь даже и на зиму. Молодь поки-
дает Дунай в конце августа и в сентябре, значительно позднее взрослых
(Antipa, 1906; Borcea, 1936).
Хозяйственное значение небольшое. В 1937 г. улов
в Дунае составлял около 6 тыс. ц.
*3с. Alosa caspia tanaica (Grimm) — Азовский пузанок, плоскун,
плоскунец, пластун, пластунец (табл. XI).
Clupea tanaica Гримм, Вести, рыбопр., XVI, 2, 1901 : 59, 62, 67 (низовья
Дона, Керчь).1 — Alosa tanaica Браунер, Тр. Бессарабск. общ. ест., II, 2,
1912 : 124 (Керчь). — Clupeonella tanaica Берг, Мат. позн. русск. рыбол., II, 3,
1913:12. — Caspialosa tanaica Берг. Рыбы пресных вод, 1916 : 27; Алексан-
дров, Тр. Керченск. ихт. лаб., I, 1, 1926: 30 (Керченский прол., Таганрог-
ский зал., дельта Дона); В о г с е a, Ann. Sci. Univ. Jassy, XXII, 1936 : 327
(частью: восточная половина Черного и., Азовское м. и Доп); Майорова,
Тр. Научн. рыбохоз. биолог, ст. Грузии, II, 1939 : 29 (биометрика). — Caspialosa
caspia tanaica Световидов, Зоолог, журн., XXII, 4, 1943 : 231; Берг, Рыбы
пресных вод, I, 1948 : 135; Световидов, в: Промысловые рыбы СССР, 1949 : 98,
табл. 24.
Распространение, биология. Данилевский, Исслед. сост.
рыбол. России, VIII, 1871 : 213, 214, 216 (пузанок; Керченский прол, и низовья Дона;
миграции); Бородин, Азовско-донск. рыбол., Новочерк., 1901 : 44 («плоскун»,
в Дон идет вслед за взломом льда); Тихонов, Бюлл. Всеукр. Гос. черном.-
азовск. научно-промысл. оп. ст., 19—20, 1927 :58 (северное побережье Азовского
моря; с июня по конец сентября); Книпович, Тр. Азовско-черном, научно-
промысл. эксп., 2, 1927 : 59 (ход в р. Дон); Недошивин, там же, 4, 1929 : 32
(Таганрогский зал., низовья Дона, р. Аксай и Маныч; ход); Телегин, там же :
209 (Таганрогский зал.; ход на нерест); Троицк и й, Тр. Азовско-черном, научн.
рыбохоз. ст., 6, 1930 : 7 (низовья Дона); Есипов, там же, 7, 1930 : 48 (лиманы
дельты р. Кубани; ход на нерест); Малятский, Тр. Новоросс. биолог, ст.,
1931 : 5 (Черное море против Новороссийска; миграции); Пчелина, там же,
I, 6, 1937 : 18 (Черное море у Новороссийска; миграции); Вещезеров, Рыбн.
хоз., 1937, 7 : 23 (содержание жира); Троицкий, Природа, 1939, 10 : 71 (дельта
Кубани); Сыроватский, Раб. Доно-кубанск. научн. рыбохоз. ст., 6, 1940 : 19
(попои Манычского займища); Москвин, Тр. Новоросс. биолог, ст., II,. 3, 1940 :
269 (у Новороссийска; питание); Воробьев, Тр. Азовско-черноморск. научно-
исслед. инет. рыбн. хоз. и океаногр., 12, ч. 1, 1940 : 149 (Сиваши Утлюкский лим.;
в августе и сентябре); Сыроватский, Учен. зап. Ростовск. н/Д. Гос. унив.,
XII, 1948 : 48 (р. Маныч, до сооружения плотины до лиманов выше хут. Веселого).
D III—IV 12—15 (13.4), общим числом 16—18 (17.4), A HI (IV) 16—
19 (17.7), общим числом 19—22 (20.7), sp. br. 62—85 (75.7), vert. S. 48—49
(49.20), caud. vert. 31—34 (32.63).1 2 Жаберные тычинки тонкие, нежные,
не особенно частые, длинные, в l1/^—1/4 раза длиннее жаберных лепест-
ков, верхний край их выпуклый. Зубы развиты слабо, на нижней
челюсти часто незаметные на ощупь. Голова самая короткая из всех
форм вида, длина ее 23.7—25.9 (24.7)%, высота 18.2—24.9 (20.2)% длины
тела. Глаза очень крупные, 24.3—28.2 (26.0)% длины головы. Грудные
плавники длинные, 16.7—19.2 (17.5)% длины тела. Тело не особенно
высокое, наибольшая высота его 20.7—26.1 (24.2)%, наименьшая высота
6.5—8.4 (7.6)% длины. Спина и верхняя часть головы темные. С каждой
стороны тела за жаберной крышкой по одному пятну и изредка сзади
него по ряду из 4—5 черных пятен. Размеры до 20 см, наичаще 14—16 см.
1 Тип не указан. За тип следует считать экземпляр длиной 147 мм, низовья Дона
у Ростова н/Д., 1885, Гримм, № 16125 коллекций Зоологического института Академии
Наук СССР.
2 Кроме того, у рыб со срощенными позвонками, нередко встречаемых у этой
формы, число их было 41, 42, 44, 47 (3 экз.).
236
CLUPEIDAE
Описание дано по 50 экз. длиной от 10.1 до 17.3, в среднем 13.6 см, со-
бранным 20—21 IV 1940 в Керченском прол. Количество жаберных тычи-
нок дано по 75 экз. (просчитаны еще у 25 экз. длиной от 10.6 до 14.0,
в среднем 12.6 см, собранных 26 VII 1913 в Азовском море у косы Камы-
шеватой, у экземпляров из Керченского прол, жаберных тычинок 66—85,
в среднем 77.2; у экземпляров от косы Камышеватой — 62—81, в сред-
нем 72.5). По данным Гримма (1901), у 18 экз. длиной в среднем около 14 см
жаберных тычинок 58—77 (около 70); по данным Майоровой (1939), у
237 экз. длиной от 9 до 13, в среднем 10.5 см, жаберных тычинок 60—75
(63.1), позвонков 47—51 (48.5), пилорических придатков 26—50 (36.3);
по данным Александрова (1926), жаберных тычинок 62—78 (размеры
не указаны).
Полупроходная форма, размножается в низовьях рек.
От других черноморско-азовских форм вида отличается главным
образом более крупными глазами. Количество жаберных тычинок, как
видно из приведенного выше, сильно варьирует, и есть основания пред-
полагать, что это обусловлено помимо размеров и систематическими раз-
личиями, стоящими в связи с нерестом в двух обособленных местах, —
Рис. 32. 1-я жаберная дуга Alosa
caspia tanaica. Длина тела 147 мм.
в низовьях Дона и в кубанских лиманах.
Этим яш, повидимому, объясняется и на-
личие упоминаемых двух волн хода в Кер-
ченском прол.
Распространение. Восточная
половина Черного моря, на юг до Ба-
туми, Азовское море, откуда входит в
низовья Дона, единично подымаясь до
Кочетовской плотины и выше (до ст. Цим-
лянской; по Замахаеву); в лиманах дельты
Кубани, заходит в Сиваш и Утлюкский
лиман. Икрометание в низовьях Дона на
разливах его притоков Маныча, Сала и
Аксая и в лиманах дельты Кубани, ча-
стично мечет икру и в Таганрогском зал. перед устьем Дона. В Маныч
особенно много пузанка заходило до сооружения плотины на этой реке.
Биология. Нерест с апреля по начало июня, в низовьях Дона,
повидимому, раньше, чем в лиманах дельты Кубани. Зимует в Черном
море против берегов Кавказа, повидимому значительно южнее, чем
A. brashnikovi maeotica, так как весной заходит в Сухумскую бухту;
в Батумской бухте встречается единично. Зимой, повидимому, держится
на значительном отдалении от берегов, так как по выходе из Азовского-
моря в течение всей осени и зимы у берегов не ловится. В Новороссий-
скую бухту весной начинает подходить обычно с середины апреля, в теп-
лые зимы с конца февраля, ловится в небольшом количестве (1—2%
улова), но в разгар хода, обычно в конце апреля, уловы иногда достигают
значительных размеров — до 30% и выше, а временами, когда улов
мал, он и целиком состоит из этой формы. С конца июня в Черном море
ловиться уже перестает (Малятский, 1931; Пчелина, 1937). В Керчен-
ском прол, при весенних и осенних миграциях почти не облавливается,'
составляя всего около 2—4% улова; в 1934 г. появился здесь 16 марта,
причем наблюдалось два максимума хода — один 22—24 марта, второй
6—11 апреля. В дельте Дона обычно появляется в первой поло-
вине апреля, но единично входит, повидимому, и раньше. В 1925 г.,
например, первые экземпляры начали попадаться с 6 апреля (Телегин,
9. ALOSA
237
1927), а в 1938 г., но наблюдениям К. Г. Дойникова, уже в конце марта.
Разгар хода, по наблюдениям Д. С. Талина, в конце апреля, к середине
мая ход уже заканчивается. В лиманах дельты Кубани появляется в пер-
вой половине апреля, разгар хода в конце апреля, к этому времени захо-
дит уже в верхние лиманы. Икрометание в низовьях Дона происходит
в основном на Аксайском займище и на разливах Маныча, но в неболь
тпом количестве подымается и выше — до Кочетовской плотины, где
составляет 1—2% в уловах, изредка, обычно когда улов мал, и выше,
.до 10 и даже 34%. Нерест частично, повидимому, происходит и в пред-
устьевом пространстве (по данным К. Г. Дойникова; см. также Недоши-
вин, 1929). В дельту Кубани для икрометания входит в лиманы: Тем-
рюкские, Куликовские,- Черноерковско-Сладковские и Гривенско-Ахтар-
ские, причем заходит и в самые верхние лиманы, в Темрюкских лима-
нах, например, до лимана Куркуй, в Черпоерковско-Сладковских —
в лиманы Глубокий и Круглый (Есипов, 1930). В начале хода идут более
крупные рыбы. В большинстве уловов как в реке и предустьевом про-
странстве, так и в море, например против Новороссийска, обычно коли-
чество самок больше количества самцов (от 40.4 до 74.8% с 1932
по 1935 г.), что, возможно, обусловливается отбирающим влиянием ору-
дий лова, так как самки несколько крупнее самцов. У Новороссийска
в начале хода, в марте, ловятся преимущественно особи со II стадией
зрелости половых продуктов, с конца марта начинают ловиться с III ста-
дией, которая преобладает с конца апреля (Пчелина, 1937). Керченским
прол, проходит, имея половые продукты в III стадии зрелости. В Дон
входит с половыми продуктами в IV и IV—V стадиях зрелости. Почти
текучие или даже текучие встречаются и в Таганрогском зал. перед
устьями Дона (Недошивин, 1929). В Маныче с текучими половыми про-
дуктами в 1930 г. ловился с половины мая, в начале июля ловится уже
отнерестившийся. Плодовитость, по данным Д. С. Талина, от 12 до 39 тыс.
икринок. После икрометания скатывается в низовья Дона и в Таган-
рогский зал., а также, повидимому, и в море, так как в прежние годы
ловился, с июня по конец сентября, по> всему северному побережью Азов-
ского моря от Таганрогского зал. до Геническа, наиболее же у Бердян-
ской косы и в Таганрогском зал. (Тихонов, 1927). В начале хода идут
более крупные рыбы, в 1938 г. размеры ходового пузанка в Таганрогском
зал. были от 11 до 18 см, наичаще 14—16 см. Половой зрелости дости-
гает в два года, в кубанских лиманах (Ахтари) встречаются зрелые и одно-
годовалые. Основной возрастной группой в ходовых косяках в 1938 г.
были трехгодовалые (61.5%) и двухгодовалые (33.3%), в небольшом
количестве (5.2%) встречались четырехгодовалые (по данным Д. С.
Талина). Питается преимущественно планктонными организмами. В ве-
сенний период (конец апреля) в Черном море в районе Новороссийска
основной пищей являются Copepoda (56.9%), в меньшем количестве
поедается микрофлора (27.4%) и отчасти макрофиты (15.7%). Из Cope-
poda главную роль играют С alarms helgolandicus, Acartia clausi, Pseudo-
calanus parvus и в меньшей степени некоторые другие (Москвин,
1940). В летнее время в Азовском море вместе с молодью сельди
поедается судаком. Наиболее упитан бывает осенью (33.3—34.6% жира),
весной в период нереста менее жирен (7.2 — 10.9%; Вещезеров, 1937).
Хозяйственное значение небольшое, уловы не велики
и промыслом отдельно не учитываются. В низовьях Дона в 1928 г. пой-
мано около 350 ц (2.13% улова). Составляет единицы процентов в общих
уловах и в других районах.
238
CLUPEIDAE
*3d. Alosa caspia knipowitschi (Iljin) — Энзелийский, саринский
пузанок (табл. XI).
Caspialosa knipowitschi. Ильин, Сборн. в честь Книповича, 1927 : 69, фиг.
(Энзелийский зал.1) —• Caspialosa caspia knipowitschi Берг, Рыбы пресных вод,
I, 1932 : 89, фиг. 95 (на север до Астары, входит в р. Кумбашинку); Светови-
дов, Тр. Касп. ком. Акад. Наук, I, 1937 : 194, 195 (сравнение с другими формами
вида); Зоолог, журн., XXII, 4, 1943 : 231. — Caspialosa caspia knipowitschi n.
saraica Световидов, там же : 231 (по Бергу); Берг, Рыбы пресных вод, I,
1948 : 144 (по n. sarensis 1 2 Мейснер). — Caspialosa caspia knipowitschi Берг,
1. с. : 143.
Распространение, биология. Мейснер, Бюлл. Всекасп.
научн. рыбохоз. эксп., 5—6, 1932 : 21, фиг. 3 (n. knipowitschi и n. saraica, распро-
странение); Махмудбеков, Зоолог, журн., XXVI, 2, 1947 : 143 (возраст на-
ступления половой зрелости); Дмитриев, там же, XXVI, 6, 1947 : 559 (размеры,
возрастной состав, ход у берегов Ирана).
D III—IV 12—14 (13.4), общим числом 16—18 (17.4), A III (IV) 16—
20 (18.7), общим числом 19—23 (21.7), sp. br. 121—160 (142.0), vert. 8.
47—49 (47.33 3), caud. vert. 31—33 (31.70). Жаберных тычинок наиболь-
шее количество из всех форм вида. Тычинки очень тонкие, нежные,
частые и длинные, в 1/4—2 раза длиннее жаберных лепестков. Зубы
развиты очень слабо, на нижней челюсти обычно их нет, на верхней едва
заметные, или иногда совсем незаметные на ощупь. Голова большая
и высокая, длина ее 18.3—24.1 (21.7)%, высота 20.7—24.3 (22.7)% длины
тела. Глаза довольно большие, 18.3—24.1 (21.7)% длины головы. Груд-
ные плавники длинные, 16.0—19.1 (17.6)% длины тела. Тело очень высо-
кое, наибольшая высота его 25.1—32.5 (29.7)%, наименьшая—7.2—9.4
(8.6)% длины тела. Спина и голова сверху темные. За жаберной крыш-
кой сверху с каждой стороны по черному пятну, на боках тела иногда
по ряду таких же пятен числом до 7. Размеры до 25.5 см (по Ильину
до 29.6 см), наичаще 18—20 см. Описание дано по 42 экз. длиной от 15.6
до 25.5, в среднем 19.5 см, собранным в апреле (26 экз.), июле—августе
(15 экз.) и в декабре (1 экз.) 1915 г. в зал. Пехлеви. Это часть тех экзем-
пляров, по которым сделано описание этой формы Б. С. Ильиным
По данным В. И. Мейснера, у n. knipowitschi жаберных тычинок 122—
168 (144.7), позвонков 43—49 (47.4), у n. saraica жаберных тычинок 110—
180 (145.1), позвонков 45—51 (47.5).
Полупроходная форма, размножается в пресной и слегка осолонен-
ной воде.
От северокаспийских форм вида внешне отличается характерным
высоким телом с более длинными плавниками и головой. От астаринского
пузанка резко отличается количеством жаберных тычинок. Повидимому,
распадается на две формы: A. caspia knipowitschi n. knipowitschi (Iljin) —
энзелийский пузанок и A. caspia knipowitschi n. saraica (Berg) — сарин-
ский пузанок. Отличия между этими формами крайне ничтожны, внешне
они, подобно формам A. caspia caspia, почти не различаются:
1 Тип не указан, но часть экземпляров, по которым дано первоописание, сохра-
нилась. За тип следует считать один из этих экземпляров длиной 212 мм, Энзели,
15 IV 1915, № 31892 коллекций Зоологического института Академии Наук СССР.
2 Тип не указан. За тип следует считать экземпляр длиной 192 мм, о. Сара,
25 IV 1939, № 32183 коллекций Зоологического института Академии Наук СССР.
Отсюда происходят и экземпляры, по которым сделано первоописание.
3 Со срощенными позвонками среди исследованных рыб была одна, имевшая
47 позвонков.
9. ALOSA
239
В % длины тела:
Длина тела { Д° ...............
Длина грудного плавника .......
Наибольшая высота тела.........
Наименьшая » » .......
Длина головы..................
Высота » .................
В % длины головы:
Диаметр глаза.................
Межглазничный промежуток . . .
Количество жаберных тычинок . .
Длина тела ....................
A. caspia
knipowitschi
65.4—70.2 (68.3)
45.0—50.8 (47.9)
]6.0—19.1 (17.6)
25.1—32.5 (29.7)
7.2— 9.4 (8.6)
26.2—29.2 (27.8)
20.7—24.3 (22.7)
18.3— 24.1 (21.7)
16.3— 22.2 (18.8)
121 —160 (142.0)
15.6— 25.5(19.5)
A. caspia
knipowitschi
n. saraica1
65.0—70.6 (68.4)
44.6-50.3 (47.7)
16.2—18.7 (17.4)
29.8—34.1 (32.1)
8.0— 9.4 (8.6)
25.1—30.0 (27.9)
21.4—25.0 (23.0)
19.2— 24.7 (22.4)
16.9— 20.0(18.5)
122 —163 (138.6)
15.5— 19.9(18.0)
У саринского пузанка лишь немного выше тело и больше глаза, при-
чем и по этим признакам обе формы значительно перекрывают одна дру-
гую. По исследованиям же
В. И. Мейснера, саринский
пузанок отличается от энзе-
лийского по другим при-
знакам: большей длиной
грудных плавников, более
крупными глазами и более
длинной головой, причем
различия в этих признаках
ничтожны и различать по
ним обе формы в сущности
невозможно. Некоторые
различия между этими фор-
мами, наблюдаемые в тем-
пе роста, указывают на
возможную изоляцию их
друг от друга и
зацию по местам
тания. Возможно,
формы являются лишь стадами. Биологически
отличается от A. caspia knipowitschi п. saraica,
schi. Длина
Рис. 33. 1-я жаберная дуга Alosa caspia knipowit-
~ тела 212 мм.
локали-
икроме-
что обе
A. caspia knipowitschi
повидимому, так же,
как A. caspia caspia n. aestuarina от A. caspia caspia. Д. caspia knipowi-
tschi n. saraica и A. caspia caspia мечут икру в море, в опресненных частях
егсг, заходят в устья рек, в то время как A. caspia knipowitschi и A. caspia
caspia п. aestuarina размножаются в пресной воде — в дельте Волги и иль-
менях и в Пехлевийском зал. Эти различия в условиях размножения
сказываются в небольших различиях в числе позвонков, что видно из
нижеследующего (в скобках приведены, данные В. И. Мейснера):
knipowitschi
и. saraica
47.33 (47.37)
47.69 (47.53)
п. aestuarina
caspia . . .
— (49.60)
50.05 (49.86)
Формы, размножающиеся в море, имеют несколько большее число
позвонков, что, судя по всему, обусловлено различиями в температуре
1 Описание дано по 50 экз. длиной от 15.5 до 19.9, в среднем 17.9 см, собранным
25—29 IV 1939 в южной части Каспийского моря у о. Сара. Позвонков у них 47—48
(47.69).
240
CLUPEIDAE
воды в период образования позвоночника, повидимому несколько более
низкой в море.
Распространение очень узкое, в пределах южной части
Каспийского моря, преимущественно в западной его половине, в районе
Пехлевийского (Энзелийского) зал., Астары и Бакинского архипелага,
осенью, у северных берегов Апшеронского п-ова, откуда вдоль западных
берегов в это время заходит до Худата. На восток вдоль южных берегов
осенью и зимой в небольшом количестве заходит до Астрабадского зал.
К северу от Астары встречается n. saraica. Икрометание типичной
формы подвида в Пехлевийском зал. и, возможно, в устье р. Чемхалы
(к востоку от р. Сефид-руд), n. saraica нерестует у о. Сара и частично,
возможно, в устье р. Кумбашинки.
Биология изучена мало. Нерест в мае—июне в пресной или
слегка осолопеиной воде. Места пребывания в южной части моря в зим-
нее время точно не известны. Наряду с A. caspia persica одна из самых
теплолюбивых форм вида и вообще каспийских сельдей. Основная масса
нерестующих рыб у типичной формы состоит из четырех- и пятигодова-
лых, но встречаются и значительно более младшие, точно так же как
и более старшие возрасты, от двух- до девятигодовалых включительно.
У п. saraica основную массу нерестующих рыб составляют пятигодова-
лые, причем и здесь встречаются особи от двух- до восьмигодовалых
и даже девяти- и десятигодовалых. Половой зрелости впервые частично
достигает в двухгодовалом возрасте, но основная масса, судя по всему,
в более старшем (Махмудбеков, 1947). В промысловых уловах в 1932 г.,
по данным В. И. Мейснера, преобладали пяти- и шестигодовалые, состав-
лявшие свыше 76% улова; позднее преобладали четырех- и пятигодо-
валые, которые в 1934 г. составляли около 76%, в 1935 г. — около 63%
(по наблюдениям А. М. Шуколюкова), в 1945 г. — около 82.2% (Дми-
триев, 1947). Темп роста у обеих форм крайне замедленный, энзелийский
пузанок, по исследованиям Туркменской научной рыбохозяйственной
станции, в первые годы растет несколько быстрее саринского, а затем
последний его обгоняет, как это видно из сопоставления средних раз-
меров возрастных групп обеих форм (по данным В. И. Мейснера):
Возраст................................ 2 3 4 5 6 7 8
Длина (см)
A. caspia knipowitschi n. knipowitschi .... 14.0 17.1 19.0 19.2 19.8 19.7 20.5
A. caspia knipowitschi n. saraica. 11.0 15.3 18.3 20.6 21.3 22.3 21.0
Хозяйственное значение небольшое. Промыслом запасы
обеих форм почти не затронуты, о чем свидетельствует высокий возраст-
ной состав уловов и крайне замедленный темп роста. Саринский пузанок
вылавливается в большей степени, чем энзелийский, причем вылавли-
ваются более старшие возрастные группы, так как лов производится
крупноячейными орудиями лова, благодаря чему, повидимому, и наблю-
дается увеличение приростов после 5 лет. Ловится у о. Сара, осенью
составляет до 30% в уловах A. caspia caspia у северных берегов Апше-
ронского п-ова.
*3е. Alosa caspia persica (Iljin) — Астрабадский пузанок (табл. XII).
Clupea {Alosa) caspia Суворов, Тр. Касп. эксп. 1904 г., I, 1907 : 145, 163,
173—177 (астрабадская разность, частью: № 40—68 1 табл, измерений, Астрабадский
1 Экземпляры № 69—73 в таблице измерений Е. К. Суворова по количеству
жаберных тычинок (122—147) и другим особенностям относятся к A. caspia caspia.
9. ALOSA
241
зал. у Ашур-аде). — Caspialosa caspia var. persica Ильин, Сборн. в честь Книпо-
вича, 1927 : 72 (по Суворову х). — Caspialosa caspia persica Берг, Рыбы пресных
вод, 1, 1932 : 89; Световидов, Тр. Касп. ком. АН СССР, I, 1937 : 195 (сравне-
ние с другими формами вида); Зоолог, журн., XXT.I, 4, 1943 : 231.
Распространение, биология. Керенцева, Учен. зап.
Пермск. унив., Ш, 1, 1937 : 178—181 (осенью и весной у Кизил-су); М ахмудбе-
к о в, Зоолог, журн., XXVI, 2, 1947 : 143 (возраст наступления половой зрелости).
D III—IV 13—14 (13.2), общим числом 17—18 (17.2), A III (IV) 16—
19 (18.5), общим числом 19—22 (21.5), sp. br. 83—102 (94.3), vert. S. 47—
48 (47.69), caud. vert. 30—33 (31.45). Жаберных тычинок наименьшее коли-
чество из обеих южно-каспийских форм вида. Тычинки тонкие, более ред-
кие, чем у других форм вида, длинные, в I1/*—13/4 раза длиннее жаберных
лепестков. Зубов на нижней челюсти нет или имеются, но слабые, на верх-
ней челюсти обычно хорошо заметны тта ощупь. Голова большая и высокая,
длина ее 25.6—27.1 (26.8)%, высота 19.5—20.6 (20.1)% длины тела. Глаза
большие, 23.1—24.4 (23.9)% длины головы. Грудные плавники длинные,
16.5—17.7 (17.1)% длины тела. Тело очень высокое, наибольшая высота
его 28.7—31.2 (29.1)%, наимень-
шая — 8.1—8.7 (8.4)% длины тела.
Размеры небольшие, до 21 см, но
обычно меньше, от 10 до 17 см.
Описание дано по 4 экз. длиной
от 14.7 до 17.3, в среднем 15.7 см,
собранным 12 IV 1904 у юго-запад-
ных берегов южной части Каспий-
ского моря к северу от Ашур-аде
(36°53' с. ш., 53°65' в. д.). По дан-
ным В. И. Мейснера, жаберных
тычинок 51—104 (80.1), позвонков
45—51 (48.1)., По данным Керен-
цевой (1937), жаберных тычинок в Рис. 34. 1-я жаберная дуга Alosa caspia
среднем 89.2 (осень, весной у мо- . Persica- Длина тела 147.5 мм.
лоди 78.2).
Повидимому, полупроходная форма.
От других форм вида отличается характерной формой тела и неболь-
шим количеством жаберных тычинок.
Распространение очень узкое, встречается только в южной
части Каспийского моря, преимущественно в восточной его половине,
главным образом в районе Торга некого (Астрабадского) зал. Весной, летом
и осенью вдоль восточных берегов заходит на север до Красноводского зал.
(южная оконечность Красноводской косы: бухта Бековича летом и Кизил-
су весной и осенью). Вдоль южных берегов на запад заходит, возможно,
до Пехлевийского зал.1 2 Икрометание в Горганском зал.
Биология изучена мало. Условия икрометания точно не изве-
стны- Миграции совершает, повидимому, крайне ограниченные, на-
1 Тип не указан, не сохранились и экземпляры Е. К. Суворова. За тип следует
считать экземпляр длиной 147.5 мм, к северу от Ашура (36°53 с. ш., 53°55 в. д.),
25 IV 1904, Каспийская экспедиция 1904 г., № 16413 коллекций Зоологического ин-
ститута Академии Наук СССР.
2 По предположению В. И. Мейснера, экземпляры из Пехлевийского зал., имею-
щие 50—100 жаберных тычинок (годовики) и относимые Б. С. Ильиным к A. caspia
knipowitschi, следует считать за A. caspia persica, так как после первого года коли-
чество жаберных тычинок у A. caspia более не увеличивается.
1G Фауна СССР — 314
242
CLUPEIDAE
сколько известно, в пределах только южной части моря, но локализация
его здесь в зимнее время не известна. Самая мелкая и медленно растущая
из каспийских форм вида. В уловах в летнее время на местах кормежки
(бухта Бековича) держится рыба в одно-пятигодовалом возрасте, полово-
зрелые на местах нереста имели размеры от 13 до 21 см (по данным
В. И. Мейснера). Половой зрелости достигает впервые в двухгодовалом
возрасте, самцы несколько в большем количестве, чем самки. Основная
масса, судя по всему, созревает в более старшем возрасте. Иногда встре-
чаются зрелые самцы семигодовалые, а самки восьмигодовалые (Мах-
мудбеков, 1947).
Хозяйственное значение небольшое, улов не учиты-
вается.
*3f. Alosa caspia caspia (Eichwald) — Северокаспийский (среднекас-
пийский) или ильменный пузанок (табл. ХИ, XIII).
Clupea caspia Eichwald, Bull. Soc. Nat. Moscou, XI, 1838 : 134 (Каспий-
ское м., к югу); Fauna caspio-caucasica, 1841 : 203, t. XXXII, f. 1 (Каспийское м.,
к югу). — Alosa rossica Кесслер, Тр. СПб. общ. ест., I, 1870 : 76 (Волга, nomen
nudum; согласно Кесслеру= Clupea caspia Eichwald, 1841). — Alosa caspia Кес-
слер, там же : 282 (Волга у Самары, Казани, Ярославля,1 сентябрь 1869 г.). —
Alosa caspica Яковлев, Тр. Общ. ест. Казанск. унив., I, 2, 1871 : 63—64 (жабер-
ных тычинок свыше 100). — Clupea caspia Кесслер, Тр. СПб. общ. ест., V, 1,
1874:301 (частью); Гримм, Астраханская селедка, СПб., 1887 : 67 (широкая
разность). — Clupea (Alosa) caspia Суворов, Тр. Касп. эксп. 1904 г., I, 1907 :
142, 164, 168—172 (среднекаспийский пузанок, западное побережье Каспийского м.
от Махачкалы до Апшеронского п-ова; измерения), 146, 164, 178—180 (астаринский
пузанок, от Апшеронского п-ова до устья р. Астары; измерения); там же, II, 1908 :
40 (частью). — Clupeonella caspia Берг,8 Мат. позн. русск. рыбол., II, 3, 1913 : 36,
табл. I, фиг. 1, табл. II (n. caspia). —• Clupeonella caspia m. elongata Берг, там же :
38 (n. aestuarina). — Clupeonella caspia Киселевич, там же, III, 6, 1914 : 14,
40, 48—50 (северо-восточная часть Каспийского м.; измерения, ход). — Caspialosa
caspia Берг, там же, IV, 6, 1915 : 4; Рыбы пресных вод, 1916 : 27 (частью);
Киселевич, Каспийско-волжские сельди, I, 1923 : 108, 135, 49—128 прилож.
(n. aestuarina, частично n. caspia)-, Морозов, Тр. Научн. инет. рыбн. хоз., II, 4,
1928 : 47 (биометрическая обработка материалов Киселевича). — Caspialosa caspia
caspia Аверинцев и Сыч, Тр. Астрах, научн. рыбохоз. ст., VIII, 3, 1930 : 11
(количества позвонков, килевых чешуй, лучей в плавниках). — Caspialosa caspia
caspia Световидов, Докл. АН СССР, 1932 : 203 (количество пилорических
придатков). — Caspialosa caspia aestuarina Берг, Рыбы пресных вод, I, 1932 : 88
фиг. 94.1 2 3 * — Caspialosa caspia Берг, там же : 86, фиг. 93; Дехтярева. Тр. Все-
союзн. Научно-исслед. инет, морск. рыбн. хоз. и океаноГр., XIV, 1940 : 47 (описание
сеголетков); Световидов, в: Промысловые рыбы СССР, 1949 : 95, табл. 23.
Распространение, биология. Арнольд, Вести, рыбопр.,
XXI, 9—10, 1906 : 480 (Волга в 30 км ниже Симбирска, 30 VI 1906, 112 жаб. тыч.);
Тр. Касп. эксп. 1904 г., I, 1907 : 226, фиг. 3 (зал. Чада; искусственное оплодотворе-
ние); Мейснер, Мат. позн. русск. рыбол., III, 4, 1914 : 97, фиг. VI—XVII (кав-
казское побережье; биология, промысел); Киселевич, там же, III, 6, 1914 : 3
(северо-восточная часть моря; биология); В у к о т и ч, там же, IV, 6, 1915:21
(Кизил-бурун; плодовитость); К и с е л е в и ч, там же, IV, 10, 1915 : 119 (n. aestua-
rina, дельта Волги; ход, нерест); Тр. Астрах, ихт. лаб., V, 1, 1923 : 37, 41 (n. aestua-
rina ?, у устьев Волги; плодовитость); Киселевич, там же, V, 2, 1922 : 22
(рост, возрастной состав); Фаресов, там же, : 143 (низовье р. Эмбы);
1 Один из этих экземпляров хранится в коллекциях кафедры ихтиологии Ленин-
градского Государственного университета, № 405, жаберных тычинок 127, длина
29.7 см.
2 Несколько более подробные ссылки на некоторые синонимы и литературу
более раннего периода см. в этой работе и в цитируемой ниже работе Киселевича
(1923).
3 За тип n. aestuarina следует считать экземпляр длиной 205 мм из ильменя Дам-
бур, 19 V 1912 г., описанный Бергом (1913 : 32, табл. 3).
9. ALOSA
243
Киселевич, там же, VI, 1, 1924 : 70 и сл. (n. aestuarina ?, возраст и темп роста);
Недошивин, Сборн. в честь Книповича, 1927 : 304 (искусственное оплодотворе-
ние); Мейснер, Бюлл. Всекасп. научн. рыбохоз. эксп., 1—2, 1932 : 50 (средне-
каспийский и северокаспийский пузанок, миграции); там же, 5—6, 1932 : 20 (средне-
каспийская раса); Чугунов, там же, 3—4, 1932 : 13 (распределение и миграции
в море в весенне-летний и осенний периоды); там же, 5—6, 1932 : 191 (распределение
и миграции в море весной); Леванидов, там же, 5—6, 1932 : 53 (содержание
жира); Жуковский, Тр. Северн, инет. рыбн. хоз., III, 1932 : 37 и сл. (аккли-
матизация в Арале); Махмудбеков, Рыбн. хоз. СССР, 1935, И : 22 (половой
состав и изменение его во время хода); Чаянова, Тр. I Всекасп. научи, рыбо-
хоз. конфер., I, 1936 : 51 (питание); Дмитриев, Рыбн. хоз. СССР, 1936, 2 : 39
(миграции у западных берегов моря); Беляев, Первая научн. конфер. по изуч.
сельдевых рыб Каспийского м., Астрах., 1937 : 34 (распространение, нерест, возраст);
Керенцева, Учен. зап. Пермск. Гос. унив., Ill, 1, 1937 : 177 (у восточных
берегов южной части Каспийского м., Тарта, Карши, Кизил-су; апрель); Кисе-
левич, Сельди северного Каспия, Сталингр., 1937 : 25 (биология); Навозов-
Лавров, Рыбн. хоз., 1938, 4—5 : 26 (Дагестан; условия подхода в береговую
зону); Перцева, там же, 1938, 7 : 31, рис. 1—2 (n. caspia, места, время и усло-
вия нереста); Н. Танасийчук, там же, 1938, 11 : 33 (нерест в затонах Волги):
Строганов, Учен. зап. Моск. Гос. унив., 33, 1939 : 201 (Кардуанские ильмени;
нерест, развитие икры при разных соленостях); Перцева, Тр. Всесоюзн. Научно-
исслед. инет, морск. рыбн. хоз. и океаногр., VIII, 1939 : 27 (развитие и морфология
икринок и личинок); Дмитриев, Сборн., посвящ. деят. Книповича, 1939 : 266'
(условия подходов в береговую зону); Махмудбеков, Изв. Азербайджанск. на-
учно-исслед. рыбохоз. ст., 3, 1939 : 3 (расовый состав и термические условия подхо-
дов пузанков); там же : 27 (возраст и. темп роста); Замахаев, Тр. Всесоюзн.
Научно-исслед. инет, морск. рыбн. хоз. и океаногр., XIV, 1940 : 3 (нерестовые
кольца); Казанова и Халдинова, там же : 77 (n. aestuarina и n. caspia,
дельта Волги; икринки и личинки); Перцева, там же : 109 (n. caspia; нерест,
литература); Чаянова, там же : 211 (питание); Махмудбеков, Рыбн.
хоз., 1941, 3:18 (возрастной состав, перспективы промысла); Казанчеев,
Рыбн. промышл. СССР, 3, 1945 : 59 (берега Мангышлака; летом); Екатеринин-
ская и Изосимов, Тр. Общ. ест. Казанск. Гос. унив., 1—2, 1945 : 37 (Волга
выше Тетюшей; питание после нереста); Штейнфельд, там же : 76 (Волга
у Тетюшей и выше Казани); Смирнов, Изв. Акад, наук Азерб. ССР, 7, 1945 : 71
(мйграции); там же, II, 8, 1946 : 55 (биология); Докл. Акад, наук'Азерб. ССР, II, 2,,
1946 : 60 (влияние света на нерестовые миграции); Махмудбеков, Рыбн.
хоз., 1946, 9 :<6 (состояние запасов); Зоолог, журн., XXVI, 2, 1947 : 143 (возраст
наступления половой зрелости); Остроумов, Тр. Волго-каспийск. научн.
рыбохоз. ст., IX, 1, 1947 : 3 (миграции); там же, X, 1948 : 97 (возрастной состав
нерестового стада); В. Танасийчук, там же : 93 (нерест в Урале); Остро-
умов, Зоолог, журн., XXVIII, 5, 1949 : 447 (половое созревание); В. Танасий-
чук, Тр. Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океаногр., XVIII,,
1951 : 20, рис. 3, 4 (колебание урожайности молоди); Перцева-Остро-
умова, там же : 53, рис. 9, 10 (описание икринок и личинок). Н. Танасий-
чук, Промысл, рыбы Волго-Каспия, Пищепромиздат, 1951 : 39 (распространение,
миграции, места нереста).
Z) III—IV 13—15 (13.7), общим числом 17—19 (17.7), A III (IV) 15—
20 (18.3), общим числом 18—23 (21.3), sp. br. 68—135 (116.0), vert. S.
49—51 (50.05), caud. vert. 33—34 (33.26). Жаберные тычинки очень тон-
кие, густые и длинные, в 1)4—2 раза длиннее жаберных лепестков.
Зубы очень слабые, на нижней челюсти почти не развитые и обычно не за-
метные на ощупь, на верхней челюсти едва заметные. Голова сравни-
тельно небольшая и низкая, длина ее 25.5—28.1 (26.4)%, высота 18.8 —
22.0 (20.5)% длины тела. Глаза довольно большие, 19.5—24.4 (22.2)%.
длины головы. Грудные плавники относительно короткие, 16.0—18.1
(16.7)% длины тела. Тело высокое, наибольшая высота его 22.8—29.6
(26.4)%, наименьшая — 6.8—-8.9 (7.8)% длины. Спина и верхняя часть
головы темные. За жаберной крышкой почти всегда с каждой стороны
ио темному пятну, сзади которого на боках иногда еще по нескольку
пятен (3—7). Размеры до 28 см, наичаще 18—22 см. Описание дано
16* .
244
clupeidae
Рис. 55. 1-я жаберная дуга Alosa caspia caspia.
1 — длина тела 205 мм; 2 — длина тела 190 мм.
по 50 экз. длиной от 15.1 до 22.1, в среднем 18.7 см, собранным весной
(во второй половине апреля—начале мая) у западных берегов средней
части Каспийского моря (Сумгаит и Турали). По данным В. И. Мейснера,
у п. caspia жаберных тычинок 70—149 (121.5), позвонков 47—52 (49.9),
у п. aestuarina жаберных тычинок 92—149 (116.7), позвонков 45—52 (49.6),
пилорических придатков (Световидов, 1932) 30—59 (40.8).
Евригалипная форма,
размножается как в соло-
новатой, так и в пресной
воде, иногда высоко поды-
маясь вверх по течению.
Возможно, распадается
на 2 формы: A. caspia cas-
pia в. caspia — среднека-
спийский или точнее севе-
рокаспийский пузанок и
A. caspia caspia n. aestua-
rina — ильменный пуза-
нок. Морфологически обе
эти формы в сущности не
различимы. По данным
В. И. Мейснера, у A. cas-
pia caspia n. aestuarina
несколько меньше количе-
ство жаберных тычинок,
немного короче голова и
крупнее глаза, но все эти
различия крайне ничтож-
ны, едва отличаясь в сред-
них и совпадая в пределах
колебаний. По материалам
Н. Н. Коркиной, исследо-
вавшей большое количество
проб пузанка из разных
районов северной части мо-
ря и из ильменей, ре-
альные различия имеются
между всеми пробами почти
во всех исследованных ею
но все эти различия не
велики и имеют крайне неопределенный характер: пробы из ильменей
почти не отличаются от проб из моря, причем по большинству исследо-
ванных признаков отличаются друг от друга пробы и из ильменей. Общее
заключение из данных Н. Н. Коркиной таково, что различия между
этими формами имеются только в темпе роста, чем, возможно, и обуслов-
лены меньшие размеры и более удлиненная форма ильменного пузанка
(Казанова и Халдинова, 1940). Относительно мест икрометания обеих
форм указания довольно разноречивы (см. об этом у Киселевича, 1937 :
29 и сл.), но возможно, что северокаспийский пузанок мечет икру в море,
а ильменный в ильменях (см. ниже). Имеются указания, что обе формы
существенно различаются по строению икринок. У ильменного пузанка
икринки значительно мельче, чем у северокаспийского (диаметр их
у ильменного пузанка, как правило, не превышает 2 мм, между тем как
количества позвонков.
9. ALOSA
245
у северокаспийского он обычно более 2 мм), оболочка плотнее и поверх-
ность ее вследствие клейкости покрыта тонким слоем ила, чего не наблю-
дается у северокаспийского пузанка. Однако остается неясным, в прес-
ной ли воде найдены эти икринки северокаспийского пузанка или
в солоноватой. Таким образом, вопрос о существовании двух рассматри-
ваемых форм пузанка требует еще дальнейшего исследования, и по-
этому, учитывая также отсутствие отчетливых различий • между
ними, их никак нельзя признать равнозначными другим каспийским фор-
мам вида. По этим причинам ильменный пузанок принимается прови-
зорно как natio и рассматривается, подобно другим формам с неопреде-
ленным характером отличий, совместно с типичной формой.
Alosa rossica Кесслера (1870) следует считать за A. caspia caspia, так
как на стр. 77 цитируемой работы Кесслер указывает, что на рисунке
Clupea caspia Eiclrwald (1841) изображена эта форма. К Clupea caspia
Кесслер (1874) частично, судя по указываемым размерам (до 345 мм),
относится и A. kessleri volgensis. Сюда же он относит и каспийские формы
A. caspia (1. с. : ИЗ).
Распространение. Каспийское море. Наиболее широко рас-1
пространенная форма вида. Встречается почти по всему морю, за исклю-
чением, повидимому, самых северо-восточных районов северной части
его. В наибольшем количестве встречается на путях к местам нереста
вдоль западного побережья моря и на местах нереста. Икрометание почти
по всему мелководью северной части моря от Аграханского зал. до Урало-
эмбенского района, наиболее интенсивно в предустьевом пространстве
Волги между течениями Главной и Белинской банок и восточнее в райо-
не Жесткого и Новинского осередков, ицогда к юго-западу от пред-
устьевого пространства в районе Лагани. У юго-западных берегов се-
верной части моря и в Урало-эмбенском районе нерест менее интенсивен.
В небольшом количестве входит в дельту Волги, откуда для икро-
метания заходит в западные и отчасти в восточные подстепные ильмени.
В годы с низкими паводками, когда ильмени не затапливаются, подымается
для икрометания и выше дельты, в небольшом количестве заходит до Ста-
линграда и выше (до Куйбышева и выше1 и Казани, в прежние годы
даже до Ярославля 1 2), единично — в Каму выше Молотова. 3 В неболь-
шом количестве заходил в прежвие годы в низовья Эмбы, заходит в Урал.
Биология. Нерест во второй половине мая, начинается он в за-
висимости от температуры воды с конца апреля—начала мая до середины
мая и заканчивается в середине—конце июня. Зимует в южной части
моря, причем в более теплые зимы основная масса держится против запад-
ных берегов и в меньшей степени против восточных, встречается
и в средвей части, в холодные же зимы концентрируется главным обра-
зом против восточвых берегов и в меньшем количестве против западных,
встречается, вероятно, и против южных берегов. Одна из наиболее тепло-
любивых из нерестящихся в северной части моря сельдей, в море при
температуре воды ниже 5° не встречается, при 5° держится в разрежен-
1 Коллекции Зоологического института Академии Наук СССР, № 30987, Волга,
Климовский затон (110 км выше Куйбышева), 23 V 1939, жаберных тычинок 124,
длина 49.3 см.
2 № 405 коллекций Ленинградского Государственного университета, Ярославль,
1869, Кесслер. Об одном из этих экземпляров пишет Кесслер (1870). Это действительно
A. caspia caspia (см. подстрочное примечание на стр. 242).
8 Кама у с. Добрянки (60 км выше Молотбва), 2 IX 1951, № 32875 коллекций
Зоологического института Академии Наук СССР, доставлен Ю. А. Козьминым.
246
CLUPEIDAE
ном состоянии, основные концентрации в зимнее время наблюдаются
при 9—11°. Поэтому, когда температура воды против западных берегов
южной части моря ниже этих оптимальных температур зимних концен-
траций, то основная масса отходит в восточную, более теплую половину
моря. В теплые зимы зимует далее к северу, в средней части моря
(Н. Танасийчук, 1951). Наибольшие зимние скопления образует в местах
резкого-падения глубин (от 60 до 170 м и больше), где благодаря нисхо-
дящим токам создаются наилучшие условия аэрации слоев воды, причем
основная масса держится в постоянном течении, вне его, в галистати-
ческой области встречается в небольшом количестве. С наступлением
весны, в марте, начинает передвигаться на север, при этом, как показали
исследования П. К. Дорошкова, миграции в основном происходят вдоль
западного побережья, сначала южной, а затем средней частей моря
в северную часть заходит у западных берегов (Остроумов, 1947). У вос-
точных берегов средней части моря идет в значительно меньшем коли-
честве и, возможно, не эта форма, a A. caspia salina.1 В весенний период
миграций на север в центральных областях южной и средней частей моря
встречается редко, и в открытом море значительных концентраций
не образует, передвигаясь на север в основном в частях моря, не слиш-
ком удаленных от берега. В апреле подходит к восточным берегам (про-
мысел Тарта, Карши, Кизил-су) в южной части моря (Керенцева, 1937).
Подходы в прибрежную область в средней части моря у западных бере-
гов происходят в апреле—мае, одновременно на большом протяжении,
причем здесь наблюдаются две волны массовых подходов — первая
в зависимости от условий весны обычно во второй половине апреля при
температуре воды 7.6—10.2°, вторая — в первой половине мая при
10.8—44.0°. Первая волна обычно больше второй. В первой волне пре-
обладают самцы (свыше 80%), идущие в начале хода, во второй самки
(свыше 70%), идущие в конце хода. Каких-либо морфологических раз-
личий между пузанками этих двух волн подходов нет (Махмудбеков,
1935). Подходы в узкую прибрежную область обусловлены, с одной сто-
роны, несколько более высокими температурами воды здесь, чем в откры-
том море, с другой стороны, меньшими скоростями течений, причем
в зоне неводного облова миграции вдоль берегов совершает крайне огра-
ниченные. При весенних миграциях на север вместе с половозрелыми
идет и молодь, еще не достигшая половой зрелости. В мае миграции
в южной и средней частях моря заканчиваются, подходы в прибрежную
область становятся меньше, и в середине мая промысел обычно заканчи-
вается. В северной части моря первые экземпляры обычно появляются
в конце марта—начале апреля. Первое время держится разрозненно
в глубинных, осолоненных и более тепловодных участках; в предустье-
вом пространстве появляется позднее, в западной половине скопления
образует через 15—20 дней после появления здесь. В мае места концен-
трации занимают обширную площадь в западной половине, простираю-
щуюся на восток до Забурунья (Остроумов, 1947). В период миграций
в средней части моря имеет половые продукты в стадии III, III—IV и IV.
Икрометание происходит при температуре воды от 13.8 до 24.1°, мас-
совый нерест — при 18—22°, как в пресной, так и в слегка осолоненной
воде с содержанием солей от 1—2°/00; в небольшом количестве разви-
вающиеся икринки были находимы й в более осолоненной воде, до 4—6°/00
1 Относительно захода основной массы северокаспийского пузанка в северную
часть моря у восточных берегов (Киселевич, 1914), а также и о фронтальном подходе
его в северную часть (Чугунов, 1932) см. у Остроумова (1947).
&. ALOSA
247
и даже прц 8.4°/0() (в восточной половине северной части моря против
I огольского Култука). Места массового нереста располагаются в пред-
устьовом пространстве на глубине от 1 до 3 м, в меньшем количестве
нерестует и на больших глубинах, до 6 м. В дельте Волги икринки средне-
КШЧ1ИИСКОГО пузанка найдены единично, преимущественно в западных
ильменях, при температуре воды в июне от 18.2 до 19 7° Икринки иль-
менного пузанка найдены в западных ильменях, в мае при температуре
поды 19.2-21.8 , в июне - при 22-23.4°, в предустьевом пространстве
моря, а также в дельтовых протоках не встречены. В 1914 г. нерест про-
исходил как в западных, так и в восточных ильменях, куда перестал
заходить вследствие обмеления и зарастания. Встречается и в ильменях,
расположенных выше, - в ильмене Кордонном в системе р. Ахтубы^
Количество пузанка, заходящего в дельту и выше, не велико: в 1937 г.
в предустьевом пространстве Волги в промысловых уловах сельдей он
составлял 73 5«ч а в дельте лишь 7.8% (Остроумов, 1947; см. также
Киселевич, 1915). Однако временами в Волгу заходит в значительных
количествах Так, например, в 1938 г. в первой пятидневке мая у с. Ни-
кольского (240 км от Астрахани) составлял до 27.7%' неводного улова,
в среднем за май - 1.2% (Н. Танасийчук). В значительных количествах
заходил, повидимому, в 60-х годах (Кесслер, 1870). Плодовитость от 12
до 41 тыс., в среднем около 24 тыс. икринок (Вукотич, 1915), рабочая
плодовитость от 7 до 7У2 тыс. икринок (Жуковский, 1932). Инкубацион-
ный период при температуре вода около 20° длится от 42 до 52 час.,
в среднем 46 час. (Перцева,1939). Молодь, по наблюдениям В. С. Тана-
сиичук и А. И. Дехтяревои, в наибольших концентрациях встречается
в июле,1 держится на сравнительно неглубоких местах вблизи нерести-
лищ, глубже 5 м не найдена, по отношению к солености, а также, пови-
димому, и к температуре строгой приуроченности нет, но из северной
части на юг уходит ранее других сельдей, в октябре и ноябре здесь уже
не встречается. На юг мигрирует вдоль западных берегов, близко к бе-
регу. В северной части моря взрослые остаются довольно долго, однако
большая часть уже летом уходит в среднюю часть, где в значительных
обнаружена у восточного побережья (Н. Танасийчук,
1951). Обратные миграции из северной части в среднюю происходят как
у западных берегов, так и в центральной части моря и у восточных бере-
гов, причем у восточных берегов к югу, начиная приблизительно
от зал. Кендырли, встречается в меньших количествах, повидимому,
отходя отсюда в центральные части моря. В конце октября-начале
ноября основные массы переходят из средней части в южную, при этом
переход совершается главным образом у западных берегов, так как в вос-
точной половине встречается в значительно меньших количествах и,
возможно, не эта форма, a A. caspla salina. Вертикальное распростране-
ние известно мало. В зимнее время, по наблюдениям П. К Дорошкова,
основная масса держится на глубине 24.5-32.5 м от поверхности, более
или менее глубоко встречается в меньших количествах. Весной держится
в поверхностных слоях воды, опускаясь при сильном летнем нагревании ’
воды опять в более глубокие слои. Осенью вновь поднимается к поверх-
ности, и основная масса держится на глубине 0.5-16 5 м. Основу пита-
ния составляют планктонные ракообразные (Copepoda - более 70%,
1 По сообщению Н. П. Танасийчука, молодь в 1938—1939 гг была нахопима
в оптировавшихся затонах нижнего течения Волги По словам рыбаков, молодь
пузанка здесь успешно перезимовывает. г > а
248
CLUPEIDAE
9. ALOSA
249
Mysidae — около 20%, Amphipoda и Cumacea — единицами процентов),.
Питание в разное время года существенно отличается. Различают четыре
периода: 1) в зимний период во время пребывания на местах зимовки
питается очень слабо, 2) в период преднерестовых миграций питается
интенсивно, 3) в нерестовый период питается также интенсивно
и 4) в посленерестовый период миграций на юг питается особенно интен-
сивно (Чаянова, 1940). Во время нереста питается и в ильменях, так как
желудки его, по наблюдениям И. И. Кузнецовой, в этот период здесь
полны пищи. В реке (Волга, выше Тетюшей) после нереста основную'
роль в питании играет Daphnia longispina (63—77%), Cyclops strenuus
(20—30%) и дру: не ракообразные (Екатерининская и Изосимов, 1945).
Половой зрел ин и самки и самцы достигают jb двухгодовалом возрасте;
самцы несколько в большем количестве, частично в четырех------пяти-
годовалом, но основная масса тех и других созревает в трехгодовалом
возрасте и в течение жизни нерестует 2—3 и даже 4 раза (Махмудбеков,
1947; Остроумов, 1948, 1949). В уловах у самцов преобладают двух-
и трехгодовалые (до 94%), у самок — трех- и четырехгодовалые (81%).
Самки растут несколько быстрее самцов. Возрастной состав из года в год
изменяется. У берегов Азербайджана за ряд лет он был таков (Махмудбе-
ков, 1941; в процентах):
Возраст 1+ 2+ з+ 4+ S+ 6+ 7+
1929 г 1.2 23.8 48.9 24.9 1.2
1930 г 9.3 5.4 69.6 14.0 1.5 0.2
1931 г 0.9 7.0 79.4 12.6 0.1 0.003
1932 г 1.1 20.1 48.5 27.8 2.4 0.1
1933 г .1.1 39.0 49.0 10.0 0.7 0.2
1934 г 0.8 37.8 54.5 6.6 0.3 0.001
1935 г 4.4 32.7 49.0 J3.3 0.4. 0.2
1936 г 2.7 35.0 46.0 15.4 0.9 0.03
1937 г 0.1 12.7 63.4 22.9 0.9
1938 г 0.2 30.6 39.0 26.4 3.3 0.4 0.1
1939 г 0.5 21.0 54.6 20.0 3.5 0.3 0.1
1940 г 0.8 26.6 56.0 14.6 1.8 0.2 —
Параллельно со снижением возрастного состава за ряд последних
лет уменьшились и средние размеры ловимого пузанка, которые к 1940 г.
обнаружили тенденцию к повышению (Махмудбеков, 1941):
Годы.......... 1929 1930 1931 1932 1933 1934 1935 1936 1937 1938 1939 1940
Размеры (см) . . 20.9 20.1 20.7 20.1 18.7 18.5 18.1 18.3 19.4 19.4 19.8 19.7
Значительно снизились и средние размеры возрастных групп, осо-
бенно, для 1934—1936 гг. (Махмудбеков, 1941; см):
Год улова Год вывода h К 1з 1.
1931 1926 10.96 17.41 20.92 22.98
1932 1927 12.40 17.24 20.84 22.77
1933 1928 11.40 16.92 20.43 22.80
1934 1929 11.43 16.53 19.94 22.29
1935 1930 11.48 16.30 19.77 22.06
1936 1931 11.69 16.10 18.94 20.98
В 1927—1930 гг. были предприняты попытки акклиматизации пузанка
в Арал, не давшие, однако, положительного результата, но единичные
взрослые экземпляры в Арале были пойманы.1 После черноспинки одна
1 Один экземпляр хранится в коллекциях Зоологического института Академии
Наук СССР, № 25622, Уч-'сай, 14 V 1931, жаберных тычинок 97, длина 18.8 см,
из самых жирных из каспийских сельдей. В начале весенних миграций
у берегов Азербайджана и Дагестана содержит от 9.01 до 13.19°/о жира,
в северной части моря содержание жира уменьшается до 6.34—Ю.3%.
Наиболее жирной бывает осенью, у берегов Дагестана в сентябре содер-
жит до 18.10% жира (Леванидов, 1932)1
Хозяйственное значение. Одна лз важнейших промыс-
ловых рыб Каспийского моря, стоящая по уловам на первом месте среди;
каспийских сельдей. Уловы в 1936—1939 гг. составляли от 56
до 750 тыс. ц. Основная масса улова добывается у берегов Дагестана
и Азербайджана и в северной части моря, весной во время миграций
на север и на местах нереста и отчасти зимой в южной части моря.
*3g. Alosa caspia salina (Svetovidov) — Северо-восточный каспийский
пузанок (табл. XIV).
Caspialosa caspia С у в о р о в, Тр. I Всесоюзн. Геогр. съезда, 3, 1934 : 14
(у входа в зал. Мертвый Култук с восточной стороны м. Кызыл-каир).—Caspialosa
caspia salina Световидов, Докл. АН СССР, I (X), 1 (78), 1936 : 51 (в конце
мая—в июне в северо-восточной части Каспийского моря 1 у Прорвы, о. Дурнова,
в заливах Мертвый Култук и Кайдак). — Caspialosa caspia kajdakensis Каза н-
ч е е в, Рыбн. хоз. СССР, 1936, 3 : 25 (в копцс июля—начале июля в зал. Мсртвый-
Култук и Кайдак). — Caspialosa caspia salina Световидов, Тр. Касп. ком.
АН СССР, I, 1937 : 192 (нерест, распространение в связи с соленостью); Зоолог,
журн., XXII, 4, 1941 : 231.
Распространение, биология. Ч у м а е в с к а я - С в с т о в и-
д о в а, Тр. Касп. ком. АН СССР, II, 1938 : 23 (возраст и темп роста); Клыков,
там же : 77, 92 (ход у п-ова Мангышлак); Перцева-Остроумова, Тр.
Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океаногр., XVIII, 1951 : 59,
рис. 15, 16 (описание икринок и личинок); X а л д и л о в а, там же : 103, рис. 4,5-
(перест, распределение икринок и личинок).
D III—IV 13—16(13.2), общим числом 17—20(17.2), .4 III(IV) 16—
20(17.7), общим числом 19—23(20.7), sp. Ъг. 61—117(86.5), vert. S. 49—
51 (50.33), caud. vert. 31—35 (33.17). Самая малотычвнковая из каспий-
ских форм вида. Тычинки тонкие, более редкие, чем у других форм,
длинные, в —К/г раза длиннее жаберных лепестков. Зубы более или
менее развитые, на нижней челюсти чаще незаметные, реже имеются,
на верхней челюсти обычно хорошо заметные на ощупь. Голова сравни-
тельно небольшая и низкая, длина ее 24.0—26.6 (25-4)°/о, высота 17.3—
21.5 (19.6)°/о длины тела. Глаза довольно большие, 16.3—20.3 (18.5)°/о-
длины головы. Грудные плавники сравнительно короткие, 15.1—17.3-
(16.1)°/о длины тела. Тело высокое, наибольшая высота его 22.3—30.5-
(26.2)°/о, наименьшая—7'.1—9.0(8.0)% длины тела. Спинаи голова сверху
темные. За жаберной крышкой с каждой стороны всегда по черному
пятну, сзади которого иногда на боках тела по ряду таких же пятен
числом до 7. Наряду с обычно окрашенными иногда встречаются особи
с интенсивно окрашенной верхней частью головы и спиной. Размеры
до 24 см, наичаще 18—21 см. Описание дано по 93—102 экз. длиной от 16
до 24, в среднем 20.2 см, собранным в конце мая—в июне 1935 г.
в зал. Мертвый Култук и на мелководье перед входом в этот залив. Коли-
чество жаберных тычинок по 205 экз. из этих же мест длиной от 16 до 24,
в среднем 20.4 см.
Солоноватоводная форма, размножалась в солоноватой воде в море..
1 Тип № 25813 коллекций Зоологического института Академии Наук СССР,,
зал. Мертвый Култук в 10 км к западу от м. Кызыл-каир, 8 VI 1935, длина 208 мм..
250
CLUPEIDAE
От близкого по внешности A. caspia caspia отличается меньшим коли-
чеством жаберных тычинок и их строением. На местах нереста нередко
встречаются особи, по внешности напоминающие эту форму, но со зна-
чительно меньшим количеством жаберных тычинок,' и наоборот — внешне
похожие на A. brashnikovi brashnikovi, но с количеством тычинок зна-
чительно большим .(до 53 и выше, рис. такой сельди см. на табл. XV).
Распространение довольно широкое. Встречается, на-
сколько известно, в восточной половине Каспийского моря. Наиболее
1-Рис. 36. 1-я жаберная дуга Alosa caspia
salina.
.1 — длина тела 208 мм; 2 — длина тела 189 мм.
обычен и многочислен весной на
местах нереста, которые до обме-
ления были расположены в восточ-
ной половине северной части мо-
ря — на мелководье перед вхо-
дом в зал. Мертвый Култук между
о. Дурнева и м. Кызыл-каир к се-
веру от u-ова Бузачи, в зал.
Мертвый Култук у м. Кызыл-каир
и, повидимому, в районе Прорва—
Жилая Коса. Как далеко заходит
на запад, не известно. Места нереста
в настоящее время достоверно не
известны.
Биология изучена недо-
статочно хорошо. Икрометание в
мае—июне в осолоненной или мор-
ской воде. Места нахождения в
зимнее время не известны, но, как
и другие формы вида, зимует, по-
видимому, в южной части моря.
Равным образом не выяснены и
пути миграций к местам нереста,
хотя, несомненно, можно предпола-
гать, что они расположены у во-
сточных берегов. Весной в север-
ной части моря у о. Долгого
появлялся в половине апреля,
при температуре воды ниже 15°
ход плохой, при повышении
ее выше 15°, ход усиливается
(Клыков, 1938). В период с 13
по 23 мая 1935 г. в неболь-
шом количестве ловился в Прорве, с конца мая единично, а в
июне в значительном количестве ловился у входа в зал. Мерт-
вый Култук. Икринки встречались несколько в более соленой и теп-
.лой воде, чем это наблюдается у других форм вида, в зал. Мерт-
вый Култук обнаружены при солености 22.0—32.2°/00 и температуре
воды 19.2—24.5°. Развитие икринок при температуре воды от 19.2 до 24.5°
длится от 39 до 53 час. Предличинки обнаружены на мелководье перед
входом в зал. Мертвый Култук и при входе в зал. Кайдак при температуре
воды от 17 до 23.6° и солености от 27.6 до 34.9°/00 на глубине от 0.75 до 2 м.
. Личинки найдены на мелководье к востоку от о. Дурнева, по всему зал.
Мертвый Култук и в северной части зал. Кайдак. Южная граница мас-
сового распространения личинок в зал. Кайдак по западному берегу
9. ALOSA
251
Кызыл-бай, по восточному — южнее м. Донус-мурун, южнее личинки
найдены у входа в зал. Кара-кичу. Личинки встречались при температуре
воды от 17 до 21.1° и солености от 21.4 до 39.8%0, у входа в зал. Кара-
кичу— при 45.6°/00, над глубинами от 0.8'до 5 м (Халдинова, 1951).
Ла местах нереста в июне 1935 г. ловились почти исключительно самки;
это обусловлено, повидимому, тем обстоятельством, что наблюдениями
был охвачен конец нереста, а вылов производился сетями с крупными
ячеями, не задерживавшими более мелких самцов. Выносит значитель-
ные осолонения, но все же меньшие, чем долгинка, встречающаяся
в самом конце зал. Кайдак при солености 47.7°/00; в зал. Кайдак захо-
дит по западному берегу до м. Кызыл-бай (35.8°/00) и до м. Донус-мурун
(34.1°/00) по восточному. Вместе с половозрелыми в северную часть моря
заходит и молодь. В июне 1935 г. молодые особи предыдущего года вывода
размерами от 87 до 127 мм в особенно большом количестве ловились
у входа в зал. Мертвый Кул-
тук на мелководье между
о. Дурнева и м. Кызыл-каир,
южная граница нахождения
в зал. Кайдак по восточному
берегу несколько южнее мыса
Донус-мурун, по западному—
у Кызыл-бая при содержании
солей 21.4—39.8° 00. В север-
ной части держится до осени,
в сентябре и октябре в райо-
не Прорвы в значительном
количестве встречается, по-
видимому, эта форма. Поло-
вая зрелость наступает по
достижении уже двухгодова- Рис. 37. 1-я жаберная дуга Alosa brashnikovi
лого возраста, но на местах brashnikoviyiA. caspia salina. Длина тела 240 мм.
нереста преобладают трех-
годовалые, двухгодовалые встречаются в незначительном количестве.
В 1935 г. возрастной состав на нерестилищах был таков (в процентах):
Возраст ... 2 3 4 5
1935 г........2.8 67.3 16.6 1.4
Рост несколько бэлее замедленный, чем у основной формы вида
(по исследованиям Чумаевской-Световидовой, 1938):
Возраст......... 1-ф- 2-|- 3-)- 4Д- 5Д-
Длина (см)......10.31 18.4 19.2 20.5 22.0
Хозяйственное значение небольшое. У форта Шев-
ченко—о. Долгого весной во время хода не ловился. У Прорвы составлял
основную массу уловов.
*4. Alosa brashnikovi (Borodin) — Каспийско-черноморские морские
сельди, бражниковские сельди (на Каспийском море).
Литературу см. при подвидах.
Жаберных тычинок 18—47, различных по количеству и строению
у каждой формы; тычинки толстые и грубые, короче, равны или немного
1 Здесь приведены средине размеры возрастных групп, которые близко совпа-
дают с цифрами, полученными обратным расчислением.
2&2
clupeidae
длиннее жаберных лепестков, прямые или искривленные, заостренные
иди утолщенные и иногда даже раздвоенные на концах. Зубы хорошо
развитые. Нижняя челюсть в зависимости от формы вида слегка выдается
вперед, одинаковой длины с верхней или короче ее, обычно с бугорком,
на переднем конце снизу, реже, у некоторых форм, без бугорка. Голова
низкая, не сжатая в нижней части с боков, не особенно большая, зна-
чительно различающаяся у разных форм. Глаза небольшие, существенно
различающиеся у разных форм по величине. Тело сельдеобразное, низкое
и не укороченное в хвостовой области, с короткими грудными плавни-
ками. Крупные рыбы длиной почти до 50 см, черноморско-азовские до
31 см, в половозрелом состоянии каспийские от 17—19 см, черноморско-
азовские от 12—15 см длины.
Солоноватоводный непроходной вид, все каспийские формы которого
живут и размножаются в море, черноморская заходит в лиманы и пиж-
нне участки дельты..
Распадается на ряд форм. Один из наиболее изменчивых и богатых
формами видов. О причинах богатства форм этого вида и каспийских
сельдевых указывалось выше (см. стр. 58исл.). Степень отличия между
формами A. brashnikovi различна. Одни из них, как, например, A. brash-
nikovi orientalis и A. brashnikovi sarensis или A. brashnikovi grimmi и
A. brashnikovi nirchi, различаются не слишком резко, другие же, например
A. brashnikovi grimmi и A. brashnikovi kisselevitshi, обособлены крайне
резко. Морфологическая обособленность между формами этого вида под-
держивается и углубляется обособленностью их в период размножения.
Каждая из форм вида имеет свои собственные места нереста, а если на
одном и том же месте мечет икру более чем одна форма, то нерест каждой
из них происходит в разное время. Однако скрещивание форм этого
вида не только между собой, но даже с формами и других видов проис-
ходит, повидимому, нередко (см. об этом стр. 220). Вследствие морфоло-
гической близости между некоторыми каспийскими формами вида, обу-
словленной как еще невысокой степенью обособленности между ними,
так, повидимому, и их скрещиванием между собой, особи, переходные по
своим признакам, которых бывает затруднительно отнести к какой-либо
из форм, встречаются нередко. Поэтому при определении каспийских
форм этого вида при помощи определительной таблицы следует обра-
щаться к описанию этих форм и к рисункам рыб. При определении, кроме
того, следует принимать во внимание то, что многие формы свойствейны
в основном только южной части Каспийского моря, а ряд других, хотя
и, более широко распространенных, приурочен в определенное время года
точно так же к более узким районам моря. К основным частям Каспий-
ского моря в разное время года, по исследованиям А. А. Михайловской,
наиболее приурочены следующие формы вида.
Восточная половина южной части: наиболее обычны — A. brashnikovi
orientalis, A. brashnikovi kisselevitshi, A. brashnikovi nirchi, A. brashnikovi
grimmi, A. brashnikovi autumnalis, единично — A. brashnikovi brashnikovi
(весной), A. brashnikovi agrachanica (зимой), A. brashnikovi sarensis.
Западная половина южной части: обычны — A. brashnikovi sarensis,
A. brashnikovi autumnalis, единично — A. brashnikovi agrachanica, A. brash-
nikovi grimmi, A. brashnikovi kisselevitshi, A. brashnikovi orientalis
(осенью).
vЗападная половина средней части: обычны — A. brashnikovi brashni-
kovi (весной в начале хода), A. brashnikovi agrachanica (разгар—конец
хода), единично — A. brashnikovi autumnalis (летом), A. brashnikovi
9. ALOSA
S53
grbnmi (крайне редко), A. brashnikovi sarensis (неполовозрелые и молодь),
A. brashnikovi kisselevitshi (молодь в конце хода).
Восточная половина средней части: обычны — A. brashnikovi brashni-
kovi, A. brashnikovi nirchi, единично — A. brashnikovi orientalis, A. brash-
nikovi kisselevitshi, A. brashnikovi grimmi (крайне редко).
Западная половина северной части: обычны — A. brashnikovi agracha-
nica, A. brashnikovi brashnikovi (реже).
Восточная половина северной части: обычны — A. brashnikovi brash-
nikovi.
Распространение. Каспийское, Черное и Азовское моря.
В Каспийском море широко распространены лишь некоторые формы,
размножающиеся в северной части его, большинство же форм имеет
сравнительно узкое распространение и размножается в южной части
моря, почти не встречаясь вне пределов ее.
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА ПОДВИДОВ
1 (2). Сравнительно небольшие рыбы, длиной не свыше 30 см, обычно
15—20 см, в половозрелом состоянии от 12 см и даже менее. Жабер-
ных тычинок 33 -47. Черное и Азовское моря .....................
.........................*4а. A. brashnikovi maeotica (Grimm)
2 (1). Крупные рыбы длиной до 49 см, обычно около 30 см, в полово-
зрелом состоянии около 20 см, у некоторых более. Жаберных тычи-
нок 18—47. Каспийское море.
3 (6). Жаберных тычинок обычно до 26, наиболыпе до 31. Грудные плав-
ники короткие, в среднем около 13—14%, наиболыпе до 15 % % длины
тела. На конце нижней челюсти часто более или менее развитое мозо-
листое утолщение. Тело низкое. Окраска бледная, спереди белесая.
4 (5). Нижняя челюсть у взрослых всегда с мозолистым утолщением
на конце. Жаберных тычинок 18—27, первая тычинка далеко
отстоит ор основания языка, тычинки толстые, тупые, часто искрив-
ленные и разветвленные на концах. Обычно у юго-восточных бере-
гов южной части Каспийского моря, единично и у западных и вдоль
обоих берегов средней части ,*4i.A. brashnikovi grimmi (Borodin)
5 (4). Мозолистое утолщение на конце нижней челюсти едва развитое
или отсутствует. Жаберных тычинок 21—31, первая жаберная
тычинка расположена ближе от основания языка, тычинки тол-
стые, прямые, без вздутий и не разветвленные на концах. Вос-
точная половина Каспийского моря в районе зал. Красноводского
и Кендырли...................*4h. A. brashnikovi nirchi (Morosow)
б (3). Жаберных тычинок обычно от 25, наименьше от 20. Грудные
плавники длиннее, в среднем около 14)4—15%%, наименьше
от 13% длины тела. Нижняя челюсть без мозолистого утолщения
на конце. Окраска темнее, не белесая.
7 (12). Жаберных тычинок 20—37, наичаще 25—33, тычинки прямые
и заостренные или изогнутые, разветвленные и притупленные или
обломанные на концах. Нижняя челюсть обычно выдается вперед,
реже равна верхней.
8 (9). Грудные плавники очень длинные, в среднем около 18%, наи-
меньше— 16%% длины тела. Хвостовой стебель короткий, рас-
стояние от заднего конца анального плавника до начала хвостового
в среднем около 5.8%, не более 7.0% длины тела. Глаза большие,
в среднем около 21% %, наименьше 19% % длины головы. Жаберных
тычинок 21—37, наичаще 26—33. У обоих берегов южной части
254
CLUPEIDAE
Каспийского моря, единично у западных берегов средней части моря
............................*4f. A. brashnikovi autumnalis (Berg)
9 (8). Грудные плавники короче, в среднем около 15—16%, не более
18% длины тела. Хвостовой стебель удлиненный, расстояние от зад-
него конца анального плавника до начала хвостового в среднем
около Q%—7%, наименьше 6% длины тела. Глаза меньше, в сред-
нем около 18—18% %, наиболыпе 21% длины головы. Жаберных
тычинок 20—.35, наичаще 23—32.
10 (И). Нижняя челюсть обычно сильно выдается вперед, реже равна
верхней. Голова большая, в среднем около 26%, наименьше 25%
длины тела. В восточной половине южной части Каспийского моря,
единично вдоль восточных берегов средней и у западных южной
части моря...................*4е. A. brashnikovi orientalis (Mikhayl.)
11 (10). Нижняя челюсть менее выдается вперед или равна верхней.
Голова средних размеров, в среднем около 25%, наиболыпе 26%
длины тела. В западной половине южной части Каспийского миря,
единично вдоль западных берегов средней и у восточных берегов
южной части моря . . . *4d. A. brashnikovi sarensis (Mikhayl.)
12 (7). Жаберных тычинок 24—49, наичаще 28—40, тычинки обычно пря-
мые, не разветвленные, и заостренные на концах. Нижняя челюсть
одинаковой длины с верхней или слегка выдается вперед.
13 (16). Жаберных тычинок 24—48, наичаще 28—42. Нижняя челюсть
одинаковой длины с верхней или слегка выдается вперед. Голова
низкая, заостренная спереди. Позвонков наибольшее количество,
обычно 50—53. Икрометание в северной части Каспийского
моря.
14 (15). Голова самая короткая, в среднем около 24%, наиболыпе
до 25% длины тела, спереди притупленная. Грудные плавники ко-
роткие, в среднем около 14%%, наиболыпе до 15%% длины тела.
Тело высокое, в среднем около 26% длины его, спина широкая.
Западная половина Каспийского моря, зимой у восточных берегов
. южной части его, весной наиболее обычйа у западных берегов . .
......................*4с. A. brashnikovi agrachanica (Mikhayl.)
15 (14). Голова длиннее, в среднем около 25%, наименьше 23’/^% длины
тела, низкая, рыло заостренное. Грудные плавники длиннее, в сред-
нем около 15%%, наименьше 14%% длины тела. Тело ш.зное и про-
гонистое, в среднем около 20%% длины его, спина узкая. По всему
Каспийскому морю, весной обычна у обоих берегов средней и се-
верной части его .... *4b. A. brashnikovi brashnikovi (Borodin)
16 (13). Жаберных тычинок наибольшее количество, 30—49, наичаще
34—42. Нижняя челюсть равна или даже слегка короче верхней,
реже слегка выдается вперед. Тело высокое, в среднем около 26%
длины его. Голова высокая и притупленная спереди. Позвонков
наибольшее количество, обычно 43—50. Южная часть Каспийского
моря, преимущественно в его юго-западном углу, единично и в за-
падной его половине и вдоль восточных берегов в средней части
...........................4g. A. brashnikovi kisselevitshi (Bulgakov)
*4а. Alosa brashnikovi maeotica (Grimm) — Черноморско-азовская
морская сельдь (табл. XV).
Clupea pontica (non Eichw.) Кесслер, Тр. СПб. общ. ест., V, 1874 : 306
(частью). — Clupea maeotica Гримм, Вести, рыбопр., XVI, 2,-1901 : 67 (Черное?
9. ALOSA
255'-
и- Азовское моря: 1 Керчь № 1—3, Таганрог № 4—10, Темрюк № 10—12); Боро-
дин, там же, XIX, 3, 1904 : 185 (Азовское м.). — Alosa maeotica Браунер,
Тр. Бессарабск. общ. ест., II, 2, 1912 : 123, табл. 2 (Днестровский лиман у Аккер-
мана и Овидиополя). — Clupeonella maeotica Берг, Мат. позн. русск. рыбол., II, 3,.
1913 : 12. — Caspialosa brauneri Никольский, Бюлл. Всеукр. Гос. черном.-
азовск. научно-промысл. он. ст., 8—9, 1923 : 5 (по Браунеру). — Caspialosa brauneri
m. elongata Исаченко, Тр. Всеукр. черном.-азовск. научно-промысл. оп. ст.,
I, 1925 : 128 (Очаков; 3 экз.). — Caspialosa maeotica Александров, Тр. Кер-
ченск. ихт. лаб., I, 1, 1926 : 20, 30, 47 (измерения, распределение в Азовском м.);
В о г с е a, Ann. Sci. Univ. Jassy, XIX, 1934 : 387, f. 1 (у берегов Румынии, Разельм-
ский лиман); ibid., XXII, 1936 : 340 (там же); Майорова, Тр. Научн. рыбохоз.
биолог, ст. Грузии, II, 1939 : 28 (биометрика). — Caspialosa brashnikovi maeotica
Световидов, Зоолог, журн., XXII, 4, 1943 : 231; Берг, Рыбы пресных вод,
I, 1948 : 119; Световидов, в: Промысловые рыбы СССР, 1949 : 109, табл. 26.2
Распространение, биология. Данилевский, Исслед. сост.
рыбол. России, VIII, 1871 : 216 («наиболее крупная сельдь мало входит в Дон,
а мечет икру в почти пресной воде Таганрогского залива»); Тихонов, Бюлл.
Всеукр. Гос. черном.-азовск. научно-промысл. оп. ст., 19—20, 1927 : 57 (Бердянская
и Белосарайская косы); Есдиов, Тр. Керченск. научн. рыбохоз. ст., 1, 2—3,.
1927 : 212 (Керченский прол.; миграции); Недошивин, Тр. Азовско-черном,
научно-промысл. эксп., 4, 1929 ; 36 (дельта Дона); Малятский, Тр. Новоросс.
биолог, ст., 1931 : 5 (Черное м. у берегов Кавказа; миграции); Пчелина, там же,.
I, 6, 1937 : 18 (Черное м. у Новороссийска; миграции); М а й с к и й, Тр. Азовско-
черном. научно-исслед. инет. рыбн. хоз. и океаногр., 11, 1938 : 193, фиг. 6 (Азов-
ское м.; распределение молоди); Москвин, Тр. Новороссийск, биолог, ст., II, 3,
1940 : 268 (у Новороссийска; питание); Воробьев, Тр. Азовско-черном, научно-
исслед. инет. рыбн. хоз. и океаногр., 12, ч. 1, 1940 : 149 (Сиваш и Утлюкский лим.;.
изредка с конца июля и в августе).
D (III) IV 12—14 (13.5), общим числом 16—20 (17.3), А III 16—
19 (17.6), общим числом 19—22 (20.6), sp. Ъг. 33—46 (40.0). Жаберных ты-
чинок наибольшее количество из всех форм вида, тычинки тонкие и пря-
мые, часто посаженные, заостренные, без утолщений и не разветвленные
на концах, обычно короче жаберных лепестков, первая тычинка распо-
ложена близко к основанию языка. Зубы хорошо развитые. Нижняя че-
люсть равна верхней или слегка выдается вперед, реже короче верхней.
Голова средних размеров, довольно высокая, узкая, длина ее 23.6—
27.4 (25.2)%, высота 17.4—21.0 (18.5)% длины тела. Глаза большие, 20.0—
23.8 (21.8)% длины головы. Грудные плавники длинные, 15.3—18.1 (16.3)%
длины тела. Тело удлиненное, наибольшая высота его 21.7—26.4
(23.8)% длины. Спина зелено-голубоватая, слегка сероватая, голова,
более темная сверху, бока серебристые, грудные плавники светлые,,
с черным верхним краем. На боках тела за жаберной крышкой с каждой
стороны по темному пятну, сзади которого иногда по ряду более светлых
пятен.3 Длина до 31 см, наичаще 16—20 см, мелкая форма до 20—21 см,
наичаще 12—13 см. Описание дано по 41 экз. длиной от 12.5 до 21.2,..
в среднем 17.7 см, собранному 6 IV (20 экз.) и 15 IV (21 экз.) 1940 в Таган-
рогском зал. перед дельтой Дона против хут. Морской Чулек.
А. А. Михайловская различает две еще мало изученные формы — круп-
ную и мелкую, морфологически в сущности не различимые. Отличия,
между ними заключаются в основном росте, более замедленном у мелкой
(см. ниже).
1 Тип не указан. Не сохранились й экземпляры, по которым сделано описание.
За тип следует считать экземпляр длиной 25.7 см, Керченский прол., 8—10 XII 1948,.
№ 32230 коллекций Зоологического института Академии Наук СССР.
' 2 Выше не упомянуты две статьи, опубликованные в недоступном автору изда-
нии (Вогсеа, С. R. Acad. Sci. Roumanie, I, 1936 : 26—28, 216—217).
8 Пятна на боках тела указывает Берг (1948) у одного из трех экземпляров от
Очакова.
2об
CLUPEIDAE
Рис. 38. 1-я жаберная дуга Alosa brash-
nikovi maeotica. Длина тела 257 мм.
Солоноватоводная, непроходная форма, иногда заходит в пресную
воду.
Распространение. Черное и Азовское моря. В Черном море
держится к югу от Керченского прол, вдоль кавказских берегов, единично
до Батуми, у берегов Румынии, в северо-западной части его заходит
в Днепровско-Бугский, Березанский, Днестровский и Разельмский
лиманы. В Азовском море встречается летом, преимущественно в западной
части, заходит в Таганрогский зал. и в самые нижние участки дельты Дона,
изредка в Сиваш и Утлюкский лиман. Места нереста точно не известны.
Биология изучена мало. Икрометание, судя по состоянию
зрелости половых продуктов, происходит весной и в начале лета; непо-
средственно наблюдаемо не было. Одна из самых холодолюбивых сельдей
Черного моря. Зимнее распределение известно мало. Зимует в Черном
море, в восточной его половине сов-
местно с крупной формой A. kessleri
pontica, главным образом в самой
северной его части — против Анапы,
Новороссийска и перед самым входом
в Керченский прол., причем в преж-
ние годы временами в струе теплого
течения заходила иногда в большом
количестве в южную часть Керчен-
ского прол., отходя обратно при пони-
жении температуры воды до 4—3°.
В последние годы эта струя теплого
черноморского течения вследствие
прорыва косы Средней оттесняется
в проливе холодной водой Таман-
ского зал., и сельдь зимой в пролив
В западной половине Черного моря
заходит в меньшем количестве.
известна у берегов Румынии, повидимому держится и в северо-западной
части его. О нахождении в зимнее время у берегов Крыма указаний нет.
У Батуми ловится единично с января по апрель (Майорова, 1939), у Ново-
российска в самое холодное время года часто составляет основную массу
уловов, но при понижении температуры воды ниже 4—3° от берегов
отходит (Малятский, 1931). У берегов Румынии ловится в начале марта,
весной при температуре воды около 7° входила в Разельмский лиман
(Вогсеа, 1934). В Керченском прол, на пути в Азовское море, по наблю-
дениям А. А. Михайловской, идет в самом начале хода, появляется
в марте, в марте—начале апреля составляет до 60% улова, к середине
апреля ход снижается, и в конце апреля начале мая половозрелые ловятся
уже единично, в середине мая в небольшом количестве встречаются уже
незрелые. Со второй половины апреля половозрелые против Новороссийска
уже не встречаются. В Азовском море, по данным В. Н. Тихонова, со-
вместное I. kessleri pontica в апреле—мае в небольшом количестве (10—15 %
улова) подходит к косам Бердянской и Белосарайской, летом здесь встре-
чается редко. Основная масса держится в западной части Азовского моря,
к востоку количество уменьшается, в 1924 г. на косе Бердянской состав-
ляла 22% улова, на косе Белосарайской — 11% и на косе Кривой —
0.2% (Александров, 1926). Пресной воды избегает и к востоку от косы
Кривой встречается единично, но иногда заходит и в нижние участки
дельты Дона. Так, например, в середине июня 1923 г. в гирле Переволоч-
ном была поймана совместно с A. kessleri pontica (80 кг в улове в 250 кг;
9. ALOSA
‘257
Недошивин, 1929). В начале хода против Ново ровен века и в Керченском
прол, идут наиболее крупные рыбы, затем более молкно и в конце неполо-
возрелые, идущие в Азовское море для нагула. Мелкая форма в Керчен-
ском прол., по исследованиям А. А. Михайловской, ловится единично,
так как проходит сквозь ячею, в дельте Дона (у Азова) начинает ловиться
единично с конца апреля, в наибольшем количестве (46.9%) — в конце
июня. Половой состав, по тем же данным, на протяжении хода довольно
изменчив, но в общем количество самцов и самок приблизительно одина-
ково, за исключением лета, когда преобладают самки. В начале весенних
миграций против Новороссийска в море имеет половые продукты во II ста-
дии зрелости, в апреле — во II и III стадиях. В Керченском прол, про-
ходит с половыми продуктами в III, реже III—IV стадиях зрелости.
У берегов Румынии в начале марта ловилась с довольно развитыми поло-
выми железами (икринки 0.4 мм диаметром), со вполне зрелыми к концу
апреля и в начале мая (Во:сеа, 1934). Места икрометания ни в Черном,
ни в Азовском море достоверно не известны, но, судя по состоянию зре-
лости половых продуктов, в Азовском море нерестелища предположительно
указываются в западной части Таганрогского зап. и в средней части
Арабатской стрелки (Александров, 1926). Единичные почти зрелые (IV ста-
дия) крупные особи подходят в Таганрогском зал. к предустьевому про-
странству Дона (у хут. Морской Чулек) с половины апреля (в 1938 г.
с 17 апреля), ловятся в мае и в начале июня. 9 июня в Таганрогском зал.
в районе канала были пойманы крупные экземпляры с половыми продук-
тами в IV—V стадиях и некоторые даже в V стадии зрелости. Вода в этих
местах пресная или почти пресная (0.03—0.3 г CI на 1 л; по наблюде-
ниям Д. С. Талина.) К предустьевому пространству (д. Круглое) и в ниж-
ние участки дельты Дона (у Азова), по данным А. А. Михайловской, под-
ходит с той же стадией зрелости половых продуктов несколько позднее
(единично с конца апреля, в наибольшем количестве в-конце июня) и
мелкая форма. Таким образом, обе формы этого подвида могут не только
заходить в пресную воду предустьевых пространств и нижних участков
дельты, но и метать икру, крупная форма в предустьевом пространстве
и единично, а мелкая в дельте и в значительно большем количестве.
Осенью уходит в Черное море, Разельмский лиман покидает одновременно
с кефалью (Вогсеа, 1934). В Керченском прол, единично начинает ловиться
с июля месяца, но основная масса крупной формы отходит в ноябре-
декабре, в августе—сентябре идет сравнительно мелкая сельдь, состоя-
щая, повидимому, из мелкой формы и из неполовозрелых особей крупной
(по В. Н. Тихонову). Возрастной состав, по исследованиям А. А. Михай-
ловской, в 1936 г. был таков (в процентах):
Крупная форма
Возраст . . . , . : 1 2 3 4 5 6
। весна . . . . 10.0 23.2 28.0 31.2 7.0 0.6
Керчь < лето . . . . . 1.7 42.6 44.1 11.1 0.4 —
1 осень . . . . 0.2 3.8 28.4 45.3 20.8 1.5
Новороссийск J весна . . { зима . . . . . 10.2 23.9 27.6 15.0 22.0 1.3
. .1.5 4.5 18.0 39.2 33.8 3.0-
4.2 12.2 28.5 38.5 15.4 1.2
Азов >
Мелкая форма
. . 25.3 52.9 21.8
17 Фауна СССР — 314
258
CLUPEIDAE
Темп роста по сравнению даже с наиболее медленно растущими каспий-
скими формами вида крайне замедленный (по исследованиям А. А. Ми-
хайловской; см):
Возраст . . 2 3 4 5 6
Кру».» { КТ'" : . . 15.4 . . 16.2 18.1 17.7 20.8 19.6 22.7 21.2 25.7 22.7
Мелкая форма, Азов . . 12.1 13.7 14.8 — —
Хищник, питается мелкой рыбой, преимущественно хамсой и др., также
креветками, гаммаридами и другими крупными ракообразными. В районе
Новороссийска в зимне-весенний период рыба обнаружена в 95.5% иссле-
дованных сельдей, высшие ракообразные —в 3.4%. Из рыб в преобладаю-
щем количестве обнаружена хамса, в меньшем количестве встречаются
шпроты, молодь саргана и смариды (Москвин, 1940).
Хозяйственно^ значение сравнительно небольшое.
Промыслом от A. kessleri pontica не различается и учитывается вместе
с последней. Ловится главным образом в Керченском прол, и в меньшем
количестве в Черном море против Новороссийска, уловы в других местах
незначительны. В Керченском прол, за период времени с 1931 по 1935 г.
составляла от 3.2 до 17.1% улова весной и от 12.6 до 48.1% осенью, т. е.
осенью ловится относительно больше, чем весной. Происходит это вслед-
ствие того, что весной первые косяки проходят необловленными. В 1935 г.
в Черном море против Новороссийска, в Керченском прол, и в Дону со-
ставляла 7.8% годового улова. В 1936 г. крупная форма составляла 8.5%
годового улова, или 3.138 ц, мелкая — 4.0%, или 1.501 ц. Ловится
береговыми и ставными неводами, ставными сетями, аламанами.
*4b. Alosa brashnikovi brashnikovi (Borodin) — Долгинская сельдь
(долгинка) (табл. XVI).
Clupea alosa (non Linn6) Gm е li n, Reise, IV, 1784 : 51 (Тюб-караган). —
Clupea pontica (non Eichw.) Кесслер, Тр. СПб. общ. ест., V, 1874 : 306 (Каспий-
ское м., экз. Ленингр. Гос. унив. от Мангышлака и из Бакинского зал.). — Clupea
saposchnikowi (non Grimm) var. Бражников, Вести, рыбопр., XIII, 4, 1898 : 231,
Фиг. на стр. 234 (бухта о. Кулалы, Мангышлакский зал.). — Clupea saposchnikowii (non
Grimm) Голынец, О ходе и ловле сельди у берегов Мангышлака, Астрах.,
1903 : 7 (продолговатая разность с малым глазом, биология). — Clupea caspio-pontica
var. braschnikowii Бородин, Вестн. рыбопр., XIX, 3, 1^04 : 176, 180, 182—183,
184—185, фиг. 2 (частью: Александровск № 1—15, Красноводск № 25— 26 , 28— 33 1). —
Clupea caspio-pontica var. saposchnikowii (non Grimm) Бородин, там же : 182
(частью: Петровок ^s 16, Дербент № 22—23, Баку № 24). — Clupea (Alosa)
brashnikowi Суворов, Тр. Касп. эксп. 1904 г., I, 1907 : 157, 186—188, фиг. 3
(малоглазная разность, №№ 136—156); там же, II, 1908 : 43, 53, 59 (описание, рас-
пространение).— Clupeonella brashnikovi Берг,1 2 Мат. позн. русск. рыбол., II, 3,
1913 : 24, 26, табл. X (частью: Мангышлак, западное побережье до о. Тюленьего);
Киселевич, там же, III, 6, 1914 : 22, 44—46 (северо-восточная часть Каспий-
ского м., Мертвый Култук; измерения); Тр. Астрах, ихтиол, лабор., III, 5, 1914 : 76,
90—93 (зал. Мертвый Култук). — Caspialosa brashnikovi Берг, Мат. позн. русск.
рыбол., IV, 6, 1915 : 4. — Caspialosa caspia brashnikovi Киселевич, Изв. Отд.
рыбов. и научно-промысл. исслед., 1, 1, 1918 : 17, 30; Каспийско-волжские сельди, I,
1923 : 125, 147—151 (частью). — Caspialosa brashnikovi Киселевич, Промысло-
вые рыбы Волго-каспийского района, Астрах., 1926 : 7 (в районе Брянской косы);
1 Тип не указан, но экземпляры, по которым дано первоописание, сохранились.
За тип следует считать один из этих экземпляров длиной 28.0 мм, 1903 г., форт Шев-
ченко, № 13051 коллекций Зоологического института Академии Наук СССР.
2 Литературу более раннего периода и некоторые синонимы см. в этой работе.
9. ALOSA
259
Морозов, Тр. Научн. инет. рыбн. хоз., II, 4, 1928 : 47 (биометрическая обработка
материалов Киселевича). — Caspialosa caspia brashnikovi Аверинцев и Сыч,
Тр. Астрах, научн. рыбохоз. ст., VII, 3, 1930 : 12 (количества позвонков, килевых
чешуй, лучей в плавниках). — Caspialosa brashnikovi typ. Дехтярева, Тр.
Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океаногр., XIV, 1940 : 47 (описание
сеголетков); Михайловская, Докл. АН СССР, XXX, 6, 1941 : 559 (описа-
ние). — Caspialosa brashnikovi brashnikovi Световидов, Зоолог, журн., XXII,
4, 1943 : 231; в: Промысловые рыбы СССР, 1949 : 100, табл. 25.
Распространение, биология. Суворов, Тр. Касп. эксп.
1904 г., II, 1908:44, 53, 59 (распространение); В у к о т и ч, Мат. позн. русск.
рыбол., IV, 6, 1915 : 23 (плодовитость); Мейснер, Билл. Всекасп. научн. рыбо-
хоз. эксп., 5—6, 1932 : 22 (миграции); Суворов, Тр. I Всесоюзн. Геогр. съезда,
3, 1934 : 14 (у входа в зал. Мертвый Култук); К а занчеев, Тр. I Всекасп. научн.
рыбохоз. конфер., I, 1936 : 24 (уловы, ход, зрелость, размеры, питание); Бадам-
III и н, там же : 32 (возрастной состав); Надирадзе, Рыбн. хоз. СССР, 1936,
8 : 23 (возрастной состав у западных берегов); Керенцева, Учен. зап. Пермск.
Гос. унив., Ill, 1, 1937 : 173 (у восточных берегов южной части Каспийского м.;
подходы); Казанчеев, Первая научн. конфер. по изуч. сельдевых рыб Кас-
пийск. м., Астрах., 1937:24 (миграции, нерест, уловы); Световидов, Тр.
Касп. ком. АН СССР, I, 1937 : 190 (Мертвый Култук и Кайдак; нерест, мальки);
Киселевич, Сельди северного Каспия, Сталингр., 1937 : 10 (биология); А г а-
ц о в, Тр. Касп. ком. АН СССР, II, 1938 : 7 (возраст и темп роста); Клыков,
там же : 55 (ход и нерест, возрастной состав, размеры); Д орошков, Изв. Азер-
байджанок. научно-исслед. рыбохоз. ст., 3, 1939 : 44 (миграции, размеры, возрастной
состав, хозяйственное значение); Смирнов, Изв. Акад, наук Азерб. ССР, 7,
1945 : 71 (миграции); там же, II, 8, 1946 : 55 (биология); Докл. Акад, наук Азерб.
ССР, II, 2, 1946 : 60 (влияние света на нерестовые миграции); Остроумов,
Тр. Волго-каспийск. научн. рыбохоз. ст., IX, 1, 1947 : 82 (питание); Перцева-
Остроумова, Тр. Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океа-
ногр., XVIII, 1951 : 48, рис. 5, 6 (строение икринок и личинок); X алдинова,
там же : 102, рис. 3 (зал. Мертвый Култук и Кайдак, мальки); Н. Танасий-
чук, Промысл, рыбы Волго-Каспия, Пищепромиздат, 1951 : 44 (распространение,
места нереста, миграции).
D III—IV 12—15 (13.4), общим числом 15—19 (17.1), A III (IV) 16—
20 (18.3), общим числом 19—23 (21.3), sp. br. 27—47 (34.2), vert. S. 50—
53 (51.81), caud. vert. 33—35 (34.00). Жаберные тычинки тонкие и прямые,
обычно заостренные, без утолщений, вздутий и не разветвленные на кон-
цах, равны или короче жаберных лепестков, первая жаберная тычинка
расположена близко от основания языка. Зубы хорошо развитые. Ниж-
няя челюсть одинаковой длины с верхней или слегка выдается вперед,
ребристая, с бугорком на переднем конце снизу. Голова короткая и низ-
кая, длина ее 23.5—26.6 (24.9)%, высота 15.2—19.2 (17.5)% длины тела.
Глаза средних размеров, 15.2—20.6 (18.2)% длины головы. Рыло заострен-
ное и слегка удлиненное. Грудные плавники удлиненные, 14.3—16.7
(15.4)% длины тела. Тело узкое, низкое, прогонистое, высота его 18.9—
23.6 (21.4)% длины. Наиболее интенсивно окрашенная из всех форм
вида, но несколько менее, чем проходные сельди. Спина и верхняя часть
головы темные, с зеленым оттенком, или синие, в мелководной северной
части моря на местах нереста светлее, серо-зеленые. За жаберной крыш-
кой с каждой стороны по черному пятну, на боках тела пятен нет. Груд-
ные плавники темные. Наряду с обычными по окраске особями нередко,
в частности даже и на местах нереста, встречаются такие, у которых
спина и верхняя часть головы интенсивно черные. Длина до 49 см, наи-
чаще 20—35, половозрелые от 18 см. Описание дано по 50 экз. длиной от
24.1 до 39.6, в среднем 27.4 см, собранным в конце мая—начале июня
1935 г. на местах нереста в зал. Мертвый Култук и прилегающих к нему
районах. По данным Михайловской (1941), жаберных тычинок 24—47
(33.1), позвонков 48—55 (51.8).
17*
2<W
CLUPEIDAE
Солоноватоводная, непроходная форма.
По составу, повидимому, неоднородна. Так, например, сельдь, мечу-
щая икру в заливах Саратыш и Кочак и идущая сюда вдоль восточных
берегов, повидимому,. во второй волне хода (подробнее см. ниже) отли-
чается от сельди первого хода, мечущей икру севернее, меньшим коли-
чеством позвонков и жаберных тычинок, как это видно из нижеследую-
щего (по Е. Н: Казанчееву).
Зал. Сарыташ Район островов Прорва о. Тюлений
1-я половина 1-я половина 1-я половина 1-я половина 1-я половина
V IV V VI i V
Количество позвон-
ков .................51.05±0.10 51.72±0.09 51.43±0.10 51.89±0.08 51.65±0.07
Количество жабер- '
них тычинок . . .29.70 ±0.42 32.40 ± 0.36 31.80 ±0.42 34.20 ±0.47 31.00 ±0.84
,($ТРазличий между сельдью, идущей вдоль восточных и западных (о. Тю-
лений) берегов моря, как видно нз приведенных данных, невидимому,
нет.
На местах нереста дол-
гинки иногда встречаются
сельди, по внешности на-
поминающие ее, но со зна-
чительно большим количе-
ством жаберных тычинок.
Такая сельдь с 53 жабер-
ными тычинками изобра-
жена на табл. XV и рис. 37.
Распростране-
ние. Каспийское море.
Наиболее широко распро-
страненная форма этого
вида. Встречается почти по
всему морю, но в наиболь-
шем количестве на путях
к местам нереста у обоих
берегов средней части мо-
ря и на нерестилищах в
северной части. В дельту
Волги не входит, но близ
устьев иногда встречается.
В средней части моря . по
западному берегу известна,
начиная от о. Жилого и
далеко к северу, на восточ-
ном берегу констатирована
в;Кизил-су, Тарта, Карши,
. Кёйдырли. Икрометание
г, . , . частично в заливах Сары-
Рис. 39. 1-я жаберная дуга Alosa brashnikovi brash- Tf. ‘
nikovi таш. и Кочак, но главным
1 — длина тела 280 мм; 2 —длина тела 278 мм. образом на МвЛКОВОДЬез К
I - . северу от п-ова Бузачипе-
ред входом в зал.. Мертвый Култук и до отделения его в прилегающих ко
Входу частях,' в. меньшем количестве у северо-восточных берегов в районе
Буинских о-вов — Прорва — Жилая коса — о. Камынин и, кроме, .того)
9. ALOSA 261
но некоторым указаниям (Киселевич, 1937), —к западу от* устья Урала,
до Забурунья и Джамбая.
Биология. Икрометание с конца апреля—начала мая по конец
мня—начало июня. Зимой (с декабря по март) наибольшие скопления
в области восточного теплого течения до зал. Александр-бай — Кендырли,:1
мистично у Апшеронского п-ова и вдоль западного побережья южной
чисти моря от Бакинского архипелага до Астары, встречаясь здесь как
и области гидрологического течения, так и по обе стороны от него, еди-
нично встречается и у восточных берегов южной части моря. В теплые
симы широко распространена в южной части моря (Н. Танасийчук, 1951).
Наиболее холодолюбивая из всех форм вида и одна из холодолюбивых
из каспийских сельдей. В зимнее время в разреженном состоянии держится
при 5—6°, с 7.5—8.5° встречается в промысловом количестве, наи-
большие скопления при 9—11°. В 1937 г. в наибольшем количестве лови-
лась главным образом в юго-восточной половине южной части моря.
В 1938 г. большие скопления наблюдались и в западной половине. В более
теплую зиму 1939 г. значительные скопления были и севернее о. Жилого^
Держится преимущественно в области постоянного течения, в галиста-
тической области хотя зимой и встречается, но в незначительном коли-
честве. В начале марта образует большие скопления в Прикуринском
районе и у о. Жилого при температуре 7—9°, во второй половине марта
у западных берегов средней части Каспийского моря. Со второй же поло-
вины марта в массе подваливает в береговую зону вместе с большеглазым
пузанком. В апреле наблюдалась в значительных количествах у западных
берегов средней и южной частей Каспийского моря, в частности в откры-
том море, в наибольшем количестве у о. Жилого при температуре 8—10°,
в Прикуринском районе (A. brashnikovi sarensis?) и уМахачкалы. В районе
Дивичи:—Самур в открытом море встречается в небольшом количестве,
гак как подходит к берегам. В мае в средней и южной частях Каспийского
моря в открытом море встречается в меньшем количестве, так как перехо-
дит в северную часть (Дорошков, 1939). На север идет как вдоль западных,
так и вдоль восточных берегов, причем, по наблюдениям в прежние годы
(Киселевич, 1937 ; И), в наибольшем количестве шла вдоль восточных
берегов. По наблюдениям за последние годы (1937-—1939 гг., а также,,
повидимому, и в 1935—1936 гг.), вдоль восточных берегов средней части
моря встречается весной в небольших количествах, в галистатической
области еще в меньшем (Дорошков, 1939). У о. Кулалы появляется во,
второй половине марта—в первых числах апреля при температуре .6—7®
и даже ниже ( по указанию Клыкова, 1938, при 3—4°), максимум хода
здесь происходит приблизительно в половине апреля при температуре
9—10° и заканчивается к концу апреля. У западных берегов средней
части моря появляется несколько позднее — в конце марта—начале
апреля (Надирадзе, 1936), ход заканчивается в середине мая, причем
у берегов Азербайджана и Дагестана наблюдаются две волны хода — пер-
вая при 7—8°, вторая при 12—15°. В первой волне хода идет только
/1. brashnikovi brashnikovi, во второй, наряду с ней, идет A. brashnikovi
agrachanica и в небольшом количестве неполовозрелые особи некоторых
южнокаспийских форм этого вида (A. brashnikovi sarensis и A. brashni-
kovi kisselevitshi). Две волны хода наблюдаются и у восточных берегов,
причем вторая волна и здесь обычно значительно меньше, чем первая,,
1 По указанию Клыкова (1938), частично перезимовывает и в северной части
моря (у п-ова Бузачи).
262
CLUPEIDAE
но в некоторые годы обе волны бывают одинаковой мощности. Сельдь
второго хода идет на нерест, повидимому, в заливы Кочак и Сарыташ;
сельдь второго, массового, хода идет севернее. Во второй половине апреля
и в мае в средней части моря почти отсутствует, за исключением узкой
береговой полосы у западного берега. Иногда миграционные пути здесь
и вообще лежат в сравнительно узкой прибрежной.полосе, не далее 20 миль
от берега. Характеризуется большими и единовременными подходами
в отличие от проходных сельдей (черноспинки и волжской), которые
идут открытой частью моря и к берегам в зону облова подходит лишь
небольшая часть их (Керенцева, 1937). В северную часть моря
у восточных берегов главная масса проходит в зависимости от ветров
и гидрологических условий с морской стороны о. Кулалы (при восточных
ветрах) или между берегом и о. Кулалы (при западных ветрах). В начале
хода у восточных берегов вблизи мест нереста идут крупные, затем более
мелкие экземпляры, позднее подходят неполовозрелые, двух- и одно-
годовалые, к о. Кулалы подходит с еще не совсем зрелыми половыми про-
дуктами (стадия III), у о. Дурнова в конце апреля встречаются уже зре-
лые и единично текучие (стадии IV и V), в конце мая — большей частью
уже отнерестовавшие. > "Икрометание происходит на илисто-песчаных
грунтах в воде соленостью от 8')/00 и выше, в зал. Сарыташ наблюдалось
при 9—13700. Начало нереста при 15—-16° и, повидимому, при более
низкой температуре (в зал. Сарыташ при 11—19°), разгар при 17—18°,
личинки появляются при 16—20°. Плодовитость от 15.6 до 178.4, в среднем'
66 тыс. икринок (Вукотич, 1915). Инкубационный период при средней
температуре воды 16.9° равен 67—77 час. В зал. Мертвый Култук молодь
размерами от 20 до 52 мм при солености от 21.45 до 45.98 /ь0 встречается
почти повсеместно, в большом количестве заходит в зал. Кайдак, единично
почти до зал. Кара-кичу. Икра и личинки в Мертвом Култуке и Кайдаке
не найдены (Халдинова, 1951). Взрослые после икрометания остаются
в северной части моря, но обычно держатся рассеянно, большие скопле-
ния наблюдаются редко и не каждый год. В конце ноября, перед ледо-
ставом, молодь из северной части моря уходит, но, повидимому, не далеко,
так как весной во время хода вместе со взрослыми на местах нереста ж
повсеместно на пути миграций ловятся двух- и одногодавалые. Хищник,
питается тюлькой, атеринкой, бычками, молодью сельди. Кроме того,
в желудках встречаются ракообразные, остатки насекомых и даже расте-
ний. Желудки обычно бывают сильно набиты пищей, нередко содержа
до 6—8 тюлек или других рыб (Клыков, 1938). В юго-восточном районе
северной части моря в апреле, в период больших скоплений перед наступ-
лением нереста, в пище преобладает Corophium nobile (71.3%). С конца
апреля до середины июня, с уменьшением концентраций, основную роль
в питании имеет обыкновенная тюлька и отчасти бычки; С. nobile в желудках
в это время нет. В западных районах моря в течение всей весны главное
значение в питании имеет обыкновенная тюлька (82%), в апреле отчасти
Gammaridae (JDikerogammarus haemobaphes и Pontogammarus abbreviatus,
6.6%), бычки (3.1%). В мае, с переходом половых продуктов в IV стадию
зрелости, интенсивность питания снижается, и за 1—2 суток до икро-
метания долгинская сельдь вообще перестает питаться. По окончании
нереста интенсивность питания высокая (Остроумов, 1947). Форма мор-
ская, единично встречающаяся в зал. Кайдак даже при солености 34.7—
47.6°/00, н0 иногда встречается и близ устьев Волги. Зимой основная
масса держится на глубине от 16 до 32 м, весной — до 16 м, часто до 8 м,
летом — преимущественно от 9 до 24 м (Дорошков, 1939). Половой зре-
I). MQSA
ш
им*
лос'ги достигает на четвертом году и доживает до 6—7 и даже до 9 лет.
В уловах у восточных берегов вблизи нерестилищ преобладают трех-
и четырехгодовалые, в 1934 г. основу уловов составляли четырех- и пяти-
годовалые при большом количестве шестигодовалых, встречались семи-
и восьмигодовалые (Бадамшин, 1936). У берегов Азербайджана и Даге-
стана в начале и конце хода преобладают идущие на север для нагула
двух- и трехгодовалые, двухгодовалые еще незрелые. В разгар хода
подходят трех- и четырехгодовалые. Средние размеры в разгар хода
у берегов Азербайджана были в 1936 г. около 20 см, — меньше, чем в пре-
дыдущие годы. По темпу роста среди форм этого вида стоит на втором-
третьем месте (по исследованиям Агапова, 1938):
Возраст........... 1 2 3 4 5 6 1 8
Длина (см)........ 9.4 14.7 21.3 25.0 28;7 32.7 46.5 49.0
Прирост первого года обычно наибольший.
Хозяйственное значение довольно существенное.
Улов в 1936—1939 гг. колебался от 73.9 до 126.9 тыс. ц. Большая часть
улова добывается в северной части моря (от 28.7 до 71 тыс. ц) и у западных
берегов в средней вдоль Азербайджана (от 19.7 до 33.7 тыс. ц) и Даге-
стана (от 8.6 до 19.8 тыс. ц). Главное время лова — весна.
*4с. Alosa brashnikovi agrachanica (Mikhaylovsky)1 — Аграхан-
ская сельдь, аграханка (табл. XVII).
Caspialosa brashnikooi m. data Верг, Мат. позн. русск. рыбол., II, 3, 19'13 :
24,26, табл. XI (против устья р. Сулак, Аграханский зал.).— Caspialosabrashnikooi
agrachanica Мейснер, Бюлл, Всекасп. научн. рыбохоз. эксп., 1—2, 1932 : 52
(у островов Тюлений и Чечень; миграции); Дехтярева, Тр. Всесоюзн. Научно-
исслед. инет, морск. рыбн. хоз. и океаногр., XIV, 1940 : 47 (описание сеголетков);
Михайловская,1 2 Докл. АН СССР, XXX, 6, 1941 : 559 (описание; зимой
южная часть Каспийского м.; нерест в северной части у островов Тюленьего и Дар-
ги); Световидов, Зоолог, журн., XXII, 4, 1943 : 231; в : Промысловые рыбы
СССР, 1949 : 103.
Распространение, биология. Мейснер, Вюлл. Всекасп.
научн. рыбохоз. эксп., 5—6, 1932:22 (миграции, места нереста); Коркина,
Первая научн. конфер. по изуч. сельдевых рыб Каспийского м., Астрах., 1937 : 26
(миграции, возраст, нерест, уловы); Караваев, Рыбн. хоз., 1938, 4—5:19
(места И время нереста); Остроумов, Тр. Волго-каспийск. научн. рыбохоз. ст.,
IX, 1, 1947 : 90 (питание); Перцева-Остроумова, Тр. Всесоюзн. Научно-
исслед. инет, морск. рыбн. хоз. и океаногр., XVIII, 1951 : 51, рис. 7, 8 (строение
икринок и личинок); Н. Танасийчук, Промысл, рыбы Волго-Каспия, Пище-
промиздат, 1951 : 46 (распространение, места нереста, миграции).
D III—IV 13—15 (14.0), общим числом 17—19 (18.9), А ПТ 16—20
(17.9), ’общим числом 20—23 (21.0), sp. br. 20—46 (33.4), vert. 8. 50—53
(51.34), caud. vert. 33—35 (37) (34.00). Жаберные тычинки прямые, по
длине приблизительно равные жаберным лепесткам, на концах заострен-
ные или с мелкими каплеобразными вздутиями, первая жаберная тычинка
1 Описание этой формы было дано ранее опубликования работы Михайловской
(1941) Мейснером (1932), указавшим наряду с биологическими и отличительные при-
знаки, и Дехтяревой (1940), описавшей мальков. Однако оба названных автора
использовали неопубликованные данные А. А. Михайловской, и поэтому справедливо
оставить за этой формой имя последней.
2 Тип не указан.’За тип следует считать экземпляр, определенный Л. С. Бергом
как С. brashnikooi m. data, длиной 42.3 см, Сулак, 18 V 1912, № 7334 коллекций Зоо-
логического института Академии Наук СССР.
264
CLUPEIDAE
расположена близко к основанию языка. Зубы хорошо развитые. Нижняя
челюсть одинаковой длины с верхней или слегка выдается вперед, реб-
ристая, с бугорком на переднем конце снизу. Голова небольшая, корот-
кая и низкая, самая короткая из всех форм вида, длина ее 22.6—25.2
(24.0)%, высота 17.3—19.7 (18.3)% длины тела. Глаза средних размеров,
16.4—20.7 (18.8)% длины головы. Рыло укороченное, менее заостренное,
чем у основной формы. Грудные плавники очень короткие, 13.1—15.6
(14.5)% длины тела. Тело высокое и широкое, высота его 20.7—27.7
(22.5)% длины.. Сзади небольшой головы вследствие высокого тела и широ-
кой мясистой спины образуется небольшой горб. Окраска бледная, спина
и верхняя часть головы голубовато-темные. С каждой стороны на теле
по темному пятну, на боках тела пятен нет. Грудные плавники обычно
окрашены слабо. Одна из самых крупных форм вида, размеры до 50 см,
наичаще 29-—33 см. Описание дано по 44 экз. длиной от 22.3 до 42.3,
в среднем 29.6 см, собранным 18 V 1948 в северной части Каспийского
Рис. 40. 1-я жаберная дуга Alosa
brashnikovi agrachanica. Длина тела
423 мм.
моря на свалах Белинской банки
(36. экз.) и весной (30 III—18 IV)
1912 г. у западных берегов средней
части моря (Сумгаит, Турали, Кизил-
бурун; 8 экз., среди них тип).
По данным Михайловской (1941), жа-
берных тычинок 25—43 (31.2), по-
звонков 47—54 (50.9).
Солоноватоводная, непроходная
форма.
От других форм вида хорошо
отличается небольшой головой, ко-
роткими грудными плавниками и вы-
соким телом с широкой мясистой спи-
ной. В лабораторных условиях суще-
ственную помощь при определении
может оказать темп роста — самый
быстрый из всех форм вида. От дол-
гинки отличается весьма существенно по строению икринок и личи-
нок.
Распространение. Каспийское море. Встречается почти
по всему морю, кроме восточной половины средней и северной частей
его и опресненного пространства перед дельтой Волги. Наиболее обычна
и многочисленна в зимнее время у восточных берегов южной части моря
и весной на местах нереста и на пути к ним у западных берегов северной
и средней частей. Места икрометания с восточной и западной стороны
о. Тюленьего, на Вестовом осередке—свале Дарги и в прилегающих
к этим местам районах.
Биология. Икрометание довольно позднее и кратковременное,
с конца мая до начала—середины июня. Зимует главным образом в теплой
ветви гидрологического течения у юго-восточных берегов южной части
моря, где стоит в уловах на первом месте после A. brashnikovi kissele-
vitshi. Значительно более теплолюбива, чем типичная форма вида, весен-
ние миграции на север совершает позднее всех остальных сельдей, в конце
путины, во второй половине апреля—начале мая. К местам нереста идет
только вдоль западных берегов средней и отчасти южной части моря,
переходя в основной массе на западную сторону в районе Ашперонского
п-ова. В средней части моря в массе подваливает во второй половине
9. ALOSA
265-
иутины; в 1937 г., по наблюдениям П. К. Дорошкова, массовый.подход
был в середине апреля и в начале мая при температуре воды 13.0—14.0°.
В северной части моря появляется в конце апреля—начале мая при 13°,
единично при 11°. Вблизи мест нереста и на нерестилищах преобладают
самки, за исключением самого начала хода, первых чисел мая, когда
преобладают самцы. К местам нереста, по наблюдениям Н. Коркиной
и Т. А. Перцевой, подходит с глубин при 13—15°, при 17—19° держится
над глубинами 13—-18 фут. и мечет икру на глубине от 1.8 до 5.8 м, наи-
чаще от 2 до 4 м, в отличие от других видов на мягких илистых грунтах^
в воде соленостью 1.45—5.09’/0) и температурой от 20 до 22°, после чего
при дальнейшем повышении температуры воды уходит снова на глубины.
На местах нереста и вблизи них ловится главным образом в мае—июне.
В наибольших концентрациях встречается здесь у о. Тюленьего и на Весто-
вом осередке, затем вблизи Чапурьей косы и Дарги, вблизи Белинской
и Чистой банок встречается в незначительном количестве, к востоку от
Белинской банки заходит единично, в район Вышки и о, Искусственного
не заходит. В 1948—-1949 гг. встречалась в восточных районах пред-
устьевого пространства Волги (у Жесткого и Новинского осередков),
в небольшом количестве проникла к устьям Урала, о. Камынину (Н. Тана-
сийчук, 1951). Развитие икринок при 19—21° продолжается 37 час.
Молодь к концу путины попадается в скипасти по западному побережью.
В северной части моря держится до осени, в октябре—ноябре встречается
в средней части в районе р. Сулак—Махачкала (Мейснер, 1932). Как
и остальные формы вида, хищник. В северной части моря в мае основной
пищей являлась обыкновенная тюлька (80.7%), отчасти молодь сельдей
(16.5%), атеринка (2.7%) (Остроумов, 1947). Половая зрелость наступает
в трех-четырехгодовалом возрасте. В уловах на местах нереста и вблизи
них, а также и на зимовках преобладают трех- и четырехгодовалые,
в незначительном количестве встречаются двух-, пяти- и шестигодова-
лые, преобладающие размеры 29—33 см; В 1937 г. у западных берегов
средней части моря основную массу уловов составляли четырех- (37.0%)
и трехгодовалые (33.7%), в меньшем количестве ловились двух- (12.9%)
и пятигодовалые (12.7%), единично годовалые (0.4%), шести- (3.0%)
и семигодовалые (0.3%). Обладает самым быстрым ростом из всех форм
вида (по исследованиям Н. Коркиной):
Возраст....................
тт , . ( 1935 г.......
Длина (см) | 1дз6 г........
12 3 4
9.0 19.7 30.2 35.9
10.7 20.3 30,0 35.7
Прирост первого года, вследствие позднего икрометания, обычно
меньше прироста второго года, но в некоторые годы бывает и наоборот:
Возраст............
Прирост за год (см)
1935 г.........
1936 г.........
1 2
9.0 10.7
10.7 9.6
Хозяйствен но е значение, в .общем улове сельдей Ка-
спийского моря сравнительно небольшое, но по величине улова среди
бражниковских сельдей стоит на втором—третьем месте. Уловы в 1935—-
1940 гг. составляли 3.2—16.1 тыс. ц. На местах нереста в 1935 г. состав-
ляла 1.7% улова северной части моря, в 1936 г. — 7.0%. Кроме того,,
вылавливается на пути к местам нереста вдоль западных берегов средней
части моря и на местах зимовки. У восточных берегов южной части моря
зимой стоит на втором месте после A. brashnikovi kisselevitshi, составляя
вместе с A. brashnikovi brashnikovi 20% улова.
266
CLUPEIDAE
*4d. Alosa brashnikovi sarensis (Mikhaylovsky) — Саринская сельдь,
также майская сельдь (табл. XVII).
Caspialosa brashnikovi Мейснер, Бюлл. Всекасп. рыбохоз. эксп., 5—6, 1932 :
22 («раса, пока обозначенная как малотычинковая», вся южная часть и вдоль запад-
ных берегов средней части Каспийского м.; нерест в Кизилагачском зал.). •— Caspia-
losa brashnikovi sarensis Михайловская, Докл. АН СССР, XXX, 6, 1941 : 560
{описание; западное побережье южной и средней части Каспийского м.; 1 нерест
в районе мыса Бяндован, Норд-остова Култука, Зюд-остова Култука, Куринской
косы, о. Жилого); Световидов, Зоолог, журн. XXII, 4, 1943 : 231; Тара-
севич, Изв. Акад, наук Азерб. ССР, I, 3, 1946 : 48. — Caspialosa brashnikovi
derzhavini Тарасевич, там же : 48 (биометрика).
D III—IV 13—15 (13.8), общим числом 17—19 (17.7), A III (IV) 17—
20 (18.2), общим числом 19—23 (21.3), sp. br. 23—32 (27.3), vert. S. 50—
52 (50.81), caud. vert. 32—35 (33.86). Жаберные тычинки редкие, не осо-
бенно толстые, крепкие, обычно прямые и заостренные, иногда тупые,
некоторые тычинки изогнутые и
раздвоенные на концах или обло-
манные, короче или равны жабер-
ным лепесткам, первая жаберная
тычинка не особенно удалена от
основания языка. Зубы хорошо
развитые. Нижняя челюсть не-
сколько выдается вперед или равна
верхней, ребристая, с бугорком
на переднем конце снизу. Голова
средних размеров, высокая, длина
ее 23.8—26.6 (25.3)%, высота
17.8—19.7 (18.6)% длины тела.
Глаза средних размеров 17.7—20.0
(18.9)% длины головы. Грудные
плавники удлиненные, 14.1—16.2
Рис. 41. 1-я жаберная дуга Alosa brashni-
kovi sarensis. Длина тела 331 мм.
(15.0)% длины тела. Тело высокое,
22.8—28.3 (25.9)% длины его. Хвостовой стебель длинный, расстояние от
заднего конца анального плавника до хвостового 6.3—8.3 (7.2)%, высота
его 6.8—8.1 (7.6)% длины тела. Спина и голова сверху серые, травянисто-
зеленые. За жаберной крышкой с каждой стороны по темному пятну,
на боках тела пятен нет. Грудные плавники темноватые. Размеры до 40 см,
наичаще около 30 см. Описание дано по 50 экз. длиной от 24.9 до 35.0,
в среднем 29.5 см, собранным у о. Сара 25 IV 1939. По данным Михай-
ловской (1941), жаберных тычинок 20—33 (26.3), позвонков 45—53 (50.1).
Солоноватоводная, непроходная форма.
Наиболее трудно определимая форма вида. Труднее всего отличима
от A. brashnikovi brashnikovi и в особенности от A. brashnikovi orientalis, к
которой она наиболее близка, являясь промежуточной формой между ними.
Тарасевич (1946) от западных берегов южной части Каспийского моря
описана новая форма — A. brashnikovi derzhavini. По данным В. М. Та-
расевич, A. brashnikovi derzhavini отличается от А. brashnikovi sarensis
менее крупными глазами, меньшим антедорсальным расстоянием, мень-
шей длиной головы, более высоким телом и некоторыми другими призна-
ками. Из других отличий следует отметить меньшее число поперечных
рядов чешуй и большее число лучей в анальном плавнике у первой по
1 Тип не указан. За тип следует (считать экземпляр длиной 33.1 см, о. Сара,
25 IV 1939, № 32184 коллекций Зоологического института Академии Наук СССР.
Из этих мест происходят и экземпляры, по которым сделано первоописание.
9. ALOSA
261
сравнению co второй. Указанные различия, в частности длина головы
п диаметр глаза, могли отчасти быть обусловлены неодинаковыми раз-
мерами сравниваемых рыб (A. brashnikovi sarensis — 256.2 мм, A. Ьга-
shnikovi derzhavini — 294.3 мм). В. М. Тарасевич утверждает, что A. bra-
shnikovi autumnalis у западных берегов нет, и за эту сельдь А. А. Ми-
хайловской были приняты большеглазые особи A. brashnikovi sarensis.
Однако эта сельдь была находима здесь и А. А. Михайловской, и дру-
гими сотрудниками Всекаспийской рыбохозяйственной экспедиции. Кроме
того A. brashnikovi autumnalis была находима у западных берегов южной
части моря автором, обнаружена и в присланной ему пробе сельдей отПир-
сагата, собранной А. Н. Смирновым. Таким образом, следует полагать, что
имело место обратное—-какое-то количество Л. brashnikovi autumnalis
было ошибочно принято В. М. Тарасевич за A. brashnikovi sarensis и
описание последней дано ею по смешанному материалу. Следовательно,
указываемые ею различия между A. brashnikovi sarensis и A. brashnikovi
derzhavini в значительной мере обусловлены и этим обстоятельством.
Что касается различий между обеими формами в числе поперечных рядов
чешуй, то этому признаку нельзя придавать существенного значения,
зная, насколько непрочно сидят чешуи на теле сельдей и как трудно
с достаточной точностью просчитать их, особенно у хвостового плавника.
По данным В. М. Тарасевич, в анальном плавнике у A. brashnikovi
sarensis в среднем на один луч меньше, чем у A. brashnikovi derzhavini.
В связи с этим необходимо отметить, что первый неразветвленный
луч анального плавника, хорошо различимый у крупных сельдей, у мел-
ких без отщепления его просчитать невозможно. Вероятно, что у иссле-
дованных ' В. М. Тарасевич экземпляров A. brashnikovi sarensis, более
мелких по сравнению с исследованными ею экземплярами A. brashnikovi
derzhavini, этот луч не различался.
A. brashnikovi sarensis у западных берегов южной части Каспийского
моря в некотцрой степени имитирует A. brashnikovi orientalis и, повиди-
мому, подобно последней, распадается на несколько более низких си-
стематических форм. Неоднородность состава обеих этих сельдей обуслов-
лена большей по сравнению с другими формами A. brashnikovi растяну-
тостью в меридиональном направлении нерестилищ. Констатируемые
В. М. Тарасевич различия между A. brashnikovi sarensis и описываемой
ею A. brashnikovi derzhavini несомненно в некоторой мере обусловлены
и этой неоднородностью A. brashnikovi sarensis.
Ниже приведены некоторые признаки A. brashnikovi sarensis от о. Сара
и от Пирсагата:
О. Сара Пирсагат
[ жаберных тычинок . . . . . . . 27.3 (23—32) 27.3 (23—34)
Количество < лучей в А . . . 21.3 (19—23) 21.1 (20—23)
( » » D . . . 17.7 (17—19) 17.8 (17—19)
В % длины тела:
Антеанальное расстояние ........ . . . 69.4 (67.2—71.4) 68.8 (66.2—71.6)
Антедорсальное » . . . 46.4 (44.7—49.3) 45.8 (44.0—47.6)
Длина грудного плавника . . . 14.9 (14.1—16.2) 16.0 (15.2—17.9)
Длина головы . . . 25.3 (23.8—26.7) 26.2 (25.0—27.5)
Высота » . . . 18.6 (17.8—19.7) 19.7 (18.7—21.2)
Хвостовой стебель1 ... 7.2 . (6.3— 8.3) 7.6 (6.5— 8.9)
1 В. М. Тарасевич за длину хвостового стебля приняла линию v|3 (из «Руко-
водства по изучению рыб» И. Ф. Правдина). Однако измерить хвостовой стебель
таким путем точно никак нельзя. Это измерение будет всегда произвольно. Здесь
измерено расстояние от заднего конца анального до начала хвостового плавника.
268
CLUPEIDAE
В % Длиьы головы:
Диаметр головы ...........................
Межглазничный промежуток.................
Длина тела (см)..........................
18.9 (17.7—20.0)
17.6 (15.9—19.7)
29.8 (24.9—35.0)
18.5 (17.4—19.9).
18.7 (17.1—20,4)
29.5 (26.7—33.1)
При одинаковых размерах сравниваемых сельдей имеются некоторые
различия, в части признаков почти такие же по абсолютной разности, сред-
них, какие получены В. М. Тарасевич. Однако между ними нет таких
различий, какие имеются между формами бражниковских сельдей,
позволяющие различать их с достаточной точностью даже на глаз. По-
этому правильнее будет считать A. brashnikovi derzhavini за одно из стад
A. brashnikovi sarensis, аналогичное стадам A. brashnikovi orientalis, неко-
торые из которых у последней различаются весьма существйнно.
Распространение. Каспийское море. Основные места оби-
тания у западного побережья южной части моря, откуда вдоль запад-
ных же берегов проникает на север до южных дагестанских промыслов.
В восточной половине южной части моря констатирована к юго-западу
от Гасан-кули. Нерест у ленкоранского побережья, о. Сара, Куринской
косы, Зюд- и Норд-остового Култука, м. Бяндован, у ряда островов к се-
веру — Бабурьего, Свиного, Дуванного и др., у о. Жилого.
Биология. Икрометание в южной части ареала (у о. Сара и лен-
коранского побережья) происходит с половины апреля по июнь включи-
тельно, в северной части (у м. Бяндован й у островов Бакинского архи-
пелага) позднее — в мае—июне (Тарасевич, 1946). Молодь й непблово-
возрелые особи держатся по западному побережью и к северу от Ашпе-
ронского п-ова, больших концентраций здесь не образуют и в неводном
сельдяном промысле существенной роли не играют, в Бакинском архи-
пелаге держатся до глубокой осени. Сетным промыслом у Куринской
косы, о. Сара, Астары ловятся в основном четырех- и пятигодовалые.
Темп роста замедленный, немногим лишь быстрее роста A. brashnikovi
orientalis (по данным А. А. Михайловской):
Возраст............. 1
Длина (см)..........11.7
2 3 4 5 6
19.8 25.5 29.7 32.7 34.7
В северной части ареала половой зрелости достигает на втором-
третьем году, в южной — на первом(?)-втором. В северной части ареала
рост более быстрый, чем в южной (поданным Тарасевич, 1946; см):
Возраст ...........’.........
М. Бяндован и севернее.......
О. Сара и южнее...............
1 2 3 4 5
11.9 19.7 25.4 29.1 32.8
— 19.5 23.8 27.9 30.7
6
35.7
Хозяйственного значения существенного не имеет и
промыслом отдельно не учитывается. В 1937 г. в уловах по западному
побережью средней части моря составляла около 17% улова бражников-
ских сельдей.
*4е. Alosa brashnikovi orientalis (Mikhaylovsky) — Восточная сельдь,
обжорка (табл. XVIII).
Caspialosa brashnikovi orientalis М ихайловская, Докл. АН СССР, XXX,
6. 1941 : 560 (восточное побережье южной части Каспийского м., на север до вал.
9. ALOSA
269
Кондырли;1 нерест в Астрабадском зал., Гасан-кули, в районе о. Огурчинсцого, в
Красноводском зал.); Световидов, Зоолог, журн., XXII, 4,1943 : 231.
D III—IV 13—15 (13.9), общим числом 16—19 (17.6), A III (IV) 16—
19 (17.6), общим числом 19—22 (20.7), sp. br. 24—34 (28.6), vert. S. (45)
49—51 (49.95), caud. vert. 31—34 (32.83). Жаберные тычинки толстые и
крепкие, обычно прямые и
заостренные или со слабы-
ми вздутиями на концах,
иногда искривленные и
обломанные или развет-
вленные на концах, длин-
нее или равны, реже короче
жаберных лепестков, пер-
вая жаберная тычинка обы-
чно расположена близко
от основания языка. Зубы
сильно развитые. Нижняя
челюсть обычно сильно вы-
дается вперед, часто вклю-
чая в себя верхнюю, реже
равна верхней, с бугорком
на переднем конце снизу.
Голова большая, длинная Рис. 42. 1-я жаберная дуга Alosa brashnikovi orien-
и высокая, длина ее 25.0— talis. Длина тела 322 мм.
27.8 (26.1)%, высота
16.6—20.1 (18.8)% длины тела. Глаза большие, но менее крупные,
чем у A. brashnikovi autumnalis, 17.7—20.5 (19.4)% длины головы. Груд-
ные плавники длинные, 13.5—18.0 (15.8)% длины тела. Тело высокое,
брюшко обычно слегка отвислое, высота тела составляет 22.3—28.0
(24.9)% длины его. Хвостовой стебель удлиненный, расстояние от зад-
него конца анального плавника до хвостового 5.5—7.4 (6.3)%, высота
его 6.7—8.3 (7.6)% длины тела. На затылке поперек головы небольшое
углубление. Окраска слабая. Спина и верхняя часть головы серовато-
зеленые. За жаберной крышкой с каждой стороны по темному пятну,
на боках тела пятен нет. Длина до 42 см, наичаще около 30 см. Описание
дано "по 51 экз. длиной от 26.7 до 35.1, в среднем 30.7 см, собранным вес-
ной 1939 г. у восточных берегов южной части Каспийского моря про-
тив Кара-дашлы (33 экз.) 26 IV и Сев. Челекенской косы (18 экз.) 29 IV.
По данным, Михайловской (1941), , жаберных тычинок 22—35 (28.7), по-
звонков 46—53 (49.8).
Солоноватбводная, непроходная форма.
Форма довольно характерная выдающейся вперед нижней челюстью,
большими глазами, высоким телом с отвисшим брюхом и удлиненными
грудными плавниками. По внешнему виду несколько напоминает A. brash-
nikovi. autumnalis, обладающую еще более длинными грудными плавни-
ками, более крупными глазами и укороченным хвостовым стеблем. Осо-
бенно легко может быть смешана с A. brashnikovi sarensis.
1 Тип не указан. За тип следует считать. экземпляр длиной 32.2 см, восточный
берег южной части Каспийского моря против Кара-дашлы, 26 IV 1939, № 32187
коллекций Зоологического института Академии Наук СССР. Отсюда происходят
и йСсЛеДовацные ' А.» А. Михайловской экземпляры «типичной -расы», .ч 1
270
CLUPEIDAE
По местам и времени икрометания А. А. Михайловская различает
до 6 более мелких систематических форм, повидимому стад, из которых,
по наблюдениям Туркменской научной рыбохозяйственной станции,
наиболее различаются гасанкулинское и карадашлинское. Первое
в 1937 г., по исследованиям Б. И. Приходько, состояло главным образом
из четырех- и шестигодовалых сельдей, второе — из шести- и семигодо-
валых. Сельди, относящиеся к красноводскому стаду, имеют несколько
более длинные грудные плавники, немного более крупные глаза, укоро-
ченный хвостовой стебель, напоминая более по внешнему виду А. brash-
nikovi autumnalis.
Распространение. Каспийское море. В основном приуро-
чена к восточному побережью южной части моря, на север до м. Куули
(к северу от Красноводского зал.) и, вероятно, несколько далее. Осенью
констатирована в районе Бакинского архипелага. Нерест от Красновод-
ского зал. до Горганского (Астрабадского); в Красноводском зал. у
по-ва Дарджа, от о. Челекена до прол. Кара-дашлы, от Чикишляра до
Астрабадского зал. и в Торга! ском зал.
Биология. Икрометание с конца марта по май включительно,
южнее раньше, чем к северу. В Астрабадском зал. нерестует в конце
марта—начале апреля, в районе Гасан-кули—о. Челекен — в апреле—
мае, в Красноводском зал. — в мае. Нерестовые скопления при 17—
18° и выше. Зимой (январь—февраль), по наблюдениям Туркменской
станции (1937—1938 г.), держится в юго-восточном углу южной части моря,
в марте подходит в прибрежную зону к местам нереста и концентрируется
вдоль берегов, преимущественно на нерестилищах и в меньших количе-
ствах — между ними. После нереста все лето и осень держится в рассеян-
ном состоянии вдоль всего восточного побережья южной части моря,
осенью найдена у западных берегов, в Бакинском архипелаге. После
резких похолоданий отходит на места зимовок. Питается бычками, кре-
ветками, обыкновенной и анчоусовой тюлькой, амфиподами, атеринкой;
не прекращает питаться и зимой, желудки бывают пусты лишь в период
нереста. В связи с характером основной пищи (бычки, креветки) дер-
жится больше в придонных слоях воды. В уловах дрифтерных сетей и
па нерестилищах преобладают четырех-, пяти- и шестигодовалые, встре-
чаются восьми-, девяти- и десятигодовалые, точно так же как и двух- и
трехгодовалые, преобладающие размеры от 20 до 42, в среднем около
30 см. Одна из наиболее медленно растущих сельдей Каспийского моря.
По исследованиям А. А. Михайловской, темп роста таков:
Возраст.......... 1 2 3 4 5 6
Длина (см) . ..... 11.4 19.4 24.4 27.8 30.2 32.6
Хозяйственное значение небольшое, зимних скопле-
ний в промысловом количестве не найдено, составляет незначительный
прилов (около 1.5%). До начала дрифтерного лова вылавливалась в апреле
месяце на местах нереста.
*4f. Alosa brashnikovi autumnalis (Berg) — Большеглазая сельдь
(табл. XVIII).
Caspialosa brashnikovi autumnalis Берг, Мат. позн. русск. рыбол., IV, 6,
1915 : 5, 6, табл. I, фиг. 2, табл. II, фиг. 3 (у о. Челекена, Красноводска, Ленко-
рани, Кизилагачский зал. против устья р. Самур, у о. Тюленьего *). — Caspialosa
1 Тип не указан, не сохранились и экземпляры, по которым сделано первоописа-
ние. За тип следует считать экземпляр длиной 26.9 см, восточное побережье южной
&. ALOSA
271
caspia brashnikovi (non Borod.) Киселевич, Каспийско-волжские сельди, I, 1923 : 125r
128 (частью). — Caspialosa brashnikovi autumnalis Берг, Рыбы пресных вод, I, 1932 :
75; Михайловская, Докл. АН СССР, XXX, 6, 1941 : 56 (описание, у западных
и восточных берегов южной части Каспийского м., нерест в зал. Гасан-кули, у
м.^Бяндован, Норд-остов Култук); Световидов, Зоолог, журн., XXII, 4,
Распространение, биология. Мейснер, Бюлл. Всекасп.
научн. рыбохоз. эксп., 1—2, 1932 : 52 (миграции); там же, 5—6, 1922 : 22 (распро-
странение, места нереста, питание).
D III—IV (V) 13—15 (14.0), общим числом 16—19 (18.0), А (II) III
(IV) 16—20 (18.3), общим числом 19—23 (21.5), sp. br. 25—36 (30.0),
vert. S. 49—52 (50.51), caud. vert. 33—35 (33.87).1 Жаберные тычинки
толстые и крепкие, заостренные или реже обломанные на концах, прямые
или иногда искривленные, длиннее или реже равны жаберным лепест-
кам, первая жаберная тычинка расположена близко к основанию языка.
Зубы хорошо развитые. Ниж-
няя челюсть обычно не вы-
дается вперед, реже слегка
длиннее верхней, с бугор-
ком на переднем конце снизу.
Голова крупная, длинная и
высокая, длина ее 26.0—29.2
(27.5) %, высота 18.7—20.6
(19.6)% длины тела. Глаза
очень большие, 19.8—23.4
(21.4)% длины головы. Груд-
ные плавники очень длинные,
16.4—19.9 (18.3)% длины те-
ла. Тело высокое, брюшко
выпуклое, наибольшая вы-
сота тела 25.1'—30.1 (27.1)%
длины его. Хвостовой сте-
бель короткий, расстояние
от заднего конца анального
Рис. 43. 1-я жаберная дуга Alosa brashnikovi
. autumnalis. Длина тела 269 мм.
плавника до хвостового 5.1—
6.9 (5.8)%, высота стебля 7.0—8.5 (7.6)% длины тела. Окраска темнее,
чем у A. brashnikovi orientalis. Спина и верхняя часть головы темные,
с зеленым отливом, грудные плавники слегка пигментированы. За жа-
берной крышкой сверху с каждой стороны по темному пятну, на боках
тела пятен нет.2 Длина до 43 см. Описание дано по 52 экз. длиной от
26.0 до 32.9, в среднем 29.5 см, пойманным 8 IV 1948 у Гасан-кули. По-
данным Михайловской (1941), жаберных тычинок 22—37 (28,9),. позвон-
ков 45—53 (50.1).
Солоноватоводная, непроходная форма. * 1 2
части Каспийского моря у Гасан-кули, 8 IV 1948, № 31749 коллекций Зоологического,
института Академии Наук СССР.
1 Со срощенными позвонками среди исследованных ры.6 были две, имевшие 48
и 49 позвонков.
2 Однако у одного из исследованных экземпляров длиной 29.2 см, типичного-
по всем признакам, на боках тела с каждой стороны расположено по ряду из 7 тем-
ных пятен, из которых задние расплывчатые. У другого экземпляра длиной 29.9 см
на боках тела имеется 5—6 пятен, расположенных несколько выше пятен, лежащих
за жаберной крышкой, и не в ряд, а разбросанно; на правой стороне пятен меньше
и они менее отчетливы.
272
CLUPEIDAE
Состоит из двух стад — восточного и западного. В связи с этим пред-
ставляет большой интерес, происходит или нет нерест у иранских бере-
гов.
, Распространение. Южная часть Каспийского моря, как
у восточных, так и у западных берегов, на север вдоль восточных берегов
в основном до южной оконечности о. Огурчинского, единично до Кена-
уса (между м. Куули и зал. Кара-Богаз-гол), вдоль западных берегов еди-
нично заходит до устьев р. Самура и о. Тюленьего. Икрометание
у восточных (взморье у Гасан-кули—Чикишляр) и западных (м. Бяндо-
ван—Норд-остов Култук)- берегов южной части моря.
Биология. Нерест у восточных берегов происходит в конце
марта—в апреле, у западных, более поздно прогреваемых берегов,
в мае. Зимой (с конца декабря до половины февраля), по наблюдениям
Туркменской станции (1937—1938 г.), держится в основном в юго-запад-
ном углу (к югу от Белого Бугра) южной части моря,1 единичными экзем-
плярами ловится в Бакинском архипелаге. Позднее вместе с A. brashni-
kovi ' orientalis передвигается к северу (до Зеленого Бугра и далее до
Туркменского зал.), рассеиваясь по мелководью. В период нереста под-
ходит в прибрежную зону. Нерестовые скопления при 17—19°.
В Бакинском архипелаге ловится до глубокой осени, у восточных берегов
уходит на юг во второй половине ноября. Держится преимущественно
у дна, даже в том случае, если опускается глубже 25 м. Питается пре-
имущественно креветками, бычками, в меньшем количестве — анчоусо-
видной и обыкновенной тюлькой, реже атеринкой. Ловится в возрасте
от 2 до 8 лет, но у восточного берега в уловах преобладают четырех- и
пятигодовалые, у западного — пяти- и четырехгодовалые, размеры от
22 до 39, в среднем около 30 см. Темп роста довольно хороший, у восточ-
ного стада более замедленный (по данным А. А. Михайловской):
Возраст.......... 1 2 3 '4 5 6 7
Длина (см)....... 11.9 19.7 25.5 29.7 32.8 35.5 37.5
Хозяйственное значение небольшое. В зимнее время
ловится единичными экземплярами, наиболее облавливается у Астары,
о. Сара и у Норд-остова Култука.
*4g. Alosa brashnikovi kisselevitshi (Bulgakov) — Гасанкулинская
или киселевичевская сельдь (табл. XIX).
Caspialosa kisselevitshi Булгаков, Бюлл. Средне-азиатск. Гос. унив., 13,
1323 : 27, табл. II (у Гасан-кули;2 30 VI—1 VII). — Caspialosa kiselevitschi typ. et
Caspialosa kiselevitschi m. elata Морозов, Тр. Научи, инет. рыбн. хоз., II, 4, 1928 : 73,
74 (Красноводск. район; биометрическая обработка материалов Булгакова). —Caspia-
losa brashnikovi kisselewitschi Берг, Рыбы пресных вод, I, 1932 : 75. — Caspialosa
brashnikovi kisselevitschi Михайловская, Докл. АН СССР, XXX, 6, 1941 : 561
(описание; у юго-восточных берегов южной части Каспийского м.; нерест здесь же
к югу от о. Огурчинского); Световидов, Зоолог, журн., XXII, 4, 1943 : 231;
в; Промысловые рыбы СССР, 1949 : 105.
Рас пространени ё, биология. Мейснер, Бюлл.’ Всекасп.
научн. рыбохоз. эксп., 5—6, 1932 : 22 (места нереста, распространение, миграции).
1 В. И. Мейснер отмечает для 1931 г. нахождение в зимнее время (декабрь—
январь) против Красноводской косы—о. Огурчинского. ;
- А. Тип хранится при, Кафедре;зоологии Среднеазиатского Государственного уни-
верситета. ... . ,
9. ALOSA
273
Ь III—IV 12—15 (13.9), об-цим числом 15—19 (17.6), A III (IV) 14—
19 (16.5), общим числом 17—22 (19.3), sp. br. 29—44 (37.8). Жаберных ты-
чинок наибольшее количество из всех каспийских форм этого вида.
Тычинки грубые, часто посаженные, обычно заостренные, без утолще-
ний и неразветвленные на концах, по длине наичаще равные жаберным
лепесткам, первая тычинка расположена близко к основанию языка.
Зубы хорошо развитые. Нижняя челюсть равна или даже слегка короче
верхней, реже слегка выдается вперед, ребристая и с бугорком на конце
снизу. Голова средних размеров, почти самая высокая из всех форм вида,
длина ее 24.2—26.9 (25.6)%, высота 18.3—20.3 (19.2)% длины тела.
Глаза средних размеров, 15.6—18.5 (17.5)% длины головы. Рыло тупое,
верхний профиль головы прямой, со спиной образует пологую дугу.
Грудные плавники удлиненные, 13.9—16.8 (15.6)% длины тела. Тело
высокое, высота его 21.8—28.2 (26.0)96 длины. Спина и верхняя часть
головы томнозеленые, грудные
и брюшные плавники темные.
С каждой стороны за жабер-
ной крышкой по темному пятну,
на боках тела пятен нет. Длина
до 40 см, наичаще 30—35 см.
Описание дано по 45 экз. дли-
ной от 27.5 до 33.8, в среднем
30.5 см, собранным весной
1939 г. у восточных берегов юж-
ной части Каспийского моря
против южной оконечности
о. Огурчинского (34 экз.) 18 V
и Белого Бугра (И экз.) 19 V.
По данным Михайловской( 1941),
жаберных тычинок 30—49
(38.0), позвонков 43—53 (49.0).
Солоноватоводная, непро-
Рис. 44. 1-я жаберная дуга Alosa brashnikovi
kisselevitshi. Длина тела 313 мм.
ходная форма.
Наиболее существенно от других форм вида отличается количеством
жаберных тычинок, довольно большой, высокой и притупленной спереди
головой. Если оказывается возможным, следует принимать во внимание
и количество позвонков — наименьшее из всех форм вида (наичаще
48—50).
Распространение. Южная часть Каспийского моря, в основ-
ном на местах нереста и зимовки, в юго-восточном углу против Гасан-
кули—Чикишляра и несколько севернее (до Белого Бугра). Вдоль вос-
точных берегов на север заходит до Бекташ и зал. Кара-Богаз-гол,
в западной половине констатирована у Астары и о. Сара, неполовозрелые
особи встречаются здесь и севернее — на сельдяных промыслах Азер-
байджана в средней части моря. Нерест у Гасан-кули—Чикишляр.
Биология. Икрометание самое позднее из всех южнокаспийских
форм — по исследованиям Н. П. Серова, в июне—июле и даже августе
при температуре свыше 25°. Одна из наиболее теплолюбивых форм вида.
Всю зиму, с декабря по февраль и иногда даже по март, держится в юго-
восточном углу моря, главным образом против Гасан-кули—Чикишляра
и несколько далее к северу, образуя здесь вместе с другими формами
этого вида значительные скопления и являясь главной основой зимнего
дрифтерного лова. Зимой на глубинах менее 25 м встречается преиму-
18 Фауна СССР — 314
274
CLUPEIDAE
щественно в придонных слоях воды (вернее наддонных), занимая над
дном слой воды до 12 м; на глубине свыше 25 м держится в промежуточ-
ных слоях воды, на некоторой глубине от поверхности. Над глубинами
свыше 300 м встречается единично. Более крупная сельдь, с преобла-
данием самок, по наблюдениям, держится дальше от берегов, более мел-
кая, с преобладанием самцов, — ближе к берегам; к северу держатся
более старшие возрастные группы (шести-, семи-, восьми- и девятигодо-
валые), южнее более младшие (трех-, четырех- и пятигодовалые).
В течение всего этого времени находится в малоподвижном состоя-
нии и почти не питается. С марта месяца начинается передвижение на
север до о. Огурчинского, где усиленно питается гаммаридами, обыкно-
венной и анчоусовидной тюлькой, атеринкой, бычками, креветками;
в более разреженном состоянии, чем зимой, держится здесь весь апрель,
иногда начало мая. Позднее отходит к югу, к местам нереста, причем
икрометание происходит и севернее основного нерестилища, вплоть до
Зеленого Бугра, но сельдь держится здесь в более разреженном состоя-
нии. Во время нереста не питается. Молодые возрастные группы (трех-,
четырех- и пятигодовалые) в конце апреля—начале мая ловятся у Астары,
в мае одно-, двух- и трехгодовалые составляют основную массу прилова
молоди в скипастях и неводах у западных берегов (Шихова коса—Ашпе-
ронский п-ов и несколько далее к северу). Молодь держится и у восточ-
ных берегов. После нереста отходит к свалу глубин 30—80 м, распыляясь
затем по всей южной части моря и начиная вновь питаться тюлькой обык-
новенной и анчоусовидной, креветками, бычками. Осенью подходит
в, зону глубин 25—55 м и постепенно передвигается на юг к местам зи-
мовки. Осенью крупная сельдь в небольшом количестве ловится в Бакин-
ском архипелаге и у о. Сара. Зимой и весной держится при температуре
10—14° и несколько ниже, но ниже 8° в массе не встречалась. По
сравнению с другими южнокаспийскими формами вида наиболее пела-
гична. Половой зрелости достигает на четвертом и пятом году,1 в дриф-
терных сетях зимой преобладают четырех-, пяти- и шестигодовалые,
размерами от 15 до 44, в среднем 30—34 см, встречаются семи-, восьми-
и девятигодовалые. Обладает довольно быстрым темпом роста среди
южнокаспийских форм вида (по данным А. А. Михайловской):
Возраст............. 1 2 3 4 5 6
Длина (см).......... 8.4 18.9 24.9 29.1 32.0 34.1
Хозяйственное значение. Наиболее многочисленная из
всех южнокаспийских форм бражниковских сельдей (70% дрифтерного
улова сетей). В 1934—1938 гг. уловы составляли от 3 до 29.5 тыс. ц.
Ловится главным образом дрифтерными сетями на местах зимовки. Нере-
стовые скопления в летнее время промыслом не используются вследствие
жаркой погоды. По вкусовым качествам из всех бражниковских сельдей
стоит на первом месте после A. brashnikovi agrachanica.
*4h. Alosa brashnikovi nirchi (Morosow) — Красноводская сельдь
(табл. XIX).
Caspialosa brashnikovi et Caspialosa leucocephala Берг, Мат. позн. русск.
рыбол., IV, 6, 1915 : 5, табл. I, фиг. 1 (сельдь, совмещающая в себе признаки С. bra-
shnikovi и С. leucocephala, зал. Кендырли). — Caspialosa nirchi Морозов, Тр.
1 Однако Замахаев (1949) по нерестовым кольцам, которые есть и у бражни-
ковских сельдей, но выражены менее резко, чем у проходных, установил, что все
южнокаспийские формы этого вида достигают половой зрелости в двухгодовалом
возрасте и в течение жизни нерестуют 5—6—7 раз.
9. ALOSA
275
Научн. инет. рыбн. хоз., II, 4, 1928 : 73 (Красноводский зал.,1 осень). — Caspialosa
brashnikovi nirchi Берг, Рыбы пресных вод, I, 1932 : 75. — Caspialosa brashnikovi
kenderlensis Б а д а м ш и н, Рыбн. хоз., 1938, 10 : 36 (зал. Кендырли; нерест в мае,
разгар в конце мая). — Caspialpsd brashnikovi nirchi Михайловская, Докл.
ЛИ СССР, XXX, 6, 1941 : 561 (описание, восточное побережье южной части Кас-
пийского м.; нерест в Красноводском зал.); Световидов, Зоолог, журн.,
XXII, 4, 1943 : 231.
Распространение, биология. Мейснер, Бюлл. Всекасп.
научн. рыбохоз. эксп., 5—6, 1932 : 22 (распространение и миграции).
D III—IV 13—14 (13.5), общим числом 16—18 (17.3), А II—III 16—
20 (18.3), общим числом 20—23 (21.2), sp. br. 20—30 (24.9), vert. S. 49—
52 (50.75), caud. vert. 33—35 (33.69). Жаберные тычинки толстые, редко
сидящие, прямые, наичаще без вздутий и не раздвоенные на концах,
обычно короткие, равны или короче жаберных лепестков, первая жабер-
ная тычинка расположена довольно близко от основания языка. Зубы
хорошо развитые. Челюсти обычно
равной длины, нижняя челюсть
иногда с небольшим мозолистым
утолщением на конце, снизу с
бугорком, сглаженная, слабо реб-
ристая. Голова короткая, невысо-
кая и тупая, верхний профиль ее
обычно почти прямой, длина ее
23.4—26.3 (24.9)%, высота 15.9—
18.4 (17.3)% длины тела. Глаза
небольшие, 15.3—19.3 (17.8)%
длины головы. Грудные плавники
самые короткие из всех форм вида,
10.9—14.7 (13.2)% длины тела.
Тело удлиненное и невысокое,
высота его 1&.3—26.4 (23.6)%
длины. Окраска бледная. Голова рис 45 ;_я жаберная дуга Alosa brash-
голубовато-зеленая, белесая. Спи- nikovi nirchi. Длина тела 386 мм.
на светлосерая, со слабым зелено-
ватым оттенком, нижняя челюсть и грудные плавники светлые. Помимо тем-
ного пятна за жаберной крышкой на боках тела иногда по ряду расплывча-
тых серых пятен. Размеры до 42 см, наичаще около 30 см. Описание дано
по 16 экз. длиной от 29.6 до 40.4, в среднем 32.8 см, собранным у вос-
точных берегов южной части Каспийского моря в
10—15 IV 1948. По данным Михайловской (1941),
21—31 (25.2), позвонков 48—52 (50.4).
Солоноватоводная, непроходная форма.
По внешнему виду, окраске и наличию иногда i
ния на конце нижней челюсти наиболее близка к А
Близка также к A. brashnikovi agrachanica, отличаясь от нее более низ-
ким телом, меньшими размерами глаз и грудных плавников.
Описанная Б. И. Бадамшиным новая форма A. brashnikovi из зал.
Кендырли — A. brashnikovi kenderlensis, повидимому, идентична A. brash-
nikovi nirchi, которая, по указанию Мейснера (1932) «мигрирует вдоль
восточного берега к северу до Кендерлийского залива, где мечет икру
1 Тип не указан. Не сохранились и экземпляра, по которым сделано первоопи-
сание. За тип следует считать экземпляр длиной 38.6 см, восточный берег южной
части Каспийского моря против Сев- Челекенской косы, 29 IV 1939, № 31780 коллек-
ций Зоологического института Академии Наук СССР.
18*
Красноводском зал.
жаберных тычинок
мозолистого утолще-
[. brashnikovi grimmi.
276
CLUPEIDAE
(это требует еще проверки)». Различия между сельдью, описанной Бадам-
шиным, и A. brashnikovi nirchi в основных признаках таковы:
A, br. nirchi А. Ъг. п/. kenderlensis L>'a
Количество жаберных тычинок 1 25.17±0.24 (21—31) Количество позвонков 50.39±0.09 (48—52) В % длины тела Длина головы 24.59±0.09 (22—27) Высота головы 16.94±0.11 (15—20) Длина грудного плавника 13.66±0.09 (11-16) Длина тела (см) 33.2 (24—42) 26.60±0.17 4.9 ' (21—32) 50,19±0.06 1.8 (48—51) 25.07±0.15 2.7 (23.5—27) 16.33±0.14 3.4 (14—18.5) 13.81±0.12 1.9 (12.5—16) 31.1 — (18—38)
Таким образом, реальные различия, и притом незначительные,
имеются только в количестве жаберных тычинок и в высоте головы,
пределы же колебаний в сущности совпадают. По указанию А. А. Михай-
ловской, особи A. brashnikovi nirchi, мечущие икру в Красноводском зал.
с конца мая по июнь включительно, имеют несколько большее в среднем
количество жаберных тычинок, которые у них сидят чаще, равны или
длиннее жаберных лепестков, голова ниже, острее и длинее и т. д., чем
у особей, нерестящихся здесь же в апреле—мае, т. е. отличаются друг
от друга так, как отличается A. brashnikovi kenderlensis, мечущая икру
в-мае—июне (в апреле половые органы были в стадии П), от A. brashni-
kovi nirchi.1 2 3 Темные пятна на боках тела выше средней оси тела позади
жаберной крышки не редки и у тех и у других. Что касается реальности
различий в количестве жаберных тычинок и в высоте головы, то они
невелики, значительно меньше показателей различия между остальными
формами A. brashnikovi, обычно выражаемыми двузначными числами.
На основании таких различий новые формы выделять, разумеется, нельзя.
A- brashnikovi nirchi, нерестящаяся весной (апрель—май) и летом (май—
июнь), представляет несомненно два стада. В зал. Кендырли имеется,
повидимому, стадо, нерестящееся летом.
Сельди, которые, по указанию Берга (1915), совмещая в «себе признаки
С. brashnikovi и С. leucocephala, в большом количестве ловятся в.зал.
Кендырли», в значительной степени относятся, повидимому, к этой форме
и частично к A. brashnikovi brashnikovi. Жаберных тычинок у них от 20
до 36, на боках иногда бывает до 12—13 крупных темных пятен.
Распространение. Южная часть Каспийского моря в районе
заливов Красноводского и Кендырли, единично встречается и несколько
южнее. Икрометание в зал. Красноводском и, повидимому, в зал. Кен-
дырли.
Б иология. Икрометание с апреля по июнь включительно. Зимой
(в январе), по наблюдениям Туркменской станции (1937—1938 г.), в рас-
сеянном состоянии держится в юго-восточной части моря от Серебряного
Бугра до банки Ульского. В марте подходит ближе к берегам, передви-
1 В скобках указаны пределы колебаний. Средние и пределы колебаний приз-
наков для A. brashnikovi nirchi приведены по данным А. А. Михайловской.
3 А, А, Михайловская, судя по ее материалам, приводит индексы для весенне-т
нерестующих особей A. brashnikovi nirchi.
9. ALOSA
277
гнись одновременно к северу. В апреле держится на мелководье от Чикй-
шлпра до м. Тарта, но в основной массе концентрировалась в Красновод-
пком зал. (около Сев. Челекенской косы, у п-ова Дарджа, вдоль Крас-
ноподской косы). Летом и осенью держится рассеянно вдоль восточных
берегов южной части моря. Держится преимущественно в придонных
своих воды. В период нереста кишечники большею частью пустые. В
начало нереста (в апреле—мае) мечут икру пяти- и четырехгодовалые,
а конце (с конца мая по июнь включительно)—шести- и семигодовалые.
11 рообладающие размеры от 21 до 42, в среднем около 30 см. По темпу
роста одна из наиболее быстрорастущих форм вида (по данным А. А. Ми-
хайловской):
Возраст................1 2 3 4 5 6 7
Длина (см)............. 14.8 23.5 28.6 32.4 35.4 37.6 41.2
Хозяйственное значение ничтожное, в уловах дриф-
терных сетей в зимнее время встречается крайне редко. Самая мало-
численная форма вида. В последние годы ловилась во время нереста
в Красноводском зал.
*4i. Alosa brashnikovi grimmi (Borodin) — Белоголовая, или астра-
бадская сельдь, сельдь-гонец, желтоспинка (табл. XX).
Clupea caspio-pontica var. grimmi Б о p о дин, Вестн. рыбопр., XIX, 3, 1904 :
180, 184 (Ашур-аде близ Астрабадскбго зал.1; № 36—41 табл, измерений, икромета-
ние). — Clupea grimmi Книпович, Тр. Касп. эксп. 1904 г., I, 1907 : 48, 80
(Астрабадский зал., близ зал. Гасан-кули, близ Астары; зрелость).— Clupea (Alosa)
grimmi Суворов, там же, II, 1908 : 45, 53, 59 (южная часть Каспийского м.). —
Clupeonella leucocephala Берг, Мат. позн. русск. рыбол., II, 3, 1913 : 27, табл. XIV,
фиг. 1—2 (у Сумгаита и Гюргенчая у ст. Белиджи). — Caspialosa brashnikooi leuco-
cephala Берг, там же, IV, 6, 1915 : 5. — Caspialosa curensis (non Suworow) Бул-
гаков, Бюлл. Средне-азиатск. Гос. унив., 4, 1924 : 81 (у восточных берегов в районе
Красноводска). — Caspialosa brashnikooi leucocephala Булгаков, там же, 14,
1926 : 28 (от Крдсноводска до Гасан-кули). — Caspialosa leucocephala Морозов,
Тр. Научн. йнст. рыбн. хоз., II, 4, 1928 : 47 (биометрика). — Caspialosa brashnikooi
leucocephala Мейснер, Бюлл. Всекасп. научн. рыбохоз. эксп., 1—2, 1932:52
(миграции, места нереста). — Caspialosa brashnikooi grimmi Берг, Рыбы пресных
вод, I, 1932 : 75; Михайловская, Докл. АН СССР, XXX, 6, 1941 : 561 (у за-
падных и восточных берегов южной части Каспийского м.; нерест в Астрабадском
зал. и у о. Огурчинского); Световидов, Зоолог, журн., XXII, 4, 1943 : 231;
в: Промысловые рыбы СССР, 1949 : 107.
Распространение, биология: Киселевич, Тр. Астрах, ихт.
лаб., V, 2, 1922 : 24 (темп роста); Мейснер, Бюлл. Всекасп. научн. рыбохоз.
эксп., 5—6, 1932:22 (распространение, места нереста); Замахаев, Зоолог,
журн., XXVIII, 6, 1949 : 549 (нерестовые кольца на чешуе).
1X111—IV 12—15 (13.6), общим числом 16—18 (17.1), A III (IV) 16—
20 (17.5), общим числом 19—23 (20.6), sp. br. 18—27 (22.4), vert. S. 48—
51 (47.79), caud. vert. 32—34 (32.74). Жаберных тычинок наименьшее число
из всех форм вида. Тычинки толстые, грубые, искривленные и притуплен-
ные, часто расплющенные и утолщенные или раздвоенные на концах^
равны или длиннее жаберных лепестков, у молодых длиннее, у взрослых
короче, первая тычинка далеко отстоит от основания языка. Зубы сильно
развитые. Нижняя челюсть обычно слегка выдается вперед, реже оди-
наковой длины с верхней, закругленная и не ребристая, с характерным
1 Тип не указан, но экземпляры, по которым дано первоописание (№ 31—41 табл,
измерений), сохранились. За тип следует считать один из этих экземпляров длиной
34.0 см, Ашур-аде близ Горганского зал., 23 IV 1903, № 13045 коллекций Зооло-
гического института Академии Наук СССР.
'278
CLUPEIDAE
мозолистым утолщением1 на конце сверху, без бугорка на конце снизу.
Голова короткая и низкая, длина ее 22.9—26.4 (24.7)%, высота 15.5—
19.1 (17.4)% длины тела. Глаза небольшие, 14.0—20.0 (16.7)% длины
головы. Грудные плавники очень короткие, 12.9—15.2 (14.0)% длины
тела. Тело низкое и вальковатое, высота его 19.9—25.0 (22.6)% длины.
Окраска довольно бледная. Спина и задняя часть головы сверху серовато-
голубые, передняя часть головы и грудные плавники белесые. На боках
за жаберной крышкой с каждой стороны по темному пятну, сзади кото-
рого обычно имеется ряд расплывчатых серых пятен, почти сливающихся
в продольную полосу. Чешуя мелкая, тонкая, легко опадающая. Раз-
меры до 37.5 см, наичаще 27—30 см. Описание дано по 48 экз. длиной от
24.6 до 33.9, в среднем 30.4 см, собранным весной 1939 г. у восточных
берегов Каспийского моря против южной оконечности о. Огурчинского
(33 экз.) 18 V и Белого Бугра (15 экз.) 19 V. По данным Михайловской
(1941), жаберных тычинок 18—26
А (21.4), позвонков 45—52 (49.5).
/ 'У Солоноватоводная, непроходная
у А. форма.
V\ Одна из наиболее обособленных
\ \ К.Ф°рм вида, довольно резко отли-
\. чающаяся мозолистым утолщением
на нижней челюсти, наименьшим ко-
I j % , -/VTTTyvt личеством жаберных тычинок, их
аЩ V lliiiril \ строением, положением первой из
ч I I III II них и белесой окраской. Положение
первой жаберной тычинки далеко
от основания языка настолько ха-
рактерно для этой формы, что по
Рис. 46. 1-я жаберная дуга Alosa brash- этой особенности в совокупности
nikovi grimmi. Длина тела 340 мм. с другими довольно хорошо опре-
деляются молодые сельди размерами
менее 20 см, еще не имеющие мозолистого утолщения. Следует отме-
тить, что иногда встречаются сельди с зачаточным мозолистым утол-
щением на нижней челюсти и по внешнему виду похожие на A. brash-
nikovi grimmi, но с увеличенным количеством жаберных тычинок. Так,
например, нам встретился такой экземпляр с 31 жаберной тычинкой.
Наряду с нормально окрашенными иногда встречаются сельди с черной
окраской спины и боков тела. Такая сельдь из южной части моря
описана Бергом (1913 : 28, табл. XIV, фиг. 1, № 13715 коллекций
Зоологического института Академии Наук СССР) и из Красноводска
Киселевичем (1923 : 135).
Распространение. Южная часть Каспийского моря, пре-
имущественно у его юго-восточных берегов, на север до зал. Кара-Богаз-
гол и Апшеронского п-ова на запад, но единично заходит и далее, вдоль
восточных берегов до п-ова Мангышлака (Николаевское)1 2 и почти до Дер-
бента (ст. Белиджи) вдоль западных. Икрометание у восточных берегов —
на банке Михайлова (на восток от северной оконечности о. Огурчинского),
на взморье у прол. Кара-дашлы и южнее, в Горганском (Астрабадском) зал.
1 Утолщение это не хрящевое, а мозолистого характера, приобретенное в связи
с бентоядным питанием и у рыб до 20, иногда даже до 25 см отсутствующее. У круп-
ных рыб оно часто имеет вид небольшого бугорка, входящего в выемку в верхней
части челюсти позади praemaxillare.
2 № 15898 коллекций Зоологического института Академии Наук СССР.
9. ALOSA
279
Биология. Нерест с апреля по июнь включительно, единичные
особи продолжают нереститься в июле и даже августе,1 на северных не-
рестилищах несколько раньше, чем на южных (на банке Михайлова
в апреле, у прол. Кара-дашлы и в Астрабадском зал. в мае—июне).
В зимнее время (январь—февраль), по наблюдениям Туркменской стан-
ции в 1937—1938 г., держалась к югу от южной оконечности о. Огурчин-
ского до берегов Ирана. В. марте встречается в более разреженном состоя-
нии и распространяется далее к северу, до м. Тарта. В апреле держится
в прибрежной зоне у Чикишляр—Зеленый Бугор и у Кара-дашлы—Южн.
Челекенская коса — в местах концентрации бычков. До резкого похоло-
дания держится в разреженном состоянии вдоль всего восточного побе-
режья южной части моря, в сентябре наблюдались скопления к югу от
о. Огурчинского, позднее отходит к свалу глубин и южнее. По характеру
питания наиболее придонная из всех каспийских сельдей, питается пре-
имущественно бычками и иногда моллюсками,1 2 также тюлькой. Харак-
терное для этого вида мозолистое утолщение на нижной челюсти есть,
повидимому, приспособление к образу питания. В связи с характером
питания ведет преимущественно придонный образ жизни. В уловах пре-
обладают шести- и семигодовалые, встречаются как младшие возрастные
группы (от трехгодовалых), так и более старшие (восьми-, девяти-, десяти-
й до тринадцатигодовалых включительно), размерами от 15 до 37, в сред-
нем около 27—30 см. Половой зрелости, как и другие южнокаспийские
формы бражниковской сельди, достигает в двухгодовалом возрасте и
нерестует в течение жизни 5—6—7 раз (Замахаев, 1949). Темп роста до-
вольно замедленный (по исследованиям А. А. Михайловской):
Возраст........... 1 2 3 4 5 6
Длина (см)........ 11.5 19.3 24.6 28.1 30.7 33.0
Хозяйственное значение небольшое. Уловы в 1936—
1939 гг. колебались от 600 до 800 тыс. ц. В дрифтерные сети ловится
все же в бблвшем количестве, чем A. brashnikovi autumnalis и А. brash-
nikovi orientalus. Ловится зимой дрифтерными сетями.
*5. Alosa curensis (Suworow) — Куринская, полосчатая сельдь
(табл. XX).
Clupea (Alosa) curensis Суворов, Тр. Касп. эксп. 1904 г., I, 1907 162,
192—194, рис. 4 (против устья Куры и близ Кизилагачского зап.3). — Clupea kurensis
Книпович, там же : 80 (зрелость). — Clupea (Alosa) curensis Суворов,
там же, II, 1908 : 46, 53. — Clupeonella curensis Берг, Мат. позн. русск. рыбол.,
II, 3, 1913 : 22 (частью: экземпляры Суворова). — Caspialosa curensis Берг,
там же, IV, 6; 1915 : 4 (местонахождения на стр. 5 относятся не к этой сельди). —
•Caspialosa caspia curensis Киселевич, Каспийско-волжские сельди, I, 1923 :
119, 141 (экз. Суворова). — Caspialosa curensis Мейснер, Бюлл. Всекасп. научн.
рыббхоз. эксп., 5—6, 1932 : 21 (Куринская коса, Кизилагачский зал., у о. Сара)
в районе Карадага); Световидов, Зоолог., журн., XXII, 4, 1943 : 231; Та-
расевич, Докл. Акад, наук Азерб. ССР, II, 4, 1946 : 166 (измерения, рост, нерест-
D III—IV 13, А III 17—19 (17.7), sp. Ъг. 32—38 (34.0). Жаберные
тычинки редкие, длина их несколько превосходит длину жаберных лепест-
ков. Зубы развиты слабо, в виде мелких зубчиков. Нижняя челюсть у всех
1 А. П. Серов находил единичные экземпляры этой сельди с еще не вполне выме-
танными молоками и икрой на нерестилищах A. Ъг. kisselevitshi.
2 Моллюски (Cardium edule) в желудке этой сельди в апреле 1939 г. были нахо-
димы и мной.
? Один из этих трех экземпляров от устья Куры принят Л. С. Бергом за тип
(№ 13984, 1—-2 мая 1904 г., длина 17.6 см).
исследованных экземпляров слегка выдается вперед. Голова довольно
крупная, несколько крупнее, чем у большинства форм A. brashnikovi,
но короче, чем у A. saposhnikovi, 25.7—26.5 (26.1)% длины тела, довольно
высокая, 18.2—18.9 (18.5)% длины тела. Глаза довольно крупные, 21.7—
24.2 (23.0)% длины головы. Грудные плавники длинные, 17.3—18.8
(17.9)% длины тела. Тело довольно высокое, 23.5—27.0 (24.7)% длины
его. Окраска вообще слабая, но на спине пигмент развит довольно сильно,
голова окрашена слабо, по верхнему краю глаза и около него почти
всегда черная полоса, пигментация развита и на нижней челюсти. Самая
мелкая из каспийских сельдей, размеры до 24.5 см, половозрелые от
11—1'4 см. Описание дано по экземплярам длиной 17.6, 17.9, ,18.5 см,
пойманным 1—2 мая 1904 г. близ устья Куры, По данным Е. К. Суворова,
жаберных тычинок 30—44 (около 36). По данным Тарасевич (1946; 100
экз.), D общим числом 15—19 (17.3), А общим числом 18—24 (21.0), жабер-
ных тычинок 26—54 (40.0), позвонков 47—52
(49.5).
Солоноватоводная, непроходная рыба.
Провизорно, ввиду малого количества ис-
следованных экземпляров, рассматривается
как самостоятельный вид, но, возможно,
является формой A. brashnikovi.
Распространение, насколько
известно, очень узкое; все достоверные ме-
стонахождения относятся к западному побе-
Рис. 47.1-я жаберная дуга А 1о- режыо южной части Каспийского моря в
sa curensis. Длина тела 176мм. районе устья Куры, Куринской косы, зал. Ки-
рова (б. Кизилагачского) , о. Сара и Ленко-
рани; в небольшом количестве встречается в районе Карадага.
Биология известна также мало. Половой зрелости достигает
при длине И—14 см к концу второго года жизни. Нерест, судя по наблю-
дениям над степенью зрелости половых продуктов, происходит, пови-
димому, во второй половине мая (14 и 15 мая 1904 г. в Зюд-остовом Кул-
туке и у входа в Кизилагачский зал. половые продукты были близки
к нересту; Книпович, 1907). У Ленкорани и о. Сара в 1944 г. нерест на-
блюдался с конца апреля по июнь включительно. Рост крайне замедлен-
ный, по размерам сравнительно с каспийскими формами A. brashnikovi
отстает на 1—2 года (по данным Тарасевич, 1946):
Возраст...... 2 3 4
Длина (см) . . . 19.5 23.8 27.9
Хозяйственное значение. В 1930—1932 гг. в замет-
ных количествах ловилась скипастями у о. Сара и на Куринской косе.
До этого в уловах не встречалась, так как вследствие малых размеров
проходила сквозь крупную ячею применяемых здесь ставных сетей.
*6. Alosa kessleri (Grimm) s. 1. — Каспийско-черноморские проход-
ные сельди, кесслеровские сельди (на Каспийском море).
Литературу см. при подвидах.
Жаберных тычинок 47—155 (у каспийских от 59), различных по коли-
честву и строению у разных форм; тычинки у одних форм тонкие и длин-
ные, обычно длиннее жаберных лепестков, у других форм более толстые
ii короткие, короче жаберных лепестков, с обломанными или целыми кон-
цами; концы жаберных тычинок, если они не обломанные, обычно не -
образуют такой выпуклой дуги на нижней половине жаберной дуги,
как у A. caspia. Зубы более или менее развитые, у некоторых форм слабо
лимитные (у A. kessleri volgensis'). Нижняя челюсть слегка выдается впе-
ред или равна верхней, обычно с бугорком на переднем конце снизу,
голова низкая и короткая, не сжатая в нижней части с боков, высота ее
15 18%% длины тела. Глаза сравнительно небольшие", несколько раз-
личающиеся по величине у разных форм. Тело сельдеобразное, низкое
и но укороченное в хвостовой области, с короткими грудными плавниками,.
('иода относятся как самые крупные формы рода длиной до 52 см, так
и средние по размерам, в половозрелом состоянии каспийские от 19,
некоторые формы (Л. kessleri kessleri) даже, от 35—37 см, черноморские
от 10 см.
Проходные рыбы, размножающиеся в реках или иногда отчасти в пред-
ус.тьсвом пространстве.
Распадается на ряд форм. Из всех каспийских форм вида системати-
ческое положение волжской сельди было, пожалуй, наиболее неопре-
деленным. Принятая первоначально за «продолговатую разность», «про-
долговатую форму» или «волжскую форму» каспийского пузанка и опи-
санная затем как подвид его, волжская сельдь впоследствии была выде-
лена в самостоятельный вид. В настоящее время оснований для принятия
волжской сельди за самостоятельный вид нет, так как в наиболее важ-
ном признаке — количестве и строении жаберных тычинок, точно так же
как и в других признаках, резких отличий между волжской сельдью
и черноспинкой нет. Рыбы, отнесение которых к той или иной форме проход-
ных сельдей при - просмотре большого количества их затруднительно,
встречаются нередко.1 Это затруднение еще больше усложняется нали-
чием помесей, в частности весьма обычных между черноспинкой и волж-
ской сельдью. Нет резких отличий и между икринками и личинками
черноспинки и волжской сельди. Описанная в последнее время мелкая
форма проходной сельди (С. volgensis bergi Tanassijtschuk) еще больше -
запутывала систематику проходных сельдей. Принятая при описании
за подвид волжской сельди, эта форма по ряду морфологических, физио-
логических (жировые отложения в полости тела) и биологических особен-
ностей ближе все же к черноспинке, имея вместе с тем сходство й с волж-
ской сельдью, которая из всех форм проходных сельдей наиболее об-
особлена. Черноморско-азовская проходная сельдь (С. pontica auct.)
отличается от каспийских проходных сельдей, как указывалось выше,
не более, чем последние друг от друга, имея, правда, наименьшее
количество жаберных тычинок и hiatus в числе их с волжской сельдью
(см. об этом стр. 216). Различия между всеми упомянутыми выше фор-
мами, в частности между наиболее отличающимися волжской и черно-
1 В связи с этим не безинтересно привести мнения К. А. Киселевича и Н. П.
Танасийчука, которые, занимаясь в течение ряда лет изучением проходных сельдей,:
просмотрели массовые количества их. Киселевич (1923 : 104), впервые отметивший,
что волжская сельдь «по размерам и всеми своими признаками гораздо ближе стоит
к С. с. kessleri, чем к С. caspia», далее указывает, что: «Тогда как от пузанка -она
в массе легко отличается уже при первом взгляде, от черноспинки ее можно отличить
только после исследования жаберного аппарата, да и то далеко не всегда». Н. Тана-
сийчук указывает на трудность определения черноспинки. По его мнению, «несмотря
па то, что видовая характеристика С. kessleri довольно четко формулирована
не только Бергом и Киселевичем, но и прежними авторами, определения ее зачастую
производились (и производятся) не верно».
28 2
clupeidae
-спинкой или черноморско-азовской проходной сельдью, значительно
меньше, чем между соответствующими им морфологическими и биологи-
ческими A. alosa и A. jail ах, являющимися несомненными видами и резко
отличающимися, например, строением головы, даже внешне. Большая
степень отличий в количестве лучей в анальном ' плавнике между
A. alosa и A. fallax, чем между волжской сельдью и черноспинкой или
другими формами (см. об этом стр. 66), служит также подтверждением
меньшей обособленности между последними. Следовательно, все три
каспийские и черноморско-азовская формы проходных сельдей, подобно
•формам A. caspia и A. brashnikovi, представляют одну естественную
группу, связанную сходством в основных морфологических и биоло-
гических особенностях, почему их и следует считать формами одного
вида.
Распространение. Каспийское, Черное и Азовское моря,
откуда заходит в реки, впадающие в северную часть Каспийского,
в северо-западную часть Черного морей и в Азовское море.
ОПРЕДЕЛИТЕЛЬНАЯ ТАБЛИЦА ПОДВИДОВ
1 (4). Жаберных тычинок не более 95, наичаще 50—80, тычинки не осо-
бенно длинные, короче, равны или реже длиннее жаберных лепест-
ков. Зубы на челюстях обычно довольно хорошо развитые.
.2 (3). Жаберных тычинок не более 75, наичаще 50—60. Черное и Азов-
ское моря ......... *6а. A. kessleri pontica (Eichwald).
3 (2). Жаберных тычинок не менее 57, наичаще 60—80, тычинки как
толстые и грубые, часть их обычно обломанная на концах или даже
у основания, так и тонкие, не обломанные. Каспийское море . .
.................................*6с. A. kessleri kessleri (Grimm)
4 (1). Жаберных тычинок не менее 90, наичаще НО—130, тычинки тон-
кие и длинные, обычно длиннее жаберных лепестков и целые, не
обломанные. Зубы на челюстях обычно развиты слабо. Каспийское
море.............................*6b. A. kessleri volgensis (Berg)
*6а. Alosa kessleri pontica (Eichwald) — Черноморско-азовская про-
ходная сельдь, черноморская сельдь, мелкая форма—тачёк (Керчь),
подтумок (Днепр), крупная форма — буркун (Керчь), сельдь, оселедец,
.лобан, русак (Днепр) (табл. XXI).
Clupea piltschardus (non Walb.) Pallas, Zoogr. rosso-asiat., Ill, 1811 : 204
(частью). — ? Alosa immaculata Bennet, Proc. Zool. Soc. London, III, 1835 : 92
<(Черноё м. у Трапезунда). — Clupea pontica Eichwald, Bull. Soc. Nat. Moscou,
XI, 2, 1838 : 135 (Черное м. у Одессы); Nordmann, Faune pontique, 1840 : 520,
t. 25, f. 2 (Черное м. у Керчи, Крыма, устье Дуная); Eichwald, Fauna caspio-
•caucasica, 1841 : 204, t. XXXII, f. 2. — Clupea pontica Кесслер, Тр. СПб. общ.
•ест., V, 1874 : 306 (частью). — Clupea eichwaldi Гримм, Вести, рыбопр., XVI, 2,
1901 : 67 (Дон у Ростова, № 1—10 и 14—17; Кальмиус, № 11—13; Керченский прол.,
.№ 18—20). — Alosa pontica var. russac Antipa, Denkschr. Akad. Wiss. Wien,
math.-naturw. KI., LXXVIII, (1905), 1906 : 22, t. II, f. 1—5 (дельта Дуная). — Alosa
pontica var. danubii Antipa, ibid. : 17, t. B, t. I, f. 4—8 (Черноем. у берегов Румы-
нии, Дунай до Браилова и выше). — Alosa pontica var. nigrescens Antipa, ibid. ; 21,
t. A, t.I, f. 1—3 (дельта Дуная). — Alosa pontica Браунер, Тр. Бессарабск. общ.
•ест., II, 2, 1912 : 118 (Днестровский лиман у Аккермана, Днепр у Херсона, Чер-
,ное м. у Одессы, Скадовска, Севастополя, Батуми, Керченский прол.). — Clupeonella
j>ontica Б ер г, Мат. позн. русск. рыбол., II, 3, 1913 : 12. — Caspialosa pontica
Берг, Рыбы пресных вод, 1916 : 24; Исаченко, Тр. Всеукр. Гос. черном.-
.азовск. научн.-промысл, оп. ст., I, 1925 : 104, табл. 1 (Очаков). — Caspialosa pontica
9. ALOSA
283
var. chtamalocephala Исаченко, там же -.110, табл. 2 (дельта Днепра, Оча-
ков). — Caspiolosa pontica var. hypselocephala. Исаченко, там же : 112, табл. 3
(дельта Днепра, Очаков). — Caspialosa pontica var. Исаченко, там же : 119;
табл. 4, 5 (Очаков). — Caspialosa pontica Александров, Тр. Керченск. ихт.
лаб., I, 1 1926 : 20, 30, 47(Керченский прол.; измерения); Малятский, Гидро-
биолог. ж'урн., IX, 1—3, 1930 : 89, фиг. (окраска); Borc.ea, Ann. Sci. Univ. Jassy,
XXII, 1936:332 (берега Румынии, устье Дуная, Днестровский лиман); Майо-
рова, Тр. Научн. рыбохоз. биолог, ст. Грузии, II, 1939, 28 («типичная форма»,
по Исаченко). — Caspialosa pontica eichwaldi Майорова, там же : 29 (восточная
часть Черного м., Керченский прол., Дон у Азова). — Caspialosa kessleri pontica
Световидов, Зоолог, журн., XXII, 4, 1943 : 231; Берг Рыбы пресных вод,
I, 1948 : 124, фиг. 92; Световидов, в: Промысловые рыбы СССР, 1949 : 117.1
Расп р'о стр анение, биология. Kessler, Bull. Soc. Nat. Moscou,
XXIX, 1856 385 (Черное м., Днестр, Буг, Днепр, выше порогов единично до Киева,
Псел); ibid., XXX, 1857 : 475 (Днестр до Ямполя); Путин, к сев. берегу Черного
моря, 1860:9 (Буг до Вознесенска); Данилевский, Исслед. сост. рыбол.
России, VIII 1871:212 (распространение, миграции); Арнольд, Вести,
рыбопр., XI, 2—3, 5—6, 1896 : 65, 262 (Черное м. у берегов Кавказа); Бородин
Азовско-донское рыболовство, Новочерк., 1901 : 45 («тачёк» и «оселедец», ход в Дон);
Касаткин Вести, рыбопр., XIX, 1, 1914 : 35 (Черное м. у Сухуми); Макси-
м о в, Мат. позн. русск. рыбол., Ill, 8, 1914 : 78, 95, 97 (Черное м. у берегов Крыма;
ход); Толстой, Вестн. рыбопр. XXIX, 3—4, 1914:88 (дельта Дуная; ход);
Суворов, там же, XXX, 1, 1915 : 45 (Днепровские пороги; ход); Д р е н с к и,
Спис. Българск. Акад, наук., XXV, 1923 : 72 (Черное м. к северу от Бургаса); П у-
ванов, Рыбн. хоз., II, 1923 : 129 (Черное м. у Ялты); Перепелицы н, Бюлл.
Всеукр. Гос.черном.-азовск. научно-промысл. оп. ст., 13—14, 1924 : 23 (Днепровско-
Бугский лиман; ход); Квинтилианов, там же, 15—16, 1925:42 (дельта
Днепра; ход); Исаченко, там же : 54 (Днепр, выше Каховки; 4 IX малек 26 мм
длиной); Квинтилианов и Попов, там же : 83 (дельта Днепра; ход);
Ш е п т и ц к и й, там же : 85 (дельта Днепра; ход, уловы); Егерман, Тр.
Всеукр. Гос. черном.-азовск. научно-промысл. оп. ст., II, 1, 1926 : 15 (Кучурганский
лиман; единично после нереста); Сыроватский, там же, II, 2, 1927 : 139
(дельта Днепра; ход); Сыроватская, Тр. Гос. ихт. оп. ст., Ill, 1, 1927 : 11
(плодовитость); Сыроватский, там же : 145 (порожистая часть Днепра; ход,
уловы); Шептицкий, Бюлл. Всеукр. Гос. черном.-азовск. научно-промысл.
оп. ст.,’ 19—20, 1927 : 35 (низовья Днепра; ход, уловы); Тихонов, там же : 57
(Азовское м.; ход в море, молодь); Книпович, Тр. Азовско-черноморск. научно-
промысл. эксп?, 2, 1927 : 59 (ход в Дон); Drucker, Сборн. в честь Книповича,
1927 ; 355 (сезонные изменения жирности); Белин г, 36ipH. праць Дшпр. бюлог.
ст., 2, 1927 : 338 (Днепр, до постройки плотины до Александровки); Есипов,
Тр. Керченск. научн. рыбохоз. ст., I, 2—3, 1927 : 212 (Керченский прол.; миграции);
Исаченко, Тр. Гос. ихт. оп. ст., III, 2, 1928 : 9, 11 (порожистая часть Днепра;
плодовитость, уловы); Сыроватский, там же, IV, 2, 1929:157 (Днепр
•от лимана до устья р. Ингульца; ход); Егерман, там же, V, 1, 1929 : 91 (Днепр
от устья р. Ингульца до порога Вильного; ход); Недошивин, Тр; Азовско-
черноморск. научно-промысл. эксп., 4, 1929 : 32 (Дон, единично до ст. Усть-Медве-
дицкой); Телегин, там же : 208 (Таганрогский зал.; ход); Фрейберг,
Сборн. статей эконом, быта Керченск. отд. Общ. изуч. Крыма, I, Керчь, 1929 : 48
(уловы); Тихонов, Тр. Азовско-черноморск. научн. рыбохоз. ст., 5, 1930:3
(уловы); Сальников, там же, 6, 1930 : 53 (Керченский прол.; вылов молоди);
Троицкий, там же : 7 (Дон до пределов б. Воронежск. губ.); 3 а г о р о в-
с к и й, Сборн. вопр. акклиматиз. раст. и жив., 9, Одесса, 1930 : 13 (Березанский
лиман); Малятский, Тр. Новоросс. биолог, ст., 1931 : 5 (Черное м. у берегов
Кавказа; миграции); Д р е н с к и, Свед. земледел., XII, 7—8, 1931 : 72 (Черное м.
между Варной и Месемврией); Сыроватский, Докл. АН СССР, II, з, 1934 :
199 (Черное м. близ Одессы); Майорова, Тр. Научн. рыбохоз. биолог, ст. Гру-
зии, I, 1, 1934 : 28 (оз. Палеостом; единично); Малятский, Рыбн. хоз. СССР,
1934, 5 : 17 (питание зимой у берегов Новороссийска); Е в т ю х и н, там же, 1935,
5 : 28 (Дон; биология); Сыроватская, там же, 1936, 7 : 34 (Азовское м.;
вылов молоди); Аверкиев, Раб. Доно-кубанск. научн. рыбохоз. ст., 4, 1936 :
'221 (дельта Дона; ход в период запрета); Т алии, Учен. зап. Пермск. Гос. унив.,
II, 4, 1936 : 72 (Дон; биология); там же, III, 1, 1937 : 185 (Дон; миграции, нерест);
Вещ е зеро в, Рыбн. хоз., 1937, 7:19 (содержание жира); Тихонов,
1 Выше не упомянуты две статьи, опубликованные в недоступном автору изда-
нии (В о г с е а, С. R. Acad. Sci. Roumanie, I, 1936 : 26—28, 216—217).
284
CLUPEIDAE
там же, 1937, 5 : 18 (ход, уловы); Кротов, Природа, 1937, 3 : 98 (у запад-
ного берега Крыма против Ак-мечети); Пчелина, Тр. Новоросс. биопот.
ст., I, 6, 1937 : 18 (Черное м. у Новороссийска; миграции); Тонких, Раб. Доно-.
кубанск. научн. рыбохоз. ст., 5, 1937 : 8 (разхмножение); там же : 125 (личинка);
М ай с к и й, Тр. Азовско-чсрноморск. научно-исслед. инет. рыбн. хоз. и океаногр.,
11, 1938 : 193, фиг. 6 (распределение молоди в Азовском м.); Вел и к охать к'о.
Зоолог, журн., XVII, 5, 1938 : 835 (северо-западная часть Черного м.; пути
миграций); Сыроватский, Природа, 1939, 5 : 90 (Дон; ход, размножение);
Рыбн. хоз., 1939, 6 : 36 (эффективность икрометания сельди на Дону после соору-
жения Кочетовской плотины); Раб. Доно-кубанск. научн. рыбохоз. ст., 6, 1940’: 3
(Дон; биология); Москвин, Тр. Новоросс. биолог, ст., II, 3, 1940 : 261 (у Ново-
российска); Воробьев, Тр. Азовско-черноморск. научно-исслед. инет. рыбн. хоз.
и океаногр., 12, ч. 1, 1940 : 149 (Сиваш и Утлюкский лиман, с конца июля и в ав-
густе); Майский, тамже, 15, 1951:10, рис. 8 (Азовск. м., летом); 3 а м а х а о в,
Тр. Всесоюзн. Гидробиолог, общ., I, 1949 : 146 (соотношение длины чешуи и тела).
Рис. 48. 1-я жаберная дуга Alosa kessleri
pontica. Длина тела 247 мм.
дается вперед или короче верхней,
нем конце снизу. Голова узкая,
D (III) IV 12—16 (13.5), общим числом 16—20 (17.5), А III 16—
20(17.6), общим числом 19—23 (20.6), sp. br. 47—69 (56.5), у азовских
больше, чем у черноморских,.
vert. 3. 50—52 (50.97), caud. vert.
32—35 (33.53). Жаберные тычинки
довольно тонкие, не особенно длин-
ные, обычно короче или равны,
реже слегка длиннее жаберных
лепестков, обычно с боковыми
шипиками и не обломанные или
обломаны единичные из них, концы
их образуют слегка изогнутую ли-
нию. Зубы хорошо развитые, всегда
ясно заметные на ощупь на обеих
челюстях. Челюсти одинаковой
длины, реже нижняя слегка вы-
обычно с бугорком на перед-
довольно длинная, невысокая,
межглазничный промежуток 14.4—22.9 (16.6)% длины головы, длина
головы 21.9—26.5 (24.1)%, высота головы 15.7—19.6 (17.6)% длины
тела. Глаза сравнительно небольшие, 18.9—23.6 (21.3)% длины
головы. Грудные плавники 13.5—18.1 (15.3)% длины тела. Тело удлинен-
ное, наибольшая высота его 22.0—27.5 (23.9)% длины. Спина и верхняя
ча,стъ головы зеленовато-синие, бока серебристо-белые с розоватым от-
тенком. С каждой стороны за жаберной крышкой по темному пятну,
обычно слабо выраженному, иногда незаметному, изредка на боках тела
за ним ряд из нескольких более светлых пятен. Длина в Дону до 30,
наичаще 14—18 см, в Днепре до 39 см, мелкая форма до 20—21 см, круп-
ная форма в половозрелом состоянии от 20 см. Описание дано по 101 экз.
длиной от 12.3 до 29.4, в среднем 20.1 см, собранным 26—27 IV
(крупная форма) и 15 VI (мелкая форма) 1940 в Таганрогском зал.-
перед устьем Дона против хут. Морской Чулек. По данным А. А. Михай-
ловской, жаберных тычинок у крупной формы 48—76 (60.0), у мелкой —
47—65 (54.8); позвонков у крупной формы 49—52(54) (50.9), у мелкой
формы — 48—53 (51.0).
Проходная форма.
Распадается на две формы, крупную и мелкую, морфологически,
кроме размеров, мало различимых, но существенно отличающихся био-
логически. Крупная форма растет быстрее, более холодолюбива, на нерест
в реки идет значительно раньше и, повидимому, выше, чем мелкая . (по-
9. ALOS 4
дробнее об этом см. ниже). Ниже приведены признаки, в которых обна-
ружены некоторые различия между обеими формами:
.Количество
( жаберных тычинок.............
( лучей в А....................
Мелкая
47—63 (54.5)
15—20 (17.5)
Крупная
47—69 (58.6)
16—20 (17.7)
В о/о длины тела:
Л— {BST.TT.::::::::
Высота головы....................
В о/о длины головы:
Диаметр глаза....................
Межглазпичный промежуток.........
Длина тела (см)..................
14.0—18.1 (15.9)
23.9—26.5 (25.3)
17.2—19.6(18.3)
13.5—15.5 (14.7.)
21.9—24.9 (23.0)
15.7—18.9 (17.0)
20.2—23.6 (22.1)
14.1—17.6(15.8)
12.3—18.6(15.7)
18.9—22.3 (20.5)
15.5—19.1 (17.4)
19.7—29.4 (24.4)
Различия между обеими формами незначительны и имеются притом
н признаках, изменяющихся с возрастом и размерами рыб. Степень раз-
личия между крупной и мелкой формами A. kessleri pontica приблизи-
тельно такая же, как и между черноморско-азовскими подвидами
A. caspia. Однако последние, кроме систематических различий, об-
особлены и географически; все это вместе взятое дает возможность отли-
чать и, следовательно, рассматривать их как особые систематические
формы. У крупной же и мелкой форм A. kessleri pontica при незначитель-
ных отличиях географической обособленности нет, и различать их прак-
тически почти невозможно. Поэтому наиболее правильно считать их
более низкими, чем подвиды, формами (nationes) — мелкую и крупную,
не давая им особых латинских названий. Относительно мест и времени
икрометания мелкой и крупной форм в Дону достоверных сведений нет,
но можно долагать, что крупная форма, заходя в реку раньше, поды-
мается выше по течению, составляя, возможно, основную массу сельди,
заходящей по Дону выше Кочетовской плотины. Однако в силу меньшей
степени биологических отличий, чем между черноспинкой и волжской
сельдью, помеси между обеими формами несомненно более обычное явле-
ние, чем между упомянутыми каспийскими формами вида. Известно,
например, что крупная сельдь во второй половине июля, когда ход ее
в низовьях Дона уже заканчивается, после нереста выше Кочетовской
плотины выметывает остатки икры и ниже плотины. Кроме того, значи-
тельная часть крупной сельди ловится ниже плотины после ее закрытия,
точно так же как и мелкая сельдь выше плотины. Благодаря меньшей
степени различий между обеими формами помеси между ними не раз-
личаются. В прежние годы, до постройки плотины, в Днепре выше поро-
гов шла, повидимому, только крупная сельдь (Суворов, 1915). Майорова
(1939) считает сельдей, связанных с Азовским морем и восточной полови-
ной Черного моря и нерестующйх в Дону, и сельдей северо-западной
части Черного моря, нерестующих в Днепре, Днестре и Дунае, особыми
подвидами. У сельди донской, исследованной А. А. Майоровой, рыло не-
сколько короче, чем у сельди днепровской, исследованной В. Л. Исаченко.
В остальных признаках существенных различий между этими сельдями
не обнаружено и нами при сравнении сельдей, собранных в устье Дона,
с сельдями, собранными главным образом в Дунае и отчасти в Днепре.
Ниже приведены признаки, по которым обнаружены некоторые раз-
личия между сельдями из этих мест:
286
CLUPEIDAE
Устье Дона
Дунай, Днепр
мелкая
Количество жабер-
ных тычинок . . 47—63 (54.5)
В % длины тела:
Наибольшая высота
тела............. 22.3—27.5 (23.9)
Длина головы . . . 23.9—26.5 (25.3)
В о/о длины головы:
крупная
47—69 (58.6)
обе вместе
47—69 (56.5)
47—69 (52.5)
22.0—26.1 (23.9)
21.9—24.9 (23.0)
22.0—27.5 (23.9)
21.9—26.5 (24.1)
19.7—27.3 (22.7)
21.2—26.2 (24.0)
Диаметр глаза .
Межглазничный
промежуток . .
Длина рыла . . .
Длина тела (см) .
. 20.2—23.6(22.1)
. 14.1—17.6 (15.8)
. 24.1—28.2 (26.3)
. 12.3—18.6 (15.7)
18.9—22.3(20.5)
15.5—19.1 (17.4)
24.2—27.5 (26.2)
19.7—29.4 (24.4)
18.9—23.6 (21.3)
14.4—22.9 (16.6)
24.1—28.2 (26.2)
12.3—29.4 (20.1)
18.5—23.8 (20.8)
14.4—22.9(17.5)
25.6—29.5 (27.5)
16.9—32.4 (22.7)
Различия, как видно из приведенных данных, не велики, меньшие,
чем Между крупной и мелкой формами, и большинство признаков в зна-
чительной степени зависит от размеров рыб. Наиболее существенны
различия в количестве жаберных тычинок и в длине рыла, но и по этим
признакам обе группы сельдей различать нельзя. Поэтому, принимая
во внимание географическую обособленность этих сельдей, их следует
рассматривать как два обособленных стада, не давая особых латинских
наименований. При этом сельди северо-западной части Черного моря,
возможно, распадаются в свою очередь на два стада — днепровское и
дунайское. Учитывая большую степень различий между крупной и мел-
кой формами A. kessleri pontica, чем между сельдями Азовского моря и
северо-западной части Черного, несмотря даже на их географическую
обособленность, отличиям между первыми следует придавать большее
значение, чем между последними, т. е. первых, как указывалось, счи-
тать за nationes, вторых — лишь за. стада. Большее значение разделению
A. kessleri pontica на мелкую и крупную формы следует придавать, учи-
тывая также направление их изменчивости и сходство с более обособлен-
ными каспийскими подвидами — мелкой формы с A. kessleri aolgensis,
крупной — с A. kessleri kessleri (подробнее об этом см. стр. 65).
Нижний предел колебаний жаберных тычинок до сих пор принимался
за 40 (см. Берг, 1932, 1948), однако, по исследованиям А. А. Михайлов-
ской, у экземпляров из Дона жаберных тычинок меньше 47 не бывает.
По нашим материалам, собранным в дельте Дона в самом начале хода
(см. выше), у крупной формы жаберных тычинок также не бывает меньше 47.
Очевидно, предыдущими исследователями, имевшими дело с сельдями,
собранными главным образом в море или в предустьевых пространствах
рек, за эту сельдь частично принимались экземпляры A. brashnikovi
maeotica. Необоснованность выделения различных вариететов этой формы
(var. russac, var. nigrescens, var. danubii, var. chtamalocephala, var. hyp-
selocephala') достаточно убедительно доказана Майоровой (1939).
Распространение. Черное и Азовское моря, откуда входит
в реки. В Черном море держится зимой против берегов Кавказа, Бол-
гарии, Румынии, Крыма и в северо-западной части его, единично известна
по анатолийскому побережью,1 в оз. Палиастоми. В Азовском море встре-
1 В коллекциях Зоологического института Академии Наук СССР есть 16 экзем-
пляров этой формы, пойманных в сентябре 1912 г. у Синопа (№ 21046). Длина их
от 18.8 до 26.7, в среднем 23.0 см, жаберных тычинок от 45 до 56, в среднем 50.2.
9. ALOSA
287
чается в летнее время, преимущественно в восточной половине, заходит
в Сиваш и в Утлгокский лиман. Для нереста заходит в Дон, где раньше-
подымалась до Усть-Медведицкой (900 км от устья) и даже выше (в пре-
делы прежней Воронежской губ.), в Кальмиус, в Днепр в настоящее-
время до плотины (раньше подымалась выше порогов и единично до
Киева), заходит в его приток Ингулец, в Буг до Вознесенска и выше,
в Днестр до Ямполя, в дельту Дуная до Браилова, единично и выше — до-
Журжева (около 500 км от устья). В притоки Дона — Аксай и Маныч,
а также в Сев. Донец не заходит. В Дону икрометание от устья до Коче-
товской плотины (170 км от устья) и выше ее — до ст. Цимлянской (330 км
от устья) и г. Калача (567 км от устья), в основном между ст. Багаевской
(110 км от устья) и ст. Мелеховской (135 км от устья). В Днепре в настоя-
щее время нерестится ниже плотины, в прежнее время метала икру выше-
порогов.1
Биология. Икрометание с середины мая по середину августа.
Зимует в Черном море, главным образом против берегов Кавказа, у бере-
гов Болгарии и Румынии и в северо-западной части его. Против берегов
Крыма ловится в меньшем количестве, из Азовского моря, насколько
и&вестно, отходит до Феодосии, из Днепра и других рек северо-запад-
ной части Черного моря — до Севастополя,1 2 но в небольшом количестве-
ловится и у Ялты, причем у южных берегов Крыма держится в глубин-
ных слоях (Пузанов, 1923; Малятский, 1931). Зимой держится, повиди-
мому, в области постоянного течения, но временами подходит и к бере-
гам Кавказа, Румынии и заходит в бухты (например Анапскую, Ново-
российскую, Пицундскую и Сухумскую), в галистатической области,
насколько известно, отсутствует. Крупная форма вместе с A. brashni-
kovi maeotica проводит зиму в самых северных частях Черного моря,
в восточной половине его ловится против Анапы, Новороссийска,
а в теплые зимы и перед самым входом в Керченский прол., заходя вре-
менами, в прежние годы, в струе теплого течения при температуре воды
не ниже 4-—5° в самую южную часть пролива; при понижении темпе-
ратуры (до 4° и ниже) сельдь оттуда отходит. В западной половине Чер-
ного моря крупная сельдь, судя по всему, держится в северо-западной
части его, например, однажды была поймана против Одессы (9 февраля
1932 г. в 30—40 км от Б. Фонтана, 3 экземпляра, на глубине 29 м при
придонной температуре воды 3.7°), неоднократно ловилась у западного
берега Крыма против Ак-мечети (в декабре 1935 г. и в начале 1936 г.),
отмечается и южнее — у берегов Румынии (в марте, длина 32 и 34.2 см).
Более теплолюбивая мелкая форма зимует частично совместно с круп-
ной (против Новороссийска временами составляет до 64% улова даже
в январе), но в основном значительно южнее и, возможно, на значи-
тельно большем удалении от берегов. При весенних миграциях раньше
идет крупная форма, появляющаяся во всех частях Керченского прол,
совместно с A. brashnikovi maeotica в первой половине марта при темпе-
ратуре воды около 4—5° и выше, составляя в марте—начале апреля от
11 до 36% улова (1936 г., по исследованиям А. А. Михайловской).
В конце апреля—начале мая крупная форма ловится уже единичными
1 Относительно нахождения экземпляра «.Clupea pontica» (Moreau, Hist. nat.
poiss. France, Suppl., 1891 : 75—78) у берегов южной Франции (у Сетта) см. у Берга
(1948 : 113).
2 В коллекциях Зоологического института Академии Наук СССР есть 3 экзем-
пляра длиной 20.7, 24.6 и 25.5 см, пойманных 24 января 1909 г. против Севастополя
(№ 16373).
288
CLUPEIDAE
экземплярами, и в середине мая ход ее здесь прекращается. Мелкая
форма, в соответствии с пребыванием ее в более южных районах Черного
моря, миграции на север начинает несколько позднее, у Новороссийска
составляет основную массу улова (до 94%) в апреле—мае. Первые
экземпляры ее появляются в Керченском прол, во второй половине марта,
разгар хода в мае. В конце марта—начале апреля 1936 г. она составляла
здесь до 40% улова/в конце апреля—мае до 95%. В конце хода, в июне—
июле, ловится почти исключительно эта форма, причем в это время глав-
ным образом- сельдь еще неполовозрелая, идущая в Азовское море для
питания (по исследованиям А. А. Михайловской). В Керченском прол,
наблюдаются две волны хода. В первой волне, в конце марта—начале
апреля идет преимущественно крупная форма совместно с A. brashni-
kovi maeotica и примесью мелкой формы; во второй волне, более числен-
ной и продолжительной, с конца апреля по июль идет почти исключи-
тельно мелкая форма. В некоторые годы первые косяки, преимущественно
крупная форма, в Керченском прол, проходят необловленными, и тогда
большие уловы сельди в Дону бывают раньше, чем в Керченском прол.
(Тихонов, 1937). В Азовском море на косах Бердянской и Белрсарайской,
по наблюдениям К. Г. Дойникова, в 1930 г. сельдь появилась при 8—9°,
разгар хода на косе Бепосарайской в конце апреля при температуре
воды 13.8°, у Ейска при 15.6°. В западной половине Черного моря у бере-
гов Болгарии к северу от Бургаса, между Месемврией и Варной, в массе
ловится с конца февраля, в марте и апреле (Дренски, 1923). К берегам Ру-
мынии, к'устью Дуная и в Днестровский лиман, подходят в конце марта—
начале апреля при температуре воды около 6°, причем, как и в восточной
половине моря, сперва идет крупная сельдь, затем более мелкая и молодь
предыдущего года вывода (Borcea, 1936); в море у берегов ловится до поло-
ловины мая. У западных берегов Крыма крупная сельдь вначале подходит
к берегам вблизи Хорлов, затем у Кларовки и к Тендровской и Кинбурн-
ской косам (Кротов, 1937). В Днепровско-Бугском лимане появляется в по-
вине февраля и до конца марта ловится единично (Квинтилианов, 1925;
Исаченко, 1925). В Днепр входит главным образом его дельтовыми рука-
вами (реками Рвачом, Бокаем и Конкой), в годы с высоким уровнем —
хорошо и другими рукавами (реками Свинячной, Бугаем, Старым Дне-
пром и Литвинкой). В дельте Днепра обычно появляется в первых числах
апреля—в конце марта и до второй половины апреля ловится единично,
разгар хода в мае, в июне интенсивность хода снижается и в середине
его ход заканчивается, но у Основы единичными экземплярами сельдь
идет почти до середины июля (Исаченко, 1925). Наблюдаются две волны
хода, сельдь первой волны в 1936 г. в дельте шла в первых числах мая
при температуре 18—19°, вторая около 20 мая. В порожистой части
Днепра в прежние годы появлялась во второй половине апреля и шла
здесь разрозненными стаями. Вначале и здесь шла крупная сельдь, раз-
гар хода в 1927 г. наблюдался с 1 по 13 мая, затем снизился и вновь уси-
лился 19 мая, причем после снижения хода, во второй волне его шла уже
менее крупная сельдь, но даже и эта менее крупная сельдь, судя по раз-
мерам (21.9—33.0 см, 40 экз., 23 мая), относится к крупной форме
(Сыроватский, 1927; Егерман, 1929). Места и условия нереста по Днепру
точно не изучены, до постройки плотины у Днепропетровска для икро-
метания подымалась выше порогов, после сооружения плотины мечет
икру ниже нее и, судя по тому, что уловы не снизились, успешно.
В дельте Дуная за период времени с 1902 по 1908 гг. появлялась в первой
половине февраля, массовый ход в конце марта—начале апреля, конец
9. ALOSA
289
МЙЙИйИй ними' mi lit
it середине июня, продолжительность его от 74 до 118 дней. Единичные
экземпляры появляются здесь при температуре воды 4.5—6.5°, массовый
ход при 9—11.5°, конец при 20.5—25.0° (Толстой, 1914). Нерест здесь
происходит в самом Дунае, главным образом в нижнем течении до Браи-
лова, единично заходит и выше, в притоки не заходит. Возможно, что
частично икрометание происходит и в предустьевом пространстве. В Дону
сельдь обычно начинает ловиться в середине апреля, приблизительно
на месяц позднее, чем в Керченском прол., при температуре воды от
7 до 12°, но единично появляется раньше. В реку входит как через глав-
ное гирло Переволочное, так и северными (Мертвый Донец) и южными
(Недошивин, 1929). В Дону, как и в Днепре, в реку лучше входит при
верховых ветрах, усиливающих течение; при низовых ветрах, задер-
живающих течение и иногда даже устанавливающих обратное, ход сельди
замедляется или прекращается (Недошивин, 1929; Квинтилианов и По-
пов, 1925). В начале хода и здесь идет крупная форма (711,2?6 улова
в апреле 1936 г., по данным А. А. Михайловской), ход которой в боль-
шом количестве продолжается и в первой половине мая (до 39%% улова
в том же году) и заканчивается в первой половине июня. Мелкая форма
в небольшом количестве идет вместе с крупной с конца апреля (около
28% улова в 1936 г.), разгар хода в конце мая (96%% улова в том же
году), начало его при температуре от 14 до 16.5°. Ход продолжается
в июне и заканчивается в июле. Как и в Керченском прол., наблюдаются
две волны хода, причем во второй волне, более длительной и численной,
по наблюдениям А. А. Михайловской, идет мелкая форма. В дельте, по
данным К. Г. Дойникова, ход обеих форм продолжается от 90 до 125 дней,
в среднем около 100 дней, в промысловом количестве — около 75—
80 дней. Высота захода вверх по реке в настоящее время зависит от вре-
мени начала хода и от времени закрытия Кочетовской плотины. В 1935 г.,
например, массовый ход сельди за плотину продолжался всего около
7 суток (Тонких, 1937); в 1937 г. несмотря на то, что плотина была за-
крыта на 5 дней раньше (15 мая), сельди выше плотины прошло больше,
так как ход ее начался дней на 15—20 раньше, чем в 1935 г. (Сыроват-
ский, 1939). В обоих случаях установлено, что сельдь выше плотины
метала икру до г. Калача (567 км от устья). Скорость движения в Дону,
повидимому, довольно равномерна, в дельтовом участке в период запрета
(с 7 по 12 мая в 1934 г.) она определяется в 24—48 км в сутки (Аверкиев,
1936); выше по течению, между Кочетовской плотиной (170 км от устья)
и ст. Потемкинской (442 км от устья) — около 33—37 км в сутки (Тон-
ких, 1937). В реке, как Дону, так и в Днепре, ход происходит в светлое
время суток, наиболее интенсивно в первой половине дня, между 7 и
12 час., затем несколько ослабевает и вновь увеличивается к вечеру,
достигая почти таких же размеров, как утром. После заката солнца и до
рассвета ход почти прекращается. В начале хода в Дону резко преобла-
дают самцы (около 65% в 1937 г.), в июле несколько возрастает коли-
чество самок (до 46%% в том же году), в конце хода количество самцов
опять увеличивается (почти до 70% в том же году). Преобладание коли-
чества самцов над количеством самок на протяжении всего хода наблю-
далось за период с 1930 по 1937 г. (Сыроватский, 1940). Соотношение
количества самцов и самок претерпевает изменения и в течение суток,
к вечеру количество самок возрастает. Наибольшее количество самок
ловится между 5 и 7 час. вечера. На нерестилищах ранее появляются
самцы, которые дольше и задерживаются здесь. К концу августа на нере-
стилищах остаются только самцы (Тонких, 1937). В Днепре, наоборот,
19 Фауна СССР — 314
290
CLUPEIDAE
количество самок больше количества самцов, первых около 60%, вторых
около 40% (Сыроватский, 1927). В Азовское море входит в основной
массе с половыми продуктами в III стадии зрелости, единично во II стадии.
В Дон в начале хода, по исследованиям Д. С. Талина, идет с половыми
продуктами в III—IV и IV стадиях зрелости, к концу хода идет более
зрелой, в начале июня и главным образом с V и IV—V стадиями зрелости.
Приблизительно в таких же стадиях зрелости половых продуктов входит
и в Днепр, с III стадией зрелости здесь встречается единично. Неполово-
зрелые в реку не входят, рыбы длиной 10—12 см зрелые (Сыроватский,
1927). В Дону икрометание происходит на большом протяжении, начиная
с самых нижних участков дельты (г. Азов) до г. Калача (567 км от устья),
исключительно по руслу реки, ни в притоках (Аксай, Маныч, Сев. Донец),
ни на полоях нереста нет; с июня месяца, судя по степени зрелости по-
ловых продуктов (V и IV—V), повидимому, икрометание частично проис-
ходит и в Таганрогском зал. перед устьями Дона (против д. Круглое
и хут. Морской Чулок; по наблюдениям Д. С. Талина). Икрометание,
по предположению И. Я. Сыроватского, происходит на участке реки
с быстрым течением, так как здесь найдено наибольшее количество только
что выметанных икринок. Кроме того, время нереста совпадает с поло-
водьем. Сооружение Кочетовской плотины существенно на нерест сельди
не повлияло, икрометание и развитие икры происходит нормально
и ниже плотины. Часть сельди, подошедшей к плотине, нерестует под ней,
другие с менее зрелыми половыми продуктами, повидимому, спускаются
несколько ниже, где и выметывают икру (Сыроватский, 1939). Икроме-
тание начинается через 2—3 дня после наступления массового хода,
при температуре воды 17.5—19.4°, разгар нереста со второй половины
мая по вторую половину июня приблизительно при той же температуре.
Нерест наблюдался при температуре до 26° (Тонких, 1937). Икрометание
происходит днем, главным образом во вторую половину, с наибольшей
интенсивностью перед закатом солнца. С наступлением темноты нерест
прекращается, и ночью текучих самок не встречается. Икра выметывается
в течение длительного времени несколькими порциями и, повидимому,
на значительном протяжении реки, последняя порция икры выметывается
уже при скате, а весь период икрометания первых косяков длится, воз-
можно, до 2—2/4 месяцев (Тонких, 1937). Плодовитость у донской сельди,
по данным Д. С. Талина, от 10.1 до 141 тыс., в среднем 49.2 тыс. икринок,
у днепровской сельди несколько меньше, от 13.9 до 63 тыс,, в среднем
34 тыс. икринок (Сыроватская, 1927). Выклевывание личинок при сред-
ней температуре развития икры 19.4—19.6° происходит через 43—72 часа,
при 20.6—21.9° —-через 34—40 час. Икра распределяется во всей толще
воды, однако в придонных слоях ее больше всего. Мальки, как и икра
и личинки, сносятся вниз по течению, но, по мере подрастания, понемногу
задерживаются у прибрежных -мелей и кос и в других местах с затиш-
ным течением. Массовый скат мальков в 1936 г. у ст. Кочетовской начался
с конца июля и происходил до конца августа, после чего начал умень-
шаться. Мальки ловятся исключительно днем, ночью не встречаются.
В дельте Дона появились в то же время, что и у ст. Кочетовской, но мас-
совый скат их продолжался еще в конце сентября. В дельте Дона молодь
расходится по всем рукавам, заходя в ерики, даже в глухие из них, и
в реки, связанные с Доном не верховьем, а устьевой частью, задержи-
вается здесь до ноября, а в некоторые годы (1928, 1929) — даже до сере-
дины этого месяца и уходит при понижении температуры воды до 4°,
причем к концу августа отдельные экземпляры достигали длины до 10 см,
9. ALOSA
291
к n конце сентября средние размеры ее равнялись 7 см (Сыроватский,
1940). Из Таганрогского зал., по наблюдениям К. Г. Дойникова, молодь
уходит в Азовское море в октябре, покидая окончательно его в конце
ноября. В Азовском море молодь этого и предыдущего годов вывода
держится в северо-восточной части его, в основной массе близ Кривой
косы, ловится, главным образом, в июне и июле (Майский, 1938; Сыроват-
ская, 1936), причем годовики в начале августа заходят в Таганрогский
зал. и дельту Дона, где остаются до конца сентября й уходят вместе
с сеголетками. Гибели взрослых после нереста не наблюдается. Отнере-
стившиеся сельди скатываются отдельными экземплярами, летом в море
у берегов не ловятся. В Керченском прол, единично появляется в конце
июля. Мелкая форма уходит из Азовского моря в августе—начале сен-
тября, когда она составляет в Керченском прол, основную массу улова
(до 82% в 1936 г.). Крупная форма начинает единично ловиться с конца
июля, в сентябре идет в значительном количестве (до 1934 % в 1936 г.),
в октябре—ноябре основной ход (до 64% улова в том же году), обуслов-
ливающий второй максимум общего хода (по данным А. А. Михайлов-
ской и В. Н. Тихонова). Ход продолжается и в течение первой половины
декабря и заканчивается при понижении температуры до 4—3° (Еси-
пов, 1927). В связи с тем, что при весенних миграциях сперва идет круп-
ная форма, мелкая же — в конце хода, а при осенних миграциях на места
зимовки наоборот, весной в начале хода и в море и в реке ловится более
крупная рыба, а осенью — мелкая. В летнее время основная масса дер-
жится в Азовском море в Таганрогском заливе и северной части моря
(Майский, 1951). Половозрелой крупная форма, нерестящаяся в Дону,
становится по достижении 4—5 лет (самки), реже 3 (самцы). Основ-
ная возрастная группа нерестовых косяков четырех- и пятигодова-
лые. Самцы мелкой формы достигают половой зрелости изредка по
достижении одного года, в основной массе с 2 лет; самки в основ-
ном с 3, в меньшем количестве с 2 пет, основная возрастная группа
ходовых косяков трехгодовалые. По достижении половой зрелости нерест,
повидимому, происходит ежегодно. Самки обеих форм несколько круп-
нее самцов. Возрастной состав, по данным А. А. Михайловской, в 1936 г.
был таков (в процентах):
Крупная форма Мелкая форма
Возраст.................2 3 4 5 6 1 2 3 4 5 6
[ весна . . — 28.5 49.0 16.9 5.6 1.5 25.0 52.5 20.9 0.3 —
Керчь | лето — 0.8 24.9 61.0 12.9 0.4 —
| осень . . — 10.0 23.8 42.8 23.3 0.3 5.9 41.0 43.8 8.9 0.1
Азов.................... 6.4 28.0 45.0 17.5 3.1 — 10.0 61.0 28.3 0.6 —
„ .. / весна . . — 24.2 47.8 22.9 5.1 0.5 23.2 51.9 23.8 0.5 0.1
Новороссийск < зима _ 20.9 58.6 17.6 2.9 0.1 10.4 54.4 34.4 0.7 0.1
Рост по сравнению с каспийскими проходными сельдями крайне
замедленный. Мелкая форма обладает более медленным ростом, чем круп-
ная (по исследованиям А. А. Михайловской;- см):
Возраст ............. 2 3 4 5 6
Мелкая форма . . . 15.9 17.3 18.8 20.5 —
Крупная » ... 18.4 20.4 22.3 24.8 26.0
Питается преимущественно рыбой (73.3%) и отчасти высшими рако-
образными (9.5%). Из рыб главное значение имеет хамса, в меньшей сте-
пени шпрот, тюлька и некоторые другие. Из ракообразных в желудках
19*
292
CLUPEIDAE
наиболее часто встречаются Upogebia litoralis, Crangon vulgaris, Idothea
baltica, Gammams sp. и др. В зимнее время у Новороссийска существен-
ное значение в питании имеют ракообразные (Москвин, 1940), но в неко-
торые годы интенсивно питается хамсой (Малятский, 1934). Самая жирная
и ценная по вкусовым качествам из всех сельдей рода. Наиболее упитан-
ной и жирной бывает весной в море на пути к местам икрометания, уже
при входе в реку содержание жира резко снижается, наименее упитанной
и жирной бывает летом. Крупная форма содержит более жиров, чем мел-
кая. Осенью в Черном море более упитанной и жирной уходит крупная
форма, которая, отнерестовав ранее мелкой, задерживается в Азовском
море дольше; в Черном море крупная форма нагуливается мало. Мелкая
форма, уходящая из Азовского моря значительно менее упитанной, уси-
ленно нагуливается в Черном море. Количество жира в зависимости от
размеров рыб в разное время года таково (по данным В. Н. Тихонова;
в процентах):
Длина (см) Керчь Дон
Осень Весна Весна
15—17 . . . — 18.82 13.90
18—20 . . . . 13.23 20.91 16.52
21—23 . . . . 19.59 21.77 18.24
24—26 . . . . 21.26 21.78 —
Сельдь более 20 см относится к крупной форме, менее 20 см — пре-
имущественно к мелкой.
Хозяйственное значение имеет большое, составляет
основную массу улова сельди в течение всего года во всех промысловых
районах. Улов в 1936—1938 гг. составлял от 52.3 до 76.9 тыс. ц. Наи-
большее промысловое значение имеет в Дону (25.4—30.4 тыс. ц), Керчен-
ском прол. (14.2—22.8 тыс. ц) и украинских водах северо-западной части
Черного моря (5—6.7 тыс. ц). У берегов Румынии и Болгарии добывается
около 2 тыс. ц. В 1936 г. в Дону, Керченском прол, и у кавказских бере-
гов крупной формы добыто 4.3 тыс. ц (11.5% общего улова сельдей),
мелкой — 28.2 тыс. ц (76.0%). Ловится во время хода весной и осенью.
*6Ь. Alosa kessleri volgensis (Berg) — Волжская, астраханская,
волжская многотычинковая сельдь (табл. XXI).
Alosa caspia (non Eichw.) Яковлев, Тр. Общ. ест. Казанск. унив., I, 2,
1871 : 63—64 (частью: низовья Волги). — Clupea pontica (non Eichw.) Кесслер,
Тр. СПб. общ. ест., V, 1874 : 306 (частью). — Clupea caspia (non Eichw.) Гримм,
Астраханская селедка, СПб., 1887 : 5, 6 («продолговатая разность», № 15926 коллек-
ций Зоологического института Академии Наук СССР, Подовская тоня у Черного
Яра); Арнольд, Тр. Касп. эксп. 1904 г., I, 1907 : 224, фиг. на стр. 225 («про-
долговатая форма», ильмень Чада близ Оранжерейного промысла, май 1904 г., жаб.
тыч. 135—140; рукав Волги Подстенки, 19 V 1904); Суворов, там же : 150—
152, 180—183 («волжский пузанок», №№ 97—119); там же, II, 1908 : 41 (частью);
Бородин, там же : 74—78 («волжская форма»), — Clupeonella caspia volgensis
Берг,1 Мат. позн. русск. рыбол., II, 3, 1913 : 34, табл. V (западное побережье
средней части Каспийского м. близ устья Сулака, Гюргенчай, на широте Буйнака,
Мамед-кала 1 2); Киселевич, там же, III, 6, 1914 : 7, 9, 39 и сл. (биология,
1 Несколько более подробные ссылки на литературу более раннего периода
и некоторые синонимы см. в этой работе.
2 Экземпляры эти не сохранились. За тип следует считать экземпляр длиной
.34.8 см, Волга у Черного Яра (Подовская тоня), доставленный в 1885 г. Гриммом,
№ .15926 коллекций Зоологического института Академии Наук СССР. Экземпляр
этот определен Л. С. Бергом и упомянут при описании.
9. ALOSA
293
измерения). — Caspialosa caspia'volgensis Берг, там же, IV, 6, 1915 : 4. — Clupeo-
nella volgensis Киселевич, там же, IV, 10, 1915 : 119 (ход, нерест). — Caspia-
losa caspia volgensis Берг, Рыбы пресных вод, 1916 : 28, Киселевич, Изв.
Отд. рыбов. и научно-промысл. исслед., I, 1, 1918 : 17, 28; Каспийско-волжские
сельди, I, 1923 : 103, 134 (Волга у Симбирска, Н. Новгорода, Кама выше Перми,1
Урал, у Красноводска). — Caspialosa volgensis Киселевич, Промысловые рыбы
Волго-каспийского района, Астрах., 1926 : 21 (биология); Морозов, Тр. Научн.
ипст. рыбн. хоз., II, 4, 1928 : 47 (биометрическая обработка материалов Киселе-
вича).— Caspialosa caspia volgensis Аверинцев и Сыч, Тр. Астрах, ихт,
лаб., VII, 3, 1930 : 8 (количества позвонков, килевых чешуй, лучей в плавниках);
Световидов, Докл. АН СССР, 1932 ; 203 (количество пилорических придат-
ков). — Caspialosa volgensis Берг, Рыбы пресных вод, I, 1932 : 82. — Caspialosa
volgensis typ. Дехтярева, Тр. Всесоюзн. Научно-исслед. инет, морск. рыбн.
хоз. и океаногр., XIV, 1940 : 47 (описание сеголетков). — Caspialosa kessleri vol-
gensis Световидов, Зоолог, журн., XXII, 4, 1943 : 231. — Caspialosa volgensis
Ч а л и к о в, там же, XXII, 6, 1943 : 352 (сравнение с A. kessleri kessleri)', 3 а м а-
х а е в, там же, XXIII, 2—3, 1944 : 65 (отношение к A. kessleri kessleri). — Caspia-
losa kessleri isp, volgensis Берг, Рыбы пресных вод, I, 1948 : 130, фиг. 94. — Cas-
pialosa kessleri volgensis Световидов, в: Промысловые рыбы СССР, 1949 : 114,
табл. 28.
Распространение, биология. Пельцам, Тр. Общ. ест.
Казанск. унив., XV, 5, 1886 : 14, 16, 24 (биология, нерест); В у к о т и ч, Мат.
позн. русск. рыбол., IV, 6, 1915 : 1 (плодовитость); Тихий, там же ; 38 (у зал.
Кендырли; массовый ход от 26 марта по 7 апреля ст. ст.); Киселевич, Тр.
Астрах, ихт. лаб., V, 1, 1923 : 41 (плодовитость); там же, V, 2, 1922 : 21, 22, 24 (юж-
ная часть Каспийского м.; возрастной состав, рост); там же, VI, 1, 1924 : 68, 70 (воз-
растной состав, темп роста); Булгаков, Бюлл. Средне-азиатск. Гос. унив.,
14, 1926 : 31 (южная часть Каспийского м.); Петров, Изв. Отд. прикл. ихт.,
IV, 2, 1926 : 192 (нижнее течение Урала до Гурьева и несколько выше); Кис е л е-
в и ч, «Наш край», Сталингр., 8, 1927 : 37, карта (ход вдоль восточных берегов);
«Нижнее Поволжье», 1930, 7 : 48 (возрастной состав уловов за ряд лет); Мейс-
нер, Бюлл. Всекасп. научн. рыбохоз. эксп., 1—2, 1932 : 4 (места зимовок, мигра-
ции в море); там же, 5—6, 1932 : 19 (биология); Чугунов, там же, 3—4, 1932 : 7
(распределение миграции в море весной); там же, 5—6, 1932 : 192 (распределение
и миграции в море весной); Леванидов, там же : 52 (содержание жира);
Бадамшин, Тр. I Всекасп. научн. рыбохоз. конф., I, 1936:33 (у берегов:
Мангышлака; атеринка и тюлька в желудках); Строганов, там же.: 70—71
(выживаемость спермы икры и развитие ее); Н. Танасийчук, Первая научн.
конфер. по изуч. сельдевых рыб Каспийск, моря, Астрах., 1937 : 29 (распростране-
ние, миграции, нерест); Керенцева, Учен. зап. Пермск. Гос. унив., Ill, 1,
1937 : 174 (места зимовок, миграции); Киселевич, Сельди северного Каспия,
Сталингр., 1937:16 (биология, хозяйственное значение); Н. Танасийчук,
Рыбн. хоз., 1938, 11 : 33 (ход, нерест в затонах); Перцева, там же, 1938, 7 : 32
(нерест в предустьевом пространстве); Строганов, там же, 1938, 9 ; 31 (искус-
ственное оплодотворение); Учен. зап. Моск. Гос. унив., 33, 1939 : 170 (влияние пони-
женной температуры на развитие икры); там же : 185 (влияние механических факто-
ров на развитие икры); там же : 213 (действие солей тяжелых металлов на развитие
икры); там же : 220 (проницаемость икринок для воды); 3 у с с е р, Зоолог, журн.,
XVIII, 2, 1939 : 243 (ход в дельте Волги); Халдинова, там же, XIX, 5, 1940 :
805 (развитие, строение икринок и личинок); Замахав в, Тр. Всесоюзн. Научно-
исслед. инет, морск. рыбн. хоз. и океаногр., XIV, 1940 : 3 (нерестовые марки);
Казанова и Халдинова, там же : 77 (дельта Волги; икринки); Фран-
цузов, там же, XVI, 1941 : 23 (нерест); Благовидова, там же : 49 (скат
молоди в реке); Смирнов, Изв. Акад, наук Азерб. ССР, 1945, 7 : 71 (миграции);
там же, II, 8, 1946 : 55 (биология); Докл. Акад, наук Азерб. ССР, II, 2, 1946 : 60
(влияние света на нерестовые миграции); Навозов-Лавров, Рыбн. хоз.,
1947, 5 : 31, рис. 3 (распределение зимой); Краснова, Докл. Всесоюзн. Научно-
исслед. инет, морск. рыбн. хоз. и океаногр., 9, 1947 : 13 (нерест в предустьевом про-
странстве Волги); Н. Танасийчук, Тр. Волго-каспийск. научн. рыбохоз. ст.,
X, 1948 : 3 (нерестовые миграции); В. Танасийчук, там же : 83 (мальки,
распределение, питание, размеры, колебание численности); там же : 93 (нерест
в Урале); Романов, Зоолог, журн., XXVIII, 3, 1949 : 253 (суточный ход в Волге);
Монастырский, Тр. Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океа-
ногр., XVIII, 1951 : 12, рис. 4 (оценка запасов и прогноз численности); В. Тан а-
1 О нахождении у Молотова см. подстрочное примечание на стр. 295.
294
CLUPEIDAE
с и й ч у к, там же : 20, рис. 3 (учет молоди); Демидова, там же : 28 (возраст
и темп роста, соотношение количества самцов и самок); Перцева-Остро-
умова, там же : 46, рис. 3, 4 (строение икринок и личинок); Н.Танасийчук,
Промысл, рыбы Волго-Каспия, Пищепромиздат, 1951 : 31, рис. 5 (распространение,
места нереста, миграции, колебание уловов).
D III—IV 13—15 (14.0), общим числом 17—19 (18.0), А III 16—20
(17.8), общим числом 19—23 (20.8), sp. br. 99—155 (125. 1). Жаберные
тычинки тонкие и длинные, обычно длиннее жаберных лепестков, реже
равны им, с хорошо выраженными боковыми шипиками, концы тычинок
обычно не образуют выпуклой дуги и не обломанные, реже у крупных
бывают обломанные, наичаще в средней части дуги. Зубы обычно раз-
виты слабо, менее, чем у черноспинки, иногда почти незаметные на ощупь.
Нижняя челюсть слегка выдается вперед или равна верхней, обычно
с бугорком на конце снизу. Голова довольно большая и широкая, не осо-
бенно высокая, межглазничный промежуток 14.9—19.6 (17.5)% ее длины,
Рис. 49. 1-я жаберная дуга Alosa kessleri
volgensis. Длина тела 348 мм.
высота головы 15.8—18.5(17.4)%
длины тела, длина головы
23.0—25.5 (24.5)% той же
длины. Глаза сравнительно не-
большие, 17.2—21.8 (19.7)%
длины головы. Грудные плав-
ники удлиненные, 14.4—16.5
(15.2)% длины тела. Тело удли-
ненное, не особенно высокое,
наибольшая высота тела 21.4—
26.7 (24.1)% длины его. Жиро-
вых отложений в полости тела
обычно нет. По окраске сходна
с черноспинкой, с тем лишь
отличием, что весной спина
светлее, оливково-зеленая, и
ряда темных пятен на боках
тела нет. Размеры до 40 см и выше, в настоящее время в 39 см длиной
встречается редко, в половозрелом состоянии в реке от 18 см, средние
размеры от 27 до 29 см, средний вес от 250 до 350—400 г. Описание дано
по 50 экз. длиной от 24.4 до 34.8, в среднем 29.3 см. По данным
В. И. Мейснера, жаберных тычинок 90—158 (124.2), позвонков 48—54
(51.9). По данным Н. Танасийчука, жаберных тычинок 87—141 (121.3),
позвонков 50—54 (52.0); пилорических придатков (Световидов, 1932)
30—56 (44.3). По количеству позвонков и биологически одна из самых
изменчивых форм вида.
Проходная форма, размножающаяся в реке и иногда отчасти в пред-
устьевом пространстве.
По указанию Киселевича (1923 : 106), образует две расы, более
крупную и мелкую при одном и том же возрасте. Наличие двух рас
у волжской сельди указывает также Зуссер (1939), называя их запад-
ной и синеморской или восточной. В последние годы никаких подтвер-
ждений наличия этих рас нет.
Распространение. Каспийское море, где встречается почти
повсеместно, в особенности на путях к местам нереста, у обоих берегов
средней и почти по всей северной части моря, за исключением самых
восточных ее районов. В массе заходит в Волгу. Зимой держится в юж-
ной части моря, преимущественно, в юго-восточной ее стороне. Икроме-
9. ALOSA
295
тание в нижнем течении Волги, от дельты до Сталинграда и Камышина,
в основном от Замьян (70 км выше Астрахани) до Сталинграда, в мень-
шем количестве подымается до Горького, единично, возможно, заходит
и выше.1 Нерест происходит и в Ахтубе. В небольшом количестве входит
в Урал, где мечет икру от устья до с. Котельникова (около 300 км от
Гурьева). Частично и не ежегодно мечет икру и перед устьями Волги
и Урала.1 2
Биология. Нерест с половины мая по конец июля—начало ав-
густа. Зимует в южной и отчасти в средней (в ее южной половине) ча-
стях моря; в южной части держится как в восточной, так и в западной
струях гидрологического течения, ранее преобладая в иные годы в юго-
восточном углу в районе Гасан-кули; в последние годы держится раз-
реженно, образуя более высокие концентрации к концу зимовки у запад-
ных берегов. В средней части моря встречается и в самых северных
районах средней части (у Махачкалы в январе 1937 г. на глубине
65—85 м при температуре воды 8.5—8.8°). На север миграции начинает
несколько позднее долгинки, по сравнению с которой значительно более
теплолюбива, в последние годы (1925—1937) весенний ход начинает ра-
нее долгинки — в феврале, в некоторые годы — в январе (Н. Танасий-
чук, 1948). В средней части моря, по наблюдениям в предыдущие годы,
шла у обоих берегов, но в основной массе вдоль восточных (Тихий, 1915;
Киселевич, 1937). В последние годы (1934—1937) у восточных берегов
идет в меньшем количестве (Н. Танасийчук, 1951). Миграции происходят
в отдалении от берегов, вдоль свала, к берегам подходит лишь неболь-
шая часть. В северной части моря появляется почти одновременно с чер-
носпинкой, в восточных районах (у о. Кулалы) — в конце марта—начале
апреля при температуре воды 6—8°, иногда и ниже, наибольшие под-
ходы при 10—13°; в те же сроки появляется и в западных районах (о. Че-
чень, Тюлений), приблизительно при той же температуре воды. Основ-
ная масса вдет восточнее о. Тюленьего по направлению к Средней
Жемчужной банке, скопляясь ежегодно от о. Тюленьего до Средней Жем-
чужной, Чистой и Малой Жемчужной банок, на глубине 5—7 м, откуда
перемещается вдоль зоны свалов предустьевого пространства Волги к во-
стоку. Отдельные косяки идут дальше к востоку, к Уралу, где разгар хода
наступает на 5—6 дней позднее, чем в предустьевом пространстве Волги.
В предустьевое пространство Волги подходит единично в середине апреля,
в массе — в конце апреля. Ход продолжается до середины и даже до конца
июня, но уже обычно в конце мая ловится в ничтожном количестве
(Н. Танасийчук, 1951). Промысловый ход в дельте Волги происходит
значительно позднее, чем у черноспинки, по многолетним наблюдениям
(1924—1937 гг.) И. И. Кузнецовой, между концом апреля и половиной
июня, разгар хода в середине мая, конец —• в начале—середине июня.
Сроки захода в Волгу дней на 10 позднее, чем у черноспинки, ход обычно
менее растянут, икрометание по времени раньше. В западной части
дельты ход обычно начинается несколькими днями раньше, чем в восточ-
ной. Пределы температуры воды, по данным И. И. Кузнецовой за 19 лет
в западной части дельты (Самойловский наблюдательный пункт), таковы:
Начало хода...........от 2.8° (1929 г.) до 9.2° (1935 г.)
Разгар » .........» 8.9° (1927 г.) » 16.4° (1937 г.)
1 Указание Киселевича (1923) о нахождении волжской сельди в Каме выше Моло-
това, как установил Б. С. Лукаш (Тр. Вятск. научно-исслед. инет, краевед., V, 1929 ;
21), ошибочно. Достоверно эта сельдь в Каме не известна.
2 О нересте в море в районе Махачкалы см. примечание на стр. 302.
296
CLUPEIDAE
Усиление хода обычно наблюдается при 12—15° с дальнейшим уси-
лением при повышении температуры воды до 16—17°; при повышении
температуры воды выше 17° интенсивность хода снижается. При нагон-
ных ветрах, поднимающих уровень воды, когда сельдь идет в реку вместе
с более теплой водой предустъевого пространства, или в тихие дни после
сильных ветров условия для захода в реку более благоприятны. Сгонные
ветры, как правило, ход задерживают. Массовый ход в дельту продол-
жается очень короткое время, очень редко до двух недель. В годы с за-
тяжной ветреной весной ход бывает неравномерный, с периодами ослабле-
ния и вновь усиления; в годы со спокойным интенсивным прогреванием
воды ход происходит в очень короткий период, продолжительностью
всего в несколько дней. В некоторые годы наблюдаются несколько, наи-
чаще две волны подхода в дельту, в апреле и в мае, рассматриваемые ранее
(Киселевич, 1937) как подходы двух обособленных косяков — апрель-
ского, так называемого «егорьевского» и майского — «Никольского».
В иные годы наблюдается лишь один подход, например, в 1933—1936 гг.,
не было первого подхода, в 1937 г. — второго. В последние годы эти волны
рассматриваются как обусловленные не подвалами обособленных кося-
ков, а особенностями гидрологического режима, оказывающего влияние
на ход. В начале хода в уловах составляет небольшую примесь к черно-
спинке, с усилением хода количество ее в уловах увеличивается и в раз-
гар хода достигает от 83 до 96% улова. В реке ход происходит в мае и
в первой половине июня, в местах наиболее интенсивного нереста
(с. Никольское—Черный Яр) появляется во второй половине апреля,
первый максимум хода в конце мая, второй — во второй половине июня,
дней на 15—20 позднее, чем в дельте. Скорость движения волжской сельди
в реке указывается различная — от 12—13 км (Гримм, 1887) до 30—
35 км в сутки (Чаликов, 1943). В годы с быстрым прогреванием речной
воды передвигается со скоростью 25—30 км, в годы с холодной весной —
медленнее, 10—15 км в сутки (Н. Танасийчук, 1951). Высота захода вверх
по реке в разные годы неодинакова и зависит, как и у черноспинки, от
количества сельди, идущей на нерест, и от степени вылова в море и
дельте. Мощность хода в море и в реке, так же как й у черноспинки,
испытывает колебания: ход был исключительно хорошим в 1914—1917 гг,
и оставался таковым до 1927 г., хотя уловы и снизились в годы граждан-
ской войны вследствие ослабления интенсивности промысла, с 1928 до
1936 г. наблюдалось уменьшение мощности хода, после чего с 1937 до
1945 г. началось повышение, затем вновь наступил период низких уловов,
продолжавшийся до 1948 г. (Н. Танасийчук, 1951). Подобно черноспинке,
идет стрежневой частью русла, но несколько ближе к берегу. В светлое
время суток идет близко к берегу, ночью ход не прекращается, но сельдь
отходит от берегов дальше и идет стрежневой частью реки вне зоны дей-
ствия неводов; поэтому неводные уловы днем выше, чем ночью. В при-
брежной части реки наиболее интенсивен ход от 8 до 11 час. В начале хода,
при 10—11° идет в придонных слоях воды, при повышении температуры
воды до 15° и выше — в промежуточных и поверхностных (Романов,
1949). В реку входит со вполне зрелыми половыми продуктами, первые
порции икры часто выметываются перед входом в дельту. Нерест проис-
ходит при температуре воды от 12.7 до 24°, разгар — при 15—19°, конец —
при 25—27° (Н. Танасийчук, 1948). В предустьевом пространстве нере-
стятся наиболее зрелые особи, чаще всего в годы с холодной весной,
причем нерест здесь наблюдался при более низких температурах (от
14.7 до 21.5°), чем в реке, и икринки найдены исключительно в пресной
9. ALOSA
29T:
иоде, личинки же — как в пресной, так и в воде с содержанием солей
до 9.47°('оо (Перцева, 1938). Однако в некоторые годы в предустьевом
пространстве нерестует значительное количество (до 40% в 1940 г.).
Икринки в указанном году были найдены на глубине 1—2 м, при темпе-
ратуре воды 13.3—22.0° и солености l^oo (Краснова, 1947). В низовьях
Волги икринки найдены преимущественно в реках дельты, почти отсут-
ствуют в ильменях, в наибольшем количестве найдены в середине и во
второй половине мая, при температуре воды в мае от 13.2 до 16.6°/
в июне — при 17.2—19.1° (Казанова и Халдинова,. 1940). Районы мас-
сового нереста в реке не являются постоянными: в некоторые годы основ-
ная масса выметывает икру ниже Сталинграда с наибольшей интенсив-
ностью икрометания у с. Никольское—Черный Яр (в 1935 г., по наблю-
дениям И. И. Кузнецовой), в другие годы — выше по течению, от'
Замьян до Камышина, с наибольшей интенсивностью с. Никольское—
Сталинград (в 1937 и 1938 гг.; Н. Танасийчук, 1948). Нерест, по указанию
одних авторов (Французов, 1941), происходит на всем течении реки, по
наблюдениям других (Пельцам, 1886; Гримм, 1887; Н. Танасийчук,
1948), — в затонах и в реке в местах с замедленным течением и водово-
ротами. Основная масса сельди мечет икру вечером, между 16 и 22 час.,)
в другое время суток — в значительно меньших размерах, в ночное время
нерест не констатирован (Французов, 1941). Икра выметывается несколь-
кими порциями. Плодовитость, по данным И. И. Кузнецовой, от 100 до
281 тыс. икринок — в среднем 179.4 тыс., средняя рабочая плодовитость-
22.5 тыс. икринок (от 2.5 до 40 тыс. икринок). Период инкубации икри-
нок близок к периоду инкубации у черноспинки, при 19.6—21.5° ли-
чинки выклевываются через 43 час. 50 мин. после оплодотворения (Халди-
нова, 1940). Молодь в реке днем и вечером держится в поверхностных
слоях, ночью отходит на глубину и держится у дна и в толще воды, утром
появляется над свалом в верхних слоях воды (Благовидова, 1941). В пред-
устьевом пространстве Волги молодь появляется в июле, возможно, и-
ранее, к октябрю из северной части моря уходит; на юг идет западной
стороной северной части моря (В. Танасийчук, 1948). Питается главным
образом ракообразными (Copepoda, Mysidae, Сшпасеа, Amphipoda).
Наряду с ракообразными поедает молодь и мелких рыб (тюлька, атеринка,
бычки, в реке случайно сеголетки сазана). В реке питается не только
в период ската, но и во время хода на нерест (Н. Танасийчук, 1948).
Половой зрелости достигает в массе в четырех-трехгодовалом и от-
части в пятигодовалом возрасте, в небольшом количестве — в шести-
и двухгодовалом; основная масса нерестящейся сельди состоит из трех-
и четырехгодовалых, с преобладанием в разные годы то одних, то дру-
гих, но чаще четырехгодовалых; в некоторые годы в значительном и даже
большем количестве встречаются пятигодовалые, в небольшом количе-
стве — шести- и изредка даже семигодовалые. Возрастной состав в дельте
Волги за ряд лет был таков (Монастырский, 1951; в процентах):
Возраст . . . 2 3 4 5 6 7
1933 г. . . . . . . 0.1 21.2 71.7 6.6 0.4 —
1934 г. . . . — 38.6 56.0 5.1 0.3 —
1935 г. . . . — 8.6 83.0 8.3- 0.05 —
1936 г. . . . — 3.2 57.5 38.0 1.3 —
1937 г. . . . . . . 0.1 47.7 38.4 12.8 1.3 —
1938 г. . . . . . . .0.4 18.3 65.5 15.3 0.4 0.1
В 1936 г. было исключительно большое количество пятигодовалых
даже по сравнению с самым большим количеством их за наблюдаемый
298
CLUPEIDAE
период (20.5% в 1919 г.; Киселевич, 1937; Н. Танасийчук, 1948). Зна-
чительные колебания в отдельные годы наблюдаются и в размерах иду-
щей на нерест сельди. В 1935—1936 гг. в дельте Волги преобладали рыбы
размерами 29—33 см (свыше 80%), в 1937 г. преобладали рыбы длиной
25—28 см (57%). Начиная с 1934 по 1937 г. наблюдалось заметное сни-
жение и средних размеров возрастных групп (Н. Танасийчук, 1948).
В начале хода идет более крупная сельдь, к концу хода — более мелкая.
Самцы достигают половой зрелости раньше самок, самки же достигают
большего возраста. В младших возрастных группах (у трехгодовалых)
преобладают самцы, в старших (у четырех- и пятигодовалых) — самки,
двухгодовалые почти исключительно самцы, шести- и семигодовалые —
самки (Демидова, 1951). Гибели после нереста, по наблюдениям в послед-
ние годы, не происходит и во всяком случае массового характера она не
имеет. Вторично на нерест приходит 8—10%, в некоторые годы до 25%
мечущей икру сельди, причем вторично нерестующая сельдь состоит
из трех-, четырех-, пяти- и шестигодовалых, в старших возрастных груп-
пах количество повторно нерестующих сельдей больше: у шестигодова-
лых— до 80%, у трехгодовалых — около 3% (Н. Танасийчук, 1948);
основная масса второй раз на нерест идет на следующий год, иногда через
год, отдельные сельди мечут икру до 4 раз в жизни. По окончании икроме-
тания скат отнерестовавших сельдей происходит начиная с июня, наи-
более же интенсивно — в середине и второй половине июня; часть отне-
рестовавшей сельди ловится в низовьях Волги до октября. Летом и
осенью держится разреженно, не образуя больших скоплений, в откры-
той средней части моря, избегая прибрежной области; в южной части моря
летом, по наблюдениям С. И. Пейсаховой, за небольшими исключениями,
отсутствует. Одногодовалые миграций в северную часть не совершают.
Средние размеры одновозрастных в среднем течении Волги больше,
чем в нижнем. Сельди, заходящие в среднее течение, имеют также
и более быстрый темп роста, что видно из нижеследующего (Демидова,
1951; см):
Места лова Возраст 1.. 12 13 b V 1»
3 11.9 21.2 27.2 —
Камышин 4 5 10.4 9.9 19.1 17.9 26.0 24.3 30.0 28.5 32.5
6 9.3 16.2 21.6 26.7 30.1 38.7
3 11.3 20.1 25.2
Замьявы 4 10.8 18.5 24.3 27.5 — —
5 9.6 17.1 23.2 27.7 30.5 —
Во время миграций на север содержание жира уменьшается с 9.6%
у экземпляров от берегов Азербайджана до 7% у экземпляров из дельты
Волги (Леванидов, 1932).
Хозяйственное значение. Самая многочисленная из
всех форм вида и одна из наиболее важных в промысловом отношении
сельдей Каспийского моря. По размерам улова среди каспийских сель-
дей стоит на втором месте. Уловы в 1936—1939 гг. колебались от 75.8
до 691.7 тыс. ц, составляя 23—29% улова всех сельдей Каспийского
моря. Наибольшее промысловое значение имеет в Волго-каспий-
ском районе, где вылавливается около 40% общего улова этой
сельди по всему морю и 35—40% общего улова сельдей этого района.
Ловится главным образом весной во время миграций к местам не-
реста.
9. ALOSA
299
*6c. Alosa kessleri kessleri (Grimm)—-Черноспинка, бешенка, залом,
полузалом, железница, веселка (табл. XXII, XXIII).
Clupea alosa (non Linne) Pallas, Raise, I, 1771 : 132 (Симбирск); там же,
III, 1776 : 489 (Кама у Сарапула; массовая гибель). —Clupea piltschardus (non Walb.)
var. Pallas, Zoogr. rosso-asiat., Ill, 1811 : 206 (частью: Волга у Камы и Оки). —
Clupea pontica (non Eichw.) Кесслер, Тр. СПб. общ. ест., I, 1870 : 76, 281 (Волга
до Казани и Нижнего, а может быть и выше); Яковлев, Тр. общ. ест. Казанск.
унив., I, 2, 1871 : 63—64 (частью: низовья Волги; жаберных тычинок 68—70)ч— Clupea
pontica (non Eichw.) Кесслер, Тр. СПб. общ. ест., V, 1, 1874 : 306 (частью). —
Clupea kessleri Гримм, Астраханская селедка, СПб., 1887 : 7, 16 (дельта Волги х);
Баженов, Вести, рыбопр., XX, 5, 1905 : 286 (в 1904 г., Волга между Самарой
и Симбирском; некрупные экземпляры, жаберных тычинок 70—75, на верхней че-
люсти есть зубы); там же, XXI, 3, 1906 : 123 (в тех же местах, в конце июня и начале
июля ст. ст. 1905 г., размеры не превышали пузанков); Арнольд. Тр. Касп.
эксп. 1904 г., I, 1907 : 224, фиг. на стр. 225 (ильмень Чада близ Оранжерейного про-
мысла, 18 мая 1904 г.; рукав Волги Подстепки, 19 мая 1904 г.). — Clupea (Alosa)
kessleri Суворов, там же : 152, 184—186 (измерения); там же, II, 1908 : 42, 56,
58, 91 (описание, распространение, Урал выше Уральска). — Clupea kessleri Баже-
нов, Рыбол. в басе. Волги выше Саратова, 7, 1909 : 27 (Волга между Самарой и
Симбирском). — Clupeonella kessleri Берг,1 2 Мат. позн. русск. рыбол., II, 3, 1913 :
29, табл. VI, VII (западное побережье средней части Каспийского м., Волга выше
Н. Новгорода, Кама, Ока, Урал); Киселевич-, там же, III, 6, 1914 : 7, 9 и сл.
(биология, измерения). — Caspialosa kessleri Берг, там же, IV, 6, 1915 : 4; Рыбы
пресных вод, 1916 : 25. — Caspialosa caspia kessleri Киселевич, Изв. Отд.
рыбол. и научно-промысл. исслед., I, 1, 1918 : 17, 28; Каспийско-волжские сельди,
I, 1923 : 98, 134 (у западных и северных берегов Каспийского м. от Апшеронского
п-ова до Мангышлака, Волга до Н. Новгорода, Кама до Перми). — Caspialosa caspia
volgensis (non Berg) Киселевич, там же : 128 (частью: 3 экз. из восточной части
дельты Волги, жаберных тычинок 74—83, «ближе всего примыкали к С. caspia volgen-
sis, хотя отличались вытянутым телом и характером тычинок»), — Caspialosa kessleri
Киселевич, Промысловые рыбы Волго-каспийского района, Астрах., 1926 : 20
(биология); Морозов, Тр. Научн. инет. рыбн. хоз., II, 4, 1928 : 47 (биометри-
ческая обработка материалов Киселевича). — Caspialosa caspia kessleri Аверин-
цев и Сыч, Тр. Астрах, ихт. лаб., VII, 3, 1930 : 7 (количество позвонков, киле-
вых чешуй, лучей в плавниках); Световидов, Докл. АН СССР, 1932 : 203 (коли-
чество пилорических придатков). — Caspialosa kessleri Берг, Рыбы пресных вод,
I, 1932 : 80. — Caspialosa volgensis bergi Н. Танасийчук, Рыбн. хоз., 1938,
11 : 33 (ход, нерест в затонах); Докл. АН СССР, XXVI, 1, 1940 : 103 (Волга до
Куйбышева и, вероятно, выше, р. Урал). — С aspialosa kessleri Дехтярева, Тр. Все-
союзн. Научно-исслед. инет, морск. рыбн. хоз. и океаногр., XIV, 1940 : 47 (описа-
ние сеголетков). — Caspialosa kessleri kessleri Световидов, Зоолог, журн.,
XXII, 4, 1943 : 231. — Caspialosa kessleri bergi Световидов, там же : 231. —
Caspialosa kessleri Ч а л и к о в, там же, XXII, 6, 1943 : 352 (отношение к С. vol-
gensis bergi и С. volgensis imitans); Замахаев, там же, XXIII, 2—3, 1944 : 65
(отношение к С. volgensis bergi и С. volgensis kisselevitshi). — Caspialosa kessleri Берг,
Рыбы пресных вод, I, 1948 : 127. — Caspiolosa kessleri isp. volgensis bergi Берг,
там же : 134. — Caspialosa kessleri kessleri Световидов, в:Промысловые рыбы
СССР, 1949 : 111, табл. 27.
Распространение, биология. Guldenstadt, Reise, II,
1791 : 448 (Ока у Серпухова и Калуги); П е л ь ц а м, Тр. Обил. ест. Казанск. уняв.,
XV, 5, 1886 : 14, 16, 24 (биология, нерест); Диксон, Вести, рыбопр., XVIII,
10, 1903 : 553 (Волга у Усть-Курдюма в 20 в. выше Саратова в 1903 г., в большом
количестве); там же, XX, 5, 1905 : 276 (Волга у Усть-Курдюма; питание); Баже-
нов, там же, XXI, 3, 1906 : 124 (ход в Волге выше Самары в 1905 г., смертность
после нереста в 1903 г.); Бородин, Тр. Касп. эксп. 1904 г., II, 1908 : 65, 118
(мальки, распространение); Баженов, Рыбол. в Волге выше Саратова, 7, 1909 :
28 (ход); Н а в о з о в, Вести, рыбопр., XXVII, 6—7, 1912 : 256 (Урал у Орен-
бурга?); Киселевич, Мат. позн. русск. рыбол., IV, 10, 1915 : 119 (биология,
ход); Тр. Астрах, ихт. лаб., V, 1, 1923 : 44 (плодовитость); там же, V, 2, 1922 : 21, 22
1 Тип при описании не указан, установлен позднее Л. С. Бергом из числа экзем-
пляров О. А. Гримма, № 15925 коллекций Зоологического института Академии Наук
СССР, дельта Волги, Оранжерейный промысел, 1885 г., длина 40.1 см.
2 Более подробные ссылки на некоторые синонимы и литературу более раннего
периода см. в этой работе и цитируемой ниже К. А. Киселевича (1923).
300
CLUPEIDAE
(возрастной состав); Петров, Изв. Отд. прикл. ихт., IV, 2, 1926 : 192 (низовье
р. Урала до Гурьева и несколько выше); Меньшиков, Изв. Биолог, научно-
исслед. инет. Пермск. Гос. унив., VI, 8, 1929 : 383 (Кама у Н.-Курьи, у Перми лови-
лось с 1920 по 1924 г.); Мейснер, Бюлл. Всекасп. научн. рыбохоз. эксп., 1—2,
1932 : 49 (места зимовок и миграции в море); там же, 5—6, 1932 ; 18 (темп роста);
Чугунов, там же, 3—4, 1932 : 7 (распределение и миграции в море в весенне-
летний и осенний периоды); там же, 5—6, 1932 : 191 (распределение и миграции
в море весной); Леванидов, там же, 50 (содержание жира); Бадамшин,
Тр. I Всекасп. научн. рыбохоз. конфер., 1, 1936 : 33 (у берегов Мангышлака; II ста-
дия зрелости); Н. Танасийчук, Первая Научн. конфер. по изуч. сельдевых
рыб Каспийск, моря, Астрах., 1937 : 27 (распространение, миграция, нерест, возраст,
уловы); Киселевич, Сельди северного Каспия, Сталингр., 1937 : 13 (биология,
хозяйственное значение); Тихий, Большая Эмба, II, 1938 : 344 (Урал); Н. Та-
насийчук, Рыбн. хоз., 1938, И : 33 (ход, нерест); Сушкина, Зоолог, журн.,
XVIII, 2, 1939 : 221; Тр. Всесоюзн. Научно-исслед. инет, морск. рыбн. хоз. и океа-
ногр., XIV, 1940 : 171 (питание личинок и сеголетков); Замахаев, там же : 17
(нерестовые марки); Сомова, там же : 149 (развитие и строение личинок и икри-
нок); Клыков, Изв. АН СССР, сер. биолог., 1940, 5 : 717 (ход, нерест); Фран-
цузов, Тр. Всесоюзп. Научно-исслед. инет, морск. рыбн. хоз. и океаногр., XVI,
1941 : 23 (нерест); Благовидова, там же : 49 (скат молоди в реке); Суш-
кина, Изв. АН СССР, сер. биолог., 1942, 5 : 5 (питание личинок и сеголетков);
Недошивин, Учен. зап. Казанск. Гос. унив., 102, 1942 : 119 (Волга у Тетюшей,
Камского устья, Свияжска и Васильсурска; Кама у Чистополя, Елабуги и Сарапула;
биология); Екатерининская и Изосимов, Тр. Общ. ест. Казанск.
Гос. унив., БУШ, 1—2, 1945 : 37 (Волга; питание после нереста); Штейнфельд,
там же : 75 (Волга; ход, нерест); Остроумов, Тр. Волго-каспийск. научн.
рыбохоз. ст., IX, 1, 1947 : 90 (питание); В. Танасийчук, там же, X, 1948 : 93
(нерест в Урале); Дрягин и Муратова, Тр. Татарок, отд. Всесоюзн. На-
учно-исслед. инет, озерн. и речи. рыбн. хоз., 3, 1948 : 96 (Волга у Чебоксар); Рома-
нов, Зоолог, журн., XXVIII, 3, 1949 : 257 (суточный ход в Волге); Замахаев,
Тр. Всесоюзн. Гидробиолог, общ., I, 1949 : 146 (изучение роста и строения чешуи);
Н. Танасийчук, Промысл, рыбы Волго-Каспия, Пищепромиздат, 1951 : 29
(распространение, места нереста, миграции), 38 («сельдь Берга», нерестовый ход).
D III—IV 12—16 (14.2), общим числом 16—20 (18.2), А III 16—20
(18.1), общим числом 19—23 (21.1), sp. br. 59—92 (72.4), vert. S. 47—50
(48.91), caud. vert. 31—33 (32.45). Жаберные тычинки у крупных толстые
и грубые, часть их обычно обломанная на концах или иногда даже у са-
мого основания, короче жаберных лепестков, реже длиннее их и не об-
ломанные, некоторые из тычинок искривленные, у некоторых рыб тычинки
имеют боковые шипики, у более крупных обычно исчезающие; у мелких,
рыб тычинки довольно тонкие, не особенно длинные, короче или длиннее’
жаберных лепестков, обычно с хорошо выраженными боковыми шипи-
ками, особенно в средней части дуги; концы тычинок образуют почти
прямую линию, не обломанные, некоторые из них с булавовидными утол-
щениями. Зубы развиты довольно хорошо, почти всегда более ил:и менее
заметные на ощупь. Челюсти одинаковой длины или нижняя слегка вы-
дается вперед, с бугорком на переднем конце снизу. Голова наиболее
широкая из всех форм вида, высокая, межглазничный промежуток 18.4—
23.0 (20.3)% длины ее, высота головы 14.9—18.0 (16.5)% длины тела,
длина головы 21.7—25.0 (23.1)% той же длины. Глаза небольшие, 15.1—
20.4 (18.0)% длины головы. Грудные плавники короткие, 13.7—15.9
(14.9)% длины тела. Тело высокое, наибольшая высота его 20.3—28.0
(23.9)% длины его. В нерестовый период в море и в нижнем течении
Волги характерна слабой степенью зрелости половых продуктов (обычно.
III стадия). Помимо обильных жировых отложений в спинной мускула-
туре в области спинного плавника имеет’ много жировых отложений
и в полости тела. Окраска интенсивно темная. Спина темная, почти чер-
ная, весной темнофиолетовая, голова сверху и грудные плавники темные,
почти черные, в особенности на конце рыла и у основания грудных плав-
9. ALOSA
301
пиков. За жаберной крышкой сверху с каждой стороны обычно по темному
пятну, часто неясно выраженному, на боках тела изредка по ряду таких
же пятен. На местах нереста спина и бока становятся серыми или зеле-
новато-серыми, на боках и на жаберных крышках появляются желто-
бронзовые пятна. Самая крупная из всех форм вида и вообще из всех
сельдей рода. Длина до 52 см, в половозрелом состоянии во время хода от
32 см, основная масса от 36 до 44 см. Описание дано по 50 экз. длиной
от 30.5 до 44.9, в среднем 40.0 см. По данным В. И. Мейснера, жаберных
тычинок 57—93 (71.9), позвонков 50—54 (52.6); у мелких экземпляров
(Л. kessleri bergi), по данным Н. П. Танасийчука, жаберных тычинок 63—
95 (78.2), позвонков 51—54 (52.3); пилорических придатков (Световидов,
1932) 36—62 (48.2).
Проходная форма.
Систематическое положение мелкой проходной сельди, описанной
как С. volgensis bergi Tanass., крайне запутано. Принятая при описании
как подвид волжской сельди, эта форма по ряду основных признаков
(количеств^ жаберных тычинок, жировые отложения в полости тела)
ближе к черноспинке и поэтому рассматривалась (Световидов, 1943)
в качестве формы последней. В дальнейшем эта сельдь признавалась за
«морфо-физиологическую популяцию» черноспинки, выделяемую послед-
ней под влиянием изменяющихся условий каспийского бассейна (Чали-
ков, 1943), или за ее возрастную группировку (Замахаев, 1944). Отли-
чия между этими сельдями таковы:1
Длина тела (см).....................
tj, . Г в D.............
Количество лучей у (> ^
Количество жаберных тычинок . . . .
30.5—44.9 (40.0)
12—16 (14.2)
16—20 (18.1)
59—92 (72.4)
20.0—28.3 (22.7)
12—15 (14.1)
16—20 (17.4)
63—87 (78.1)
В % длины тела:
Длина грудного плавника...............13.7—15.9(14.9)
Наибольшая высота тела............. . 20.3—28.0 (23.9)
Длина головы.......................... 21.7—25.0(23.1)
Высота » .......................14.9—18.0 (16.5)
В % длины головы:
Межглазничный промежуток ..... 18.4—23.0(20.7)
Диаметр глаза.........................15.1—20.4 (18.0)
Число рыб......................• . . . 50
13.7—15.6(14.6)
18.2—23.7 (20.3)
23.0—25.4 (23.9)
15.5—17.4 (16.3)
15.7—18.2 (17.0)
18.9—24.8(22.2)
43
Большинство этих различий (наибольшая высота тела, длина головы,
диаметр глаза, отчасти межглазничный промежуток, повидимому, коли-
чество жаберных тычинок, обломанных у крупных) обусловлено возраст-
ной изменчивостью. Однако количество лучей в анальном плавнике воз-
растной изменчивости не подвержено. Таким образом, наиболее правильно
считать эту сельдь особой группировкой (возможно natio), стоящей на на-
чальной стадии формообразования (см. об этом еще на стр. 6о): В пользу
этого говорят и некоторые биологические особенности мелкой сельди.
Распространение. Каспийское море. Наиболее широко рас-
пространенная форма проходных сельдей. В море, в особенности весной,
встречается повсеместно, за исключением самых восточных районов север-
ной части его (Мертвый Култук), зимует в южной части против берегов
Ирана. Наиболее обычна и многочисленна весной на пути к местам нереста
у западных и отчасти восточных берегов средней и в северной части моря,
1 Данные для крупной сельди приведены по экземплярам, использованным выше
для диагноза.
302
CLUPEIDAE
в предустьевом пространстве и в Волге, куда подымается высоко, в массе
иногда до Саратова, в меньшем количестве до Куйбышева, единично
заходит до Горького, в Каму выше Молотова, в Вятку, Оку до Серпу-
хова и Калуги. Входит в Урал, но в небольшом количестве, как в нижнее
течение,1 так и выше Гурьева, до Котельникова. Нерест1 2 в Волге в ос-
новном от Сталинграда до ТетюШей (устье Камы) и по Каме до Чистополя,
единичные особи нерестятся начиная от с. Никольского (240 км от
Астрахани).
Биология. Икрометание с середины мая по август, разгар —
со второй половины июня до середины июля. Зимой в разреженном состоя'-
нии держится в южной половине средней и почти на всем пространстве
южной части моря, в средней части преимущественно в восточной струе
гидрологического течения, в южной — как в западной, так и в восточной
половине моря (в западной несколько больше), единично и вне течения.
Точных данных о распределении ее в море нет. В марте—апреле проис-
ходит передвижение на север, причем в средней части моря идет в основ-
ной массе вдоль западных берегов, в открытых частях моря, частично
подходя в сферу действия неводов. Судя по срокам хода, наиболее холо-
долюбивая из всех форм вида. В северной части моря первые экземпляры
вместе с единичными волжской сельди появляются вслед за долгинкой,
в начале апреля, при температуре воды 6—8° и даже 5° и ниже, посте-
пенно распространяясь к северо-западу от о. Тюленьего, к Лаганской
яме и к северо-востоку от нее, вдоль свалов предустьевого пространства
Волги. У восточных берегов в северную часть моря подходила с морской
стороны о. Кулалы, направляясь далее на северо-восток к Жилой Косе
и далее к дельте Волги (Киселевич, 1915). По наблюдениям в последние
годы, миграции на север происходят только вдоль западных берегов. Массо-
вый ход крупных в дельту Волги начинается в конце апреля—начале мая
при температуре воды приблизительно около 9°, разгар — при 12—15°
и конец — приблизительно при 22°; единично заходит при более низкой
температуре ранее — в начале—середине апреля; мелкие идут позд-
нее, в конце мая. Главная масса идет западной частью дельты. С началом
промыслового хода волжской сельди интенсивность хода черноспинки
резко снижается. В середине—второй половине мая в некоторые годы
наблюдается небольшое усиление хода, в июне нередко опять наблю-
дается усиление хода, но еще более слабое. В дельте ход продолжается
2—2% месяца. В среднем течении Волги появляется во второй половине
апреля—начале мая, у Саратова, по наблюдениям за ряд лет (с 1919
по 1937 г.), первые экземпляры ловятся между 12 мая и 7 июня при тем-
пературе от 9.5 до 18.5°, массовый ход начинается между 9 и 25 июня
при температуре от 17 до 26° (Клыков, 1940). Путь от дельты до Камы-
шина преодолевает в 20 дней, от Камышина до Вольска — в 11 дней,
1 Бородин (1908 : 91) и Суворов (1908 : 56) указывают, что «по р. Уралу черно-
спинка поднимается выше г. Уральска в довольно значительном (но не промы-
словом) количестве», выметывая здесь и икру. Единично и не каждый год какая-то
сельдь доходит до Оренбурга (Навозов, 1912 : 256). Киселевич в одной статье
(1923 : 103) относительно нереста черноспинки в Урале высказывает сомнения,
а в другой (1937 : 13) указывает, что черноспинка в Урал не входит. Однако,
по устному сообщению В. В. Петрова, среди упомянутых им из низовьев Урала сель-
дей (1926), несомненно, была черноспинка. Указывает ее здесь и В. Танасийчук
(1948 : 93).
2 Д. Демин (Рыбн. хоз. СССР, 1936, 12 : 26) указывает на нерест черноспинки
и волжской сельди в начале июня 1936 г. в море в районе Махачкалы. Это указание,
однако, требует проверки и более тщательных наблюдений.
9. ALOSA
30»
т. e. на первом отрезке пути
идет со средней скоростью 32 км,
на втором — 35 км. В районе Пе-
черское — Куйбы ш ев—Тет ю ш и
идет с максимальной скоро-
стью 60—70 км в сутки (Клы-
ков, 1940). Высота захода вверх
по реке зависит от массовости
хода и от степени вылова в
море и дельте. Массовость по-
явления в Волге испытывает из
года в год колебания. Особенно
массовый ход наблюдался в
1903 г. (Диксон, 1903), после
чего произошло опять уменьше-
ние. С 1932 г. наблюдается
уменьшение мощности хода; в
последние годы имеет место
некоторое усиление хода. Круп-
ные идут стрежневой частью
русла, а не около берега,
днем несколько приближаются
к берегам, в темное время су-
ток от берегов отходят и идут
не у поверхности воды, а в
средних и даже придонных сло-
ях; мелкие идут преимущест-
венно вблизи берегов, а не
серединой реки, где течение
сильнее, в массе выпрыгивая из
воды (Романов', 1949; Н. Тана-
сийчук, 1951). До середины или
конца мая в районе Камышина
идет исключительно черно-
спинка, позднее к ней обыч-
но примешивается волжская
сельдь, в 1935 г. уже 24 мая
она составляла 10% улова (Клы-
ков, 1940). В начале хода пре-
обладают самцы, в июне пре-
обладают самки, в целом же за
весь период хода число самок
приблизительно равно числу
самцов (Н. Танасийчук, 1938),
что наблюдается и в Волге
(у Тетюшей), при этом, чем
выше по течению реки, тем
крупнее сельдь (Штейнфельд,
1945). В отличие от других
проходных форм в Волгу входит
с незрелыми половыми продук-
тами (III стадия), в нижнем те-
чении (до с. Никольского—Ста-
Рис. 50. 1-я жаберная дуга Alosa kessleri-
kessleri.
1 — длина тела 214 мм; 2 — длина тела 215 мм;:
3 — длина тела 401 мм; 4 — длина тела 360 мм.
30'4
CLUPEIDAE
линграда) с текучей икрой и молоками не встречается. Нерест про-
исходит при температуре 15—23°, в среднем при 18°, на значительном
протяжении Волги, повидимому, как и у волжской сельди не только
в местах с замедленным течением, где образуются водовороты и встреч-
ные течения, а также и на стрежне и у мелководного песчаного берега,
на всем протяжении реки. Нерест мелких наблюдается (в 1938 г.) и
в замкнутых, отшнуровавшихся после спада воды затонах. Икрометание
в основном происходит вечером, между 16 и 22 час, в другое время зна-
чительно менее интенсивно; в ночное время нерест не отмечен (Францу-
зов, 1941). Икра созревает и выметывается несколькими, возможно,
многими порциями. Плодовитость 135—312, в среднем 218 тыс. икринок
(Киселевич, 1923). Выклевывание личинок при средней температуре
19.6° происходит через 49 час., при 20.4° — через 42 часа (Сомова, 1940).
В реке молодь, как и у волжской сельди, днем и вечером держится
в поверхностных слоях, ночью отходит на глубины и держится у дна
и в толще воды, утром появляется в поверхностных слоях воды над сва-
лом. Молодь в реке проводит 1 % —2 месяца, скатывается двумя волнами —
в августе и сентябре. Не исключена возможность перезимования еди-
ничных экземпляров молоди в реке (18 июля 1939 г. в районе В. Ле-
бяжьего, 2 годовика; Благовидова, 1941). В нижнем течении Волги
молодь появляется в середине июля, наиболее интенсивно скат проис-
ходит в августе и продолжается до октября включительно; в предустье-
вом пространстве появляется в августе, в сентябре встречается в наи-
большем количестве, в ноябре из пределов северной части моря уходит
(Н. Танасийчук, 1951). Основная масса молоди, по наблюдениям В. С.
Танасийчук, в среднюю часть скатывается вдоль западных берегов. Жир-
ная и упитанная при входе в реку, по окончании икрометания сильно
истощается, так как на пути к местам нереста в море и в реке почти
не питается.1 Гибель после нереста, как теперь установлено (Замахаев,
1940; см. также Мейснер, 1932),—явление необязательное, а наблюдаемое
редко и происходящее, повидимому, не от истощения,1 2 причем гибнут,
судя по всему, преимущественно самки (Баженов, 1906; Штейнфельд,
1945). Отнерестовавшаяся и оставшаяся в живых сельдь в реке держится
главным образом в затонах, задерживаясь здесь иногда до сентября
{Штейнфельд, 1945). Половой зрелости достигает в четырех-пяти-
годоваЛом возрасте, изредка в трехгодовалом, основная масса мечущей
икру сельди четырех- и пятигодовалые, встречаются шести- и изредка
семигодовалые. По достижению половой зрелости икру мечут ежегодно,
иногда два-три раза. Вторично на нерест в 1937 г., по наблюдениям
Е. Раменского, пришло 18.7%, в третий раз 3.0%; четырехгодовалых
вторично пришло метать икру 13.6%, пятигодовалых 21.2%. В конце
1 Диксоном (1905) исследовано содержимое желудков 14 черноспинок, пойман-
ных у с. Усть-Курдюма (20 в. выше Саратова) и у в?ех найдены остатки переварен-
ной или полупереваренной пищи, состоявшей из Cladocera и Copepoda, Cordylophora,
Insecta, статобластов Bryozoa и в одном случае мальков рыб. Баженов (1909) ука-
зывает, что если черноспинка во время нерестового хода и питается, то очень мало.
2 Ряд авторов (Киселевич и др.), утверждавших, что черноспинка мечет икру
только раз в жизни, после чего погибает, совершенно не принимали во внимание ука-
зания Баженова (1909 : 27) на то, что массовая гибель ее наблюдалась только в те
годы, когда она в большом количестве заходит в среднее течение Волги (выше Сара-
това), как, например, в 1903 г. (Баженов, 1906 : 121) и лет за 15—20 до этого, когда
она в массе заходила сюда ежегодно. В последующие годы (1904—1905) такой массо-
вой гибели Баженов здесь не наблюдал. Массовую гибель черноспинки наблюдал
и Лаплас (1776).
9. ALOSA
30-5
хода количество рыб, идущих на нерест повторно, увеличивается. В год
нереста и после него темп роста резко падает. В начале хода идут млад-
шие возрастные группы, но быстрее растущие; позднее — старшие,
но с замедленным темпом роста. В младших возрастных группах,
по наблюдениям Н. Соловьевой, преобладают самцы, в старших —
самки, в реке количество самок в одни годы больше количества самцов
(1936), в другие годы, наоборот, преобладают самцы. Неполовозрелые
двух- и трехгодовалые встречаются только в южной части моря, мигра-
ции на север, подобно молоди долгинки, не совершают. Темп роста самый
быстрый по сравнению с ростом других каспийских сельдей (по данным
В. И. Мейснера):
Возраст............. I 2 3 4 5 6
Длина (см)..........8.4 21.0 28.(> 30.4 41.3 44.7
Во взрослом состоянии хищник, питается главным образом мелкой
рыбой (тюлька, атеринка и др.), реже ракообразными, личинками насе-
комых. В северной части моря в мае основной пищей является обыкно-
венная тюлька (92%), отчасти молодь судака (6.6%), Gammaridae (1.0%)
(Остроумов, 1947). Основной пищей сеголетков является Copepoda
(от 41.0 до 52.5%), меньшее значение имеют Cladocera (от 11.9 до 53.7%)
и непланктонные организмы (от 5.3 до 35.6%), причем в течение суток
наблюдаются два максимума питания, один, наибольший, вечерний
(6—10 час. веч.) и утренний (около 8 час. утра) (Сушкина, 1939, 1940,
1942). В посленерестовый период в Волге взрослые питаются зоопланкто-
ном, компоненты которого в содержимом желудка в зависимости от места
поимки рыбы различны: в большинстве случаев преобладают Cyclops
strenuus и Daphnia longispina, местами значительную роль играет Lep-
todora kindlii (Екатерин.шская и Изосимов, 1945). Одна из самых жирных
и ценных по йкусовым качествам каспийских сельдей. По мере продви-
жения к основным районам промысла и к местам нереста количество
жировых отложений уменьшается — с 18.9% в среднем у берегов
Азербайджана до 15.6% в дельте Волги и 6.8% в районе Саратова (Лева-
нидов, 1932). После нереста во второй половине августа 1937 г. в Бороз-
динском затоне (Волга у Свияжска) содержание жира колебалось от 0.5
до 2.6%, в среднем 1.15% (Недошивин, 1942).
Хозяйственное значение довольно существенное. Улов
в 1937—1940 гг. колебался от 13.7 до 57.5 тыс. ц; главная масса его
(от 10.5 до 50 тыс. ц) добывается в Волго-каспийском районе. Ловится
весной на пути к местам нереста.
Alosa kessleri kessleri (Grimm) X Alosa kessleri volgensis (Berg) —
Волжская малотычинковая сельдь.
Caspialosa volgensis Мейснер, Бюлл. Всекасп. научн. рыбохоз. эксп., 5—6,
1932 : 19 (малотычинковая раса). — Caspialosa volgensis kisselevitschi Киселевич,
Сельди северного Каспия, Сталингр., 1937 : 20 (описание, биология). — Caspialosa
volgensis imitans Н. Танасийчук, Рыбн. хоз., 1938, И : 33 (по Бергу). —
Caspialosa kessleri kesslerixC. kessleri volgensis Световидов, Зоолог, журн.,
XXII, 4, 1943 : 231 (отношение к обеим каспийским формам вида и другим видам). —
Caspialosa kessleri Ч а л и к о в, там же, XXII, 6, 1943 : 352 (отношение к A. kessleri
kessleri); Замахаев, там же, XXIII, 2—3, 1944 : 65 (идентичность с A. kessleri
kessleri). — Сaspialosa kessleri isp. volgensis imitans Берг, Рыбы пресных вод, I, 1948 :
133; Н. Танасийчук, Промысл, рыбы Волго-Каспия, Пищепромиздат, 1951 :
39 («волжская малотычинковая сельдь», миграции, нерест, хозяйственное значение).
20 Фауна СССР —314
нос
CLUPEIDAE
По данным В. И. Мейснера, жаберных тычинок 43—95 (71.7), по
звонков 48—54 (51.6).1 Жаберные тычинки тонкие, сходные с тычинками
A. kessleri kessleri, некоторые тычинки обломанные. В остальном близка
к A. kessleri volgensis, с некоторым отклонением к A. kessleri kessleri.
По указанию К. А. Киселевича, зубы, в отличие от A. kessleri kessleri,
как и у Л. kessleri volgensis, едва заметные. Половые продукты более раз-
виты, жировые отложения в полости тела отсутствуют. Н. Танасийчук
не считает достаточными отличия в степени зрелости половых продук-
тов, жировым отложениям в полости тела и по развитию зубов. Зубы,
по его указанию, развиты хорошо и по этому признаку отличия более
значительны от A. kessleri volgensis, чем от A. kessleri kessleri. По размерам
близка A. kessleri volgensis.
По мнению Чаликова (1943), С. volgensis imitans является «мор-
фофизиологической популяцией» A. kessleri kessleri, выделяемой послед-
ней под влиянием изменяющихся условий Каспийского бассейна. Зама-
хаев (1944) считает эту сельдь возрастной группировкой A. kessleri
kessleri. На самом деле вопрос представляется более сложным и
запутанным. К С. volgensis kisselevitshi Meissner (=С. volgensis imitans
Berg) относились, с одной стороны, сельди гибридного происхождения,
с другой стороны, к ней, вероятно, относились экземпляры A. kessleri
kessleri и A. kessleri volgensis, промежуточные по своим признакам
между этими подвидами. Кроме того, сюда, несомненно, относились
экземпляры J. brashnikovi brashnikovi. За последнее говорят как систе-
матическая характеристика, так, в особенности, крайне неопре-
деленные и разноречивые сведения о биологии волжской малотычин-
ковой сельди. По указанию Киселевича (1937 : 22), главная масса
волжской малотычинковой сельди не входит в реки, а нерестует в слабо
соленых участках моря, главным образом в северо-восточной половине
северной части его (к востоку от Урала и даже у о. Кулалы), т. е. в тех
же местах одновременно и при той же температуре воды (начало с конца
апреля при 15.3—15.6°, окончание в конце мая при 22°), при которых
происходит нерест A. brashnikovi brashnikovi. Наиболее высокий здесь
указывался и процент волжской малотычинковой сельди в уловах
(до 12%). Если при этом принять во внимание небольшое количество
жаберных тычинок нижнего предела колебания их, указываемое для
волжской малотычинковой сельди (от 43), и то, что, по указанию В. И.
Мейснера, она легко поэтому может быть смешана с долгинкой, то можно
полагать, что эти биологические сведения и количество жаберных тычинок
относятся к долгинке, ошибочно относимой к волжской малотычинковой
сельди.1 2 Кроме того, на местах нереста A. brashnikovi brashnikovi в северо-
восточной части моря нередко встречаются сельди, по внешности напо-
минающие эту сельдь, но по числу и характеру жаберных тычинок про-
межуточные между этой сельдью и нерестящимися здесь же несколько
позднее A. caspia salina (см. рис. 37, табл. XV, 1), которые несомненно
являются помесями между этими двумя сельдями (см. стр. 260).
1 По данным Н. Танасийчука, жаберных тычинок 77.5, позвонков 52.4.
2 Необходимо отметить, что приведенные сведения о местах нереста относятся
к 1930 г., когда эта сельдь, только что обратившая на себя внимание, была мало
известна и несомненно больше, чем в последующие годы, смешивалась с другими сель-
дями. Необходимо также принять во внимание, что сбор материалов обычно произ-
водился наблюдателями, далеко не всегда в указанное время хорошо разбиравши-
мися в сельдях.
9. ALOSA
307
Но указанию В. И. Мейснера, нерест волжской малотычинковой
сельди происходит в Волге и Урале, но в основном в море перед устьями
Урала и частью Волги; последнее категорически отрицается Киселевичем
(1937 : 23). Наконец, в последние годы наиболее достоверные сведения
о биологии волжской малотычинковой сельди дает Н. П. Танасийчук,
но указанию которого эта сельдь нерестится в.Волге (подробнее см. ниже).
За гибридное происхождение волжской малотычинковой сельди говорит
и самый характер наследования ею основных отличительных признаков
и особенностей черноспинки и волжской многотычинковой сельди:
часть признаков наследуется от первой, часть от второй формы. По всем:
главным признакам, за исключением жаберных тычинок, а также в основ-
ном и по биологии волжская малотычинковая сельдь сходна с много-
тычинковой сельдью. По количеству же жаберных тычинок и их строе-
нию эта сельдь напоминает черноспинку, т. с. основные признаки насле-
дуются мозаично. По указанию В. И. Мейснера, волжская малотычинко-
вая сельдь, повидимому, несколько более скороспела, чем даже волжская
многотычинковая сельдь, т.е., если это действительно так, то здесь наблю-
дается явление гетерозиса, столь характерного при гибридизации. Явле-
ние гетерозиса, выражающегося точно так же в несколько более раннем
созревании, наблюдается и у гибрида между сазаном и карасем (см. Нико-
люкин, Изв. Воронежск. Гос. пед. инет., III, 1928 : 5—35). Гибриды
между близкими формами и видами и даже межродовые, как известно,
у рыб не являются редкостью. Здесь необходимо отметить лишь, что-
гибрид, подобный волжской малотычипковой сельди, известен и у сход-
ных биологически Alosa alosa и A. fallax, причем благодаря тому, что
степень различия между этими видами Alosa гораздо больше, чем между
A. kessleri kessleri и A. kessleri volgensis (см. об этом стр. 66), и они
являются несомненными видами, имеющими большой hiatus в количестве
жаберных тычинок и, кроме того, отличающиеся внешне, Хёк (Ноек,.
Tijdschr. Ned. Dierk. Ver. (2), VI, 3, 1900 : 156) и Редеке (Redeke, Arch.
Neerland. Zool., Ill, Suppl., 1938 : 148), описавшие этих сельдей, бев
особых затруднений разгадали их гибридное происхождение. Наследо-
вание основных признаков у гибрида A. alosa и A. fallax имеет проме-
жуточный характер, но по внешнему виду, как и волжская малотычин-
ковая сельдь, он ближе к виду более мелкому и нерестящемуся в нижнем
течении реки (A. fallax), точно так же, как и по количеству жаберных
тычинок, он ближе к виду с наименьшим количеством их (в данном слу-
чае тоже A. fallax).
Таким образом, за основную массу волжской малотычинковой сельди
принимались особи как гибридного происхождения между A. kessleri
kessleri и A. kessleri volgensis', (см. также стр. 323), так и промежуточ-
ные по своим признакам между этими сельдями. Кроме того, за эту сельди
отчасти принимались особи A. brashnikovi brashnikovi и помеси между
последней и A. caspia salina (в восточных районах северной части моря).
Распространение в море, повидимому, такое же широкое,
как и у проходных сельдей. Зимние месяцы проводит в южной части
моря. В северной части моря весной, по указанию ряда авторов, преоб-
ладает в восточной половине, что, возможно, обусловлено тем, что за эту
сельдь здесь принималась долгинка. Относительно мест икрометания
существуют разные указания, но из всех наиболее достоверно, что нерест
происходит в Волге и, возможно, в небольшом размере в Урале. Вверх
по Волге подымается, повидимому, высоко, до Сталинграда и даже Камы-
шина и Куйбышева. Икрометание наиболее интенсивно происходит
20*
308
CLUPEIDAE
у с. Никольского (240 км от Астрахани) и выше, нерестует и в дельте
точно так же, как и в среднем течении Волги.— в районе Камышина
и Куйбышева.
Биология известна мало, все сведения об этом крайне разно-
речивы. Разгар нереста в нижнем течении Волги в конце июня—начале
июля, конец в середине июля; у Камышина нерест начинается в середине
июня, у Вольска — в конце июня, у Куйбышева разгар хода в середине
июля. В северной части моря появляется в апреле, разгар хода обычно
в середине мая. В дельте Волги идет во второй половине мая и даже
в начале июня, большей частью с незрелыми половыми продуктами
(Н. Танасийчук, 1951).
Хозяйственное значение ничтожное. В уловах состав-
ляет небольшой процент, причем весьма характерно то, что в морских
уловах, в особенности в восточной половине северной части моря, этот
процент указывается значительно выше, чем в речных: в море до 12% (по
Мейснеру), в реке иногда до 7%, но в основном значительно меньше (1 —
4%). Улов в Волго-каспийском районе в 1935—1939 гг. составлял в сред-
нем около 12 тыс. ц, в 1940—1943 гг. до 61 тыс. ц (около 7% улова сель-
девых в Волго-каспийском районе; Н. Танасийчук, 1951).
*7. Alosa fallax (Lacepade) s. 1. —Финта.
Литературу см. при подвидах.
Жаберных тычинок приблизительно 30—80, на нижней половине
жаберной дуги 20—40; тычинк г короткие и грубые, обычно равные по
длине жаберным лепесткам, со слабо развитыми редкими и тупыми боко-
выми шипиками, концы тычинок на нижней половине жаберной дуги не
в виде выпуклой линии. Голова невысокая и узкая, не сжатая клиновидно
в нижней части с боков. Рыло узкое, заостренное. Длина до 50 см. По
Хэку (Ноек, 1900), sp. br. до' 43, по Смитту (Smitt, 1895) и Эренбауму
(Ehrenbaum, 1921), до 60, по Фасьо (Fatio, 1890), у A. fallax lacustri до 52,
по Винчигуера (Vinciguerra, 1921), у A. fallax gracilis до 76 (ср. стр. 313).
Проходные или пресноводные рыбы.
Распадается на несколько малоизученных географических форм
(обзор их см. у Ригэна, 1916): A. fallax fallax (Lacepede) (Атлантическое
побережье Европы), A. fallax killarnensis Regan (оз. Килларней, юго-
западная часть Ирландии),1 A. fallax algeriensis Regan (описана по 1 экз.
из Алжира), A. fallax nilotica (Geoffroy) (Средиземное море), A. fallax
lacustris Fatio (озера Маджоре, Комо,1 2 Лугано), A. fallax gracilis Regan
(оз. Гарда). Кроме того, в особую форму A. fallax rhodenensis Roule (Bull.
Soc. Zool. France, 49, 1924 : 265) выделяется финта, заходящая в р. Рону.
Различия между некоторыми из этих форм незначительные, многие из них
изучены по небольшому количеству экземпляров. Во всяком случае
ни одна из этих форм ни систематически, ни биологически не изучена
в такой степени, как наши проходные сельди. В пределах СССР встре-
чаются A. fallax fallax и A. fallax nilotica.
Распространение. Атлантическое побережье Европы
от южной части Скандинавского п-ова до Пиренейского п-ова, у берегов
северной Африки (М гадор), в Балтийском, Средиземном и отчасти
в Черном морях. Входит в реки, в некоторых озерах живет постоянно.
1 Об этой форме см.: Trewavas, Proc. Linn. Soc. London, 150, (1937—
1938), 1938 : 110—112.
2 В оз. Комо различается A. fallax lariana Pirola.
9. ALOSA
309
*7a. AJo-a fallax nilotica (Geoffrey) — Средиземноморская финта
(табл. XXIV).
Clupea nilotica J. Geoffrey, Descr. Egyptc, XXIV, Hist, nat., 1829 : 289,
t. X, f. 10 (p. Нил). — Clupea jinta В oulenger, Cat. Afr. freshwat. fish., I,
1909 : 154, f. 123 (p. Нил). — Alosa jinta Берг, Мат. позн. русск. рыбол., II, 3,
1913 : 4 (Константинополь). — Alosa jinta nilotica Regan, Ann. Mag. Nat. Hist. (8),
XV1I1, 1916 : 10 (Египет, Константинополь, Адриатическое м.). — Alosa fallax
nilotica Берг, Рыбы пресных вод, I, 1932 : 91 (Константинополь); II, 1933 : 838
(Керченский прол.); I, 1948 : 145.
Распространение, биология. D’A п с о n a, Intern. Rev. ges.
Hydrob. u. Hydrogr., XX, 5/6, 1928 : 430 (p. Тибр; нерест, рост, питание); Кни-
пович, Тр. Азовско-черном, научно-промысл. эксп., 5, 1932, дополнения (Кер-
ченский прол.).
Рис. 51. 1-я жаберная дуга Alosa fallax
nilotica. Длина тела 243 мм.
D IV 15—16(15.4), общим числом 19—20(19.4). A III 17—19(18.6),
общим числом 20—22(21.6). я». br. 34—37 (35.3). на нижней половине
жаберной дуги 21—23 (22 0). Жа-
берные тычинки по строению и
длине как у типичной формы,
точно так же как и строение че-
люстей. Голова небольшая, невы-
сокая и узкая, длина ее 22.6—24.5
(23.2)%, высота 17.8—19.2(18.5)%
длины тела, межглазничный про-
межуток 18.6—22.9 (20.3)% длины
головы. Глаза сравнительно не-
большие, 17.5—24.5(19.7)% длины
головы. Грудные плавники 14.2—
18.1 (15.3)% длины тела. Высота
тела 23.4—28.9 (25.9)% длины его.
Длина, как и типичной формы.
Описание дано по 2 экз. из Нила
(26.6 и 28.1 см длины) и 1 экз. из
Константинополя (24.3 см). 2 экз.
из Палермо и 3 экз. из Средиземного моря (повидимому из запад-
ной его части) отличаются несколько большим количеством жабер-
ных тычинок (36—51, на нижней половине жаберной дуги 23—32),
будучи ближе по этому признаку к A. fallax algeriensis, между
тем как, по данным Моро (Moreau. Hist. nat. poiss. France, III, 1881 ;
456), тычинок у финты от средиземноморских берегов Франции значи-
тельно меньше (31—34, на нижней половине дуги 21—23). По Рулю
(Route, 1924), у финты из Роны жаберных тычинок 34—36, на нижней
половине дуги — 22—23.
Проходная форма.
Распространение. Средиземное море, возможно, только-
в восточной части его, так как для Алжира и Франции описаны особые
формы (см. выше). Адриатическое, Мраморное (Константинополь) и
Черное (Керченский прол.) моря. Входит в реки.
Биология. Морской период жизни не изучен. В реки Италии
(Тибр) идет в первой половине марта. Расстояния от устья Тибра до Орви-
сто (210 км) проходит за 1—1% месяца, со скоростью около 5 км в день.
Нерест в Тибре происходит при впадении р. Палья (Paglia, 210 км
от устья), по ночам, на мелких местах с каменистым грунтом, при тем-
пературе воды 22—25°. Взрослые после нереста в море скатываются
ZU)
CLUPEIDAE
в конце июня. Молодь с мест нереста скатывается в устье в октябре,
прибрежную область покидает в апреле. Взрослые в реке в период нере-
ста не питаются, в море основной пищей служат ракообразные (в основ-
ном Gammarus pungens и др.), иногда мелкие рыбы (Engraulis, Sardina).
Половой зрелости самцы достигают в четырехгодовалом возрасте, неко-
торые в трехгодовалом и как исключение в двухгодовалом. Самки созре-
вают в основном в пятигодовалом возрасте, реже в четырехгодовалом.
Нерест происходит несколько раз в жизни, на нерестилищах встречаются
семи- и восьмигодовалые рыбы. Самцы растут несколько медленнее самок.
Темп роста, по исследованиям Анкона (1928), несколько более медлен-
ный, чем у атлантической финты.
X оз яй ст в.е иного значения в наших водах не имеет,
так как встречается единичными экземплярами.
*7b. Alosa fallax fallax (Lacepede) — Атлантическая финта
(табл. XXIV).
Clupea fallax Lacepede, Hist. nat. poiss., X, 1800 : 188, 225 (Сена). —
Clupea finta Cuvier, Regne animal, ed. II, II, 1829 : 319 (частью: Северное м.);
Day, Fish Great Britain Ireland, II, 1884:236 (описание, биология)..— Clupea
alosa var. finta S m 1 t t, Scand. fish., II, 1895 : 984 (описание, биология). — Clupea
finta H о e k, Tijdschr. Ned. Dierk. Ver. (2), VI, 3, 1900 : 156 (sp. br. 38—43, био-
логия).— Alosa finta Regan, Ann. Mag. Nat. Hist. (8), XVIII, 1916:6
(атлантические берега Европы). — Paralosa fallax Route, Poiss. eaux donees
France, 1925 : 78 (атлантические берега Франции, sp. br. 40—44). — Alosa fallax
Берг, Рыбы пресных вод, I, 1932 : 90; I, 1948 : 144.
Распространение, биология. Pouchet et Bietrix, Journ.
Anat. Physiol., Paris, XXV, 1889 : 628 (Сена; развитие икринок, помесьc A. alosa);
Ehrenbaum, Mitt. Deutsch.Seefischerei-Ver., 10,1894 : 21 (p. Эльба; нерест, разви-
тие); J e n k i n s, Wiss. Meeresunters. (N. F.), Abt. Kiel, VI, 1902 : 39 (возраст, пло-
довитость); Collett, Vid.-Selsk. Christ., 1903, 9, 1905 : 36 (у берегов Норвегии
в Кристианиа-фиорде и у Бергена); G. Schneider, Rapp. Proces-Verb., IX,
1908 : 109 (Балтийское м., в Финском зал. вдоль Финляндии на восток до Ловизы);
Берг, Мат. позн. русск. рыбол., II, 3, 1913 : 4 (Певе в Эстляндии); Суворов,
Тр. Балт. эксп., II, 1913 : 57, 61, 98 (у Виндавы, Пернова); R о u 1 е, Compt. Rend.
Soc. Biol., Paris, 83, 1920 : 1542 (p. Сена; рост); Bull. Mus. Nat. Hist. Nat., Paris,26, 7,
1920 : 610 (p. Сена; миграции); Ehrenbaum, Fischerbote, 1921, 17 : 681; 18 : 726
(sp. br. 40—60, распространение, биология, хозяйственное значение); R о u 1 е, Ann.
Sci. Nat. (Zool.), Paris, ser. 10, V, 1922 : 61 (p. Сена; миграции, нерест, рост); A n o-
n у m., Fiskeriditiskr. f. Finnl., 1937, 8—9 : 150 (Финский зал. у Бьёркэ); R е d е k е
Arch. Neerland. Zool., Ill, Suppl., 1938 : 148 (помеси c A. alosa, количество жа-
берных тычинок и лучей в анальном плавнике); Берг, Изв. Всесоюзн. Научно-
исслед. инет, озерн. и речи.'рыбн. хоз., XXII, 1940 : 5 (Лужская губа).
D IV (V)’13—16 (14.9), общим числом 17—20 (18.9), А III 18—
20(19.0), общим числом 21—23 (22.0), sp. br.. 37—42 (39.6), на нижней
половине жаберной дуги 22—27 (24.7), vert. S. 53—56 (55.36), caud. ver!.
36—39. Жаберные тычинки толстые и грубые, заостренные на концах,
прямые или слегка изогнутые, по длине обычно равные жаберным лепест-
кам. Челюсти одинаковой длины или нижняя слегка выдается вперед.
Голова нэболыпая, невысокая и узкая, длина ее 21.4—24.8 (22.8)%,
высота 16.7—-19.0 (18.2)% длины тела, межглазничный промежуток
18.5—24.2 (20.9)% длины головы. Глаза небольшие, 15.2—21.2 (18.5)%
длины головы. Грудные плавники 13.9—15.9 (15.2)% длины тела. Высота
тела 21.8—29.3 (24.6)% длины его. Спина темноголубая. На боках тела
с каждой стороны за жаберной крышкой сверху по темному пятну и
по ряду, изредка по 2—3 ряда1 таких же пятен сзади него. Длина
1 В коллекциях Зоологического института Академии Наук СССР есть экзем-
пляр A. fallax killarnensis с двумя рядами темных пятен на боках тела.
9. ALOSA
311
не свыше 60 см, обычно 30—50 см, вес не более 1 кг. Описание дано
по 6 экз. из Лужской и Нарвской губ Финского зал., 2 экз. с южных
берегов Балтийского моря, 4 экз. из Рейна, 1 экз. из Северного моря,
2 экз. из Аркашонского зал. длиной от 20.8 до 34.8, в среднем 29.1 см.
По Хёку (Ноек, 1900), sp. br. 38—43, по Смитту (Smitt, 1895) и Эренбауму
(Ehrenbaum, 1921), 40—60. Позвонков 52—57, в среднем 54.8 (по Хёку).
Проходная форма.
Различия между A. fallax fallax и A. alosa по количеству жаберных
тычинок, судя по данным Редеке, не так велики, как считает Хёк,
однако и не настолько малы, как считает Эренбаум (ср. стр. 313)
Несомненно, что нижний предел колебаний количеств жаберных тычи-
нок у недостаточно изученной A. alosa значительно менее 110 (по
Хёку). Резкие различия между этими двумя видами в реках, впадаю-
щих в Северное море, в значительной степени затемняются наличием
помеси между ними, о несомненности существования которой свидетель-
ствует промежуточный характер
ряда признаков (см. об этом выше,
стр. 307).
Распространение. Ат-
лантический океан у берегов Ев-
ропы от южной части Скандинав-
ского п-ова (от Кристианиа-фиорда
и Бергена) до Пиренейского п-ова.
Есть в Балтийском море, Ботниче-
ском зал. и Финском, на восток,
вдоль северных берегов которого
обычна до Ловизы, реже до Бьёрке
и Stursudd, вдоль южных берегов
до Лужской губы. Входит в реки
и речки, не подымаясь - высоко
вверх по течению, в Рейне глав-
ным образом в нижнее течение
(в пределах Голландии), единично
Триера. В Неву не входит. В река^
Рис. 52. 1-я жаберная дуга Alosa fallax
fallax. Длина тела 272 мм.
и в среднее течение, в р. Мозель до
Скандинавского п-ова, как и A. alosa
alosa, распространенная здесь значительно севернее (рис. 27), редка. В реках
Северного моря (Эльба, Везер) более многочислен этот вид, в Эмсе
несколько более многочисленна A. alosa alosa. В Великобритании
в одних реках преобладает A. alosa alosa (р. Северн), в других этот вид
(р. Темза).
Биология. О морском периоде жизни известно мало. Нерест
в реках Германии в мае—июне. В реки входит приблизительно на один
месяц позднее A. alosa alosa, в реки Великобритании — с середины
апреля, разгар хода в мае—начале июня, в июле скатывается обратно
в море; в р. Сену начало хода в конце первой половины мая, нерест
с середины мая до конца июня—начала июля. Высоко в реки, в отли-
чие от A. alosa alosa, заходящей на 500—700 км от устья (в Рейн,
до Базеля, в его притоки Некар, Майн, Мозель), обычно не подымается,
выметывая икру в нижнем течении рек, в Рейне в пределах Голландии,
в Сене от устья до Руана и Эльбеф (100—120 км от устья), а вообще начи-
ная от границы солоноватых вод, при температуре воды выше 15—16°.
в конце мая встречаются уже' личинки. Плодовитость от Ц0 до 180 тыс.
икринок (Jenkins, 1902). Икра развивается в придонных^ слоях воды.
Инкубационный период при 19° длится 96 час. В реках в период нереста,
3J2
CLUPEIDAE
повидимому, не питается, так как желудки обычно бывают пусты или
содержат лишь в пилорической части их слизистые комки из остатков
рыб {Ammodytes, Sprattus), ракообразных {Mysis, Corophium). Молодь
длиной 5—13 см питается мальками рыб {Clupea harengus и др.), рако-
образными {Муsis, Corophium и даже Copepoda — Temorella affinis).
Половой зрелости основная масса самцов достигает в трехгодовалом
возрасте, реже в двухгодовалом, самки в четырех-пятигодовалом
возрасте, реже в трехгодовалом. Возрастной состав нерестующих рыб
в разные годы неодинаков. По данным Редеке (Redeke, 1938), в Рейне
он был таков (в процентах):
Возраст . . • • . з-г 4-F 5-1- 6-1- 7
( 1929 . . . . — 9.0 88.7 2.3 — —
Год вылова 1930 . . . . 6.5 0.7 88.7 50.4 3.0 0.7
1 1931 . . . . 18.0 .13.1. 3.3 41.0 24.6 —
В р. Сене самцы преобладают в трех-двухгодовалом возрасте, более
крупные самки — в четырех- и трехгодовалом возрасте. Темп роста
более быстрый, чем у волжской сельди, но значительно более замедлен-
ный, чем у черноспинки.
Возраст........... 4 5
Длина (см) 1 . . . 31.2 39.8
В пищевом отношении менее ценна, чем A. alosa, так как менее жирна.
Хозяйственное значение в настоящее время небольшое,
так как запасы как этого вида, так в особенности и A. alosa, вследствие
загрязнения рек и гидротехнических сооружений (в зап. Европе) сильно
снизились. В наших водах ловится единичными экземплярами. В реках
Германии, по данным Эренбаума (Ehrenbaum, 1921), уловы были таковы
(й) :
1910 г. 1911 г. 1912 г. 1913 г. 1914 г.
Басс. Северного м . . . 14853.5 14265.0 10172.0 7603.0 11824.8
» Балтийского м. . . . . . 18362.5 27234.5 16048.5 20355.5 23177.4
1М5 г. 1916 г. 1917 г. 1918 г. 1919 г.
Басс. Северного м . . . 9506.2 180.2 2460.3 12.1
» Балтийского м. . . . . . 14533.7 11449.5 5722.1 24348.4 31202.9
*8. Alosa alosa (L.)—Алоза, майская рыба.
Clupea alosa Linne, Syst. nat., ed. X, 1758 : 3'18 (Oceano Europeo). — Clu-
panodon alosa R 1 s s o, Hist. nat. Europ. merid., Ill, 1826 : 453. — Alosa communis
Y a г г e 1 1, Hist. Brit, fish., ed. I, II, 1836 : 136. — Alausa vulgaris Valencien-
nes, in: Cuvier et Valenciennes, Hist. nat. poiss., XX, 1847 : 391,
t. 604. — Alosa cuvieri Malm, Goteb. Bohusl. Fauna, 1877 : 654. — Alosa vulgaris
Moreau, Hist. nat. poiss. France, III, 1881 : 456. — Clupea alosa var. alosa S m i 11,
Scand. fish., II, 1895 : 985. — Clupea alosa H о e k, Tijdschr. Ned. Dierk. Ver. (2),
VI, 3, 1900 : 156 (sp. br. 110—130, биология). — Alosa alosa Regan, Ann. Mag.
Nat. Hist. (8), XVIII, 1916 : 8.
Распространение, биология. Baade r, Ber. Senckenberg.
naturf. Ges., (1873—1874), 1875:182 (Марокко); Collett, Vid.-Selsk. Christ.;
1903, 9, 1905 : 36 (Намсен-фиорд у Намсоса, реже Сальтен-фиорд у Будё); Piet-
schmanu, Ann. К. К.. Naturhist. Hofmus., Wien, XXI, 1906 : 101 (у берегов Ма-
рокко, Могадор, Агадир, Азамор); R о u 1 е, Bull. Soc. Zool. France, 49, 1924 : 265
(P- По).
1 Средние, вычисленные по данным Дженкинса (Jenkins, 1902). Длина до конца
средних лучей хвостового плавника.
9. ALOSA
313
Жаберных тычинок приблизительна 85—130, на нижней половине
жаберной дуги 55—85; тычинки тонкие и длинные, длиннее жаберных
лепестков, с хорошо развитыми острыми и часто сидящими боковыми
шипиками, концы тычинок цельные, не обломанные, на нижней половине
жаберной дуги обычно в виде выпуклой линии. Голова высокая и ши-
рокая, клиновидно сжатая в нижней части с боков,1 рыло широкое.
Крупные рыбы, в половозрелом состоянии длиной до 70 см и весом до
2Уг кг. По Хёку (Ноек, 1900), sp. br. у A. alosa alosa 110—130, по
Смитту (Smitt, 1895), 90—120, по Эренбауму (Ehrenbaum, 1921), 60—120
(ср. стр. 311). Позвонков 53—57, в среднем 55.4 (по Хёку).
Проходные или пресноводные рыбы.
На протяжении обширного ареала распадается на ряд форм. Формой
этого вида является, повидимому, A. africana Regan (1 экз. из Алжира,.
45 жаберных тычинок на нижней половине жаберной дуги) и А. тасе-
donica [Vinciguerra. Annali Mus. Civico Stor. Nat. Genova. (3), TX (ХТЛХ),
1921 : 4, оз. Бешик-гёль, бассейн Эгейского моря, жаберных тычинок
85—105, на нижней половине жаберной дуги 56—70]. В качестве формы
этого же вида следует, судя по всему, рассматривать и A. bulgarica
Drensky.
Распространение. Атлантическое побережье Европы
от Скандинавского п-ова (от Намсен-фиорда у Намсоса, реже от Саль-
тен-фиорда у Будё) до Пиренейского п-ова, у берегов северной Африки
(на юг до Могадор, Агадир и Азамир в Марокко, в океане против м. Бланко).
В западной части Балтийского моря (до Киля), в Средиземное море как
в западней части (р. Рона), так и в восточной (бассейн Эгейского моря),
если считать A. macedonica за форму этого вида, и у западных берегов
Черного моря, если считать A. bulgarica за форму этого вида. Входит
в реки.
*8а. Alosa alosa bulgarica Drensky — Черноморская алоза (табл. XXV).
Alosa bulgarica Дренски, Изв. Природонаучн. инет, въ София, VII,
1934 : 79, фиг. 1—2 (Черное м. у берегов Болгарии к югу от Бургаса, р. Ропо-
тамо, Караач, Велека, Резвая).
D IV 13—14, общим числом 17—18, А III 19—20, общим числом 22—
23, sp. br. 100—101, на нижней половине жаберной дуги 58. Жаберные
тычинки тонкие и длинные, с ясно выраженными боковыми шипиками,
концы тычинок обычно целые, не обломанные, и на чижней половине
дуги образуют выпуклую линию. Нижняя челюсть слегка выдается
вперед. Голова сравнительно небольшая, клиновидно сжатая с боков,
длина ее 23.2—24.1%, высота 18.4—18.8% длины тела. Грудные плавники
14.9—15.4% длины тела. Высота тела 26.9—27.2% длины его. Спина
темносиняя, бока и брюшко серебристо-белые. На исследованных, обес-
цвеченных экземплярах пятен на боках тела нет; по описанию Дренски,
с каждой стороны по ряду из 6—8 черных пятен. Длина до 24 см. Опи-
сание дано по 2 экз. длиной 19.9 и 20.2 см. По данным Дренски, жабер-
ных тычинок 100—НО, поперечных рядов чешуй 48—50.
От близкой A. alosa macedonica, по указанию Дренски, отличается:
1) меньшим количеством продольных рядов чешуй (у A., alosa macedo-
1 По строению головы A. alosa напоминает A. caspia, на что указывал еще
Кесслер (Тр. СПб. общ. ест., V, 1874 : 114). Подобное же строение головы,
имеет A. sapidissima.
314
CLUPEIDAE
..nica 64—67), 2) большим количеством жаберных тычинок (у A. alosa
.macedonica 88—105), 3) у Я. alosa macedonica нет черных пятен на боках
тела (вероятно они есть). От A. alosa alosa отличается: 1) числом жабер-
ных тычинок (у A. alosa alosa Дренски считает 98—126), 2) отсутствием
у A. alosa alosa черных пятен на боках тела (на самом деле они есть),
3) меньшими размерами. Дренски высказывает мысль, что A. alosa bul-
garica и A. alosa macedonica являются географическими формами A. alosa,
но, следуя Винчигера, считает их все же за виды.
Распространение. Юго-западная часть Черного моря
у берегов Болгарии. Заходит в заливы Бургас, Созополь, Кюприя,
Резово. Входит в реки и речки, расположенные к югу от Бургаса:
в небольшом количестве в р. Ропотамо и Караач, в несколько большем
количестве в р. Велека, в наибольшем количестве в р. Резвая (Резовка).
Единично, вероятно, встречается у берегов Румынии, заходя и в наши
воды.
Биология не изучена.
В р. Резвая ловится в изобилии в
мае—июне.
Хозяйственное значе-
ние, повидимому, не особенно боль-
шое. В устье и нижнем течении
р. Резвой является объектом спе-
циального промысла. Ловят сетями.
Данных об уловах нет.
*9. Alosa sapidissima (Wilson) —
Шед (табл. XXV).
Рис. 53. 1-я жаберная дуга Alosa alosa Clupea sapidissima Wilson, in:
bulgarica. Длина тела 202 мм. R e e s’s, New Cyclopedia, IX (страницы
и года нс указано, но ранее 1812 г.; место-
нахождение также не указано, но, повиди-
мому, Филадельфия; цитировано по Jordan a. Evermann). — Clupea indigena М i t-
c h i 1 1, Trans. Lit. Phil. Soc. N. Y., I, 1815 : 454 (Нью-Йорк, цит. no Jordan a. Ever-
mann). — Alosa praestabilis D e К a y, New York fauna, Fishes, 1842 : 255, t. 15,
л' (Нью-Йорк). — Clupea alosa var. sapidissima Smitt, Scand. fish., II,
1895 : 985. — Alosa sapidissima Jordan a. Evermann, Fish. N. a. M. Ame-
rica, 1,1896 : 427, f. 191 (синонимия, распространение); V 1 a d у к о v a. Wallace,
Trans. Amer. Fish. Soc., 67, 1937 : 52 (атлантическое побережье Сев. Америки, коли-
чества лучей в плавниках, позвонков, жаберных тычинок, изучение рас); W а г f е 1
a.. Olsen, Copeia, 1947, 3 : 177 (р. Коннеттикет; число позвонков); Clothier,
Fish bull., 79, 1950 : 35, pl. I (южная Калифорния; количество позвонков).
Распространение, биология. Lei m, Contrib. Canad. Biol.
Fisher, (n. s.), II, 11, 1924 : 163 (распространение у берегов Канады, биология, промы-
сел, литература); Bigelow a. W е 1 s h, Bull. U. S. Bureau Fisher., XL,
1924 : 113 (атлантическое побережье Сев. Америки от зал. Св. Лаврентия до Флориды;
биология); Leach, Rept. U. S. Comm. Fisher., (1924), 1925 : 459 (распространение,
биология, нерест); Schultz a. De Lacy, Mid-Pacific Mag., Okt.-Dec.,
1935 : 369 (распространение, литература); Vladyko v, Copeia, 1936, 3 : 168
(нахождение в море против Н. Шотландии, 44°25' с. ш., 61°05’ з. д.); Каганов-
•с к и й, Вести. Дальневосточн. фил. АН СССР, 33, 1939 : 205 (зал. Корфа на восточ-
ном берегу Камчатки); Craig a. Hacker, Bull. U. S. Bureau Fisher., XLIX,
(32), 1920:201 (p. Колубмия; история заселения, методы разведения); П а н и н,
Природа, 1944, 3 : 72 (восточные берега Камчатки: зал. Корфа в июне 1935 и летом
1937, б. Уала в сев. части прол. Литке в августе 1939 г.1); Welander, Copeia,
1940, 4 ; 221, карта (тихоокеанское побережье Сев. Америки от Сан-Диего до о. Кадь-
яка на Аляске); Clemens a. Wilby, Fisher. Res. Board Canada, Bull. LXVIII,
1 10 июля 1950 г. в Камчатском зал. пойман еще один экземпляр длиной
-54.5 см, весом 1446 г. (по сообщению К. И$ Панина),
9. ALOSA
315
1946 : 76 (тихоокеанское побережье Канады, на север до зал. Кука); Vladyko V,
Canad. Fisherm., 1'1, 1948 : 10 (р. Св. Лаврентия; миграции); Fitch, Calif. Fish
.a. Game, 36, 2, 1950 : 72 (Huntington Beach).
Рис. 54. -1-я жаберпая дуга Alosa sapidis-
sima. Длина тела 399 мм.
D IV 15, A III 17—18, sp. br. 103—108, на нижней половине жабер-
ной дуги 66—68. Жаберные тычинки тонкие и длинные, длиннее жабер-
ных лепестков, с хорошо выраженными боковыми шипиками, концы
тычинок обычно необломанные и на нижней половине жаберной дуги
образуют выпуклую линию. Челюсти одинаковой длины или нижняя
слегка выдается вперед. Голова небольшая, высокая, широкая, клино-
видно сжатая с боков, длина ее 22.9—23.0%, высота 18.5—19.8% длины
тела, межглазничный промежуток 21.5—21.8% длины головы. Грудные
плавники короткие. 14.4—14.9% длины тела. Высота тела 23.7—25.6%
длины его. Спина темноголубая или зеленоватая. На боках тела с каж-
дой стороны за жаберной крышкой по темному пятну, сзади которого
обычно имеется еще несколько расположенных в ряд пятен (у крупных
не менее 5, иногда до 27). У не-
которых рыб ниже этого ряда
имеется еще один ряд из 1—16
пятен. Изредка ниже имеется тре-
тий ряд из 2—9 пятен. Длина в
настоящее время до 76 см и бо-
лее, вес до 5Уг—6 кг, тихоокеан-
ская шед крупнее и тяжелее. Опи-
сание дано по 1 экз. с атлантиче-
ского побережья Сев. Америки
(р. Коннектикут, 42.7 см) и по 1 экз.
из бухты Уала с восточного побе-
режья Камчатки (39.9 см). По дан-
ным Лича (Leacji, 1925), жаберных
тычинок 93—120. Позвонков у эк-
земпляров из рек Канады, по ис-
следованиям Лейма (Leim, 1924), 52—60, наичаще57—58(включая urostyl);
у экземпляров из рек США, по данным ряда авторов, 54—59, наичаще
56—57; у экземпляров из Калифорнии—56—57 (Clothier, 1950).
Проходная рыба.
В реках, впадающих в Мексиканский зал., представлена близким
видом A. alabamae Jord, et Everm. (sp. br. 56—69, на нижней половине
жаберной дуги 34—45) и его подвидом A. alabamae ohiensis Everm. (sp.
br. 66—75, в среднем 72, на нижней половине жаберной дуги 43—49,
бассейн р. Миссисипи, р. Огайо), которые являются, возможно, формами
A. sapidissima. Как указывалось выше (см. стр. 221), A. sapidissima
не отличается резко от A. alosa, и, повидимому, обе они являются фор-
мами одного вида. У атлантических берегов, повидимому, распадается
на расы или стада, свойственные разным рекам (Vladykov a. Wallace,
1937).
Распространение. Атлантический океан у берегов Сев.
Америки от зал. Св. Лаврентия до Флориды, наиболее многочисленна
от Сев. Каролины до о. Лонг, заходит в реки. Акклиматизирована
в Тихом океане, где. в настоящее время распространена вдоль берегов
Сев. Америки от юго-восточных берегов Аляски (о. Кадьяк) до зал. Мон-
тери и южнее (Сан-Диего). В последние годы неоднократно ловилась
единичными экземплярами в зал. Корфа и б. Уала на восточном берегу
316
CLUPEIDAE
Камчатки. Нерест происходит почти во всех реках Сев. Америки на про-
тяжении ареала и в предустьевых пространствах выше солоноватых
вод. В р. Св. Лаврентия подымается до Монреаля, заходит в приток ее
р. Оттаву, в р. Сакраменто подымается на 300 миль, в р. Колумбии
в большом количестве ловится в 150 милях от устья.
Б и о л о г и я. Морской период жизни почти не изучен. В море,
повидимому, держится вблизи рек, в которых происходит нерест. Из р. Св.
Лаврентия, как показали опыты мечения, отходит к югу. Меченые в этой
реке рыбы были пойманы у северной оконечности Новой Шотландии,
к юго-западу от южной оконечности ее и у м. Код (Провинстоун); в по-
следнем случае в 1200 милях от мест мечения в реке (Vladykov, 1948).
Летом и осенью наблюдалась в море вместе с макрелью и сельдью при
температуре воды преимущественно от 15.5 до 21°. Необычно холод-
ной зимой 1935 г. 25—30 рыб были пойманы на значительном отдалении
от берегов (44° 25' с. ш., 61° 05' з. д.) на глубине около 73 м. Время
захода в реки обусловливается в основном температурой воды, поэтому
в реки, расположенные южнее, заходит раньше, чем в северные. В р. Са-
ванна (шт. Георгия) и Эдисто (шт. Южн. Каролина) ход начинается
в январе и заканчивается в конце марта. В р. Потомак (впадает в зал.
Чезапик) единичные экземпляры появляются в феврале, разгар хода
в апреле. В р. Делавэр (впадает в залив того же названия) разгар хода
в начале мая. В реках, расположенных к северу от р. Дел .вэридо Канады,
ход происходит в мае—июне, в реках Канады — с конца мая, иногда
с начала мая. В р. Св. Лаврентия вверх по течению идет со скоростью
25—50 миль в сутки. Ход начинается при температуре воды от 10 до
12°, единично — при более низкой температуре, разгар хода —
при 13—15.5°. В начале хода идут преимущественно самцы, которые
раньше достигают мест нереста, в конце хода преобладают самки. Нерест
начинается при температуре воды от 11 до 14.5°, заканчивается при 18—
21°, при температуре воды выше 26.5° как развивающаяся, так и невы-
метанная икра гибнет. Нерест происходит в реке, преимущественно
в частях ее с замедленным течением выше приливно-отливной зоны и
в предустьевом пространстве, но в пресной воде, перед заходом солнца,
от 5 до 10 час. веч. Плодовитость от 25 до 30 тыс. икринок, у отдельных,
наиболее крупных рыб насчитывали до 60, 80, 100, 115 и даже 156 тыс.
икринок. Икра, повидимому, выметывается в несколько порций, так
как в яичниках нерестящихся рыб наряду с крупными, зрелыми икрин-
ками имеются мелкие, еще не развитые (Leim, 1924). Икра придонная,
в поверхностных слоях воды встречается в незначительном количестве.
Инкубационный период при температуре воды 12.2° длится 408 час.,
при 13.9° — 148 час., при 17.8° — 109 час., при 23.3° — 70 час. (Leach,
1925). При температуре воды 22° развитие протекает ненормально, при
26° происходит массовая гибель развивающейся икры. Хотя нерест
обычно происходит в пресной воде, однако оптимальные условия для
развития икры и личинок, как показали экспериментальные исследо-
вания, в солоноватой воде при содержании солей 7%°/оо и температуре
воды 17°. Желточный пузырь у личинок при температуре воды 12° вса-
сывается через 7 дней, при 17° — через 4—5 дней после вылупливания
(Leim, 1924). Молодь в средних атлантических штатах скатывается
в конце ноября—начале декабря в р. Потомак при понижении
температуры воды до 4.5°, имея длину около 5 см. Истощенные после
нереста взрослые сельди скатываются вниз по течению. В нижнем те-
чении р. Св. Лаврентия (у о. Вёрт) скатывающиеся особи появляются
9. ALOSA 377
мямммц
в первые две или три недели июля, в самом нижнем течении наблю-
дались в июле и августе (Vladykov, 1948). Неполовозрелые рыбы преды-
дущего года вывода и двухгодовалые заходят в нижнее течение рек,
и р. Потомак на 30 миль от границы солоноватых вод. В реке до выме-
тывания икры не питается, по окончании нереста начинает захватывать
пищу. Планктоноядная; в море питается главным образом зоопланкто-
ном; преимущественно Gopepoda (Calanus, Acartia, Eurytemora, Euphau-
siidae}, Mysidae, Ostracoda, Amphipoda и некоторые другие ракообраз-
ные, изредка мелкие рыбы (Osmerus mordax). Молодь начинает питаться
сразу же после всасывания желточного пузыря, при длине от 11 мм. Основ-
ная пища молоди — Copepoda, личинки Chironomidae, личинки других
насекомых, Cladocera, Ostracoda, у наиболее крупных Amphipoda. В море
в уловах встречаются рыбы длиной от 16 до 65 см, наичаще от 20 до 30 см.
причем в течение первой половины августа ловятся преимущественно
крупные рыбы длиной свыше 30 см, во второй половине августа — пре-
имущественно мелкие рыбы. Половой зрелости достигает в четырех-
пятигодовалом возрасте; рыбы моложе четырехгодовалого возраста
не нерестятся. Нерест происходит несколько раз в жизни. На местах
нереста в реках Канады преобладают пятигодовалые и более старшие
возрастные группы. Темп роста значительно более быстрый, чем у дру-
гих видов рода и у проходных сельдей из подрода Caspialosa (по данным
Лейма, обратное.расчисление):
Возраст............ I 2 3 4 5 6 -7
Длина (см) 1 .... 12.9 26.3 35.2 41.9 48.4 51.4 52.5
Первые опыты оплодотворения икры шед были предприняты в 1848 г.
и затем в более широких размерах в 1867 г. В Тихом океане мальки
впервые были выпущены в 1871 г. в р. Сакраменто и Колумбию, затем
в 1873 г. и в 1876—1880 гг. Впервые на нерест в тихоокеанских реках
шед в значительных количествах пошла в 1877 г. В настоящее время
шед наиболее многочисленная рыба в реках Калифорнии. Большое коли-
чество мальков было выпущено в реки, впадающие в Мексиканский зал.,
в р. Колорадо (у Needles, шт. Аризона), в озера Большое Соленое, Бэр
и Юга, но без положительного результата.1 2
Хозяйственное значение имеет очень большое, зани-
мая по размерам уловов в США третье—четвертое место. Общий
улов в 1937—1940 гг. достигал 53.9 тыс. ц, из которых у атланти-
ческих берегов было выловлено 44.8 тыс. ц, у тихоокеанских —
9.1 тыс. ц. Наибольшее количество вылавливается в средних атланти-
ческих штатах (43 тыс. ц в 1920—1921 гг.). В начале заселения страны
почти каждая река, впадающая в Атлантический океан, изобиловала
этой рыбой, но к началу 70-х годов запасы ее истощились. В дальней-
шем путем рыбоводных мероприятий уловы были увеличены, но затем,
вследствие усиленного вылова, устройства гидротехнических сооруже-
ний и загрязнения воды, опять снизились. На атлантическом побережье
уловы изменялись следующим образом: 1880 г. — 87.3 тыс. ц, 1888 г.—
172.8 тыс. ц, 1896 г. — 227 тыс. ц, 1908 г. — 117.9 тыс. ц, 1918—
1 Средние из средних различных возрастных групп 23 экз. (р. Shubenacadic,
Канада).
2 Сведения по промысловому значению, истории заселения тихоокеанских рек
и технике разведения шед приводит Н. Д. Жуковский (Искусственное разведение
сельдевых рыб. Тр. Сев. инет. рыбн. хоз., III, 1932).
31g
CLUPEIDAE
1922 гг. — 68.9 тыс. ц. в 1937—1940 гг. — 44.8 тыс. ц. То же самое
наблюдалось и на тихоокеанском побережье. Так, например, в р. Сакра-
менто в 1915 г. было поймано 60% улова предыдущего года, а в 1916 г.
40% улова 1915 г. По всему тихоокеанскому побережью в 1914 г. было
поймано 31.7 тыс. ц, в 1937—1940 гг. — 9.1 тыс. ц, причем уменьшение^
улова последних лет обусловлено болыпеа экономическими причинами,
чем отсутствием рыбы.
10. Род CLUPANODON LACEPEDE
Clupanodon Laceped е, Hist. nat. poiss., X, 1803 : 247 (тип : Clupea
thrissa L.).— Konosirus Jordan a. Snyder, Proc. U. S. Nat. Mus., ХХШ,
1900:349 (тип: Chato'essus punctatus Schl.). — Clupanodon, Regan, Ann. Mag.
Nat. Hist. (8), XIX, 1917 : 308. — Nealosa 1 H err e a. Myers, Lingnan Sci. Journ.
Canton, X, 1931 : 236 (тип: Cl. punctatus).
Верхняя челюсть с медиальной вырезкой в межчелюстных костях.
Supramaxillare одно, переднее отсутствует. Жировые веки есть, оди-
наково прикрывают глаза сзади и спереди. Последний луч спинного
плавника вытянут в длинную нить. Крышечная кость гладкая, без ради-
альных бороздок. Тело довольно высокое, брюхо сжатое с боков, брюш-
ные килевые чешуи хорошо развитые на всем протяжении от горла
до анального плавника, образуя острый киль. Рот сравнительно неболь-
шой, конечный или почти конечный, окаймлен посредством как меж-
челюстных, так и верхнечелюстных костей, без зубов, сочленение ниж-
ней челюсти с черепом у мелких под или за вертикалью середины глаза,
у крупных под или за вертикалью заднего края, задний конец верхне-
челюстной кости заходит за вертикаль переднего края глаза, у крупных
достигает середины его. Жаберные тычинки верхней части жаберной
дуги загнуты кверху, на них налегают снаружи тычинки нижней части
дуги, тычинки тонкие, не особенно длинные, многочисленные. Отростки
плавательного пузыря помещаются в prooticum и pteroticum. Брюшные
плавники расположены под передней частью спинного, основание спин-
ного плавника окаймлено бороздкой из мелких чешуй, более крупных
в передней части. За жаберной крышкой сверху большое темное пятно,
позади него несколько рядов мелких темных пятнышек, расположен-
ных в несколько параллельных рядов. Небольшие рыбы длиной до 200—
300 мм и несколько более.
Скелет.2 Bulla prootica и b. pterotica приблизительно одинако-
вого размера. В. prootica образует на черепе сбоку (табл. LIII, 4}
небольшое вздутие, - едва выдающееся над поверхностью; b. pterotica
заметна в виде небольшого вздутия сбоку и более крупного сверху у осно-
вания fossa praeepiotica. Отростки плавательного пузыря помещаются
с каждой стороны в продольном углублении вдоль переднего края occi-
pitaie laterale, ограниченном сзади и спереди гребнями, заходят в череп
через отверстия, каждое из которых расположено значительно ниже
opisthoticum, посредине переднего края occipitale laterale, далее рас-
положено в кости. Fenestra auditiva небольшая, продолговатая, несколько
более высокая сзади. Fossa praeepiotica небольшая, в виде треугольника,
обращенного основанием вверх, углом вниз, высота ее немного меньше
длины. Foramen temporale по размерам в длину и высоту немного пре-
1 См. Myers, Copeia, 1932, 1:3.
3 Описание и рисунки скелета головы близкого рода подсем. Dorosomatinae —
Nematalosa (N. соте) см. у Райдвуда (Ridewood, 1904а : 463—468, f. 126—129).
10. CLUPANODON
319-
вышает fossa praeepiotica, наиболее высокое посредине. Сочленовная
поверхность hyomandibulare на sphenoticum и pteroticum одна, про-
долговатая, более высокая спереди. Сошник и передняя часть парасфе-
ноида слегка изогнутые, крылья парасфеноида широкие и короткие,
выступают под миодомом вниз, круто поднимаются вверх позади prooti-
cum, не простираются назад за задний конец черепа. Нисходящий отро-
сток базисфеноида отсутствует. Задний край supracccipitale и epioticum
каждой стороны на черепе сверху (Б) расходятся в стороны и назад под .
тупым углом. Pteroticum оканчивается сзади длинным и тонким шипом.
Передний конец каждого sphenoticum направлен в стороны, имеет форму
треугольника с острой вершиной. Крылья ethmoidalia lateralia едва
выдаются с каждой стороны из-под переднего конца лобных костей,,
задние в виде направленных в стороны треугольников, передние закруг-
ленные спереди. Псперечпые отростки мезээмоида спереди закруглены,
сзади вогнуты, направлены в стороны. Череп довольно широкий,
ширина его у основания шипа pteroticum около двух раз, ширина лоб-
ных костей около трех раз в длине черепа. Сошник снизу черепа (В)
широкий и короткий, с закругленным задним концом, вогнутый посере-
дине, с небольшим двураздельным округлым возвышением на головке
спереди. Парасфеноид спереди широкий, суживается сзади, с продоль-
ной вогнутостью на передней части, крылья его тесно прилегают ниж-
ними краями друг к другу, расходятся впереди заднего края prooticum.
Fossa temporalis posterior с каждой стороны на черепе сзади (В) большая
и глубокая. Над шипом pteroticum с каждой стороны черепа небольшая
продолговатая fossa subtemporalis. Hyomandibulare сверху с одной сочле-
новной головкой для сочленения с черепом. Quadratum без выемки
в верхнем крае. Предкрышечная кость широкая, одинаковой ширины
с продолговатой крышечной. Нижнечелюстная кость выше и длиннее
сочленовной. Описание дано по одному скелету Cl. punctatus.
Морские рыбрт, заходят в пресные воды.
2 вида в тропических и субтропических частях западной части Тихого •
океана и в прилегающих морях. В наших водах один вид.
*1. Clupanodon punctatus (Schlegel) — Пятнистая сельдь (табл. XXVI)..
Chatoessus punctatus Schlegel, in: Temminck et Schlegel, Fauna
Jap., Pisces, 1846 : 240, t. CIX, f. 1 (Нагасаки); Cuvier et Valenciennes,.
Hist. nat. poiss., XXI, 1848 : 107 (Япония); Gunther, Cat. fish., VII, 1868 : 408-
(Китай: Амой).—Dorosoma punctatus Jordan a. Snyder, Proc. Acad. Hat.
Sic. Phila., 1897 : 62 (Сватау). — Clupanodon thrissa (non L.) Jordan a. Sny-
der, Proc. U. S. Nat. Mus., XXIII, 1900 : 743 (Иокогама). — Konosirus punctatus
Jordan a. Herr e, ibid., XXXI,' 1906 : 624 (южная Япония: Токио, Нагасаки,
зал. Мацусима, входит в эстуарии). — Clupanodon punctatus Regan, Ann. Mag.
Nat. Hist. (8), XIX, 1917 : 309 (Китай, Япония).—Dorosoma thrissa (non L.)
Tanaka, Fish. Japan, XLIV, 1928 : 866, f. 490 (южная Япония, на север до зал.
Мацусима и Фукуи, Корея, Порт-Артур). — Clupanodon punctatus Берг, Рыбы
пресн. вод, I, 1932 : 92, рис. 97 (от Сватау до зал. Петра Вел., Япония); Fowler,.
U. S. Nat. Mus., Bull. 100, v. 13, 1941 : 559 (Япония, Корея). —• Nealosa punctata
T c h a n g, Bull. Fan Mem. Inst. Biol., Zool., VIII, 4, 1939 : 331, f. 1 (Китай).
Распространение, биология. Blee k e r, Verb. Bat. Gen.,.
XXV, 1853 : 50 (Нагасаки); Ned. Tijdschr. Dierk., II, 1865 : 57 (Китай: Амой);
К n e r, Reise «Novara», Fische, 1865 : 336 (Мадрас, Таити); Gunther, Ann. Mag.
Nat. Hist. (4), XIII, 1874 : 158 (Чифу); Mertens, Preuss. Exped. Ost-Asien, I,
1876 : 404 (Токио, Иокогама); Gunther, Ann. Mag. Nat. Hist. (7), I, 1898 : 263
(сев. Китай : Ню-чжуан); Jordan a. Snyder, Proc. U. S. Nat. Mus., XXIII,
1900 : 349 (Токио); Franz, Abh. Bayer. Akad. Wiss., IV, Suppl.-Bd. 1, 1910 : 5
(зал. Сагами, Мисаки); Павленко, Мат. позн. русск. рыбол., III, 10...
1914 : 146, фиг. 26; Берг, Ежегодн. Зоолог, муз. Акад. Наук, XIX, 4, (1914),..
320
CLUPEIDAE
1915 : 555 (устье p. Тумень-ула, 25—30 IX 1913); Jordan a. Metz, Mem. Car-
negie Mus., VI, 1, (1913), 1914 : 8 (Пусан); Jordan a. Hubbs, ibid., X, 2, 1925 :
120 (Мисаки, Микава, Кагосима, Фукуи, базар Миязу, Токио и Киото); Амброз,
Произв. силы Дальн. Вост., IV, 1927 : 74 (зал. Посьета); W u, Contrib. Biol. Lab.
Sci. Soc. China, V, 4, 1929 : 18, f. 14 (Амой); Шмидт и Ji п н д б с р г, Изв.
АН СССР, отд. мат. и ест. наук, 1930 : 1137 (Цуруга); Ш м и д т, там же, 1931 : 103
(Обама); Тр. Тихоокеанск. комит. АН СССР, II, 1931 : 18 (Нагасаки, Кагосима);
С h u, Index pise. Sinens., 1931 : 15 (Амой, Чифу, Сватау, Ню-чжуан); Mori
a. U с h i d a, Journ. Chosen Nat. Hist. Soc., 19, 1934 : 4 (Пузан, Мокпхо); P y-
м я и ц e в, Зоолог, жури., XXVI, 1, 1947 : 47 (в наших водах известна до 1914 г.,
встречалась и после 1941 г.).
D IV 13—14 (13.3), общим числом 17—18 (17.3), А II (III) 18—23
(19.8), общим числом 20—25 (21.9), У I 7, sp. br. 143—290 (176.9), на ниж-
ней половине жаберной дуги 74—152 (122.6), vert. S. 48—50 (49.0), caud.
vert. 33—26 (34.4), килевых чешуй (16)18—20+14—17 (18.9+15.4),
общим числом (31) 33—36 (34.3). Голова сравнительно небольшая и
широкая, длина ее 20.8—22.9 (21.4)% длины тела, межглазничный про-
межуток 20.2—23.5 (20.0)% длины головы, с. тупым средним гребнем.
Рот полунижндй, нижняя челюсть углом. Глаза небольшие, 18.7—23.5
(21.1)% длины головы. Тело, в особенности брюхо, сжатые с боков,
довольно высокое, наибольшая высота 21.1—25.5 (22.8)%, высота головы
у затылка 15.8—18.1 (16.9)% длины тела. Килевые чешуи острые.
За жаберной крышкой сверху большое темное пятно. В верхней части
тела несколько параллельных рядов мелких темных пятнышек. Длина
до 320 мм, в наших водах в начале лета обычно мельче, до 130 мм, в конце
лета крупнее. Описание дано по 25 экз. из устья р. Тумень-ула, от бере-
гов Японии и Кореи, длиной от 133 до 265, в среднем 190 мм. По Фау-
леру (Fowler, 1941), sp. br. 182+170, килевых чешуй 20+13—15..
Морская рыба, заходит в устья рек.
Распространение. Западная часть Тихого океана и приле-
гающие моря — Японское, Желтое, Восточно- и Южно-китайское. Вдоль
азиатских берегов на север до зал. Петра Великого, на юг до Сватау.
Вдоль западных берегов Японии на север до Фукуи и Микавы, вдоль
восточных — до зал. Мацусима. Индия (Мадрас) и Полинезия (Таити),
если верно указание Кнера (Кпег, 1865).
Биология изучена мало. Наиболее многочислен в заливах и
эстуариях, заходит в устья рек (р. Тумень-ула). В наших водах впервые
констатирован в 1913 г., причем встречался и в период времени с 1938
по 1945 г., когда ряд теплолюбивых рыб не заходил. В зал. Петра Вели-
кого ловится с середины июня до октября. В Японии внутри заливов
и вдоль юго-западных берегов ловится осенью и зимой.
Хозяйственное значение незначительное. В наших
водах промыслового лова нет. У берегов Кореи в 1937—4942 гг. уловы
составляли от 25.8 до 43.1 тыс. ц.
11. Род ILISHA GRAY
Platygaster Swainson, Nat. hist, animals, II, 1839 : 294 (тип: Clupea afri-
?cana Bloch = I. africana, nomen praeoccupatum). — Ilisha (Gray) Richardson,
Ichth. China Japan, 1846 : 306 (тип: I. abnormis (Gray) Rich = I. elongata). — ? Zuna-
sia J о r d a n a. Metz, Mem. Carnegie Mus., VI, 1, (1913), 1914 : 7 (тип: Pristi-
gaster chinensis Basilewski = ? I. elongata). — Euplatygaster Fowler, Proc. Acad.
Nat. Sci. Phila., LXXXV, (1933), 1934 :,246 (подрод, тип: Pellona brachysoma Bleeker =
I. brachysoma).
Верхняя челюсть без медиальной вырезки. Тело и брюхо сжаты
с боков, брюхо с острым килем. Брюшные килевые чешуи сильно раз-
11. ILISHA
321
витые, покрывают не только брюхо на всем протяжении до анального
плавника, но и горло. Жировые веки развиты слабо, слегка прикрывают
глаза сзади и несколько менее спереди. Удлиненных чешуй при осно-
вании лопастей хвостового плавника (ala), удлиненных последних двух
лучей анального плавника и бороздок на крышечной кости нет. Рот
небольшой, верхний, нижняя челюсть далеко выдается вперед, сочле-
нение нижней челюсти с черепом под вертикалью переднего края глаза,
верхнечелюстная кость широкая, закругленная, задний конец ее не захо-
дит за вертикаль середины глаза. Клыков нет, слабые зубы есть на ниж-
нечелюстных и межчелюстных костях, мелкие зубчики по нижнему краю
верхнечелюстных, на нёбных .и мезоптеригоиде и языке. Верхнечелюст-
ная кость не прикреплена к межчелюстной, между задним концом меж-
челюстной и серединой верхнечелюстной связка, а не окостенение, несу-
щее зубы. Отростки плавательного пузыря помещаются в prooticum и
pteroticum, bulla prootica больше, чем b. pterotica. Спинной и брюшные
плавники есть, брюшные небольшие, расположены далеко впереди
начала спинного. Анальный плавник длинный, с 33—52 лучами, начало
его под задним концом спинного или сразу за ним. Основание спинного
плавника расположено в бороздке из расширенных чешуй. Чешуи
на боках тела с поперечными неправильными бороздками, прерванными
по середине. Жаберные тычинки короткие и толстые, немногочисленные,
16—25 на нижней части дуги. Небольшие и крупных размеров рыбы,
от 50 до 500 мм и более.
Скелет не изучен.1
Морские и солоноватоводные рыбы, некоторые виды заходят в реки
(они, возможно, проходные), один вид известен только из пресных вод
(возможно, что в море он не найден).
16 видов в тропических частях Индийского и отчасти западной и
восточной частях Тихого и восточной части Атлантического океанов.
Род в основном индо-пацифический, по одному виду известно из вос-
точных частей Тихого (Панама) и Атлантического (берега Африки) океа-
нов; в западной части Атлантического океана (у берегов Америки) отсут-
ствует. В наших водах один вид.
*1. Ilisha elongata (Bennett) (табл. XXVI).
Alosa elongata Bennett, Mem. life Raffles, 1830 : 691 (non vidi, Суматра).—
Clupea affinis Gray, Illustr. Ind. Zool. Hardwicke, I, 1835, t. 96, f. 2 (Пинанг). —
Platygaster affinis Swainson, Nat. hist, animals, II, 1839 : 294 (sec. Gray). —
Clupea melastoma (non Schneider) Bleeker, Nat. Gen. Arch. Nederl. Ind., II,
1845 : 509 (Батавия). — Schlegel, in Temminck et Schlegel, Fauna
Jap., Pisces, 1846 : 237, t. CVIII, f. 1 (Нагасаки). — Ilisha abnormis (Gray) R i-
chardson, Ichth. China Japan, 1846 : 306 («Chinese Sea»). — Pellona grayana
Valenciennes, in: Cuvier et Valenciennes, Hist. nat. poiss., XX,
1847 : 315 (sec. Gray). — Pellona vimbella Valenciennes, 1. c. : 317 (Макао). —
Pellona affinis Cantor, Cat. Malayan fish., 1850 : 291 (Пинанг, Малакка, Синга-
пур). — Pellona schlegelii Bleeker, Verb. Bat. Gen., XXVI, 1854 : T18 (Нага-
саки). — ? Pristigaster chinensis Basilewski, Nouv. Mem. Soc; Nat. Moscou,
X, 1855 : 243 (Чжилийский зал.). — Pellona elongata Gunther, Cat. fish., VII,
1868 : 456 (Суматра, Китай: Амой, Япония). — Ilischa schlegeli Bleeker, Versl.
Akad. Amsterd. (2), IV, 1870 : 252 (Китай). — Pellona elongata Day, Fish. India,
1878 : 643, t. CLXV, f. 1 (берега Индостана, Малайского архипелага, Китая и Япо-
нии). — ? Pristigaster (Pristigaster) sinensis S a u v a g е, Bull. Soc. Philom., Paris
(7), V, 1881 : 107 (Сватау). — Ilisha elongata Jordan a. Herr e, Proc. U. S.
1 Остеология I. motius (=Pellona motius) и Opisthopterus valenciennesi (=Pris-
tigaster tartoor) изучена Райдвудом (Ridewood, 1904 : 459—460, 461—462). Рисунков
нет.
21 Фауна СССР —314
,Ч2Я
CLUPEIDAE
Nat. Mus., XXXI, 1906 : 635 (Гонконг, Нагасаки, Ваканоура). — Pellona elongata
Weber a. Beaufort, Fish. Indo-Austr. Archipel., II, 1913:90, f. 30 (Ява,
Мадура, Суматра, Пинанг, Сингапур, Банка, Борнео, Китай, Тайван, Япония,
Индия). — ? Zunasia chinensis Jordan a. Metz, Mem. Carnegie Mus., VI, 1,
(1913), 1914 : 7, t. I, f. 1 (Корея: Нампхо). — Ilisha elongata Norman, Ann.
Mag. Nat. Hist. (9), XI, 1923 : 7 (Индия, Малайский архипелаг, Китай, Япония,
исследованы типы I. abnormis и Р. schlegelii и экземпляры, полученные от Блекера
как/, affinis)-, Fowler, U. S. Nat. Mus., Bull. 100, v. 13, 1941 : 661 (Корея,
Китай, Япония, Батавия, Бомбей, Гонконг).
Распространение, биология. Gunther, Ann. Mag. Nat.
Hist. (4), XIII, 1874:158 (Чифу); Peters, Monatsber. Akad. Wiss. Berlin,
1880:926 (Нинбо); Jordan a, E v e r m a n n, Proc. U. S. Nat. Mus., XXV,
1902 : 328 (Тайван); Hora, Mem. Asiat. Soc. Bengal, 6, 1924 : 481 (Singgora); Jor-
dan a. Hubbs, Mem. Carnegie Mus., X, 2, 1925 : 121 (Осака, Фукуока, идентич-
ность Zunasia chinensis)-, Pillay, Journ. Bombay Nat. Hist. Soc., XXXIII, 2,
1929 : 355 (Траванкор); W u, Contrib. Biol. Lab. Sci. Soc. China, V, 4, 1929 : 16,
f. 12 (Амой); Fowler, Proc. Acad. Nat. Sci. Phila., LXXXI, (1929), 1930 : 599
(Гонконг); III м и д т, Тр. Тихоокеанск. комит. АН СССР, II, 1931 : 19 (Пусан);
М о г i a. Uchida, Journ. Chosen Nat. Hist. Soc., 19, 1934:4 (Нампхо,
Jin-sen, Вонсан); Охрямкин, Вести. Дальневост. фил. АН СССР, 18, 1936 : 168
(зал. Америка в зал. Петра Вел., сентябрь 1934 г.); Т а р а н е ц, Кратк. опред..
рыб дальневост, морей, 1937 : 56 (зал. Петра Вел.); Румянцев, Зоолог, журя,,
XXVI, 1, 1947 : 47 (зал. Петра Вел.).
D IV 12—15, общим, числом 16—19, А IV 43—50, общим числом 47—
54, sp. br. 34—37, на нижней половине дуги 22—25, килевых чешуй 24—
27+12—15. Длина головы 19.5—23.1% длины тела, межглазничный
промежуток 8.1—10.2% длины головы, глаза 18.5—24.0% той же длины.
Тело сжатое с боков, высокое, наибольшая высота его 19.2—24.2% длины.
Профиль брюха более выпуклый, чем спины, с сильно развитыми киле-
выми чешуями, имеющимися и на горле. Верхнечелюстная кость про-
стирается до середины зрачка, нижняя челюсть сильно выдается вперед.
Начало анального плавника под последними лучами спинного или даже
позади него. Окраска бледная, желтовато-серебристая, спина темная.
Длина до 60 см и выше. Описание дано по 9 экземплярам длиной от 45.5
до 58.8 см из зал. Петра Великого (1 экз.) и Пусана (8 экз.). По Нор-
мэну (Norman, 1923), D (15)17—18, А (40)44—52, жаберных тычинок
на нижней. половине дуги 20—25, поперечных рядов чешуй 50—54, киле-
вых чешуй 24—28+12—15.
Распространение. Восточная половина Индийского и запад-
ная часть Тихого океанов у берегов Индостана, Индокитая, Индо-малай-
ского архипелага (Суматра, Банка, Ява, Мадура, Борнео), Филиппин-
ских о-вов, Китая, (включая у берегов Тайвана), Кореи, Японии.
На север вдоль тихоокеанских берегов Японии до Осаки, в Японском
море до Фукуоки и зал. Петра Великого в наших водах.
Биология изучена мало. Встречается в море и в устьях рек.
В наших водах редок. В зал. Петра Великого появился после 1914 г.
и ловился с середины июня до середины октября по 1938 г. включительно.
С 1939 г. вместе с рядом других теплолюбивых рыб в наших водах не
встречается.
Хозяйственное значение небольшое. В наших водах
промыслового значения не имеет. Данных по уловам по всем возможным
местам промысла нет. У берегов Кореи в 1937—1941 гг. уловы составляли
6.6—14.8 тыс. ц.
ДОПОЛНЕНИЯ
Стр. 307. Н. И. Николюкин в вышедшей во время печатания этой
работы книге (Межвидовая гибридизация рыб, 1952 : 286) полагает,
что форма, описанная • Редеке как гибрид A. al sax A. fallax, на
самом деле есть полиморфная популяция особей, из которых, вероятно,
лишь незначительная часть представлена гибридом первого поколений,
большая .же часть возникла в результате многократных скрещиваний
этого .гибрида как inter se, так и возвратных, главным образом
с A. fallax, поскольку этот вид встречается в бассейне Рейна гораздо
чаще, чем A. alosa. Вероятно, сходное явление наблюдается и у ги-
брида A. kessleri kessleri X A. kessleri volgensis, нерест которого в Волге
наиболее интенсивно происходит в тех же местах, что и A. kessleri
volgensis.
Стр. 308, 311 и рис. 27. Alosa fallax изредка встречается у юго-
западных берегов Исландии, где была находима у м. Рейкьянес ж
к югу от него (Saemundss6n, Zool.. Iceland, IV, 72, 1949: 107).
АЛФАВИТНЫЙ УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ1
abnormis, Ilisha 320, 321, 322
abrau, Clupeonella 14, 18, 37, 44, 56,
66—68, 75, 93, 192, 193, 208
abrau, Harengula 208
acuta, Dussumieria 101
aestuarina, Alosa caspia caspia n. 239,244
aestuarina, Caspialosa caspia 242
aestuarius, Spratelloides 36
affinis, Clulea 321
affinis, Ilisha 382
affinis, Pellona 321
affinis, Platygaster 321
africana, Alosa 313
africana, Alosa alosa 35, 37
africana, Clupea 320
africana, Ilisha 94, 320
agrachanica, Alosa brashnikovi 24, 29, 30,
76, 78, 82, 221, 252—254, 261, 263,
274, 275
agrachanica, Caspialosa brashnikovi 263
alabamae, Alosa 315
Alausa 211
alba, Clupea 123
alba, Rogenia 115, 123
Albula 13.
Albulidae 9, 13, 19, 20
Albulina 10
albulina, Etrumeus 100
Albuloidae 9
Alepocephalidae 9.
Alepocephaloidae 9
algeriensis, Alosa fallax 308, 309
allecia, Clupea 173
allecia, Sardinella 173
Alosa 10, 22—25, 28, 33, 37, 42, 44, 48,
50, 51, 55, 56, 58—63, 65, 66, 69, 72—
74, 76—78, 91, 94, 95, 98, 100, 117,
211, 213, 214, 221, 222, 307
alosa, Alosa 22—25,.28, 48, 65, 213, 221,
223, 292, 307, 311, 312, 314, 315
alosa, Alosa alosa 65, 66, 311, 313, 314
alosa, Clupanodon 312
alosa, Clupea 258, 299, 312
•alosa, Clupea alosa var. 312
Aiosinae 11, 22, 31, 37, 38, 42, 93
altamazonica, Pellona 94
amazonica, Rhinosardinia 37, 43, 93
Arrib li gas ter 170
Amiidae 9
anchovia, Clupea 173
anchovia, Sardinella 172, 173
Anodontostoma 31, 38, 42, 94
antipodum, Sprattus 20, 36, 103—107
arcuatus, Sprattus 36, 103, 105, 106, 117
Arengus 186
allanticus, Clupea harengus 123
aurita, Clupea. 173
aurita, Sardinella 14, 17, 35, 39, 43, 46,
48, 49, 51, 61, 77, 170—172—174
autumnalis, Alosa brashnikovi 30, 224,
252, 254, 267, 269, 270, 279 .
autumnalis, Caspialosa brashnikovi 270, 271
azowi, Clupeonella delicatula 194, 196
baltica, Clupea sprattus var. 112
baltica, Spratella sprattus 112
balticus, Clupea sprattus 112
balticus, Sprattus sprattus 18, 21, 83, 97,
103—105, 107, 112
bassensis, Clupea 103
bassensis, Sprattus 36, 104, 105, 117
bentincki, Clupea 40, 106, 117
bergi, Alosa kessleri 301
bergi, Caspialosa kessleri 299
bergi, Caspialosa kessleri isp. volgensis 299
bergi, Caspialosa volgensis 281, 299, 301
binagadensis Clupeonella 16
borealis Clupea harengus 123
brachysoma, Ilisha 320
brachysoma, Pellona 320
braschnikowii, Clupea caspio-pontica var.
223, 258
brashnikovi, Alosa 23, 24, 28—31, 56—58,
61, 62, 66, 73, 75, 78—80, 82, 216—
218, 221, 222, 230, 251, 252, 275,
280, 282
brashnikovi, Alosa brashnikovi 24, 29, 30,
62, 75, 76, 78—80, 82, 215, 217—221,
250, 252—254, 258, 261, 265, 266,
276, 307
brashnikovi, Caspialosa 258, 59,266, 274,276
brashnikovi, Caspialosa brashnikovi 259
brashnikovi, Caspialosa caspia 258, 259, 271
brashnikovi, Clupea (Alosa) 223, 258
brashnikovi, Clupeonella 258
brasiliensis, Clupea 173
1 Курсивом выделены синонимы; жирные цифры обозначают страницы с основ-
ными описаниями названной формы.
АЛФАВИТНЫЙ УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
325
brauneri, Caspialosa 255
brevicauda, Brevoortia tyrannus 38
Brevoortia 10, 38, 42, 48, 50, 51, 92—95
brittanicus, Clupea harengus 123
bryoporus, Spratelloides 146
bulgarica, Alosa 313
bulgarica, Alosa alosa 223, 313, 314
caerulea, Clupea 123
caerulea, Meletta 175
caerulea, Sardinops sagax 54, 69, 78, 81,
175, 177, 181, 182, 186
caeruleo-vittata, Clupea 172
caledonicus, Clupea harengus 123
caspia, Alosa 22—25, 27, 28, 31, 33, 37,
44, 49, 56—58, 61, 66, 71, 73, 74,
78—80, 211, 214—219, 221, 222, 229,
241, 245, 281, 282, 285, 313
caspia, Alosa 242, 292
caspia, Alosa caspia 24, 25, 27, 56, 57,
71, 72, 74, 76, 77, 78, 79, 80, 82, 211,
214, 217, 220, 232, 238, 239, 240, 242,
244, 245
caspia, Alosa caspia caspia n. 244
caspia, Caspialosa 211, 216, 220, 242,
249, 281
caspia, Caspialosa caspia 242
caspia, Clupea 215, 231, 242, 245, 292
caspia, Clupea (Alosa) 240, 242
caspia, Clupeonella 211, 242
caspia, Clupeonella delicatula 12, 18, 21,
57, 71, 82, 192, 194, 196, 199, 204,
207, 216
Caspialosa 10, 55, 66, 211, 213, 214,
216, 218
caspica, Alosa 242
easpio-pontica, Clupea 214, 215
castelnaeana, Pellona 94
cepedianum, Dorosoma 37, 44
cepedianum, Dorosoma cepedianum 36’
Chanina 10
Chaninae 10
Chanoidei 10
Chatoessina 10
chinensis, Pristigaster 320, 321
chinensis, Zunasia 322
Chirocentridae 9
Chirocentrodon 31, 32, 42, 43, 94, 95
chrysochloris, Pomolobus 35, 37, 44
chtamalocephala, Caspialosapontica var. 282
cimbricus, Clupea harengus 123
Clupanodon 31, 40, 42, 94, 95, 100, 318
Clupea 10, 14, 15, 16, 17, 18, 33, 41, 44,
48—50, 74, 91, 93, 95, 99, 106, 115,
117, 121,.167
Clupeichthys 37, 40, 41, 93
Clupeidae 9, 10—13, 20, 71, 91
Clupeiformes 9, 10, 13, 92
Clupeina 10
Clupeinae 10, 11, 13, 14, 16, 18—20,
22—25, 31—35, 38, 41, 92, 98, 99, 214
Clupeini 10
Clupeoidae 9
Clupeoidei 92
Clupeoidei 91
Clupeoides 37, 40, 41, 93
clupeoides, Ambligaster 120
clupeoides, Sardinella 171, 172
clupeolla, Harengula 17, 166
Clupeonella 10, 16—19, 33, 37, 41, 44,
48, 51, 55, 56, 58—63, 66, 72, 91, 93,
95, 98, 100, 191, 211, 214, 216
Clupeonella 211
Clupeonia 166
come, Nematolosa 318
communis, Alosa 312
Corica 37, 40, 41, 93
cultriventris, Clupea 194, 196
cultriventris, Harengula 194
curensis, Alosa 56, 218, 219, 222, 279
curensis, Caspialosa 219, 277, 279
curensis, Caspialosa caspia 279
curensis, Clupea 279
curensis, Clupea (Alosa) 279
curensis, Clupeonella 218, 219, 279
cuvieri, Alosa 312
Cynothrissa 41, 43, 93
dactylolepis, Fimbriclupea 170
dakini, Sardinops 40, 177
danubii, Alosa pontica var. 282
delicatula, Clupea 59, 194, 199
delicatula, Clupeonella 14, 18, 19, 20, 22,
33, 49, 56, 57, 67, 76, 77, 82, 93, 192,
193, 199, 214, 216
delicatula, Clupeonella delicatula 18, 21,
57, 61, 82, 191, 192, 194, 196, 216
delicatula, Harengula 194, 199
delicatulus, Spratelloides 36
derzhavini, Alosa brashnikovi 266—268
displonotus, Harengula 166
dobrogica, Sardina 189
Dolichopterygidae 9
Dorosoma 31, 36, 37, 42, 43, 46, 51, 73, 94
Dorosomatidae 10
Dorosomatinae 11, 22, 31, 34, 37, 38,
42, 73, 91, 94, 100, 318
Dorosomatini 10
Dorosomidae 10, 91
durbanensis, Hilsa 36
Dussumieria 40, 41, 92, 101 •
Dussumieriidae 10
D ussumieriidae 91
Dussumieriina 10
Dussumieriinae 11, 38, 41, 92,b97, 99, 101
Dussumieriini 10
eba, Sardinella 43, 51
eichwaldi, Caspialosa pontica 283
eichwaldi, Clupea 282
elata, Caspialosa brashnikovi m. 263
elata, Caspialosa kisselevitshi m. 272
elongata, Alosa 321
elongata, Caspialosa brauneri m. 255
elongata, Clupea 123
elongata, Clupeonella caspia m. 242
elongata, Ilisha 94, 320, 321, 322
elongata, Pellona 321, 322
Elopidae 9, 13, 19, 20, 50
Elopina .10
Elopoidae 9
engrauliformis, Clupea 205
ЛЙ(1 алфавитный указатель латинских названий
'engraullformis, Clupeonella 14, 16, 18, 19,
56, 61, 192, 193, 205
'engrauliformis, Harengula 205
Engraulina 10
Engraulinae 10
esea, Cyprinus 123
Escualosa 167
Ethmalosa 38, 42, 43, 46, 92—94
Ethmidium 38, 42, 92, 93
Etrumeus 36, 41, 45 46 48, 51, 92, 95,
99, 10Э
Euplatygaster 320
euxina, Sardinella 173
exile, Dorosoma cepedianum 36
fallax, Alosa 23, 24, 25, 28, 48, 65, 211—
214, 221, 223, 282, 307, 308, 310
fallax, Alosa fallax 223, 308, 310, 311
fallax, Clupea 310
fallax, Paralosa 310
fijiense; Harengula 166
Fimbriclupea 170
finta, Alosa 309, 310
finta, Clupea 309, 310
finta, Clupea alosa var. 310
Fiscina 170
frisicus Clupea harengus 123
fuegensis, Clupea 40, 106, 117
Fusciclupea 177
Qilchristella 92
gisu, Pterothrissus 72
Gonialosa 31, 37, 40, 42, 94
gracilis, Alosa fallax 37, 44, 65, 308
grayana, Pellona 321
grimmi, Alosa brashnikovi 24, 29, 30,
62, 215, 217—220, 252, 255, 275,
277, 278 ~
grimmi, Caspialosa brashnikovi 220, 277
grimmi, Clupea 277
grimmi, Clupea (Alosa) 277
grimmi, Clupea caspio-pontica var. 277
grimmi, Clupeonella 14, 16, 18, 19, 56,
61, 97, 191—193, 207, 209, 214 .
grimmi, Harengula 205
Gudusia 37,-40, 42, 93, 94
halec, Clupea 123
haleciformes, Sprattus 103
Halecula 92
Harengula 17—19, 36, 37, 40, 41, 45, 46,
93, 95, 100, 166, 167, 170
Harengula 191
harengus, Clupea 14, 19, 20, 22, 23, 33,
36, 37, 39, 44, 45, 48, 49, 51—53, 55,
68—70, 73—76, 78—80, 82, 96, 115,
117, 119—121, 123, 140, 145, 158
harengus, Clupea harengus 12, 18, 20, 21,
33, 53, 60, 62, 65, 69, 70—73, 76—82,
97, 116, 119, 120—123, 141, 164
Heringia 93
Herkotsella 166
Hilsa 38, 40, 42, 93, 94
humeralis, Harengula 17
Hyodontidae 9
Hyperolophus 36, 41, 48, 55, 93
hypselocephala, Caspialosa pontica var. 282
Ilisha 31, 32, 38, 40, 42, 43, 45, 46, 94,
100, 320
imitans, Caspialosa volgensis 218, 299,
305, 306
immaculata, Alosa 282
immaculata, Clupea 171, 173
indica, Ilisha 37, 94
indigena, Clupea 314
inermis, Clupea 145
islandicus, Clupea harengus 123
Isospondili 10
ivernicus, Clupea harengus 123
jaksoniensis, Etrumeus 36, 102, 103
Jenkinsia 41, 43, 46, 92
jeussieui, Clupeonia 166
kaidakensis. Caspialosa caspia 249
kenderlensis, Alosa brashnikovi 275, 276
kessleri, Alosa 23—25, 27, 37, 56—58,
79 218 220_________222
kessleri, Alosa kessleri’24,25, 27, 28, 57, 58,
65, 66, 73, 75, 76, 79, 80, 82, 97, 211,
214—216, 218—221, 281, 282, 286,
293 295, 299, 305, 306, 307
kessleri, Alosa kessleri X Alosa kessleri
volgensis 305
kessleri, Caspialosa 217, 281, 299, 305
kessleri, Caspialosa caspia 281, 299
kessleri, Caspialosa kessleri 299
kessleri, Caspialosa kessleriy<_Caspialosa
kessleri volgensis 305
kessleri, Clupea 204, 299
kessleri, Clupea (Alosa) 299
kessleri, Clupeonella 299
killarnensis, Alosa fallax 37, 44, 65,
308, 310
kisselevitschi, Caspialosa volgensis 305
kisselevitshi, Alosa brashnikovi 29, 30,
58, 62, 78, 82, 217, 218, 220, 252—
254, 261, 264, 265, 272, 279
kisselevitshi, Caspialosa brashnikovi 272
kisselevitshi typ., Caspialosa 272
kisselevitshi, Caspialosa volgensis 218, 306
knipowitschi, Alosa caspia 216, 218, 221,
230, 232, 238, 239, 241
knipowitschi, Alosa caspia knipowitschi n.
238—240
knipowitschi, Caspialosa 238
knipowitschi, Caspialosa caspia 238
Konosirus 318
Kowala 40, 41, 93
kowal, Clupea 169
kurensis, Clupea 278
lacustris, Alosa fallax 37, 44, 65, 308
lariana, Alosa fallax 77, 308
laticosta, Clupea 189
latulus, Clupea 123
latulus, Harengula 166
leachii, Clupea 123
lemuru, Sardinella 173
Lepidosteidae 9
АЛФАВИТНЫЙ УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
327
Leptolepidae 13, 50
Leptolepidoidei 13
leucocephala, Caspialosa 274, 276, 277
leucocephala, Caspialosa brashnikovi 220, 277
leucocephala, Clupeonella 277
Lite 41, 43, 46, 93
Limnothrissa 41, 43, 93
lineolata, Clupea 123
longiceps, Clupea 173
longiceps, Sardinella 174
Lycopteridae 13
Lycopteroidei 13
macedonica, Alosa 313
macedonica, Alosa alosa 37, 44, 65,
313, 314
Macristiidae 9
macrogaster, llisha 37, 94
maerolepis, Clupea 1 (>7
macrognathus, Opisthopterus 94
macrophthalma, Clupea 166
macrophthalma, Harengula 209
Macrura 94
macrura, Hilsa 38
maeotica, Alosa 218, 255
maeotica, Alosa brashnikovi 25, 56—58,
215, 217, 236, 253, 254, 286— 288
maeotica, Caspialosa 216, 217, 255
maeotica, Caspialosa brashnikovi 255
maeotica, Clupea 108, 254
maeotica, Clupeonella 255
inajorina, Harengula 17
malabaricus, Spratelloides 92
Malacopterygii 10
maris-albi, Clupea harengus pallasi 159
maris-albi, Clupea harengus pallasi n.
18, 20, 21, 36. 60, 68—70, 75, 77, 78,
82, 116, 119, 120, 122, 123, 158, 159
maris-albi var. a, Clupea harengus pal-
lasi 159
maris-albi var. fl, Clupea harengus pallasi
159
maris-albi, Clupea pallasi 121
Maugeloclupea 103
Medipellona. 94
mediterranea, Meletta 173
Megalopidae 9, 13, 50-
megaloptera, llisha 94
melanosticta, Clupea 173, 178
melanosticta, Sardinella 178
melanosticta, Sardinia 178
melanosticta, Sardinops 178
melanosticta, Sardinops melanosticta 178
melanosticta, Sardinops sagax 14, 17, 54,
60, 69, 70, 72, 75, 78, 80—82, 177, 178
melanostictum, Ambligaster 178
melanostictus, Ambligaster 178
melanosticlus, Clupanodon 178
melanostoma, Sprattus 36, 105, 106
melastoma, Clupea 321
Meletta 103
membras, Clupea harengus 18, 121, 140, 158
membras 3, Clupea harengus 140
membras, Clupea harengus harengus n.
21, 77, 81, 82, 116, 119, 122, 140
membras, Clupea harengus var. 140
micropus, Clupea 100, 102
niicropus, Etrumeus 36, 46, 51, 60, 101,
102, 103
Microthrissa 41, 43, 93
minima, Clupea 123
mirabilis, Clupea 145
mirabilis, Clupea harengus pallasi 146
mizun, Clupea 167
Montalbania 100
motius, llisha 321
motius, Pellona 321
muelleri, Sprattus 20, 36, 103—107
muhlisi, Clupeonella 66, 208
muhlisi, Clupeonella 208
murmanica, Clupea harengus harengus n. 123
natalensis, llisha 36
Nealosa 318
Nematalosa 31, 38, 40, 42, 48, 94, 318
neopilchardus, Sardinops sagax 36, 54,
177, 178
Neosteus 94
nigra, Caspialosa 218, 219
nigra, Caspialosa caspia 218, 219, 223
nigrescens, Alosa pontica var. 282
nilotica, Alosa fallax 29, 35, 37, 69, 223,
208, 309
nilotica, Alosa jinta 309
nilotica, Clupea 309
nirchi, Alosa brashnikovi 24, 29, 30,
217, 252, 253, 274—276.
nirchi, Caspialosa 27 i
nirchi, Caspialosa brashnikovi 275
nordmanni, Alosa 59, 233
nordmanni, Alosa caspia 25, 27, 57, 60,
74, 217, 231, 233, 234
nordmanni, Caspialosa 233
nordmanni, Caspialosa caspia 231, 233
nordmanni, Caspialosa tanaica 216, 233
nordmanni, Clupea 233
nordmanni, Clupeonella 233
norvegicus, Clupea harengus 123
Notopteridae 9
ocellata, Sardinops sagax 36, 54, 177
Odaxothrissa 41, 43, 93
Odontognathus 32, 42, 46, 94
ohiensis, Alosa alabamae 37, 44, 65, 315
okinawensis, Clupea 171
Opistonema 41, 46, 93
Opisthopterus 32, 42, 45, 94
orientalis, Alosa brashnikovi 29, 30, 78,
252—254, 266—268, 271, 272, 279
orthonops, Etrumeus 102
Osteoglossidae 9
othonops, Perkinsia 100, 102
palaeostomi, Alosa caspia 25, 27, 57,
217, 231, 232
palaeostomi, Caspialosa caspia 231
paleaostomi, Caspialosa tanaica 216, 231
palaeostomica, Caspialosa 231
palaeostomica, Caspialosa tanaica 231
pallasi, Clupea 121, 146
pallasi, Clupea harengus 18, 20, 21, 36,
37, 51—53, 60, 68, 70, 72, 78—82, 116,_
119—122, 145, 146
328
АЛФАВИТНЫЙ УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
pallasi, Clupea harengus var. 146
pallasii, Clupea 145, 146
papalina, Clupea 107
Paralosa. 211
patronus, Brevoortia tyrarmus 35, 38
pectinata, Brevoortia 38
Pellona 31, 32, 42, 43, 45, 46, 91, 94
Pellonula 37, 41, 43, 93
Pellonulinae 11, 37, 38, 41, 93
Perkinsia 100
persica, Alosa caspia 25, 28, 58, 74, 78,
80, 216, 218, 221, 231, 232, 240, 241
persica, Caspialosa caspia 241
persica, Caspialosa caspia var. 241
phalerica, Clupanodon 107
phalerica, Clupea 107
phalerica, Meletta 107
phalerica, Spratella sprattus 108
phalericus, Sprattus sprattus 18, 21, 35,
44, 61, 69, 75, 83, 104, 105, 107, 108
pilchardus, Alausa 189
pilchardus, Clupea 186, 188
pilchardus, Sardina 19, 39, 79, 81, 120, 188
pilchardus, Sardina pilchardus 37, 77,
81, 188, 190, 191
piltschardus var., Clupea 299
platana, Lile 43
Platygaster 320
Pliosteostoma 32, 42, 43, 91, 94
Poecilothrissa 41, 43, 93
Pomolobus 10, 11, 37, 42, 44, 48, 49, 51,
74, 91, 93—95
pontica, Alosa 218
pontica, Alosa 282
pontica, Alosa kessleri 12, 24, 25, 27, 28,
57, 58, 60, 65, 66, 76, 82, 215, 218,
256—258, 282, 285, 286
pontica, Caspialosa 214, 216, 231, 281—283
pontica var., Caspialosa 283
pontica, Caspialosa kessleri 221, 283
pontica, Clupea 214, 215, 254, 258, 282,
287, 292, 299
pontica, Clupeonella 231, 282
posterus, Ambligaster 170
posterus, Sardinella 170
Potamalosa 36, 37, 41, 45, 55, 93
Potamothrissa 41, 43, 93
praestabilis, Alosa 314
Pristigaster 32, 42, 43, 94
Pristigasterinae 10, 11, 22, 31, 32, 34,
38, 42, 92, 94
pristigasteroidcs, Ilisha 94
probatowi, Clupea harengus pallasi n. 163
probatowi, Clupea pallasi 163
productissima, Dussumieria 92
Pseudobericidae 9
Pseudochirocentrodon 94
pseudoharengus, Pomolobus 37
pseudo-hispanica, Sardinia 170, 173
pseudohispanicus, Clupanodon 173
Pterothrissidae 9
pumila, Spratella 103
punctata, Harengula 167, 168
punctata, Nealosa 319
puncfatus, Chataessus 318, 319
punctatus, Clupanodon 51, 318, 319
punctatus, Dorosoma 319
punctatus, Konosirus 319
Raconda 31, 32, 40, 42, 92, 94
reeversii, Hilsa 38, 69
Rhinosardinia 41, 43, 93
rhodenensis, Alosa fallax 308
richardsoni, Nematalosa 36
richmondia, Potamalosa 36
robustus, Spratelloides 36
Rogenia 115
rossica, Alosa 245, 242
rossica, Clupea 214
russac, Alosa pontica var. 282
sadina, Etrumeus 36, 102 '
sagax, Arengus 178
sagax, Clupea 177, 178
sagax, Sardina 178
sagax, Sardinops 19, 44, 45, 48, 51, 54,
69, 73, 79—81, 120, 177
sagax, Sardinops sagax 36, 54, 177
•salina, Alosa caspia 25, 27, 56—58, 71,
74, 77, 78, 216, 218—220, 231, 232,
245, 247, 249, 306, 307
salina, Caspialosa caspia 249
sapidissima, Alosa 22—25, 49, 69, 73, 77,
212, 221, 223, 313, 314, 315
sapidissima, Clupea 314
sapidissima, Clupea alosa var. 314
saposchnikowi, Clupea 258
saposchnikowii, Clupea 223, 258
saposchnikowii, Clupea caspio-jjontica var.
223, 224, 258
saposhnikovi, Alosa 23, 24, 56, 61, 73,
83, 211, 215, 218—220, 222, 223,
228, 229, 280
saposhnikovi Caspialosa 220, 223, 224
saposhnikovi, Caspialosa caspia 223
saposhnikovi, Clupeonella 223
saraica, Alosa caspia knipowitschi n.
238, 239, 240
Sardina 10, 14, 16—18, 32, 36, 41, 44,
48, 51, 54, 55, 91, 93, 95, 100, 186,
191, 214, 310
sardina, Arengus pilchardus f. 189
sardina, Clupanodon 189
sardina, Clupea 189
sardina, Clupea pilchardus var. a 189
sardina, Sardina pilchardus 14, 60, 61,
77, 81, 188, 189
Sardinella 10, 16, 17, 18, 19, 32, 36, 37,
40, 41, 43, 45, 46, 48, 51, 54, 55,
93, 95, 100, 170, 177, 186, 191
Sardinia 170
Sardinops 15—18, 32, 36, 41, 49, 54, 91,
93, 95, 100, 175, 186, 191, 214
sarensis, Alosa brashnikovi 252—254, 261,
266—269 .
sarensis, Caspialosa brashnikovi 266
Sauvagella 92
scandicus, Clupea harengus 123
schlegeli, Ilisha 321
schlegelii, Pellona 321, 322
scoticus, Clupea harengus 123
senegalensis, Alosa 189
АЛФАВИТНЫЙ УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ 32&-
septemtrionalis, Clupea harengus 123
serdinka, Spratella 108, 109
Signalosa 31, 37, 42, 43
sinensis, Pristigaster (Pristigaster) 321
smithi, Brevoortia 38, 94
smithi, Dorosoma 43, 94
sphaerocephala, Alosa 23, 24, 56, 61, 211,
218, 220, 222, 227
sphaerocephala, Caspialosa 227
sphaerocephala, Caspialosa caspia 227
sphaerocephala, Clupeonella 227
Spratella 103
Spratelloides 10, 11, 36, 40, 41, 48, 92
Spratellomorpha 92
Sprattus 10, 14, 16, 17, 20, 33, 36, 41, 44,
45, 48, 51, 54, 55, 63, 69, 91, 93, 95,
99,103, 105, 106, 115, 117, 167, 214, 312
sprattus, Clupea 107, 112, 189
sprattus, Sprattus 14, 18, 19, 20, 22, 33,
37, 39, 48, 54, 72, 81, 83, 103, 107,
117, 120
sprattus, Sprattus sprattus 21, 103, 105,
106, 107
Stolephoridae 91
Stolephorus 10, 92
Stolothrissa 41, 43, 93
Sudidae 9
sulinae, Clupea 59, 107—109
suvorovi, Caspialosa 219
suvorovi, Caspialosa caspia 219
suworowi, Caspialosa 219, 220, 224
suworowi, Clupea harengus pallasi 163
suworowi, Clupea harengus pallasi n.
18,' 20, 21, 36, 52, 53, 70, 78, 82, 116,
119, 123, 163
suworowi, Clupea pallasi 121
suworowi, Clupeonella 219
Syllaemidae 9
tambowcewi, Clupea harengus pallasi n. 163
tanaica, Alosa 235
tanaica, Alosa caspia 25, 27, 57, 76, 217,
231, 235
tanaica, Caspialosa 216, 233
tanaica sbsp., Caspialosa 231
tanaica, Caspialosa caspia 235
tanaica, Clupea 233, 235 •
tanaica, Clupeonella 231, 235
tartoor, Pristigaster 321
tawilis, Harengula 37, 93
thoracata, Kowala 93
thrissa, Clupanodon 319
thrissa, Clupea 318
thrissa, Dorosoma 319
thrissina, Harengula 17
translucidus, Hyperolophus 36
tscharchalensis, Clupeonella delicatula
caspia m. 37, 67, 77, 193, 194, 204.
tscharchalensis, Clupeonella delicatula m. 204
tscharchalensis, Hareagula 204
tscharchalensis, Clupea cultriventris var, 204
tyrannus, Brevoortia 78, 81
tyrannus, Brevoortia tyrannus 38
valenciennesi, Opisthopterus 321
vexata, Clupeonella 16
vimbella, Pellona 321
vittata, Clupea 123
vittata, Clupeonia 166
vittata, Harengula 166
volgensis, Alosa kessleri 24, 25, 27, 28,,
49, 57, 58, 65, 66, 73—79, 81, 82, 211,
212, 214—216, 218, 220, 221, 229, 245,
281, 282, 286, 292, 306, 307
volgensis, Alosa kessleri x Alosa kessleri-
kessleri 305
volgensis, Caspialosa 216, 217, 293, 305-
volgensis, Caspialosa caspia 293
volgensis, Caspialosa kessleri 293
volgensis, Caspialosa kessleri XCaspialosa-
kessleri kessleri 305
volgensis, Caspialosa kessleri isp. 221, 293-
volgensis, Clupeonella 293
volgensis, Clupeonella caspia 292
vulgaris, Alausa 312
vulgaris, Alosa 211, 312
vulgaris, Meletta 103, 112
Wilkesina 166
xanthoptera, Ilisha 94
Zunasia 320
zunasi, Clupea 169
zunasi, Harengula 14, 17, 35, 51, 168, 169'
zunasi, Sardinella 169 •
УКАЗАТЕЛЬ РУССКИХ НАЗВАНИЙ СЕЛЬДЕВЫХ РЫБ
-аграханка 263
алоза 312
алоза черноморская 313
бешенка 299
буркун 282
веселка 299
долгипка 258
железница 299
желтоспинка 277
залом 299
зунаси 169
иваси 178
килька (неправ.) 193
килька анчоусовидная 205
килька балтийская 112
килька большеглазая 209
килька обыкновенная 199
килька средиземноморская 107
килька черноморская 107
кильки 103
лобан 282
обжорка 268
оселедец 282
пластун 235
пластунец 235
плоскун 235
плоскунец 235
подтумок 282
полузалом 299
пузанки каспийско-черноморские 229
пузанок аграханский 227
пузанок азовский 235
пузанок асТрабадский 240
пузанок большеглазый 223
пузанок дунайский 233
пузанок ильменный 242
пузанок круглоголовый 227
пузанок палиасто^ский 231
пузанок сапожниковский 223
пузанок. саринский 238
пузанок северо-восточный каспийский 249
пузанок северокаспийский 242
пузанок среднекаспийский 242
пузанок суворовский 219
пузанок черпый 218
пузанок энзелийский 238
ризовка 233
русак 282
рыба майская 312 .
салака 140
capдель 107
сарделька 193
сарделька абрауская 208
сарделька анчоусовидная 205
сарделька большеглазая 209
сарделька каспийская 199
сарделька черноморско-азовская 194
сардельки 191
сардина 188
сардина дальневосточная 178
сардина средиземноморская 189
сардина япономорская 178
сардинка 107
сардинка (неправ.) 205
селедочка чархальская 204
сельдевые 92
сельди атлантическо-скандинавские весен-
ние 126, 129
сельди банковские 127, 130
сельди бражниковские 251.
сельди весенние Скагеррака, Катте-
гата и Вельта 127, 130
сельди датских проливов 127, 130
сельди зимние Каттегата 127, 131
сельди зимние шотландские 126, 130
сельди Зюдерзее 127, 130
сельди каспийско-черноморские морские
сельди каспийско-черноморские про-
ходные 280
сельди кесслеровские 280
сельди Ламанша 127, 130
сельди морские 115
сельди океанические 115
сельди осенние Северного моря 127, 130
сельди осенние северо-восточной части
Каттегата 127, 130
сельди осенние южной части Каттегата
и Зунда 127, 131
УКАЗАТЕЛЬ РУССКИХ НАЗВАНИЙ СЕЛЬДЕВЫХ РЫВ
331
сельди южного входа в Ирландское
море 127., 130
сельдь 282
сельдь аграханская 263
сельдь астрабадская 277
сельдь астраханская 292
сельдь атлантическая 123
•сельдь балтийская 140
сельдь белоголовая 277
сельдь беломорская 158
сельдь большеглазая 270
сельдь волжская 292_
сельдь волжская малотычинковая 305
сельдь волжская многотычинковая 292
сельдь восточная 145, 268
сельдь восточносахалинская 149
сельдь гасанкулинская 272
сельдь-гонец 277
сельдь декастрипская 149
сельдь долгинская 258
сельдь зал. Петра Великого 149
сельдь киселевичевская 272
сельдь корейская 149
сельдь красноводская 274
сельдь куринская 279
сельдь лимана Аккеси 150
сельдь майская 266
сельдь малопозвонковая 158, 163
сельдь многопозвонковая 123
сельдь морская 117
сельдь мурманская 123, 132
сельдь норвежская 123, 131
сельдь океаническая 117
сельдь Пенжинская 149
сельдь пластунско-нельминская 149
сельдь полосчатая 279
сельдь пятнистая 319
сельдь саринская 266
сельдь северокамчатская 150
сельдь тихоокеанская .145
сельдь тоннайская 150
сельдь тохокуккайская 149
сельдь хинумская 150
сельдь черноморская 282
сельдь черноморско-азовская морская 254
сельдь черноморско-азовская про-
ходная 282
сельдь чёшско-печорская 163
сельдь южнокамчатская 150
сельдь южносахалинско-хоккайдская 149
тачек 282
тюлька 193
тюлька абрауская 208
тюлька анчоусовидная 205
тюлька большеглазая 209
тюлька каспийская 199
тюлька чархальская 204
тюлька черноморско-азовская 194
тюльки 191
уруме-иваси 102
финта 308
финта атлантическая 310
финта средиземноморская 309
черноспинка 299
шед 314
шпрот балтийский 112
шпрот средиземноморский 107
шпрот черноморский 107
шпроты 103
Таблица 1
1.— Etrumeus micropus. Кагошима. Длина 197.5 мм. 2 — Sprattus sprattus phalericus. Черное море, Очаков. Длина 107 мм. (Из Берга,
один из типов S. serdinca). 3 — Sprattus sprattus balticus. Финский зал., д. Конново. Длина 120 мм. (Из Берга).
Таблица IT
l___Clupea harengus harengus. Побережье Норвегии, Алезунд. Длина 324 мм. 2 — Clupea harengus harengus. Баренцево море, Новая
Земля, Белушья губа. Длина 172 мм. (Из Агапова).
Таблица Ill
22 Фауна СССР—314
1 — Clupea harengus harengus n. membras. Балтийское море, район Мерсрагс. Длина 187 мм. 2 — Clupea harengus pallasi. Южная
часть западного побережья Сахалина у Антоново. Длина 345 мм.
Таблица IV
I—Clupea harengif.s pallasi n. maris-albi. Белое море, Беломорск. Длина 161 мм. 2 — Clupea harengus pallasi n. suworowi. Мезенский
зад., Щекино. Длина 212 мм.
•ИНГ’ •
Таблица И
1 — Harengula zunasi. Зал. Петра Великого. Длина 138 мм. 2— Sardinella aurita. Черное море, Батумская бухта.
Длина тела 216 мм. (Рис. жаб. дуги см. рис. 19),
Таблица Vl
7 — Sardinops sagax melanosticta. Зал. Петра Великого, Устье р. Тумень-ула. Длина 180 мм. (Рис. жаб. дуги см.
рис. 22). 2 — Sardina pilchardus sardina. Черное море, Батумская бухта. Длина 159 мм. (Рис. жаб. дуги см. рис. 25).
Таблица VII
1 — Clupeonella grimmi. Южная часть Каспийского моря к востоку от Баку. Длина
126 мм. 2 — Clupeonella engrauliformis. Каспийское море близ Буйнак. Длина.
124 мм. Тип. 3 — Clupeonella abrau. Оз. Абрау. Длина 82 мм. Тип.
Таблица VIII
1 — Clupeonella delicatula delicatula. Черное море, 1838, Нордманн. Длина 74 мм. Тип.
2 — Clupeonella delicatula caspia. Дельта Волги, Оранжерейный промысел. Длина
152 мм. Тип. 3 — Clupeonella delicatula caspia m. tscharchalensis. Волга, затон Криуша
близ с. Подгоренки, 20 км ниже Саратова. Длина 104 мм.
Таблица IX
1 — Alosa saposhnikovi. - Дельта Волги, Оранжерейный промысел. Длина 173 мм. Тип. (Из Берга). (Рис.
жаб. дуги см. рис. 28). 2 — Alosa sphaerocephala. Северная часть Каспийского моря близ о. Тюленьего.
Длина 190 мм. Тип. (Из Берга). (Рис. жаб. дуги см. рис. 29).
Таблица X
1 — Alosa caspia palaeostomi. Черное море, оз. Палеостом. Длина 146.5 мм. (Рис. жаб. дуги см.
рис. 30). 2 — Alosa caspia nordmanni. Дунай близ Вилково. Длина 154 мм. Тип. (Рис. жаб. дуги см,
рис, 31).
Таблица XI
23 Фауна СССР—314
1 — Alosa caspia tanaica. Низовья р. Дона у Ростова н/Д. Длина 147 мм. Тип. (Рис. жаб. дуги см. рис. 32).
2 — Alosa caspia knipowitschi. Южная часть Каспийского моря, Энзели. Длина 212 мм. Тип. (Рис. жаб. дуги см.
рис. 33).
Таблица XII
ГРи/жаб Каспийского моря к северу от Ашур-аде. Длина 147.5 мм. Тип.
; . . ду и см. рис. 34). 2 Alosa caspia caspia. Западное побережье Каспийского моря, Сумгаит
Длина 172 мм. (Из Берга). J
Таблица XIII
1 — Alosa caspia caspia. Дельта Волги, ильмень Дамбур. Длина 205 мм. Тип n. aestuarina. (Из Берга),
(Рис, жаб. дуги. см. рис. 35, 1). 2 ~ Alosa caspia caspia. Волга, Климовский затон, НО км выше Куйбышеву.
Длина 190 мм. (Рис, жаб. дуги см. рис. 35, 2).
1 — Alosacaspia. salina. Зал. Мертвый Култук, 10 км к западу от м. Кызыл-каир. Длина 208 мм. Тип. (Рис. жаб. дуги
см. рис. db, 1). г — Alosa caspia salina. Западный берег зал. Кайдак, против Кызыл-таш. Длина 189 мм. (Рис. жаб. дуги см.
рис. 36,2).
Таблица XV
1 — Alosa brashnikovi brashnikovi x A. caspia salina. Западный берег зал. Кайдак, против Кызыл-таша. Длина 240мм.
(Рис. жаб. дуги см. рис. 37). 2 — Alosa brashnikovi maeotica. Керченский прол. Длина 257 мм. Тип. (Рис. жаб. дуги
см. рис. 38).
Таблица XV1
1 — Alosa brashnikovi brashnikovi. Форт Шевченко. Длина 280 мм. Тип. (Рис. жаб. дуги см. рис. 39, 1). 2 —
Alosa brashnikovi brashnikovi. Зал. Кайдак у Кызыл-бай. Длина 278 мм. (Рис. жаб. дуги см. рис. 39, 2).
1 — Alosa brashnikovi agrachanica. Западное побережье Каспийского моря у Сулака. Длина 423 мм. Тип. (Рис.
жаб. дуги см. рис. 40). 2 — Alosa brashnikovi sarensis. Южная часть Каспийского моря у о. Сара. Длина 331 мм.
Тип. (Рис. жаб. дуги см. рис. 41).
Таблица XVIII
1 — Alosa brashnikovi orientalis. Восточное побережье южной части Каспийского моря у прол. Кара-дашлы.
Длина 322~мм. Тип. (Рис. жаб. дуги см. рис. 42). 2 — Alosa brashnikovi autumnalis. Восточное побережье
южной части Каспийского моря у Гасан-кули. Длина 269 мм. Тип. (Рис. жаб. дуги см. рис. 43).
1 — Alosa brashnikovi kisselevitshi. Восточное побережье южной части Каспийского моря у южной оконечности
о. Огурчинского. Длина 313 мм. (Рис. жаб. дуги см. рис. 44). 2 — Alosa brashnikovi nirchi. Восточное побережье
южной части Каспийского моря против Сев. Челекенской косы. Длина 386 мм. Тип. (Рис. жаб. дуги см. рис. 45).
Таблица XX
I Alosa brashnikooi grimmi. Южная часть Каспийского моря, Ашур-аде. Длина 340 мм. Тип. (Рис. жаб. дуги см.
рис, 46). 2 Alosa curensis. Южная часть Каспийского моря близ устьев Куры. Длина 176 мм. Тип. (Из Берга)-,
(Рис. жаб. дуги см. рис. 47).
Таблица XXI
1 - Alosa kessleri pontica. Таганрогский зал. у хут. Морской Чулек. Длина 247 мм-(Рис-®а%^сгажС“б дугиш’
2 — Alosa kessleri volgensis. Волга, Подовская тоня у Черного Яра. Длина 348 мм. Тип. (Рис. жаО. дуги см,
рис. 49).
1 — Alosa kessleri kessleri. Волга у с. Никольского (240 км выше Астрахани). Длина 214 мм. (Тип A. kessleri bergi). (Рис. жаб.
дуги см. рис. 50, 1]. 2 — Alosa kessleri kessleri. Волга у с. Никольского, тоня Песок. Длина 215 мм. (Рис. жаб. дуги см.
рис. 50, 2).
Таблица XXI11
1 — Alosa kessleri kessleri. Дельта Волги, Оранжерейный промысел. Длина 401 мм. Тип. (Рис. жаб. дуги см. рис. 50, 3).
% — Alosa kessleri kessleri. Волга у Куйбышева. Отнерестовавщая. Длина 360 мм. (Рис. жаб. дуги см. рис. 50, 4).
Таблица XXIV
1 — Alosa fallax nilotica. Константинополь. Длина 243 мм. (Рис. жаб. дуги см. рис. 51). 2 — Alosa fallax fallax.
финский зал., Лужская губа, Усть-Луга. Длина 272 мм. (Рис. жаб. дуги см. рис. 52).
1 — Alosa alosa bulgarica. Черное море* к югу от Бургаса. Длина 202 мм. (Рис. жаб. дуги см. рис. 53). 2 —
Alosa sapidissima. Восточное побережье Камчатки, бухта Уала. Длина 399 мм. (Рис. жаб. дуги см. рис о4).
Таблица XXVI
1 — Clupanodon punctatus. Зал. Петра Великого, устье р. Тумень-ула^ Длина 129 мм. 2 — llisha elongata. Зал. Петра Великого. Длила
ОБОЗНАЧЕНИЯ НА ТАБЛИЦАХ ЧЕРЕПОВ
На таблицах с рисунками черепов (XXVII—LIII) приняты следующие обозна-
чения:
А — череп сооку Б. — череп сверху als — alisphenoideums Ъос — basioccipitale bs —-basisphenoideum ебс— exooccipitale (occipitale laterale) epo — epioticum eth. 1— ethmoidale laterale / — frontale hy — hyomandibulare jneth — mesethmoideum В — череп снизу Г — череп сзади оро — opisthoticum orb — orbitosphenoideum р — parietale pro — prooticum ps — parasphenoideum pto — pteroticum spho — sphenoticum soc — supraoccipitale v — vomer
Таблица XXVII
Etrumeus micropus. Японское море у о. Хондо против зал. Тояма.
Длина черепа 34.0 мм.
Таблица XXVIII
Sprattus sprattus balticus. Балтийское море, Выборгский зал., р-н Хумалиок.
Длина черепа 18.7 мм.
Таблица X XIX
Clupea harengus harengus. Баренцево море к югу от Шпицбергена. Длина
черепа 43.2 мм.
Таблица XXX
Clupea harengus pallasi. Западное побережье южной части Сахалина
у Антоново. Длина черепа 44.5 мм.
Таблица XXXI
Clupea harengus pallasi n. suworowi. Баренцево море, южный склон Гусиной
банки. Длина черепа 32.5 мм.
Таблица XXXII
Harengula zunasi. Берега северного Китая. Длина черепа 21.3 мм.
Таблица XXXIII
Sardinella aurita. Средиземное море у Палермо. Длина черепа 37.5 мм.
Таблица XXXIV
ps
Sardinops sagax melanosticta. Японское море, зал. Петра Великого.
Длина черепа 34.5 мм.
Таблица
Sardina pilchardus sardina. Средиземное море. Длина черепа 24.5 мм.
Таблица XXXVI
Clupeonella grimmi. Южная часть Каспийского моря против Ашперонского
п-ова. Длина черепа 22.2 мм.
Таблица XXXVI
Clupeonella abrau. Оз. Абрау. Длина черепа 15.3 мм.
Таблица XXXVIH
Clupeonella engrauliformis. Южная часть Каспийского моря против
Апшеронского п-ова. Длина черепа 22.1 мм.
Таблица XXXI)
Clupeonella delicatula caspia. Южная часть Каспийского моря у Апшерон-
ского п-ова. Длина черепа 18.7 мм.
Таблица XL
Alosa saposhnikovi. Северная часть Каспийского моря у п-ова Мангышлак.
Длина черепа 64.0 мм.
Таблица XLI
Alosa sphaerocephala. Северная часть Каспийского моря, Аграханский зал.
Длина черепа 28.0 мм.
Таблица XLII
Alosa caspia knipowitschi. Южная часть Каспийского моря, зал. Пехлеви.
Длина черепа 39.5 мм.
Таблица XLIII
Alosa caspia caspia. Северная часть Каспийского моря близ дельты Волги.
Длина черепа 40.4 мм.
Таблица XLIV
Alosa brashnikovi brashnikovi. Северная часть Каспийского моря, зал.
> Мертвый Култук. Длина черепа 49.9 мм,
Таблица XLV
Alosa brashnikovi orientalis.
ского моря у прол.
Восточное побережье южной части Каспий-
Кара-дашлы. Длина черепа 60.4 мм.
Таблица XLVI
Alosa brashnikovi kisselevitshi. Восточное побережье южной части Каспий-
ского моря у южной оконечности о. Огурчинского. Длина черепа 55.4 мм.
Таблица XLVL
Alosa brashnikovi nirchi. Восточное побережье южной части Каспийского
моря против Сев.-Челекенской косы. Длина черепа 63.0 мм.
Таблица XLVIII
Alosa brashnikovi grimmi. Восточное побережье южной части Каспий-
ского моря у южной оконечности о. Огурчинского. Длина черепа 57.3 мм.
Таблица XLIX
Alosa kessleri pontiea. Северо-западная часть Черного моря, Днепр у Херсона.
Длина черепа 49.4 мм.
Таблица L
Alosa kessleri volgensis. Дельта Волги. Длина черепа 41.7 мм
Таблица LI
Alosa kessleri kessleri. Волга у с. Никольского. Длина черепа 65.7 мм.
Таблица LII
Alosa fallax fallax. Балтийское море у Салацарово. Длина черепа 47.7 мм.
Таблица LIU
Clupanodon punctatus. Тихоокеанское побережье Японии, Иокогама. Длина
черепа 39.5 мм.
СОДЕРЖАНИЕ
Стр.
Предисловие ......................................................... 3
Систематический указатель видов и подвидов.......................... 7
Введение ............................................................ 9
Краткий исторический очерк системы семейства.................... 9
Система семейства и принципы классификации..................... 11
Географическое распространение................................. 35
Биология ...................................................... 68
Хозяйственное значение . ...................................... 81
Литература .................................................... 83
Систематическая часть............................................. 91
Сем. Clupeidae — Сельдевые..................................... 91
1. Род Etrumeus......................................... 100
2. Род Sprattus......................................... 103
3. Род Clupea...............................• ........ 115
4. Род Harengula...................................... 166
5. Род Sardinella ........................ 170
6. Род Sardinops........................................ 175
7. Род Sardinia....................................... 186
8. Род Clupeonella ..................................... 191
9. Род Alosa ........................................... 211
10. Род Clupanodon ....................................... 318
И. Род Ilisha............................................ 320
Дополнения ...................................•.................... 323
Алфавитный указатель латинских названий............................ 324
Алфавитный указатель русских названий сельдевых рыб................ 330
Печатается по постановлению
Редакционно-издательского совета
Академии Наук СССР
*
Редактор издательства К. А. Борисов
Технический редактор Р. А. Ароне
Корректоры Н. А. Малевич,
3. Г. Сегаль и Н. М. Шилова
РИСО АН СССР № 4725. Пл. № 9—28 В.
Подписано к печати 14/VIII 1952 Г. М-39802.
Бумага 70х1081/16 Бум. л. 13. Печ. л. 35.44,
Уч.-изд. л. 33,4 Тираж 2000. Зак. 314.
Номинал по прейскуранту 1952 г..
в перепл. 24 р. 90 к.
1-я тип. Издательства Академии Наук СССР
Ленинград, В. О., 9-я лин., д. 12.